信号肽及发酵条件优化促进胶原蛋白在谷氨酸棒杆菌中分泌表达
2022-08-18齐静静范炳森张萌许菲
齐静静,范炳森,张萌,许菲
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
胶原蛋白是哺乳动物体内含量最多的一类蛋白质,占蛋白质总量的25%~30%,是动物结缔组织和细胞外基质的重要组成成分。胶原蛋白由3条左旋多脯氨酸α链以相错一个残基的形式相互缠绕形成右手三股螺旋[1],典型的三股螺旋结构决定了其具有良好的生物力学性能和生物相容性[2],在医药组织工程、化妆品、食品等领域[3]均有广泛的应用,2019年全球胶原蛋白市场规模达153.56亿美元,并保持稳步增长的趋势。目前市面上的胶原蛋白主要通过动物提取获得,具有潜在的免疫原性,有一定的安全隐患;此外,也可通过转基因动植物表达和化学合成获得,但往往价格昂贵、产量低,难以大批量生产。而微生物发酵表达重组胶原蛋白由于具有安全性高、成本低、产量高、序列设计灵活等优点[4],近年来受到了越来越广泛的关注,市场潜力大。
目前重组胶原蛋白常用的表达系统有大肠杆菌(Escherichiacoli)和毕赤酵母(Pichiapastoris),大肠杆菌具有发酵周期短、表达量高、便于遗传操作等优点,是蛋白质异源表达最广泛的宿主菌。利用大肠杆菌表达来源于化脓性链球菌(Streptococcuspyogenes)的胶原蛋白Scl2[5],即使缺乏脯氨酸羟化酶修饰,仍能形成稳定的三股螺旋结构,且在接近、甚至略高于37 ℃稳定性较好,在摇瓶水平胶原蛋白V-CL的最优产量为300 mg/L,补料分批发酵最优产量为19 g/L[6-7];通过共表达伴侣蛋白、响应面优化等策略可以促进单链类人源胶原蛋白在大肠杆菌中的异源表达[8-9],其中类人源II型胶原蛋白产量达到14.2 g/L[10]。然而由于大肠杆菌外膜的屏障作用,外源蛋白多为胞内表达,且易形成包涵体,此外,大量内毒素的存在也为后期纯化带来压力。酵母作为真核表达系统,可进行翻译后修饰,并且无致病性、易进行高密度发酵。利用毕赤酵母分泌表达单链重组人源胶原蛋白的研究比较成熟,人源Ш型胶原蛋白α1链的胶原域片段经亲水性改造及补料分批发酵条件优化,产量提高至19.49 g/L[11];其胶原域全长在毕赤酵母GS115的胞外分泌产量最高达3.36 g/L[12]。然而由于缺少促进三股螺旋折叠的C-端前导肽,重组胶原蛋白只能以单链的形式分泌到胞外。通过表达带有C-端前导肽的胶原蛋白序列和共表达羟化酶可以促进人源胶原蛋白在毕赤酵母中折叠形成三股螺旋[13],但是会导致其表达量下降和在内质网中的积累[14];即使仅截取9 kDa的胶原域片段并将C-端前导肽替换为分子量低的折叠域仍无法在毕赤酵母分泌具有三股螺旋结构的胶原蛋白[15]。
谷氨酸棒杆菌(Corynebacteriumglutamicum)是公认的符合食品安全标准的宿主,不含内毒素,可应用于氨基酸、有机酸、药用蛋白等的生产,其含有丰富的信号肽序列和单层膜结构,且胞外很少检测到蛋白酶活性,有利于异源蛋白的分泌表达。目前研究表明其具有2条主要分泌途径,通过不同信号肽使蛋白质穿过细胞膜,分别是分泌未折叠蛋白的Sec依赖型和转运折叠蛋白的Tat依赖型。对C.glutamicumATCC 13032的胞外蛋白组进行研究,发现在摇瓶水平,分泌型蛋白Cg2052的含量最高[16];对该菌株在高密度培养条件下的分泌组分析,发现胞外蛋白Cg1514占比最高[17],以Cg1514的信号肽介导分泌淀粉酶的产量达786.2 mg/L;PorB是谷氨酸棒杆菌中4种孔道蛋白之一,对阴离子选择型细胞壁通道的形成起重要作用,可以有效地作为锚定蛋白用于细胞表面展示,而且其信号肽介导的Sec依赖性分泌途径可以高效分泌外源蛋白,介导M18 scFv的分泌量达68 mg/L[18];CspB作为几种谷氨酸棒杆菌菌株的主要分泌蛋白和表面蛋白,其信号肽作为Sec类型的强信号肽用于多种外源蛋白的分泌表达[19]。对C.glutamicumR基因组分析发现,由CgR0949介导的Tat依赖型分泌途径分泌的α-淀粉酶活性最高[20];后续与Ptac启动子结合CgR0949进行(green fluorescent protein,GFP)分泌表达,产量可达2.8 g/L;此外,有研究报导来源于大肠杆菌的TorA信号肽可以有效地介导GFP在C.glutamicumATCC 13869中经Tat依赖型途径的分泌表达[21],过表达Tat途径的TatABC蛋白的同时用TorA信号肽介导分泌的pro-TG蛋白的量大于经Sec途径的产量[22]。
为了搭建谷氨酸棒杆菌分泌表达重组胶原蛋白的平台,本研究选用来自Streptococcuspyogenes胶原蛋白Scl2中稳定性较高的B片段(约占CL胶原域的1/3)[6]为研究对象,在B前端插入辅助胶原折叠形成三股螺旋结构的V-domain和胰蛋白酶切位点LVPRGS,通过在V-B前端引入不同信号肽,并进行发酵条件优化,对目的蛋白进行分离纯化和表征。本研究为重组胶原蛋白异源表达新宿主的选择提供基础,也为谷氨酸棒杆菌分泌表达信号肽的选择提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌E.coliJM109用于载体构建和扩增,谷氨酸棒状杆菌C.glutamicumATCC 13032用于目的基因表达;大肠杆菌-谷氨酸棒杆菌穿梭表达质粒pXMJ19、克隆有V-B基因的质粒pCold-III-V-B,本实验室保藏。扩增不同信号肽构建重组质粒pXMJ19-SPs-V-B所用的引物(表1)苏州金唯智生物科技有限公司。

表1 本研究使用的引物Table 1 Primers used in this study
1.1.2 主要试剂和培养基
蛋白Marker、Prime STAR®HS(Premix)、Blunting Kination Ligation (BKL) Kit、T4 DNA Ligase,TaKaRa公司;异丙基-β-D硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、氯霉素,上海生工生物工程股份有限公司;脑心浸出液肉汤(brain heart infusion,BHI),青岛海博生物;其他试剂均为国产分析纯。
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10,固体培养基含琼脂糖15;氯霉素作为大肠杆菌抗性筛选时,终质量浓度为30 μg/mL。
种子培养基:BHI培养基。
发酵培养基1(g/L)[23]:(NH4)2SO420,玉米浆干粉20,K2HPO41,KH2PO41,MgSO40.25,3-(N-吗啉基)丙磺酸钠盐42,葡萄糖20,pH 7.0。
发酵培养基2:BHI培养基。
发酵培养基3(g/L):葡萄糖150,(NH4)2SO440,KH2PO41,MgSO40.5,玉米浆15,酵母膏1,蛋白胨0.5,MnSO4·H2O 0.01,FeSO4·7H2O 0.01,焦磷酸硫铵素0.001,生物素0.001,轻质碳酸钙20,pH 7.2。
氯霉素在谷氨酸棒杆菌中作为抗性筛选时,终质量浓度为15 μg/mL。
1.2 实验方法
1.2.1 表达载体的构建
pXMJ19-V-B的构建:将质粒pCold-III-V-B和空载pXMJ19均用Hind Ⅲ和EcoR I双酶切,分别回收目的产物,经纯化后,用T4 DNA连接酶于16 ℃过夜连接,并转化至E.coliJM109中,然后涂布于含30 μg/mL氯霉素的LB平板,挑取转化子于37 ℃培养,提取质粒,将测序验证正确的重组质粒命名为pXMJ19-V-B。
pXMJ19-SPs-V-B的构建:以质粒pXMJ19-V-B为模板,设计引物CspB-F/R、PorB-F/R、Cg1514-F/R、CgR0949-F/R、Cg2052-F/R、TorA-F/R,通过PCR获得带有6种不同信号肽的重组质粒。PCR体系为:Prime STAR HS (Premix) 25 μL、上下游引物1 μL、模板1 μL,加水至50 μL。PCR扩增条件为:98 ℃ 2 min;98 ℃ 10 s,55~68 ℃ 10 s,72 ℃ 8 min,30个循环;72 ℃ 10 min。产物回收后做磷酸化处理,16 ℃过夜连接,转化至E.coliJM109,然后涂布于含30 μg/mL氯霉素的LB平板,培养12~14 h挑取单菌落培养送基因测序。测序验证正确后,将质粒命名为pXMJ19-SPs-V-B。
1.2.2 谷氨酸棒杆菌的转化
将测序正确的重组质粒pXMJ19-SPs-V-B电击转化进C.glutamicumATCC 13032感受态细胞,通过抗性筛选得到阳性转化子,并命名为C.glutamicumATCC 13032/pXMJ19-SPs-V-B。为了能够更好地反映信号肽的分泌表达情况,同时构建胞内表达C.glutamicumATCC 13032/pXMJ19-V-B作为对照菌株。
1.2.3 重组菌诱导表达的初始条件
将保存重组菌的甘油管在BHI平板上划线,30 ℃,培养24~32 h,然后挑取单菌落至5 mL的BHI中,30 ℃,200 r/min过夜培养;取一定量的种子液转接至发酵培养基[23],使初始OD600为0.1,28 ℃,200 r/min培养3 h后添加IPTG至终浓度为0.8 mmol/L进行诱导,培养48 h。
1.2.4 重组菌发酵条件的优化
(1)信号肽的优化:将C.glutamicumATCC 13032/pXMJ19-SPs-V-B和C.glutamicumATCC 13032/pXMJ19-V-B分别诱导表达,每隔8 h取样静置15 min测OD600,并绘制生长曲线,诱导结束后,收集发酵上清液,浓缩20倍进行SDS-PAGE分析,比较目的条带的粗细,确定最优信号肽。
(2)发酵培养基的优化:选择最优信号肽对应菌株,分别用发酵培养基1、2、3进行诱导表达,诱导结束后取上清液浓缩后进行SDS-PAGE分析,确定最佳发酵培养基。
(3)起始诱导OD600的优化:将种子液转至最佳发酵培养基,在OD600分别为2、6、10、14时,加入IPTG诱导,48 h后取上清液浓缩,通过SDS-PAGE确定最佳诱导时机。
(4)诱导时长的优化:在最佳起始诱导OD600,加入IPTG分别诱导24、32、40、48、56、64 h,探究诱导时长对pXMJ19-SP-V-B表达量的影响。
(5)IPTG浓度的优化:在最佳起始诱导OD600加入终浓度分别为0.2、0.5、0.8、1.1 mmol/L的IPTG,28 ℃诱导至最佳时长,研究IPTG浓度对pXMJ19-SP-V-B表达的影响。
(6)溶氧条件的优化:在最优条件基础上,将诱导表达培养基的装液量改为50 mL/500 mL(带挡板摇瓶)、50 mL/500 mL、100 mL/500 mL(带挡板摇瓶)、100 mL/500 mL,研究不同溶氧条件对表达的影响。
1.2.5 胶原蛋白的纯化
在最优发酵条件下,收集菌液,4 ℃、12 000 r/min离心25 min,取上清液,经0.22 μm水系滤膜过滤。然后用His TrapTMHP 5 mL亲和纯化,先用5倍柱体积结合缓冲液A(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、10 mmol/L咪唑、pH 7.4)平衡,再以5 mL/min的流速上样。上样结束后,用洗脱缓冲液B(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L咪唑、pH 7.4)进行梯度洗脱获得目的蛋白,并利用SDS-PAGE分析纯化情况。
1.2.6 胰蛋白酶酶切
将纯化后的胶原蛋白与胰蛋白酶以物质的量比250∶1的比例混合,16 ℃过夜酶切后,用HiTrap Desalting做脱盐处理,以超纯水为流动相,流速为5 mL/min,经SDS-PAGE验证后进行真空冷冻干燥。
1.2.7 圆二色谱检测
将冻干后的样品用10 mmol/L、pH 7.4的PB缓冲液溶解成1 mg/mL的溶液,4 ℃平衡48 h后进行圆二色谱鉴定。全波长是在4 ℃下以1 nm为间隔测定190~260 nm的圆二色谱光谱,平均扫描时间为5 s。热变曲线是通过监测225 nm处的圆二色谱信号,以10 ℃/h的升温速率从10 ℃升高到70 ℃获得的,每个温度下平衡8 s,熔融温度(Tm)通过拟合热变曲线的一阶导数求得。
2 结果与分析
2.1 不同信号肽对重组菌表达的影响
信号肽种类不同,介导分泌外源蛋白的能力也有所差别。为了研究不同信号肽对重组胶原蛋白表达的影响,在目的基因前端分别引入信号肽CspB、PorB、Cg1514、CgR0949、Cg2052、TorA,构建重组菌进行诱导表达。如图1-a所示,引入信号肽的菌株整体生长趋势相近,在诱导期的前24 h,均保持较快的生长速度,积累较多菌体;诱导24~48 h,菌体生长速度明显变缓,OD600维持在25左右;对照菌株V-B在诱导期的前24 h生长趋势与其他菌株相似,但诱导24~40 h仍保持较高的生长速度,诱导40~48 h趋于平稳,OD600约为28。诱导结束后,取发酵上清液进行SDS-PAGE分析,如图1-b、图1-c所示,与未插入信号肽的对照菌株相比,所有引入信号肽的菌株发酵上清液中均出现分子质量约为23 kDa的条带,高于目的蛋白的理论分子质量17.82 kDa,这可能是由于胶原域含有大量的脯氨酸,导致胶原蛋白在SDS-PAGE中迁移速度较慢,表观分子质量约为理论分子质量的1.4倍[24]。其中,Cg1514、CspB、PorB介导分泌蛋白的效果较好,尤其是PorB对应目的蛋白条带最粗,因此选择PorB作为介导胶原蛋白V-B分泌的信号肽。

a-不同重组菌株的生长曲线;b-引入信号肽菌株的发酵上清液的SDS-PAGE图;c-对照菌株(未插入信号肽)发酵上清液的SDS-PAGE图(1~6分别对应引入信号肽CspB、PorB、Cg1514、CgR0949、Cg2052、TorA的菌株;M: premixed protein marker)图1 信号肽对菌体生长和蛋白表达的影响Fig.1 Effects of different signal peptides on bacterial growth and protein expression
谷氨酸棒杆菌ATCC 13032在摇瓶水平胞外含量最高的蛋白是Cg2052[16],而在高密度培养条件下胞外的Cg1514蛋白含量最高,本研究中信号肽Cg1514介导分泌胶原蛋白的量明显高于信号肽Cg2052,这种差异可能是由于摇瓶培养条件的区别[17],也可能是由于宿主菌胞外蛋白含量的高低并不能完全决定其信号肽分泌外源蛋白能力的强弱。YIM等[17]对比了摇瓶水平信号肽Cg1514和PorB介导分泌内切木聚糖酶的能力,发现Cg1514介导分泌目的蛋白的产量高;而在本实验中PorB作为信号肽分泌V-B的量约为Cg1514的1.8倍,这可能和蛋白自身性质有关,如蛋白结构和形态等[25],或者与目的蛋白和信号肽的适配性有关[26]。此外,从分泌途径来说,作为Sec依赖型信号肽的Cg1514、CspB、PorB介导的胶原蛋白产量高于Tat依赖型的信号肽CgR0949和TorA,在最新的研究中利用谷氨酸棒杆菌分泌表达蛛丝蛋白,其主要分泌途径为Sec依赖型[27],因此推测Sec依赖型信号肽介导的分泌途径有利于胶原蛋白、蛛丝蛋白等纤维状蛋白的分泌表达。
2.2 发酵培养基对C.glutamicum ATCC 13032/pXMJ19-PorB-V-B表达的影响
在微生物发酵培养的过程中,合适的营养供给是微生物快速生长和目的产物大量合成的基础。为了获得适合C.glutamicumATCC 13032/pXMJ19-PorB-V-B表达的发酵培养基,选取了3种谷氨酸棒杆菌常用培养基1、2、3进行重组菌的发酵。如图2-a所示,重组菌在3种发酵培养基中的生长状况有明显差异:在培养基2中,诱导16 h菌浓度达到最高,直到诱导结束一直维持在10左右,菌体生长受限,积累菌量最少;在培养基1中,菌体前期生长迅速,后期生长趋势变缓,诱导24~48 h,OD600逐渐增加到25左右;发酵培养基3中菌体前期生长速度虽低于培养基1,但诱导40 h内一直维持较高的增长速度,诱导48 h时OD600与培养基1相当。

a-不同培养基下菌株的生长曲线;b-不同培养基下发酵上清液的SDS-PAGE图(泳道1~3分别对应培养基1、2、3)图2 培养基条件对菌体生长和蛋白表达的影响Fig.2 Effects of medium conditions on bacterial growth and protein expression
取发酵上清液做SDS-PAGE鉴定,如图2-b所示,培养基1中目的蛋白表达量最高,条带最粗;培养基3次之;培养基2产量最低,几乎看不到条带。分析胶原蛋白在培养基1表达量高的原因可能包括:
(1)培养基1中特有的3-(N-吗啉基)丙磺酸钠盐可提供pH在6.5~7.9范围的缓冲环境,有利于菌体的快速生长和外源蛋白的表达;(2)培养基1和培养基3虽然诱导结束菌浓度相近,但培养基1中的菌体前期生长速度快,积累了较多菌量,在发酵后期较培养基3更有利于目的蛋白的表达和积累。因此,选择培养基1作为重组胶原蛋白V-B分泌表达的发酵培养基。
2.3 起始诱导OD600对C.glutamicum ATCC 13032/pXMJ19-PorB-V-B表达的影响
起始诱导OD600对重组菌合成目的蛋白有很大影响,当菌体处于对数生长期,活力最强,能很快适应添加诱导剂后的环境,迅速进入蛋白合成期。为了探究起始诱导OD600对C.glutamicumATCC 13032/pXMJ19-PorB-V-B表达的影响。如图3-a所示,培养前4 h,菌种处于延滞期,生长缓慢,OD600约为2;培养4 h后开始进入对数期,4~14 h为菌种的对数生长期,OD600从5提高至18;之后生长速度明显变缓。因此,在种子液转接至发酵培养基后,控制OD600分别达到2、6、10、14时,添加IPTG至终浓度为0.8 mmol/L进行诱导,28 ℃培养48 h,每隔8 h测定OD600并绘制生长曲线。如图3-b所示,受起始OD600的影响,菌株在诱导表达前8 h,OD600仍维持较大差距。诱导16 h,差距明显缩小,OD600达到22左右;诱导24 h后,菌体生长速度变缓,OD600以较低速度增长,诱导48 h,所有条件的最终OD600差别不大,都达到28左右。由图3-c可知,诱导结束后,起始OD600为2和6的菌株对应目的条带较粗,蛋白表达量高。可能是由于起始OD600为10和14的菌株诱导剂添加时间较晚,前期培养基中营养物质被大量消耗,影响后期目的蛋白合成。而OD600为2时,可观察到菌体处于延滞期,故选取处于对数生长期的OD600=6为最佳起始诱导菌浓度。

a-未加诱导剂菌株的生长曲线;b-不同起始诱导OD600下菌株的生长曲线;c-不同起始诱导OD600下发酵上清液的SDS-PAGE图(泳道1~4分别对应起始诱导OD600为2、6、10、14;M-premixed protein marker)图3 起始诱导OD600对菌体生长和蛋白表达的影响Fig.3 Effect of initial induction of OD600 on bacterial growth and protein expression
2.4 诱导时长对C.glutamicum ATCC13032/pXMJ19-PorB-V-B表达的影响
由图3-b诱导期菌浓度变化情况发现,诱导48 h,OD600仍有缓慢上升的趋势,表明菌体仍在积累,诱导时间会影响菌量和目的蛋白的表达量。为了确定最佳诱导时长,在OD600=6时加入IPTG至终浓度为0.8 mmol/L进行诱导。由图4-a可看出,在诱导前16 h,菌体保持较快的生长速度,诱导16~48 h,菌体生长速度放缓,诱导48~64 h,OD600趋于稳定,维持在28左右。从图4-b可观察到,在24~40 h,目的条带亮度增加,目的蛋白表达量随诱导时间的延长而增加;诱导时间超过40 h后,目的蛋白条带没有明显的变化,蛋白未出现降解的迹象。考虑到随着培养时间的延长,体系中营养物质有限,会积累较多代谢产物,导致菌体衰退和老化,以及获得更高的时空产量,故选取40 h为最佳诱导时长。

a-不同诱导时长菌株的生长曲线;b-不同诱导时长下发酵上清液的SDS-PAGE图(泳道1~6分别对应发酵时长24、32、40、48、56、64 h)图4 诱导时长对菌体生长和蛋白表达的影响Fig.4 Effect of induction time on bacterial growth and protein expression
2.5 IPTG浓度对C.glutamicum ATCC 13032/pXMJ19-PorB-V-B表达的影响
IPTG作为半乳糖的结构类似物,能够诱导乳糖操纵子下游基因的表达,其添加量对菌株生长及蛋白产量可能有一定影响。为了确定诱导剂最适添加浓度,在OD600=6时加入IPTG。从图5-a可看出,IPTG浓度对菌体整体生长趋势无太大影响。由图5-b可知,IPTG终浓度为0.5 mmol/L时,目的蛋白条带最粗,0.2 mmol/L次之;终浓度为0.8和1.1 mmol/L的目的条带较浅,可能是由于较高的诱导剂浓度会造成菌体代谢压力大而导致蛋白产量下降[28]。因此在本实验中诱导剂IPTG的最佳工作浓度为0.5 mmol/L。
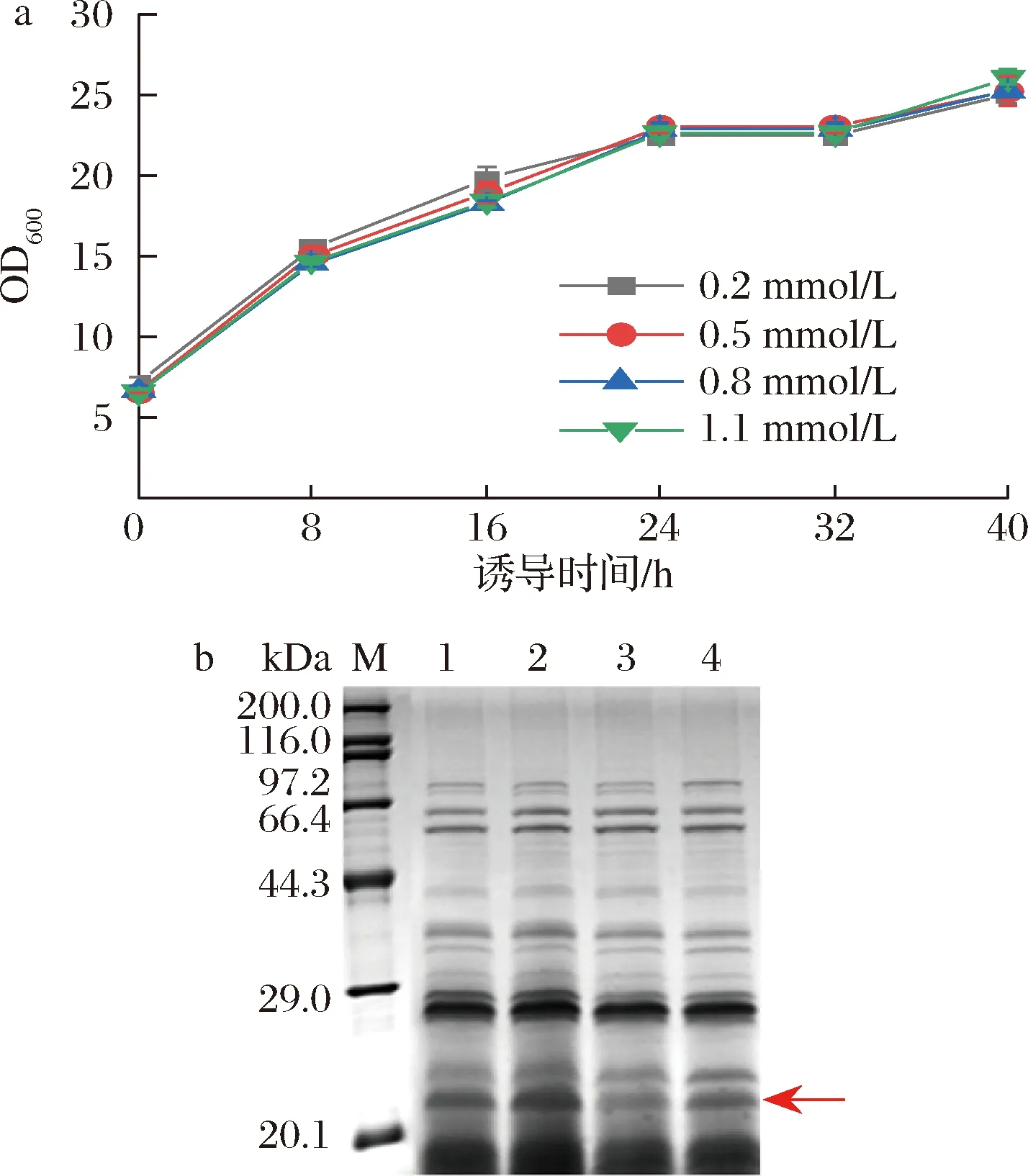
a-不同IPTG浓度下菌株的生长曲线;b-不同IPTG浓度下发酵上清液的SDS-PAGE图(泳道1~4分别对应IPTG浓度为0.2、0.5、0.8、1.1 mmol/L)图5 IPTG浓度对菌体生长和蛋白表达的影响Fig.5 Effects of IPTG concentration on bacterial growth and protein expression
2.6 溶氧对C.glutamicum ATCC 13032/pXMJ19-PorB-V-B表达的影响
谷氨酸棒杆菌是严格的好氧型细菌,其生长代谢和产物合成均需要氧气,因此氧气浓度至关重要。由图6-a可看出,在诱导相同时长下,带挡板的摇瓶OD600比不带挡板的高,且相同类型摇瓶,装液量低的OD600较高,说明溶氧对菌体的生长状况影响较大。诱导0~8 h,带挡板摇瓶的菌体生长速度很快,约为相同装液量不带挡板摇瓶的2倍,其中装液量为50 mL和100 mL的带挡板摇瓶在诱导8 h的OD600分别超过50和43,之后OD600无太大变化,进入稳定期;不带挡板摇瓶条件下的菌体OD600在诱导0~24 h稳定增长,诱导24 h后,OD600保持平稳,诱导40 h后,装液量50 mL和100 mL的摇瓶OD600分别达到40和28。如图6-b所示,装液量50 mL带挡板的摇瓶目的条带最粗。表明溶氧对菌体生长和蛋白表达有显著影响,高的溶氧条件有利于菌体生长和外源蛋白表达。YANG等[29]在谷氨酸棒杆菌中表达腈水合酶,摇瓶培养最高OD600为15.6,酶活性为143.1 U/mL,在10 L发酵罐中的高密度发酵,OD600达到200,总酶活性达到1 432 U/mL,表明在发酵罐水平对溶氧的严格控制可以显著提高谷氨酸棒杆菌中外源蛋白的表达,对进一步高密度培养有指导意义。
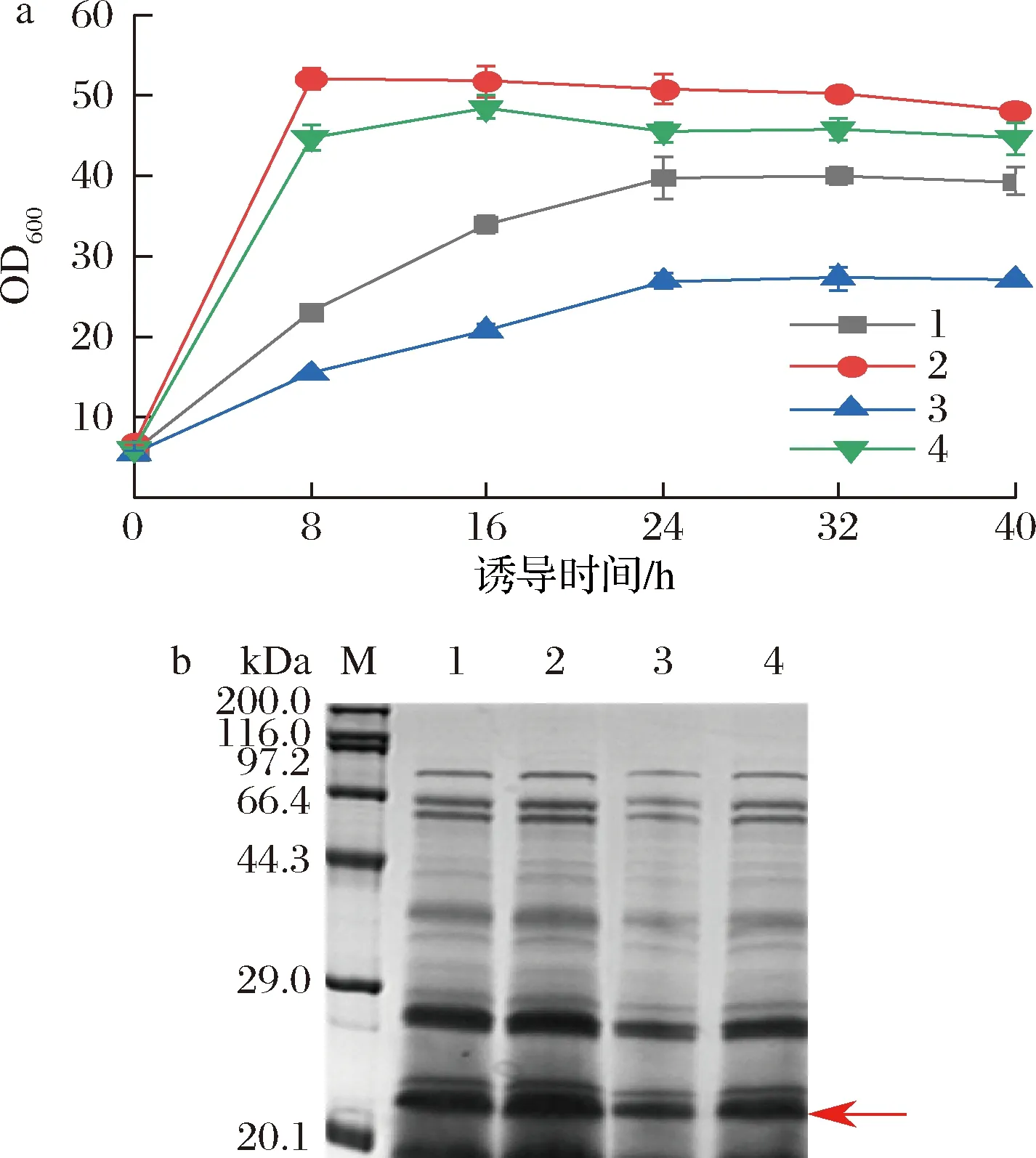
a-不同溶氧条件下的生长曲线;b-不同溶氧条件下发酵上清液的SDS-PAGE图(1~4分别对应50 mL/500 mL、50 mL/500 mL带挡板摇瓶、100 mL/500 mL、100 mL/500 mL带挡板摇瓶)图6 溶氧对菌体生长和蛋白表达的影响Fig.6 Effects of dissolved oxygen on bacterial growth and protein expression
2.7 重组胶原蛋白V-B的表征
重组胶原蛋白V-B包含V domain和胶原域B,纯化后经胰蛋白酶消化,V domain被切成多个小肽段,而胶原域B如果正确折叠形成了具有刚性的三股螺旋结构,则不会被胰蛋白酶消化。由图7-a可知,酶切前V-B分子质量约为23 kDa,酶切后有明显的单一条带,分子质量约为12 kDa,与胶原域B分子质量的1.4倍相符,可以推测分泌表达出的胶原蛋白具有三股螺旋结构。对胶原域B进行除盐冻干处理,称重估算产量约为30 mg/L,是优化前的3倍。为了进一步确定胶原域B的二级结构,进行了圆二色谱鉴定,如图7-b所示,胶原域B在225 nm处有胶原蛋白的特征正峰,表明其正确折叠形成三股螺旋结构。又利用圆二色谱在10~70 ℃扫描其热变曲线,如图7-c所示,进行拟合后显示胶原域B的Tm值为25.82 ℃,与文献报道相近[30]。因此,通过信号肽的优化,构建的谷氨酸棒杆菌表达体系可以直接分泌表达具有三股螺旋结构的胶原蛋白。
PENG等[7]在大肠杆菌中表达来源于化脓性链球菌的全长Scl2胶原蛋白V-CL,在摇瓶水平最高产量为300 mg/L,发酵罐水平最高产量达19 g/L。本研究中胶原域B的表达量约为30 mg/L,忽略酶切、除盐、浓缩的损失以及序列长度对蛋白表达的影响,根据分子质量估算酶切前重组胶原蛋白V-B的保守产量约为67.3 mg/L,而V-B的分子质量约为胶原蛋白V-CL的1/2,由此推算V-B在谷氨酸棒杆菌中的产量约为大肠杆菌中的1/2,且本研究中目的基因尚未进行针对宿主的密码子优化,因此推测谷氨酸棒杆菌在分泌表达胶原蛋白上仍有较大潜力。
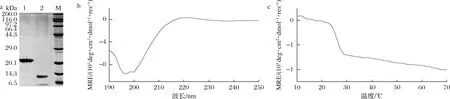
a-SDS-PAGE图(泳道1为纯化后的V-B,泳道2为酶切后样品);b-胶原域全波长图谱;c-胶原域热变曲线图7 重组胶原蛋白V-B纯化、酶切后的SDS-PAGE图及胶原域B的圆二色谱图Fig.7 SDS-PAGE after purification and digestion of V-B and circular dichroism of B domain
3 结论
本研究以食品安全级菌株谷氨酸棒杆菌为底盘细胞,通过引入不同种类信号肽介导胶原蛋白的分泌表达,结果显示Sec依赖型信号肽PorB介导分泌胶原蛋白的产量最高,经发酵条件优化,胶原蛋白的产量提高到优化前的3倍,经圆二色谱表征,证明其胶原域正确折叠形成三股螺旋结构,同时发现溶氧是摇瓶水平影响胶原蛋白产量的关键因素,为工业生产水平的进一步放大试验提供了指导。本研究是胶原蛋白在谷氨酸棒杆菌中表达的首次尝试,后续可通过密码子优化、表达元件和载体结构等方面的进一步优化提高胶原蛋白的表达量,并且,溶氧作为好氧发酵过程中的重要参数,通过在发酵罐水平对溶氧的严格控制有望大幅度提高胶原蛋白在谷氨酸棒杆菌中的产量。本研究中谷氨酸棒杆菌分泌表达胶原蛋白体系的建立,为胶原蛋白的重组表达提供了新的宿主选择,也为微生物难以分泌具有三股螺旋结构胶原蛋白的困境提供了解决思路和理论依据。
