糖耗速率对浓香型白酒发酵过程异戊醇合成的影响
2022-08-18梁清文方芳
梁清文,方芳*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2(江南大学 未来食品科学中心,江苏 无锡,214122)3(江南大学 食品合成生物技术教育部工程研究中心,江苏 无锡,214122) 4(江南大学 江苏省食品合成生物技术工程研究中心,江苏 无锡,214122)
异戊醇是微生物在发酵过程中代谢产生的高级醇重要组分。异戊醇对白酒的风味有一定的贡献作用,但其浓度过高可能会使酒体呈现异味且可能产生一定的毒性效应[1-2]。在保证白酒风味的同时提高白酒的饮用舒适感需要将白酒中的异戊醇含量控制在适当范围(<35 mg/100 mL)[3]。
白酒发酵体系是多菌种参与的开放发酵体系,异戊醇的合成不仅与酵母菌的氨基酸代谢有关,也受多种环境因素影响,依此异戊醇的减控策略主要分为微生物手段、调整合成前体含量和优化发酵条件3种。Saccharomycescerevisiae、Pichiakudriavzevii、Kazachstania是异戊醇合成的主要贡献菌[3-5],其中S.cerevisiae是减控异戊醇的主要研究对象。选育低合成异戊醇的酵母菌是减控单一菌种发酵酒类中异戊醇的有效手段,使用基因工程[6-9]、诱变选育[10-12]、天然优良菌株的分离纯化[13]等选育方法获得的酵母菌在对应模拟发酵体系可减控20%~60%异戊醇。但基因工程菌目前不能用于食品发酵,而其他选育获得的菌株在混菌发酵体系中减控效果尚未获得验证。选育高效合成异戊酯的菌株对减少固态发酵白酒异戊醇也有一定效果,如采用高产酯低产高级醇酵母作为主发酵菌可使清香型白酒的异戊醇质量浓度从779.6 mg/L降至643.1 mg/L[14],在起始时接种Wickerhamomycesanomalus也能使浓香型白酒异戊醇质量浓度从127.7 mg/L降至70.2 mg/L[15]。减少酵母增殖量被证实为是有效的减控手段,如添加活性干酵母可使酱香型白酒中异戊醇高级醇含量降低24.6%[16]。增加氮源或碳氮源供给也能达到异戊醇的减控作用,如提高α-氨态氮含量可使高粱汁发酵体系中高级醇含量降低31.8%[17],添加快速氮源也使黄酒发酵体系中异戊醇合成量降低23.03%~27.9%[18-19];提高用曲量或添加酶制剂能使液态法发酵的大曲酒异戊醇含量降低52.2%[20],但是此策略具有不稳定性,有时会导致异戊醇含量升高[21]。此外,也有研究通过调整发酵工艺来控制固态白酒发酵体系中的异戊醇含量,如使用高温发酵可将酒醅的异戊醇含量降低44.6%[22]、提高酒醅孔隙度可将清香型白酒里异戊醇相对含量降低25%[23]。综上可知,虽然可通过多种方法来减控异戊醇,但是一些方法的适用性仍待验证。因此,深入研究调控策略的内在调控机制,对解析白酒发酵过程的异戊醇合成机制及研究异戊醇的精准调控具有重要意义。
本研究将通过考察浓香型白酒发酵过程中主要产异戊醇酵母菌种类、初始浓度、发酵条件和大曲糖化酶活力对异戊醇合成的影响,揭示与异戊醇合成相关的发酵指标或参数,以期减少浓香型白酒中异戊醇的合成量,为降低白酒发酵过程的异戊醇提供减控策略。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品采集
本研究中的样品均由江苏某酒厂提供。大曲为同一车间的样品,适当粉碎后混合室温保存;酒醅为浓香型白酒发酵用酒醅,取样后置于-80 ℃保存。
1.1.2 菌株
酵母菌株SaccharomycescerevisiaeJP3、PichiafermentansJP22、PichiakudriavzeviiJP1为本课题组保藏菌株,分离自浓香型白酒发酵酒醅[3];NaumovozymacastelliJP7W-W、TorulasporadelbrueckiiJP2d-2、KazachstaniahumilisJP5d-30为本研究获得,分离自浓香型白酒发酵酒醅;NaumovozymadairenensisCBS421为标准菌株,生物风网站。
1.1.3 培养基
YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母提取物10。
孟加拉红培养基(g/L):蛋白胨5,葡萄糖10,KH2PO41,MgSO2·7H2O 0.5,琼脂20,0.3%(体积分数)孟加拉红溶液100 mL,氯霉素0.1,琼脂20。
1.1.4 主要试剂及仪器
异戊醇、叔戊醇,Sigma公司;福林酚试剂,麦克林公司;DNS试剂、蜗牛酶,索莱宝生物科技有限公司;2×TaqPlus Master Mix,康为世纪生物科技有限公司;琼脂糖及其他试剂均为色谱纯或分析纯,上海生工生物工程公司;引物由苏州金唯智生物科技有限公司合成。
恒温培养箱,上海博迅公司;GC-2010AF气相色谱仪、UV1240紫外可见分光光度计,日本岛津公司;Waters 2695高效液相色谱仪,美国沃特世公司;PCR仪、Aminex HPX-87H有机酸分析柱,美国Bio-Rad公司;恒温水浴锅,上海精宏实验设备有限公司;DYY-6C型电泳仪,北京市六一仪器厂;凝胶成像系统GelD,美国 Bio-Rad公司。
1.2 试验方法
1.2.1 酵母种类及初始浓度对异戊醇合成的影响
称取250 g入池酒醅于500 mL广口瓶中,分别与用生理盐水洗涤并重悬的S.cerevisiaeJP3(5×105,5×106,5×107CFU/g)、P.fermentansJP22(1×106,5×106,1×107CFU/g)、P.kudriavzeviiJP1(1×106,5×106,1×107CFU/g)菌液混合,密封后发酵置于30 ℃下发酵。对照组为不添加酵母菌。
1.2.2 发酵条件对异戊醇合成的影响
发酵起始温度根据实际生产时的发酵条件进行梯度设置和升温过程模拟,分别以18、22、26、30 ℃作为发酵起始温度,在0~2 d温度保持不变, 3~7 d每天升温2 ℃直至达到30 ℃后保持恒温发酵,其中起始发酵温度为18 ℃时,在第6~7天共升温4 ℃。
考察装料量对异戊醇合成的影响时,使用密封性良好的50 mL离心管为发酵容器,分别装填20 g(松散装料),25 g(正常装料),30 g(较紧实装料)以及35 g(紧实装料)。盖紧盖子后置于30 ℃下发酵。
1.2.3 大曲糖化酶活力对异戊醇合成的影响
以不同糖化酶活力的大曲为考察对象,探究还原糖供应对异戊醇合成的影响。将3种大曲分别与酒醅充分混合后,取250 g装于500 mL广口瓶中,密封后置于30 ℃恒温发酵。
1.3 分析测定
1.3.1 酒醅中酵母数量的测定
准确称取5.0 g酒醅,置于装有95 mL生理盐水的摇瓶(含玻璃珠)中。置于摇床中,30 ℃、220 r/min振荡30 min,取上清液进行梯度稀释,涂布于孟加拉红平板30 ℃培养1~2 d。毕赤酵母数量分析采用孟加拉红平板计数法(图1-b中的大菌落)。酿酒酵母数量通过对图1-b中的非毕赤酵母菌落进行PCR验证后计数。扩增所用的特异性引物为SC2F(GGCCAGGTTCTTGTAGCCAA)、SC2R(GCTTCCCTGAGA-TCGCTTCT)。具体操作为:挑菌落至含10 μL ddH2O的PCR管中,加入5 μL 50 U/μL蜗牛酶混匀,37 ℃水浴10 min再置于-80 ℃中放置30 min。取上层液体作为PCR的模板DNA。PCR扩增体系:12.5 μL 2×TaqPlus Master Mix,上下游引物各1 μL,模板DNA 3 μL以及ddH2O 7.5 μL。PCR条件:94 ℃变性5 min,其次是30个循环包括在94 ℃ 30 s、63 ℃ 15 s和72 ℃ 15 s,最后在72 ℃延伸5 min。对产物进行凝胶电泳检测,将PCR产物为235 bp的菌落记录为酿酒酵母。
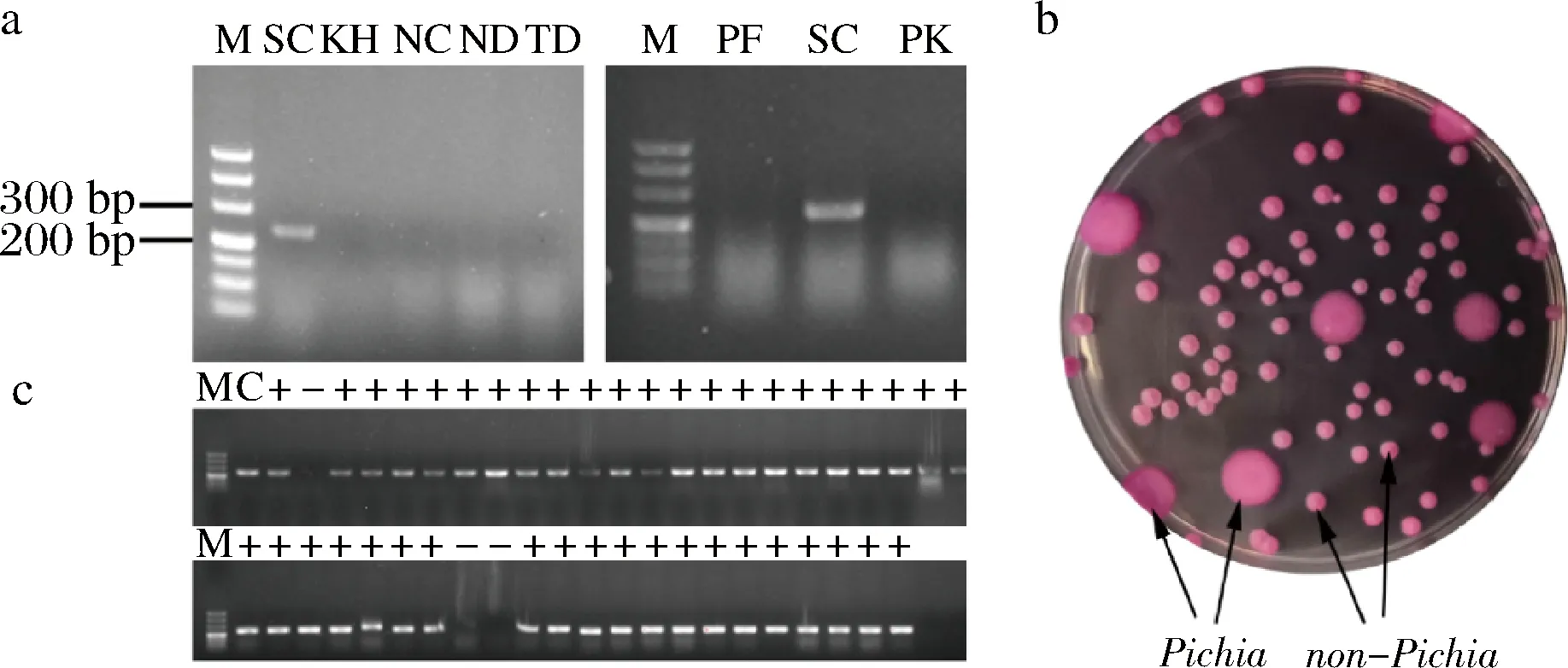
a-酿酒酵母特异性引物验证(M-Marker,SC-S.cerevisiae,KH-K.humilis,NC-N.castelli,ND-N.dairenensis,TD-T.delbrueckii,PF-P.fermentans,PK-P.kudriavzevii,下同);b-涂布孟加拉红的毕赤酵母计数方法(大菌落为Pichia);c-菌落PCR法分析图b中的S.cerevisiae数量(C-S.cerevisiae对照,+-S.cerevisiae, --non-S.cerevisiae)图1 酒醅中毕赤酵母和酿酒酵母的定量分析Fig.1 Quantitative analysis of Pichia and S.cerevisiae in fermented grain
1.3.2 大曲酶活力的测定
糖酶活力测定参考QB/T 4259—2011《酿酒大曲通用分析方法》,蛋白酶活力测定参考SB/T 10317—1999《蛋白酶活力测定法》。
1.3.3 还原糖的测定及表观耗糖速率的估算
固态样品预处理:准确称取10 g发酵酒醅,加入20 mL超纯水,冰浴超声30 min,4 ℃下10 000 r/min离心5 min,取上清液用于检测分析[24]。采用DNS法检测还原糖含量[25],预估表观耗糖速率的计算如公式(1)所示:

式中:m0,拌曲酒醅中初始还原糖含量,g/kg;m1,考察时间范围对应的最高还原糖含量,g/kg;m2,考察时间范围对应的最低还原糖含量,g/kg;t,发酵时间,d。
1.3.4 酒醅乙醇含量的测定
样品提取液采用高效液相色谱法检测乙醇含量[26]。色谱柱为Aminex HPX-87H有机酸分析柱 (300 mm×7.8 mm),色谱条件:流动相0.05 mol/L H2SO4;流速0.5 mL/min;进样量10 μL;柱温40 ℃;示差检测器45 ℃。
1.3.5 异戊醇的测定
待测样品中加入终质量浓度为6 mg/L的叔戊醇,采用顶空-气相色谱-氢离子火焰检测器检测异戊醇含量[27]。色谱柱为DB-Wax(30.0 m×0.32 mm×0.25 μm),平衡温度70 ℃,平衡时间35 min。进样口温度200 ℃,检测器温度260 ℃,分流比3∶1。升温程序:初始温度40 ℃,保持5 min,然后以10 ℃/min的速度升至180 ℃保持5 min。载气N2,流速9 mL/min。
2 结果与分析
2.1 酵母种类及其初始菌浓对异戊醇合成的影响
S.cerevisiae和Pichia是浓香型白酒发酵过程合成异戊醇的主要酵母菌[3],它们在增殖过程主要通过Harris途径合成异戊醇[28-29]。Harris途径以糖的利用为起始,为探究白酒发酵过程酒醅中S.cerevisiae和Pichia的增殖、糖的消耗与异戊醇合成的关系,本研究首先考察了酒醅中酵母种类与起始浓度对还原糖消耗和异戊醇合成的影响。由图2-c可知,实验条件下异戊醇的合成时期为1~7 d。
由图2-a可知,发酵起始酒醅中Pichia的种类和菌浓度对S.cerevisiae在异戊醇合成时期的增殖几乎没有影响,而发酵起始酒醅中S.cerevisiae的种类和菌浓度对Pichia在异戊醇合成时期的增殖也没有影响。在异戊醇合成时期,Pichia的增殖倍数为0~2.5,而S.cerevisiae的增殖倍数为1.3~5.3。Pichia增殖倍数的改变没有降低异戊醇的合成水平,而S.cerevisiae的增殖倍数从5.3降低至1.3(发酵起始酒醅中S.cerevisiae数量为5×107CFU/g)时异戊醇合成量降低了22.9%,在异戊醇合成时期之后酒醅中的含量降低41.0%(图2-c)。由图2-b可知S.cerevisiae增殖倍数最低的实验组酒醅中前3 d的预估表观耗糖速率最低,为13.9 g/(kg·d),比对照低42.3%。其他实验组发酵前3 d预估表观耗糖速率为21.2~26.6 g/(kg·d),与对照[24.2 g/(kg·d)]较接近,对异戊醇无减控效果或减控效果不明显。同时,不同酵母种类及初始菌浓度的添加条件下7 d的乙醇含量均在5.1~5.8 mL/100 g,乙醇含量变化不明显(数据未展示),除添加1×106CFU/g和1×107CFU/gPichiakudriavzevii会导致乙醇含量下降1.4%~2.5%以外,其余添加情况可提高乙醇含量0.8%~12%。
这些结果说明,S.cerevisiae的增殖倍数、预估表观耗糖速率和异戊醇合成水平之间存在一定的相关性;发酵起始S.cerevisiae的数量可影响白酒发酵过程酒醅中预估表观耗糖速率和异戊醇水平,即降低S.cerevisiae增殖倍数、减慢预估表观耗糖速率可使异戊醇合成水平降低。

a-酵母增殖数量;b-还原糖消耗量;c-异戊醇合成量图2 酵母菌种类和初始菌浓对白酒发酵过程异戊醇合成的影响Fig.2 Effect of yeast species and its initial concentration on iso-amyl alcohol synthesis during Baijiu fermentation
2.2 发酵条件对异戊醇合成的影响
2.2.1 发酵起始温度对异戊醇合成的影响
酒醅温度是监测发酵进程的重要指标,在白酒窖内发酵过程中呈先升高,而后维持高温,最后缓慢降温的变化规律[22,30]。温度可通过改变微生物的代谢强度和酒醅中酶系的水解速度共同影响异戊醇的合成。为探究温度对异戊醇合成的影响机制,考察了发酵起始温度对酒醅中的S.cerevisiae增殖和糖耗速率以及异戊醇合成的影响。由图3-a可知,不同发酵起始温度对Pichia在异戊醇合成时期的增殖倍数没有影响,而采用低于20 ℃的发酵起始温度可使S.cerevisiae增殖速度减慢,增殖倍数降低。Pichia的增殖倍数为1.0~1.2,S.cerevisiae增殖倍数为1.5~2.1。S.cerevisiae增殖倍数从2.1降低至1.5(18 ℃起始发酵),发酵至2 d时预估表观耗糖速率为8.7 g/(kg·d),比26 ℃起始发酵的降低59.4%(图3-b),发酵7 d时异戊醇降低22.6%(图3-c)。而22、30 ℃起始发酵S.cerevisiae增殖倍数虽然无明显变化,但其2 d预估表观耗糖速率分别为10.9和15.1 g/(kg·d),异戊醇也降低了16.5%和17.7%(图3-c)。30 ℃起始发酵的预估表观耗糖速率比22 ℃的高,但是异戊醇减控效率较低,其原因可能是30 ℃发酵时其他不产异戊醇的微生物代谢也比较活跃,消耗了较多还原糖。起始发酵温度对乙醇合成量有较大影响,相较于异戊醇合成量最高的26 ℃起始发酵的酒醅,其他3个温度起始发酵7 d的酒醅中乙醇含量提高了23.7%~36.1%,含量在6.0~6.6 mL/100 g(数据未展示)。
这些结果表明使用较低的入池温度可减控异戊醇,其原因在于低温起始发酵可降低酿酒酵母的增殖数量和降低其预估表观耗糖速率进而减少异戊醇的合成。与本研究相似是,SUN等[31]的研究也表明温度对高级醇合成的影响在于低温降低了酵母对还原糖的利用。

a-酵母增殖数量;b-还原糖消耗量;c-异戊醇合成量图3 发酵起始温度对白酒发酵过程异戊醇合成的影响Fig.3 Effect of initial fermentation temperature on iso-amyl alcohol synthesis during Baijiu fermentation注:*表示P<0.05;**表示P<0.01(下同)
2.2.2 装料量对异戊醇合成的影响
浓香型白酒的入池发酵是先有氧后厌氧的过程[32]。初始氧气含量提高会加快酵母的增殖和代谢活动,从而导致异戊醇含量提高。而白酒的固态发酵工艺中常通过添加稻壳来保持物料蓬松,这也提高了体系中的含氧量。但有研究报道少量提高稻壳量反而能降低异戊醇[19],因此为了平衡添加稻壳带来的疏松作用和体系中的含氧量,本文在不改变酒醅稻壳量的条件下,探究了压紧程度对异戊醇合成的影响。由图4-a可知,不同的装料量对异戊醇合成时期的Pichia和S.cerevisiae增殖无影响,此时期Pichia增殖倍数为3.5~3.8,S.cerevisiae增殖倍数为4.6~4.7,无明显差别。而且4种条件下5 d预估表观耗糖速率均在4.4~4.7 g/(kg·d),无明显差别(图4-b)。由图4-c可知,在相同稻壳含量的酒醅中,压紧程度对异戊醇合成无明显影响,发酵7 d时含量为12.4~13.1 mg/kg。这也进一步验证了先前研究的结果,发酵过程S.cerevisiae大量增殖和还原糖的快速消耗是合成大量异戊醇的前提,而在4种装料量下S.cerevisiae的增殖规律和增殖倍数相同、预估表观耗糖速率都较低且没有明显差别,因此没有减少异戊醇合成的效果。而且4种装料量条件下发酵7 d酒醅中乙醇含量为2.2~2.3 mL/100 g,相较于正常装料量,其他条件的装料量乙醇含量提高了3.7%~5.9%,含量无明显差别(数据未展示)。

a-酵母增殖数量;b-还原糖消耗量;c-异戊醇合成量图4 装料量对白酒发酵过程异戊醇合成的影响Fig.4 Effect of loading amount on iso-amyl alcohol synthesist during Baijiu fermentation
2.3 大曲糖化酶活力对异戊醇合成的影响
浓香型白酒发酵过程的还原糖主要来源于大曲糖化酶水解淀粉原料,初始糖化酶活力会影响糖化速率和还原糖的供应[33]。为探究还原糖的供应对异戊醇合成的影响,考察了大曲糖化酶活力对酵母增殖、预估表观耗糖速率以及异戊醇合成影响。使用糖化酶活力差异显著的大曲对异戊醇合成时期的Pichia和S.cerevisiae生长趋势无明显影响,在此时期Pichia增殖倍数为1.7~2.1,S.cerevisiae增殖倍数为2.2~2.3,表明大曲糖化酶活力对酵母增殖无明显影响(图5-a、图5-c)。分析酒醅中还原糖消耗可以知大曲1、大曲2、大曲3的发酵2 d内预估表观耗糖速率分别为25.7、16.8、15.4 g/(kg·d),即大曲糖化酶活力与酒醅中预估表观耗糖速率是正相关关系,其中大曲2、大曲3中的预估表观耗糖速率分别比大曲1降低34.8%、40.3%(图5-d)。由图5-b可知,酶活力差异明显的大曲对异戊醇合成有显著影响。使用酶活力较低的大曲2和大曲3可减控异戊醇10.3%~13.3%。这表明可通过调整大曲糖化酶活力来达到异戊醇减控的目的。同时,使用不同的大曲对酒醅乙醇含量无明显影响,其含量在4.8~5.1 mL/100 g。相较于糖化酶活力最高的大曲1,使用大曲2、大曲3发酵的酒醅中乙醇含量分别提高了6.2%和0.6%,无明显差别(数据未展示)。
以上结果表明,在一定范围内大曲的糖化酶活力不影响酵母的增殖,但是低糖化酶活力可减慢还原糖的供应,降低酵母利用还原糖的速率来减少异戊醇的合成。

a-大曲糖化酶活力;b-异戊醇合成量;c-酵母增殖数量;d-还原糖消耗量图5 大曲糖化酶活力对异戊醇合成的影响Fig.5 Glucoamylase activity of Daqu and its effect on iso-amyl alcohol synthesist during Baijiu fermentation
3 结论与讨论
探究浓香型白酒发酵过程酵母菌种类、发酵条件以及大曲对异戊醇合成的影响是研究白酒窖内发酵异戊醇合成机制的一部分,可为减控白酒发酵过程的异戊醇提供理论支持。本研究发现改变初始的酵母菌数量与种类、发酵初始温度和大曲糖化酶活力,可降低酵母菌的增殖数量和预估表观耗糖速率,进而降低发酵过程中的异戊醇合成量。通过提高初始的酵母菌浓度确定了降低异戊醇合成时期的S.cerevisae增殖倍数(5.3降低至1.3)和预估表观耗糖速率(降低了42.3%)可减控异戊醇22.9%。同样地,采用较低的发酵起始温度和使用低糖化酶活力的大曲可降低异戊醇合成时期预估表观耗糖速率,减少了异戊醇的合成量。
本研究中所用的酒醅和大曲原料来自不同批次的样品,酵母初始含量和大曲酶活力的不同,造成批次间异戊醇含量差异较大。这也反映了在白酒发酵过程中,需根据实际情况采取对应的调控策略——通过检测大曲、酒醅中S.cerevisiae的数量以及大曲糖化酶活力,来决定是否添加酵母进行数量调整,或将不同库存时间的大曲混合来调整酶活力。通过减少S.cerevisiae增殖倍数与降低预估表观耗糖速率的方法,可实现对浓香型白酒发酵过程的异戊醇减控,并为建立浓香型白酒发酵过程异戊醇调控机制以及其他香型白酒的异戊醇调控的研究提供参考。
