模拟高原环境对小鼠肠道微生物菌群的影响*
2022-08-03仝永娟刘鹏飞丁国羽
仝永娟 束 华 马 刚 杨 斌 刘鹏飞 李 莎 丁国羽
(首都医科大学附属北京世纪坛医院实验动物中心,北京 100038)
肠道微生物菌群对维持生物体的健康起着重要作用[1]。2013年,Zackular等[2]研究发现,肠道微生物菌群不但与传统认知的营养不良、肠炎、肠应激等肠道疾病相关,与肥胖、糖尿病、心脑血管疾病、自身免疫性疾病等也具有一定的相关性。因此,肠道微生物菌群的变化与多种疾病发生及治疗的关系,也成为近些年来研究的热点,如肠道微生物菌群与阿兹海默病的相关性[3]及肠道微生物移植对治疗胃肠道炎症等疾病的作用[4]。更为重要的是,肠道微生物构建了肠脑间的双向通讯体系[5-8]。一方面,肠道微生物可以通过“微生物-肠-脑”轴影响宿主行为[5];另一方面,宿主行为上的变化也能影响肠道微生物菌群的组成[6-8]。目前,尽管较多的研究集中于在多种因素的宿主行为影响下(如饮食、药物等)肠道微生物菌群的变化。然而,有关宿主本身所在环境的变化引起肠道微生物菌群改变的研究仍然缺乏。有研究推测,环境对肠道微生物菌群的影响甚至超过了遗传基因对肠道微生物菌群的影响[9-10]。因此,开展环境变化对肠道微生物菌群影响的研究非常必要。
我国是世界上高原环境最大的国家,高海拔环境下氧分压降低可造成机体各组织器官缺氧而产生高原反应,从而引发各类疾病[11-15]。然而,低压低氧条件(模拟高原环境)下肠道微生物菌群改变的相关研究还不够充分。因此,本研究拟通过16 s rDNA高通量测序,对模拟高原环境下SPF小鼠肠道微生物菌群的变化进行分析,明确与低压低氧条件相关的关键细菌,以期为研究和今后治疗高原疾病提供一定的理论支持和数据支撑。
1 材料和方法
1.1 实验动物
选用体质量均匀的6周龄SPF级雄性C57BL/6N 小鼠12 只,实验小鼠购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】,饲养于首都医科大学附属北京世纪坛医院屏障实验室【SYXK (京) 2017-0025】,温度 20~26 ℃ ,相对湿度40%~70%,光照同期12 h/12 h。实验过程中按实验动物使用的3R原则给予人道关怀,按照首都医科大学附属北京世纪坛医院科研伦理委员会的相关规定进行实验,伦理委员会审批号:sjtkyll-lx-2021(23)。
1.2 试剂与仪器
PCR:Phusion High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶(New England Biolabs);建库试剂盒:TruSeq DNA PCR-Free Sample Preparation Kit(TruSeq);胶回收试剂盒:GeneJET(Thermo Scientific);测序仪:hiseq 2500(Illumina)。
1.3 实验分组
实验小鼠随机分为两组:常压常氧组为对照组,低压低氧组为实验组,每组6只。其中,常压常氧组饲养于高原环境模拟舱外,即为北京平原地区海拔 20~60 m处,低压低氧组饲养于高原环境模拟舱内,为模拟海拔5 000 m的低压低氧高原环境。
1.4 高原环境模拟舱参数
实验使用的DF800多功能高原环境模拟舱由潍坊华信氧业公司生产,设备容积为0.6 m3,高原环境模拟舱设置为(5 000±10)m。
1.5 实验方法
1.5.1小鼠肠道微生物的采集:实验周期28 d结束后,采集小鼠粪便样品,取样后放入冻存管内后迅速冷冻储存于-80 ℃冰箱。
1.5.2小鼠肠道微生物的扩增:采用SDS(Sodium dodecyl sulfate)方法对小鼠肠道粪便微生物进行DNA提取,提取后使用无菌水稀释至1 ng/μL作为模板,扩增引物为515F:GTGCCAGCMGCC GCGGTAA;806R:GGACTACHVGGGTWTCTAAT,2%琼脂糖凝胶电泳得到目的条带,选择400~450 bp之间的序列,割胶回收,使用Thermo Scientific的GeneJET 胶回收试剂盒进行产物纯化,使用TruSeq DNA PCR-Free Library Preparation Kit 建库试剂盒构建文库。
1.5.316 s rDNA高通量测序:用小鼠肠道微生物构建的文库进行测序分析,采用Illumina HiSeq测序平台双末端HiSeq PE250深度测序,再进行相关分析。为了研究样品的物种组成多样性,对所有样品的Effective Tag进行聚类,以97%的一致性(identity)将序列聚类成为OTU(operational taxonomic units),然后对OTU的代表序列进行物种注释。
2 结果
2.1 小鼠肠道微生物的扩增
基因序列扩增结果如图1所示,得到清晰的目的条带,其中条带1~6为常压常氧组,条带7~12为低压低氧组,所得产物清晰明亮,用于下一步测序。
图1 16s rDNA 基因序列扩增结果Fig.1 PCR result of 16s rDNA
2.2 16 s rDNA测序分析
2.2.1样本及宏基因组测序:对12个样本的OTU聚类和注释结果进行分析,结果如表1所示。由表1可知,各组样本用于OTU聚类等后续分析的平均有效数据分别为75 257条和75 568条,而用于构建OTU并且获得注释信息的平均有效序列数为72 055和73 066。
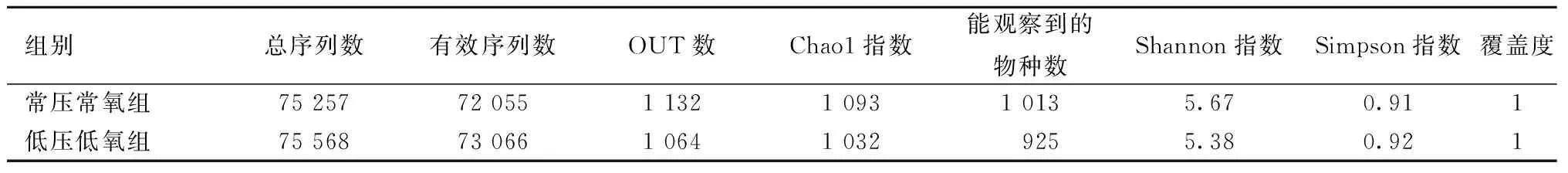
表1 样本信息和Alpha多样性统计Table 1 The sample information and statistical results of Alpha diversity
为了进一步明确测序数据量是否能充分反映低压低氧环境下小鼠肠道微生物菌群的真实情况,随机抽取了不同梯度的测序数据量,构建了物种稀释曲线,结果如图2显示。由图2可知,按组分析的稀释曲线均随着测序数量的增加趋向平坦,表明测序数据量合理。在此条件下,根据不同OTU数在不同标本中的丰度绘制的等级丰度曲线表明:随着OTU数相对丰度的增加趋于平滑,物种分布趋于均匀。
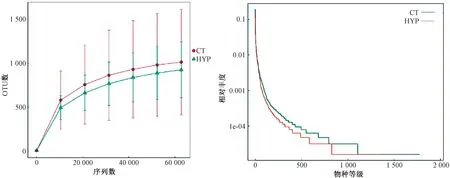
图2 高通量测序的物种多样性曲线Fig.2 The rarefaction curve and rank abundance of the high-through sequencing result
2.2.2样品菌落多样性差异性分析:为了分析不同组别各样品的菌落差异性和相似性,对样品进行基于Weighted unifrac距离的PCoA分析。样品距离越接近,物种组成结构越相似(图3)。如图3所示,常压常氧组和低压低氧组各自倾向于聚集在一起,两组之间则远远分开,使用组间群落结构差异显著性检验Anosim分析结果显示P=0.022<0.05,表示差异显著,印证了PCoA分析的组间对比差异显著。
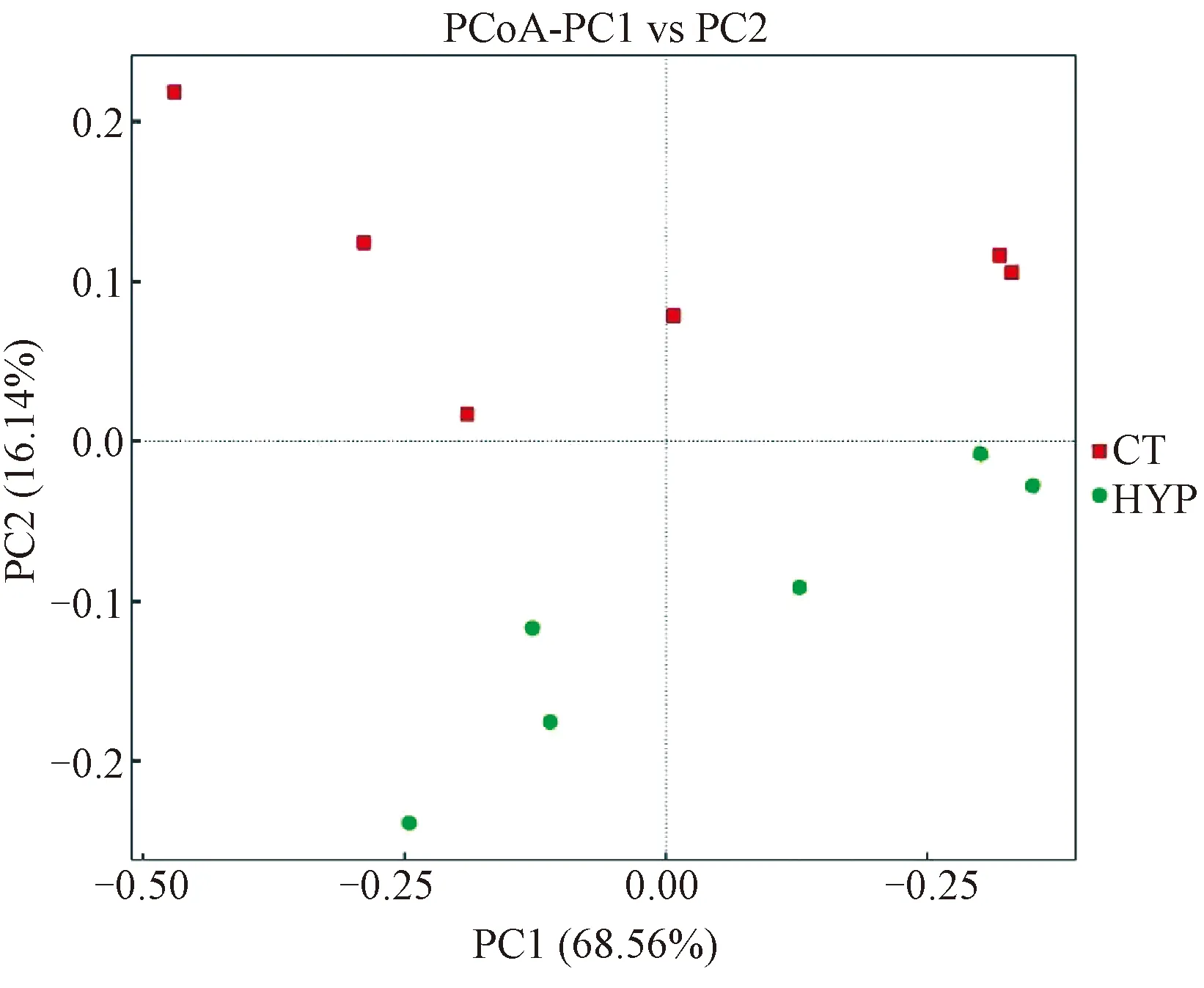
图3 基于Weighted Unifrac距离的PCoA分析Fig.3 The PCoA analysis based on weighted unifrac distance
2.2.3常压常氧组和低压低氧组物种相对丰度分析:为了比较常压常氧组和低压低氧组物种差异,首先根据物种注释结果,选取每个样品或分组在门级水平物种相对丰度前10名的物种。这些物种的频率分布柱形图如图4所示。由图4可知,常压常氧组和低压低氧组在门级水平上丰度靠前的几种微生物分别隶属于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)等,但所占比例有所差别。其中,Verrucomicrobia在组间所占比例差别最明显。为了直接反映不同组别各样品之间物种丰度的差异,将丰度排名前35的属进行聚类分析,绘制热图,找出低压低氧组和常压常氧组的主要差异属,结果如图5所示。由图5可知,低压低氧组的含量较高的属为瘤胃球菌属(Ruminococcus)、肠球菌属(Enterococcus)、阿克蔓菌属(Akkermansia)、普雷沃氏菌UCG-001属(PrevotellaceaeUCG-001)、拟杆菌属(Bacteroides)、另枝菌属(Alistipes)、狄氏副拟杆菌(Parabacteroides)等。常压常氧组含量较高的属则主要为乳杆菌属(Lactobacillus)、别样菌属(Allobaculum)、瘤胃梭菌属(Ruminiclostridium)、罗斯氏菌属(Roseburia)等。
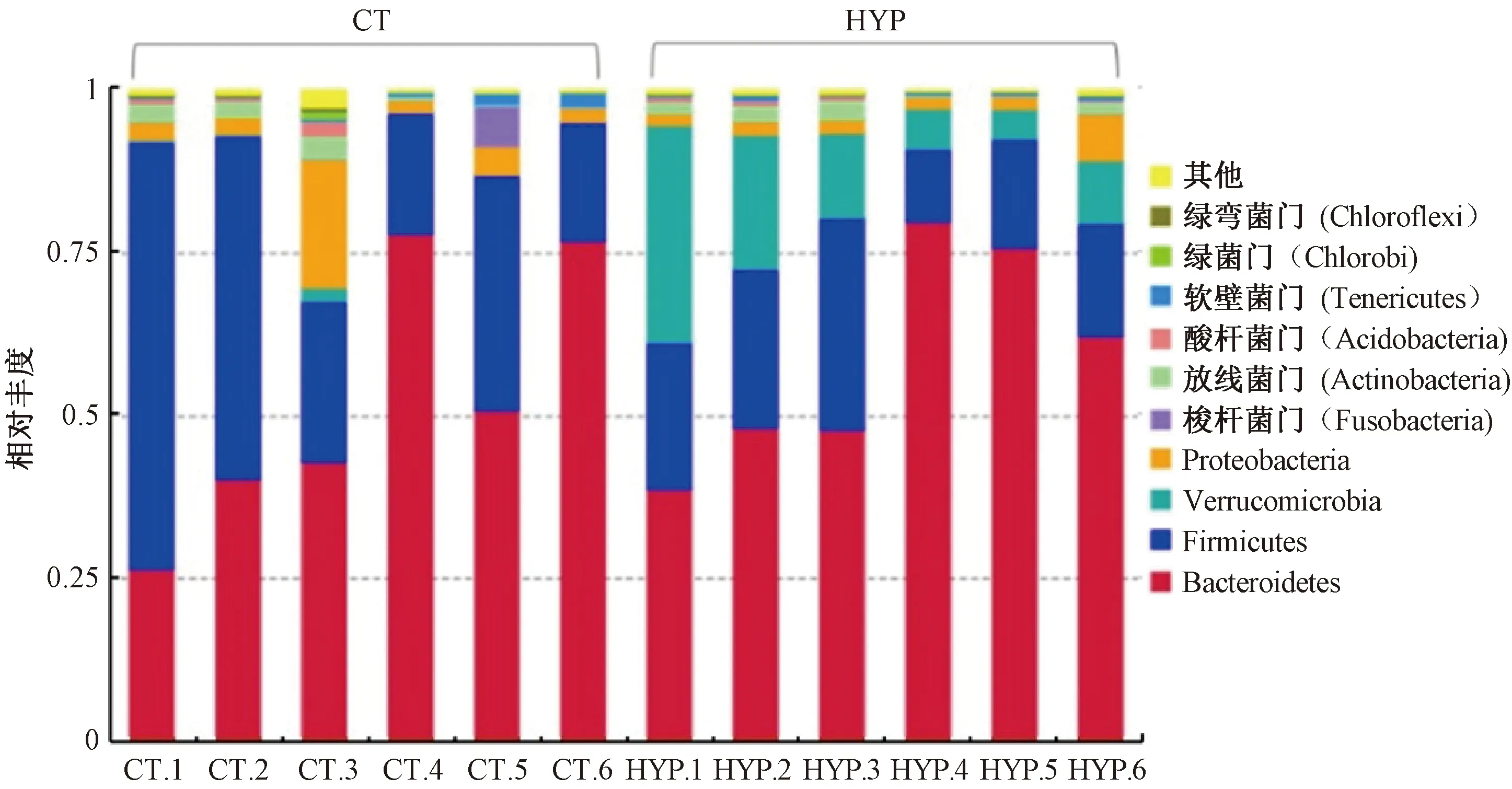
图4 常压常氧与低压低氧条件下肠道微生物在门级水平相对丰度Fig.4 The intestinal microbial flora abundance analysis on phylum level
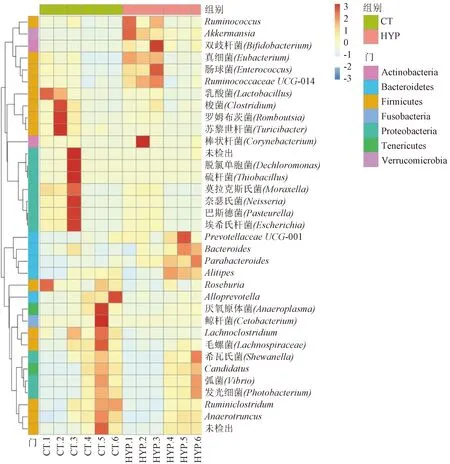
图5 常压常氧与低压低氧条件下肠道微生物的物种丰度聚类热图Fig.5 The heatmap of intestinal microflora
2.2.4低压低氧组特有物种分析:进行LEfSe分析以寻找组间差异显著的物种,结果如图6所示。由图6可知,柱状图显示低压低氧组在属水平上显著增多的菌是Akkermansia,柱状图和进化分支图均显示在低压低氧组中起到重要作用的菌是:疣微菌目(Verrucomicrobiales)的疣微菌科(Verrucomicrobiaceae)。
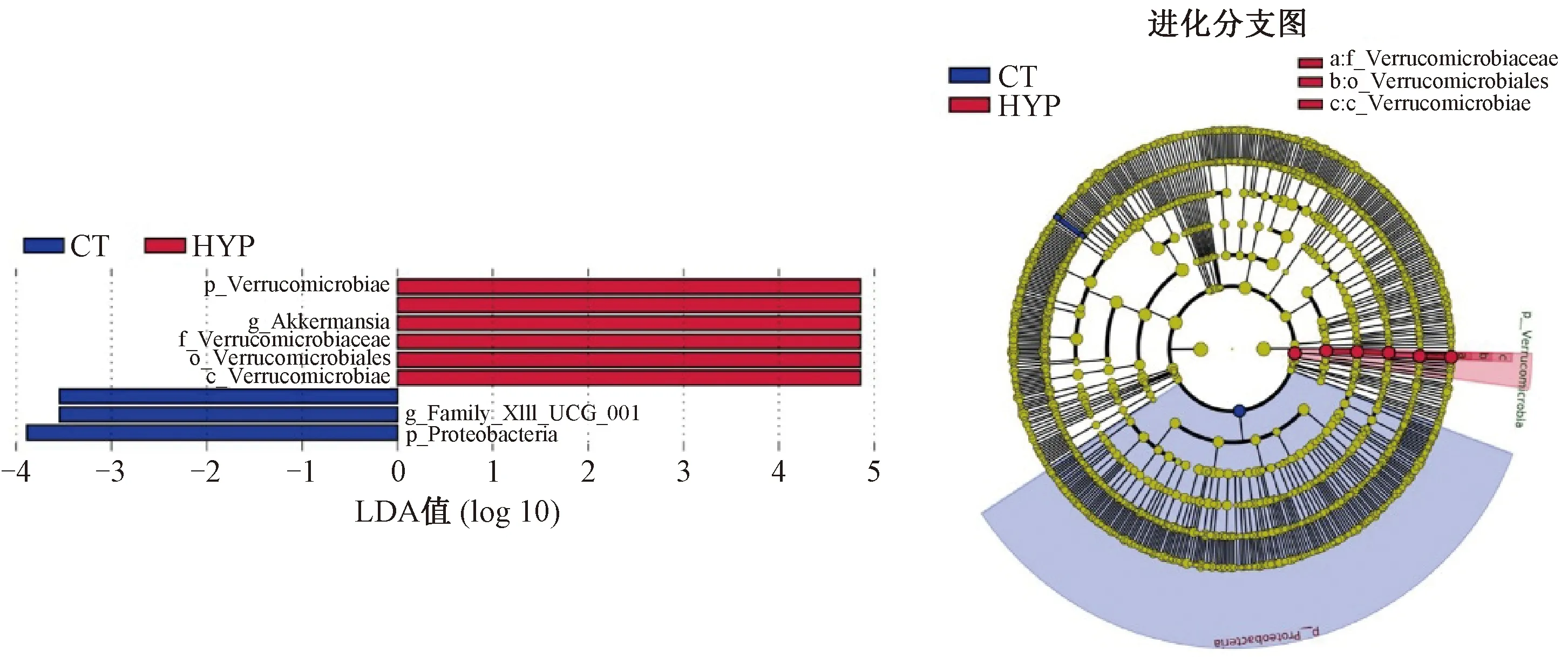
图6 LDA值分布柱状图和进化分支图Fig.6 The histogram and cladogram of LDA
物种系统树结果如图7所示,低压低氧组百分比含量较高的为Bacteroidetes和Verrucomicrobia;常压常氧组百分比含量较高的为Firmicutes和Proteobacteria等。其中低压低氧组特有的菌为隶属于Verrucomicrobia的Akkermansia,占总含量的20.60%。
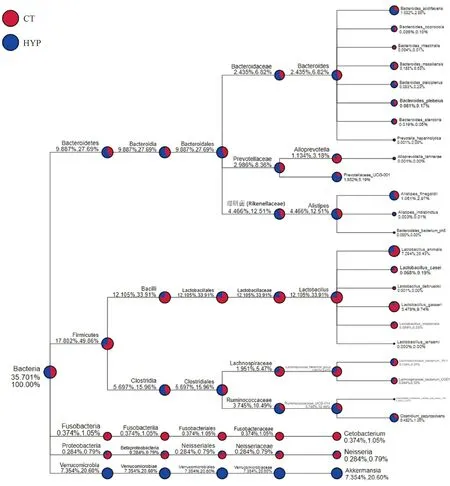
图7 常压常氧与低压低氧条件下肠道微生物的树状图Fig.7 The phylogenetic tree of normal and hypobaric hypoxic environment in intestinal microflora
3 讨论
随着研究的不断深入,微生物与人类的关系也逐渐被人们所重视。微生物定植于生物体的组织和器官,如:皮肤、胃肠道、呼吸系统、泌尿系统等,不仅在日常生活中潜移默化的影响人类,更是与疾病和健康有着不可分割的关系。有研究将人类的肠道微生物菌群视为一个器官,指出一个成人的肠道微生物菌群由1013~1014种微生物组成,并且在新陈代谢、免疫系统发育和抵御外来病原体的入侵等方面有很重要的作用[1]。
高原地区因环境气候条件与平原地区不同而影响肠道微生物菌群的变化。Wu等[16]通过对处于不同海拔地区的恒河猴肠道微生物菌群进行测序分析和比较,发现高海拔地区恒河猴肠道微生物主要以Firmicutes(63.4%)和Verrucomicrobiaceae为主,而低海拔地区以Bacteroidetes(47.4%)和普雷沃氏菌Prevotellaceae为主,这种不同被认为与环境温度以及氧气压力的不同有很大的关系。本研究通过对模拟低压低氧的高原环境和普通环境下的小鼠肠道微生物菌群测序的LEfSe分析,结果发现高海拔地区的Verrucomicrobiaceae显著增多,这与上述报道结果一致。有报道在不同海拔地区藏羚羊、藏野驴、普通绵羊等物种肠道微生物菌群的研究中发现高海拔地区物种肠道微生物的优势菌群为Ruminiclostridium(22.78%)、Oscillospira(20.00%)和Clostridium(10.00%),高海拔地区物种肠道微生物的Firmicutes所占比例比Bacteroidetes更大[17]。本研究中,属级水平上,低压低氧组Ruminococcus的含量较高,而常压常氧组Lactobacillus、Allobaculum、Ruminiclostridium、Roseburia等含量较高;门级水平上,低压低氧组百分比含量较高的为Bacteroidetes和Verrucomicrobia,而常压常氧组百分比含量较高的为Firmicutes、Proteobacteria等。本研究与Ma等[17]报道存在差异,可能与除海拔外的其他因素,如研究对象及其饮食生活习性等不同有关。
进入高原环境一段时间后,肠道微生物菌群也开始逐渐适应高原环境,Karl等[18]对高海拔地区人群以及高原反应人群肠道微生物采集分析发现,Prevotellaceae丰度的改变与高原反应的相关性很大,提示该菌的变化有利于人类对高原环境的适应。本研究发现低压低氧组的肠道微生物菌群中PrevotellaceaeUCG-001含量高于常压常氧组,说明小鼠进入低压低氧舱28 d后,逐渐开始适应环境。有研究显示,Ruminococcus通过肠道微生物与脑的联系而影响脑N-乙酰门冬氨酸(NAA)含量[19],从而影响大脑神经的发育,而本研究结果显示,模拟高原环境组小鼠肠道微生物中的Ruminococcus含量与常压常氧组相比有所升高,提示低压低氧环境可能会增加此类疾病的患病风险。而有报道称狄氏副拟杆菌(Parabacteroidesdistasonis)与肥胖负相关[20],也有研究通过对肥胖和超重人群补充阿克曼菌(A.muciniphila)后发现提高了胰岛素敏感性,减少了胰岛素血症和血浆总胆固醇,降低了体质量、脂肪量和臀围[21]。本研究发现,低压低氧会使Parabacteroides含量增高,这与作者早期的研究结果一致,低压低氧使小鼠体质量增长减慢[12],这可能与低压低氧环境下肠道微生物菌群中Parabacteroides含量增高有关。有研究发现添加阿克曼菌(A.muciniphila)能够保护由葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎,使肠炎小鼠血清和组织的炎症细胞因子和趋化因子降低[22],其不但对机体的免疫应答有一定的调节作用,还具有维持机体代谢平衡的作用,能够改善肥胖,减少糖尿病患者的炎症反应。本研究通过LEfSe分析显示,在属级水平上, 低压低氧组Akkermansia显著增多,高原环境下氧分压较小,从而使进入肺部的氧气减少,造成机体各组织器官的缺氧,进而使机体的炎性因子含量增高[23],而这可能是导致肠道微生物菌群中Akkermansia显著增多的原因,而该菌与肥胖的关系可能是小鼠在低压低氧环境中体质量增长减慢的原因。
本研究在控制其他变量对肠道微生物菌群影响的情况下,对模拟高原环境和普通环境下,小鼠肠道微生物菌群的组成及差异进行了检测和分析,对研究高原环境下肠道微生物菌群的变化有一定的指导意义,为临床上研究和治疗高原疾病提供了新的思路和一定的理论支持。基于以上研究,将进一步探索不同海拔高原环境对人体肠道微生物菌群变化的影响规律,以更科学的支持临床研究和高原疾病诊治。
