皮肤致敏对TNBS诱导小鼠急性实验性结肠炎的影响*
2022-08-03刘可心吴星星段正兰王耀辉陈玉根
刘可心 王 卯 吴星星 吴 琪 段正兰 王耀辉 王 琼 陈玉根 吴 静,2
(1.南京中医药大学附属医院,南京 210029)(2.南京大学中医研究院,南京鼓楼医院,南京中医药大学鼓楼临床医学院,南京 210008)
三硝基苯磺酸 (trinitrobenzenesulfonic acid, TNBS) 是一种半抗原物质的皮肤接触剂。Morris等[1]研究指出,TNBS诱导的实验性结肠炎机制为乙醇破坏肠道屏障,使得TNBS与结肠组织蛋白相互作用。当TNBS与具有高分子量的蛋白结合后,会对宿主免疫系统产生免疫原性,进而引起免疫应答。TNBS复合乙醇灌肠给药,此方法诱导的实验性结肠炎是常用的造模方式,以BALB/c小鼠为例,其单次给药即可出现由Th1细胞介导的炎症反应[2-3]。在TNBS诱导的急性实验性结肠炎小鼠模型中,也有采用第1天予皮肤致敏,第8天予直接灌肠[4]。然而,大多数的实验研究仅采用直接灌肠造模,不予皮肤致敏。有研究表明,使用皮肤致敏后体内会产生TNBS抗体,可能减少首次灌肠后产生的严重肠道炎症反应以及降低TNBS用药相关的死亡率[5]。也有研究指出,使用皮肤致敏可能加重肠道黏膜损伤,以促进实验性结肠炎模型的建立[6]。目前有关二者造模方式的比较研究没有相关报道,故在灌肠前是否予皮肤致敏仍无定论。
除此之外,既往研究表明,肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)是广泛应用于炎症性肠病 (inflammatory bowel disease, IBD) 中用来评价炎症及黏膜免疫的指标,其在IBD患者肠道黏膜屏障功能中具有重要作用。有研究表明,IBD患者血清TNF-α 较健康人增高[7-8],也有研究表明TNBS诱导的小鼠急性实验性结肠炎模型组中,TNF-α 较正常组增高[9]。Fu等[10]临床试验表明TNF超家族结构中B细胞激活因子 (B cell-activating factor, BAFF) ,又称BLys/TNFSF13B,可用于IBD的诊断与评估;同时,BAFF影响T细胞介导的炎性反应,血清中BAFF水平与皮肤或黏膜的过敏反应密切相关[11]。细胞间粘附分子1 (intercellular adhesion molecule-1, ICAM-1) 又称CD54,是免疫球蛋白超家族的内皮粘附分子,在各种炎症性疾病中介导白细胞与内皮细胞的紧密粘附方面起关键作用[12];Huo等[13]研究表明,在TNBS诱导的实验性结肠炎大鼠模型中ICAM-1是增加的;基质金属蛋白酶的组织抑制剂1 (tissue inhibitor of matrix metalloproteinases 1, TIMP-1) 是一种独立于基质金属蛋白酶 (matrix metalloproteinase, MMP) 抑制的多功能蛋白,参与组织重塑和创伤愈合[14]。IBD患者结肠黏膜中TIMP-1的水平已经被证实是升高的[15];同时,血浆TIMP-1的水平与内镜下黏膜损伤程度、疾病活动程度和预后密切相关[16]。由此,本研究在比较小鼠肠道炎症基础上,选取以上4个指标,检测各组小鼠血清中细胞因子的水平,比较各组指标差异,以期探索皮肤致敏对TNBS诱导的急性实验性结肠炎小鼠模型的影响。
1 材料和方法
1.1 材料
1.1.1实验动物与分组:15只SPF级雄性BALB/c小鼠,8周龄,体重(20±2)g,购于浙江维通利华实验动物技术有限公司【SCXK (浙) 2019-0001】。将小鼠随机分为NC组、NP组及SP组,每组5只。饲养于江苏省中医药基础药理实验室【SYXK(苏)2017-0069】。适应性喂养7 d,饲养期间小鼠自由饮水摄食(江苏省中医药基础药理实验室提供)。昼夜各半循环照明,湿度恒定,温度控制在(26±2)℃,湿度控制在50% ± 10%。实验符合江苏省中医院动物伦理委员会要求 (动物实验审批号:2020DW-10-01) ,并遵守ARRIVE UPDATE 2.0版实验动物报告准则[17]。
1.1.2主要试剂:5% TNBS (Sigma,P2297-5X10ML),丙酮 (南京宁试化学试剂有限公司,XK13-201-00494) ,异氟烷 (瑞普生物医药有限公司,020037015),HE染色液 (珠海贝索生物科技有限公司,BA4025),封片剂(上海国药,10004160) ,Luminex试剂盒 (R&D System,1609517) 等。
1.1.3主要仪器和设备:小型ABS动物气体麻醉机 (上海玉研科学仪器有限公司,Y100141034) ,电子分析天平 (上海恒平科学仪器有限公司,FA1004),玻片扫描影像系统 (深圳市生强科技有限公司,SQS-600P) ,液态悬浮芯片系统 (R&D System,Luminex X200) 。
1.2 方法
1.2.1药品制备:1% TNBS溶液制备:5% TNBS与丙酮按1∶4涡旋混匀;2.5% TNBS溶液制备:5% TNBS溶液与80% 乙醇按1∶1涡旋混匀。
1.2.2实验造模:SP组小鼠持续吸入麻醉,将两肩之间皮肤1.5 cm×1.5 cm充分暴露,第1天予皮肤上轻涂1% TNBS 150 μL后,记录小鼠体质量变化情况。于第8天灌肠,灌肠前禁食不禁水12 h,吸入麻醉后SP组及NP组各进行2.5% TNBS 100 μL灌肠,NC组予生理盐水100 μL灌肠,轻揉腹部30 s,头朝下倒置1 min,待其苏醒后放回笼中,保温观察[4]。
1.2.3一般指标:观察小鼠食水摄入,皮毛色泽及活动度等情况,记录体质量变化,粪便性状改变及有无肉眼血便,灌肠后进行小鼠疾病活动指数[18](disease activity index, DAI) 评分,DAI评分=(体质量增减率分数+大便性状分数+血便程度分数)/3。
1.2.4脾脏质量及指数:使用精密电子天平 (称重精度为0.000 1 g) 对脾脏称重,将脾脏质量与取材当天小鼠的体质量比较,计算脾脏指数,脾脏指数=脾脏质量/末次体质量×100% 。
1.2.5血清制备及细胞因子检测:灌肠造模后第3天,予小鼠麻醉后,将其单侧眼球摘除后取血,室温静置30 min后离心,取血清100 μL分装备用,利用Luminex试剂盒,检测血清样本中炎性细胞因子,实验过程参照试剂盒说明书进行。
1.2.6结肠CMDI及评分:麻醉取血后,予颈椎脱臼法处死小鼠,取肛门至回盲部结肠,沿肠系膜纵行剖开,观察结肠粘膜。将结肠组织平整的铺在纸板上,拍摄全结肠图片,观察并记录结肠质量、长度等,计算肠重与肠长比值及结肠指数 (结肠指数=结肠质量/末次体质量× 100%) ,并纵向剖开肠管,冲净管腔后,进行结肠CMDI评分[19]。具体评分标准为:结肠黏膜与周围组织无粘连,无溃疡形成及炎症,即无损伤,0分;结肠黏膜轻度水肿,但无溃疡,只表现局部充血,1分;结肠黏膜溃疡、充血且肠黏膜粗糙,2分;结肠黏膜溃疡面积直径约1 cm左右,3分;结肠黏膜溃疡面积较大,直径约2 cm左右,肠壁增厚,与周围组织轻度粘连,4分;结肠黏膜溃疡面积较大,直径约2 cm左右,肠壁增厚,与周围组织重度粘连,5分。
1.2.7结肠组织制备及病理评分:将远端结肠组织进行纵剖,制作瑞士卷,包绕在PBS润湿的注射器针头上,投置于4% 多聚甲醛中固定,按酒精梯度进行脱水,浸入石蜡中包埋,将修整好的石蜡切片后脱蜡,经苏木精-伊红 (hematoxylin-eosin, HE) 染色,脱水烘干后中性树脂封片,光学显微镜下观察评分[4]并采集图像。病理评分标准为:无炎症迹象且无肠黏膜损伤,0分;低水平炎症,分散浸润单核细胞(1~2个病灶),轻度肠黏膜损伤,1分;中度炎症,伴有多个病灶,中度肠黏膜损伤,2分;炎症水平高,血管密度增加,血管壁增厚明显,重度肠黏膜损伤,3分;炎症的最大严重程度,包括透壁白细胞浸润和杯状细胞丢失,伴有坏死渗出,4分。
1.3 统计学分析
应用SPSS 22.0进行统计分析。组间分析采用单因素方差分析 (One-way ANOVA) ,若服从正态分布,方差齐采用LSD检验,方差不齐采用Tamhane检验;若不服从正态分布,采用非参数检验;结果以P<0.05,提示差异有显著性。
2 结果
2.1 皮肤致敏对一般指标的影响
NC组活动良好,皮毛平顺光泽。生理盐水灌肠后有稀软便排出,无肉眼血便。SP组皮肤致敏后活动良好,皮毛光泽,大便性状正常,皮肤致敏期间无剔除小鼠。灌肠后小鼠精神倦怠,不喜动,食水摄入减少,大便黏附于肛周,拱背,扎堆,皮毛无光泽,竖毛现象明显,有血便。NP组灌肠后小鼠倦怠懒动,皮毛欠光泽,竖毛严重,食水摄入差,大便质稀黏于肛周,部分有血便。至取材前,3组小鼠均无死亡。
2.2 皮肤致敏对体质量的影响
SP组及NP组行皮肤致敏后,每日监测体质量及其增减率,与NC组比较,SP组及NP组小鼠,皮肤致敏后至灌肠前体质量均无显著差异 (图1) 。第8天禁食不禁水12 h后,3组小鼠体质量较禁食前均下降,与NC组比较,SP组及NP组差异有显著性 (P<0.01) ;SP组与NP组比较,差异无显著性;第9天NC组体质量增加,SP组及NP组体质量均降低,且SP组较NP组体质量显著下降 (P<0.05);第10天NC组体质量持续增加,SP组及NP组体质量呈增加趋势,但SP组较NP组体质量差异有显著性 (P<0.05) ;第11天SP组小鼠体质量呈增加趋势,NC组及NP组体质量有所降低,但3组小鼠体质量差异无显著性 (图2) 。
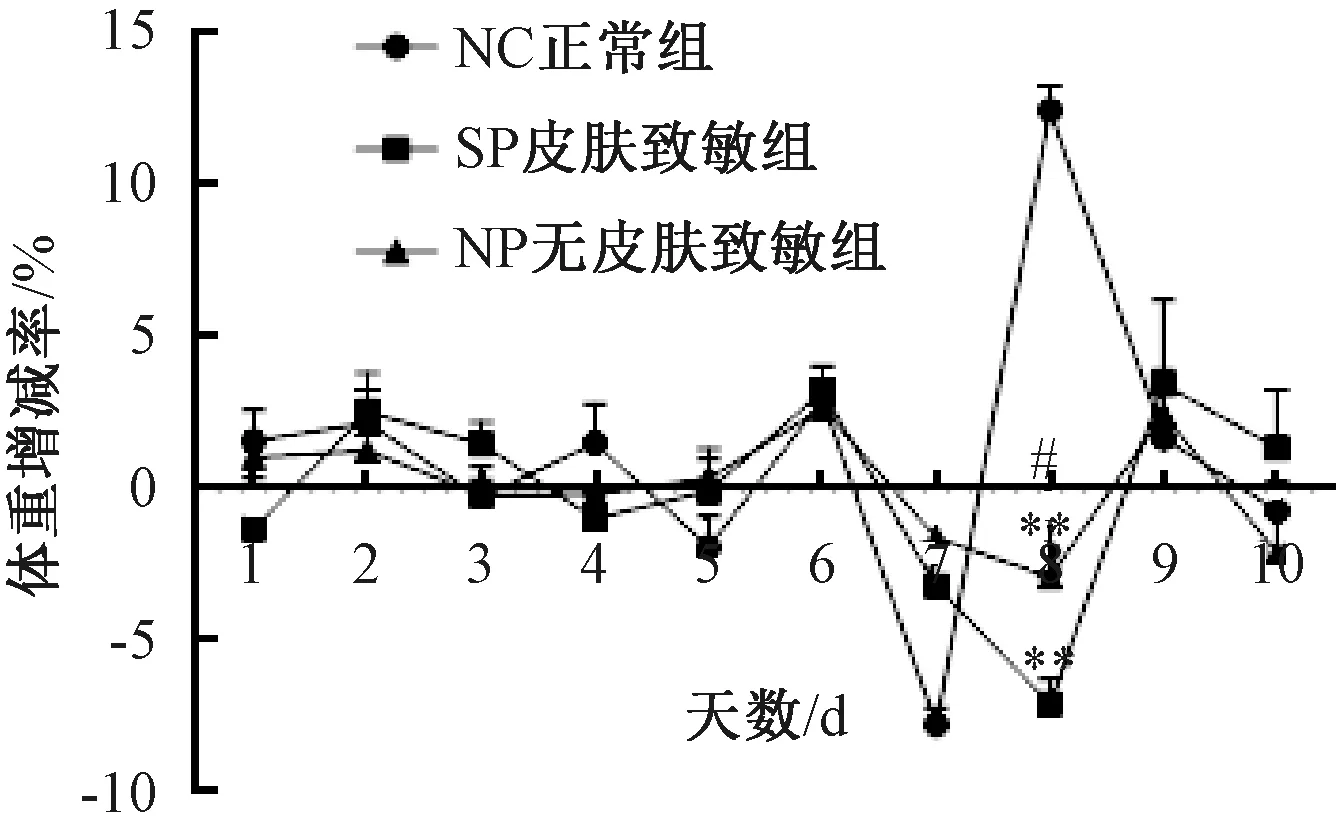
图1 不同实验组小鼠体质量的增减率变化注: 与NC组比较, * P<0.05, ** P<0.01; 与SP组比较, #P<0.05;下同Fig.1 Changes of percentage of weight gain or loss of mice in different experimental groupsNote: vs. NC group, * P<0.05, ** P<0.01;vs. SP group, #P<0.05; The same below
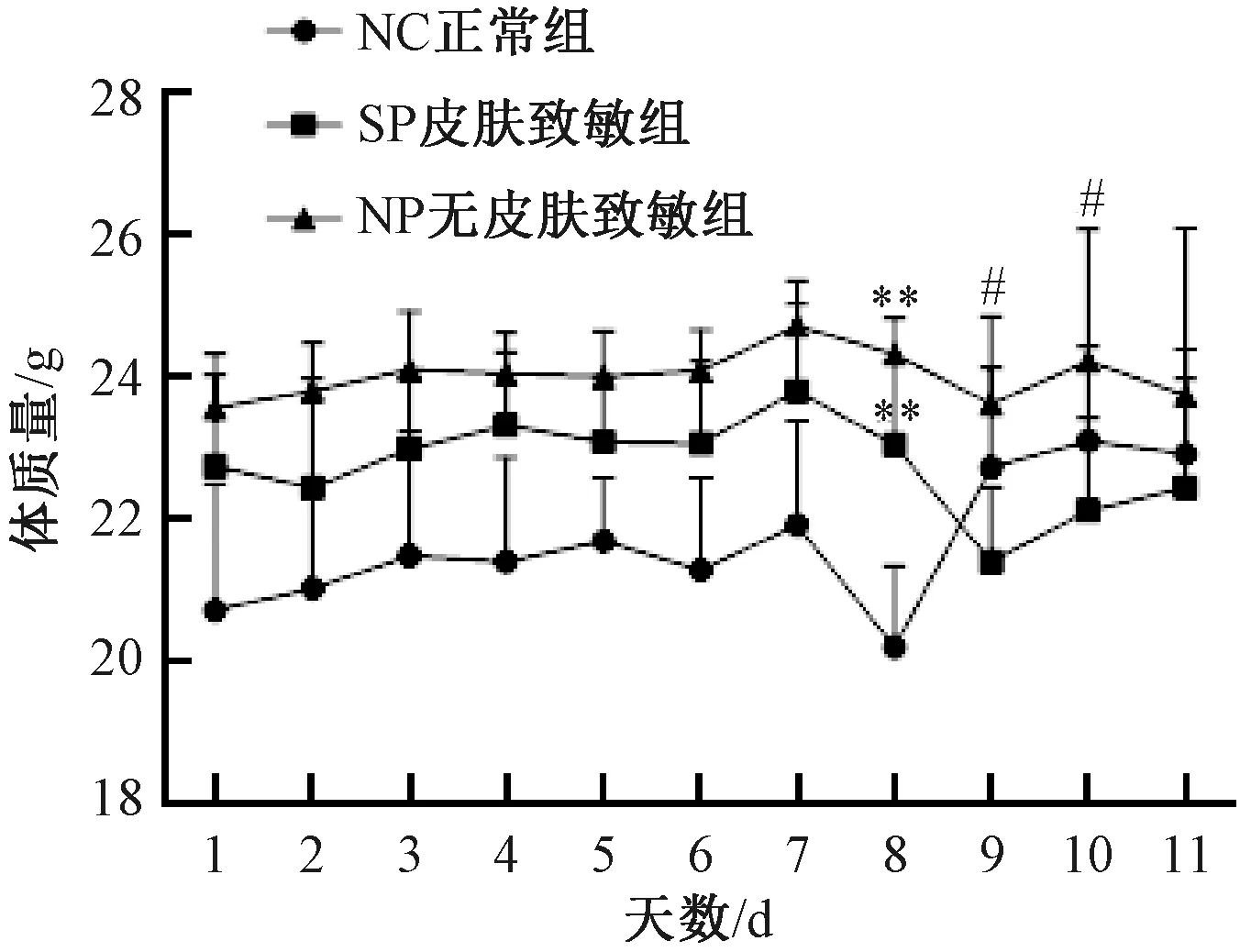
图2 不同实验组小鼠体质量变化Fig.2 Changes of weight of mice in different experimental groups
2.3 皮肤致敏对疾病活动指数评分(DAI)的影响
灌肠后至取材前,与NC组比较,SP组及NP组DAI评分均显著增加 (P<0.05) ;SP组与NP组比较,差异无显著性 (图3) 。
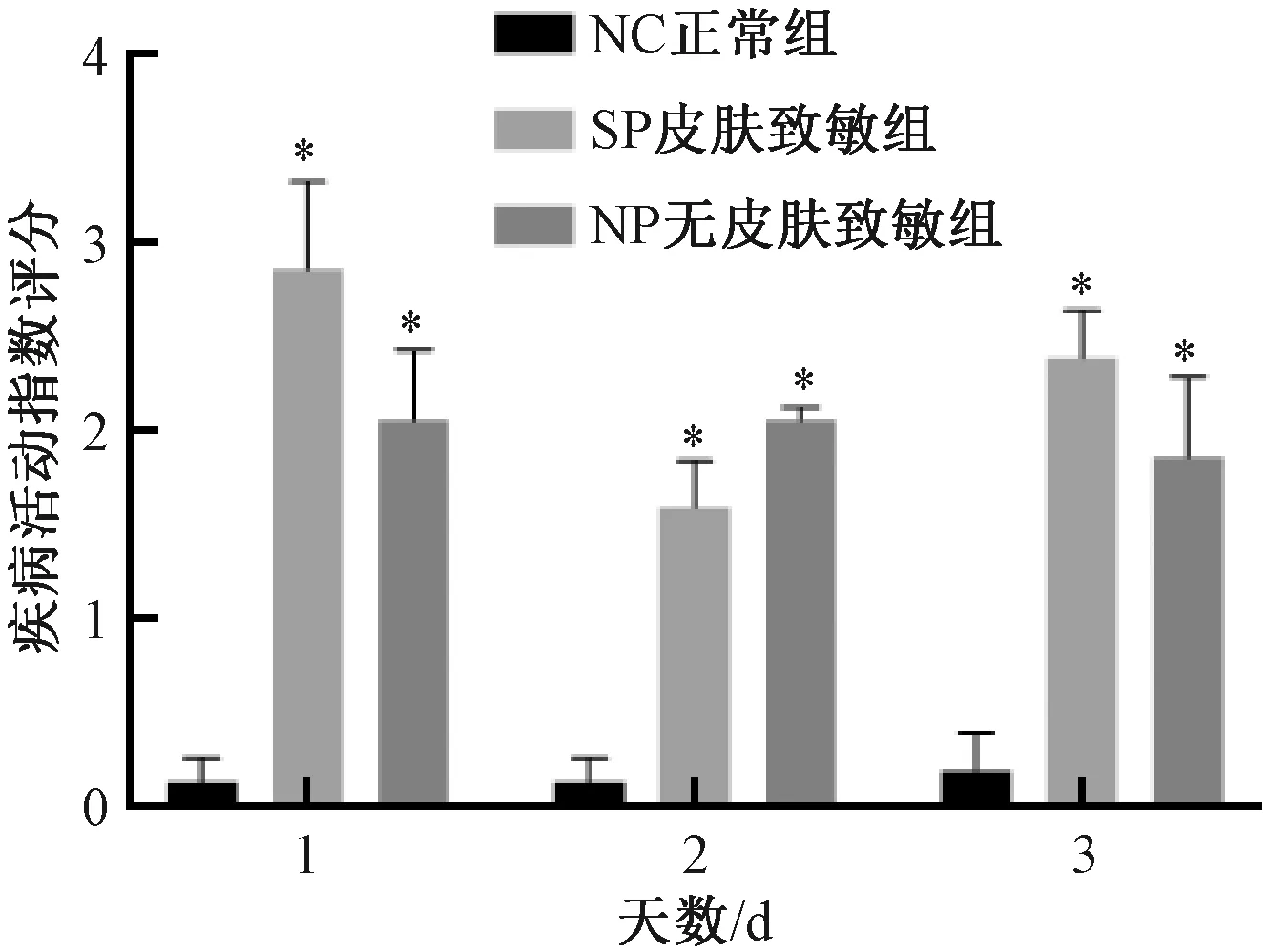
图3 不同实验组小鼠疾病活动指数评分的变化Fig.3 Changes of disease activity index score of mice in different experimental groups
2.4 皮肤致敏对脾脏质量及指数的影响
脾脏是反应机体免疫的器官,脾脏指数越高表示机体免疫能力越强[20],与NC组比较,NP组小鼠脾脏质量及指数显著下降 (P<0.05) ,SP组小鼠脾脏质量及指数下降但差异无显著性;SP组较NP组脾脏质量及指数均增加,但差异无显著性 (图4) 。
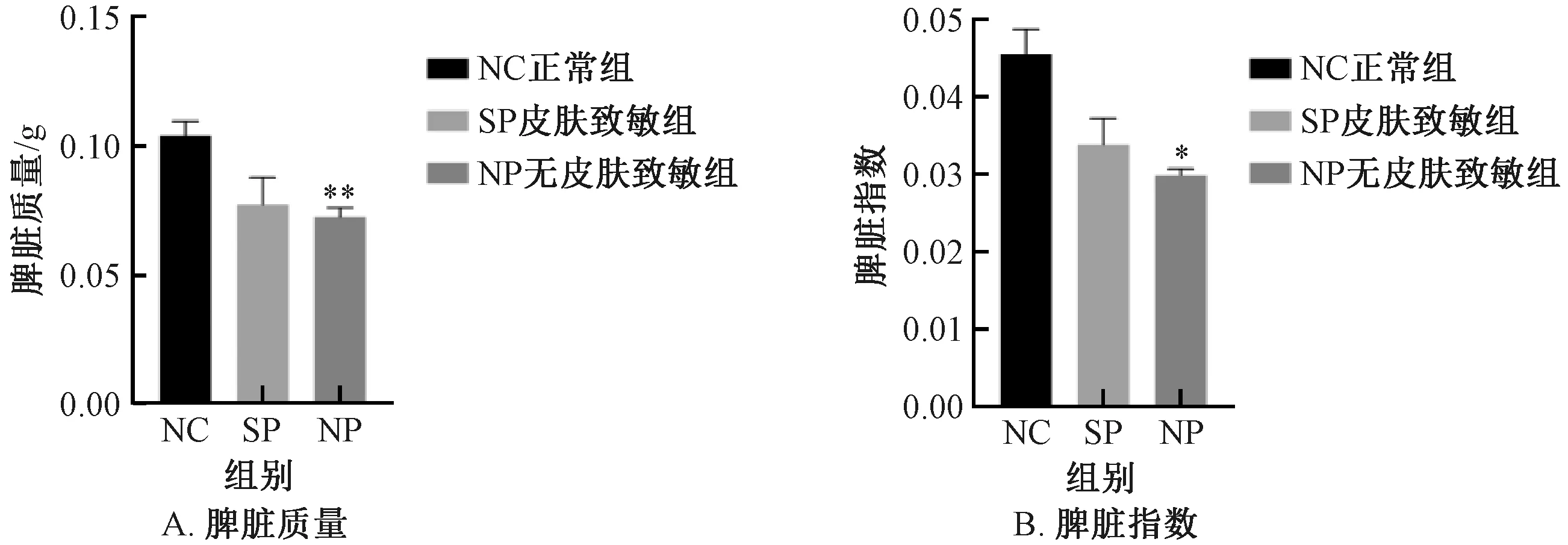
图4 不同实验组小鼠的脾脏质量及脾脏指数变化Fig.4 Changes of spleen weight and spleen index of mice in different experimental groups
2.5 皮肤致敏对结肠组织相关指标的影响
与NC组比较,SP组及NP组,结肠质量增加、结肠长度缩短、肠质量与肠长度比值升高以及结肠指数增加,但组间差异均无显著性 (图5-8) 。
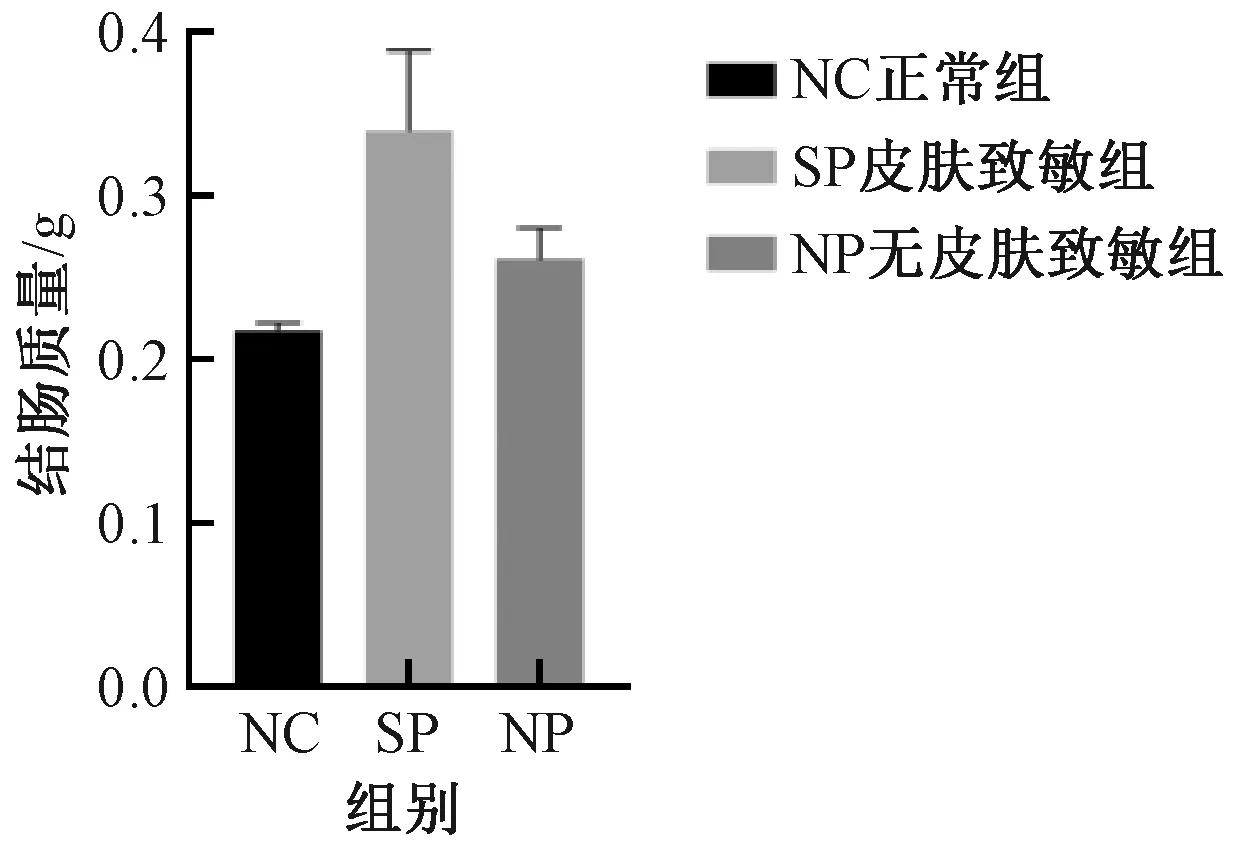
图5 不同实验组小鼠结肠质量的变化Fig.5 Changes of colon weight of mice in different experimental groups
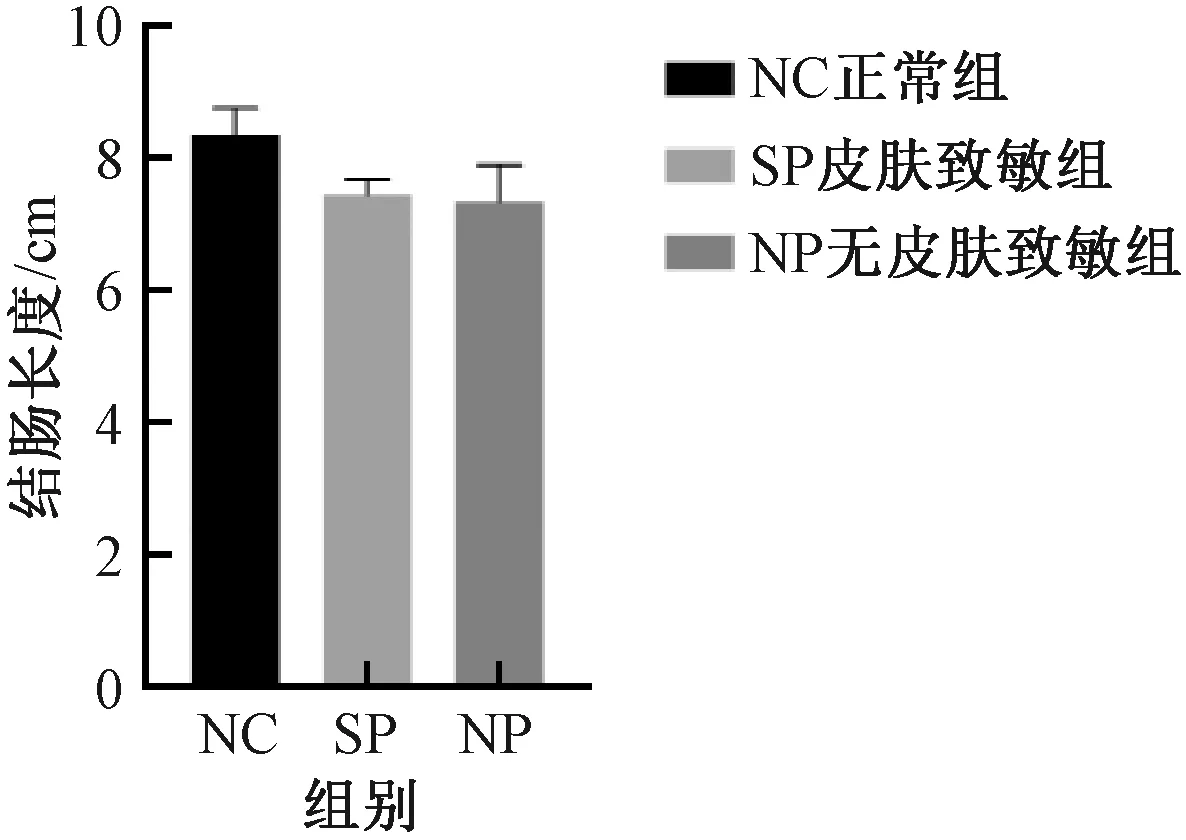
图6 不同实验组小鼠结肠长度的变化Fig.6 Changes of colon length of mice in different experimental groups
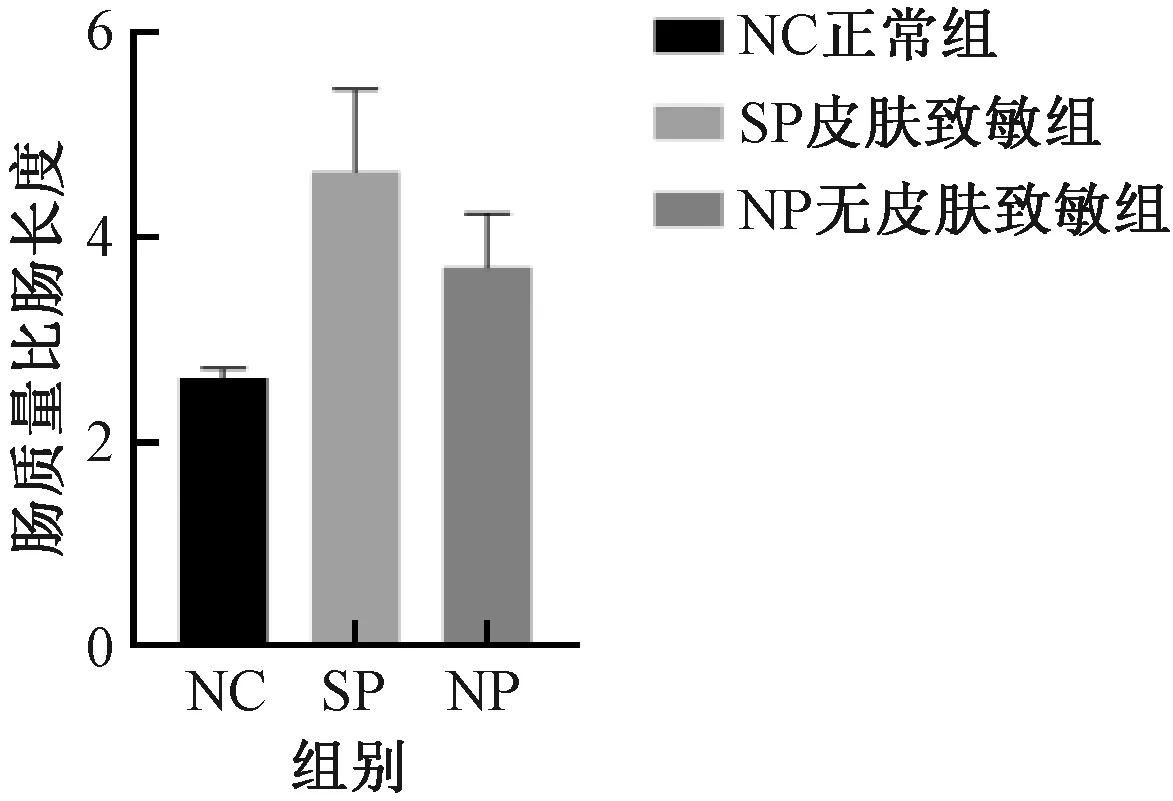
图7 不同实验组小鼠的肠质量与肠长度比值Fig.7 Intestinal weight ratio length of mice in different experimental groups
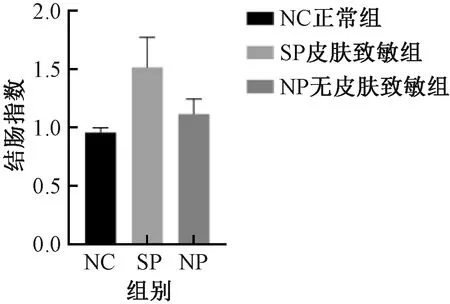
图8 不同实验组小鼠的结肠指数变化Fig.8 Changes of colonic index of mice in different experimental groups
2.6 皮肤致敏对结肠形态及CMDI评分
NC组结肠组织外观正常,未见充血,黏膜层及肌层未见明显病变;SP组结肠黏膜存在充血现象,偶见红褐色血痂,个别结肠组织与周围组织黏连;NP组结肠黏膜充血,结肠缩短,肠壁增厚明显。与NC组比较,SP组CMDI评分显著增加 (P<0.05) ,NP组CMDI增加但差异无显著性;SP组与NP组比较,差异无显著性 (图9、图10) 。
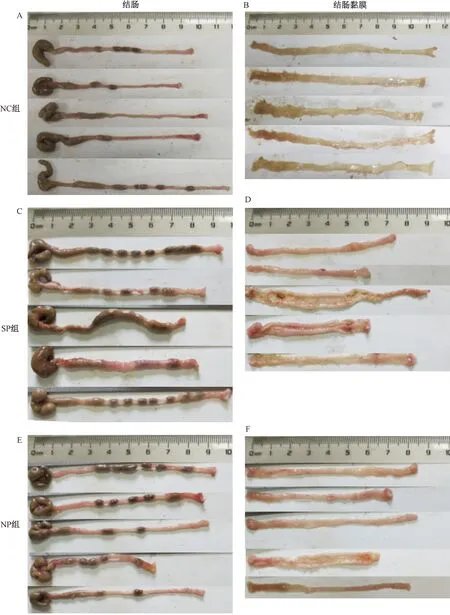
图9 不同实验组小鼠的结肠及结肠黏膜变化情况Fig.9 Changes of colon and colon mucosa of mice in different experimental groups
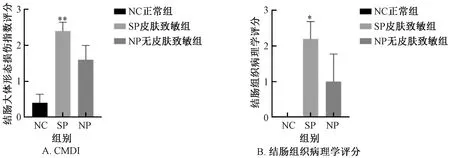
图10 不同实验组小鼠的CMDI及结肠组织病理学评分Fig.10 CMDI and colonic hispathological score of mice in different experimental groups
2.7 结肠组织病理及评分
由图11可以看到,NC组肠壁完整,黏膜无缺损。与NC组比较,SP组小鼠出现间质淋巴细胞、浆细胞略增多,小灶糜烂;组内结肠黏膜损伤程度差异较小。NP组小鼠肠黏膜糜烂,肉芽组织增生,可见坏死渗出,间质较多中性粒细胞、淋巴浆细胞浸润 (大部分黏膜层,少量累及黏膜下层) ,隐窝结构基本正常;但组内结肠黏膜损伤程度差异较大。与NC组比较,SP组结肠组织病理评分显著增加 (P<0.05) ,NP组结肠组织病理评分增加,但差异无显著性;SP组与NP组比较,差异无显著性。
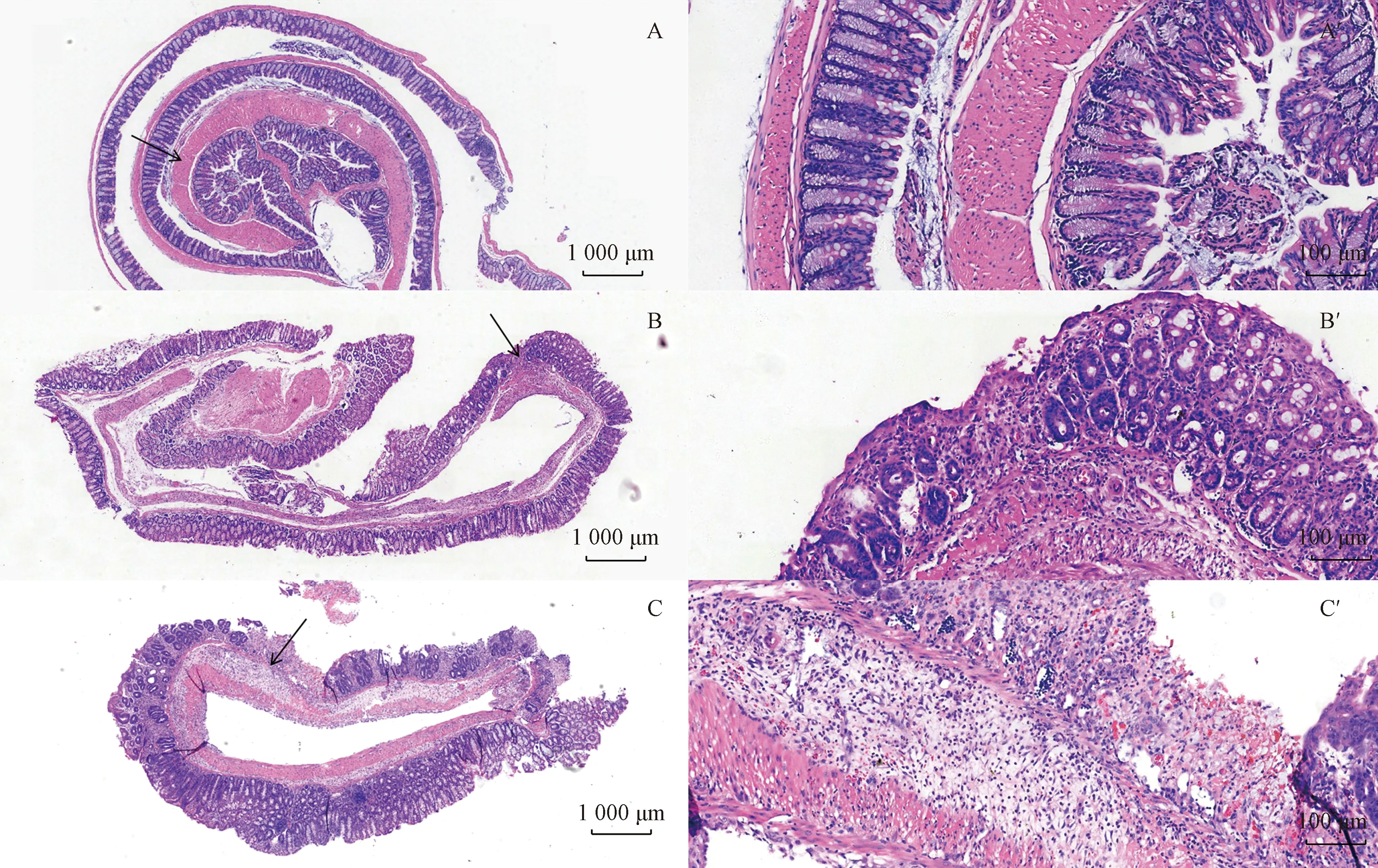
图11 不同实验组小鼠结肠组织的HE染色对比注:A : NC组 (× 20), A’ : NC组(× 100); B : SP组 (× 20);B’ : SP组(×100); C : NP组(× 20), C’ : NP组 (× 100); 黑色箭头表示图片放大区域Fig.11 Comparison of HE staining in colon tissue of mice in different experimental groupsNote. A : NC group (× 20), A’ : NC group(× 100); B : SP group (× 20), B’ : SP group(× 100); C : NP group(× 20), C’ : NP group(×100); The black arrow indicates the magnified area
2.8 皮肤致敏对细胞因子的影响
BAFF/BLys/TNFSF13B显示,与NC组比较,SP组及NP组均显著增加,差异有显著性 (P<0.01);SP组及NP组比较,差异无显著性;与NC组比较,SP组及NP组的TNF-α、ICAM-1/CD54、TIMP-1血清浓度值稍增加或持平,差异无显著性;以上指标SP组与NP组比较,差异无显著性 (图12) 。
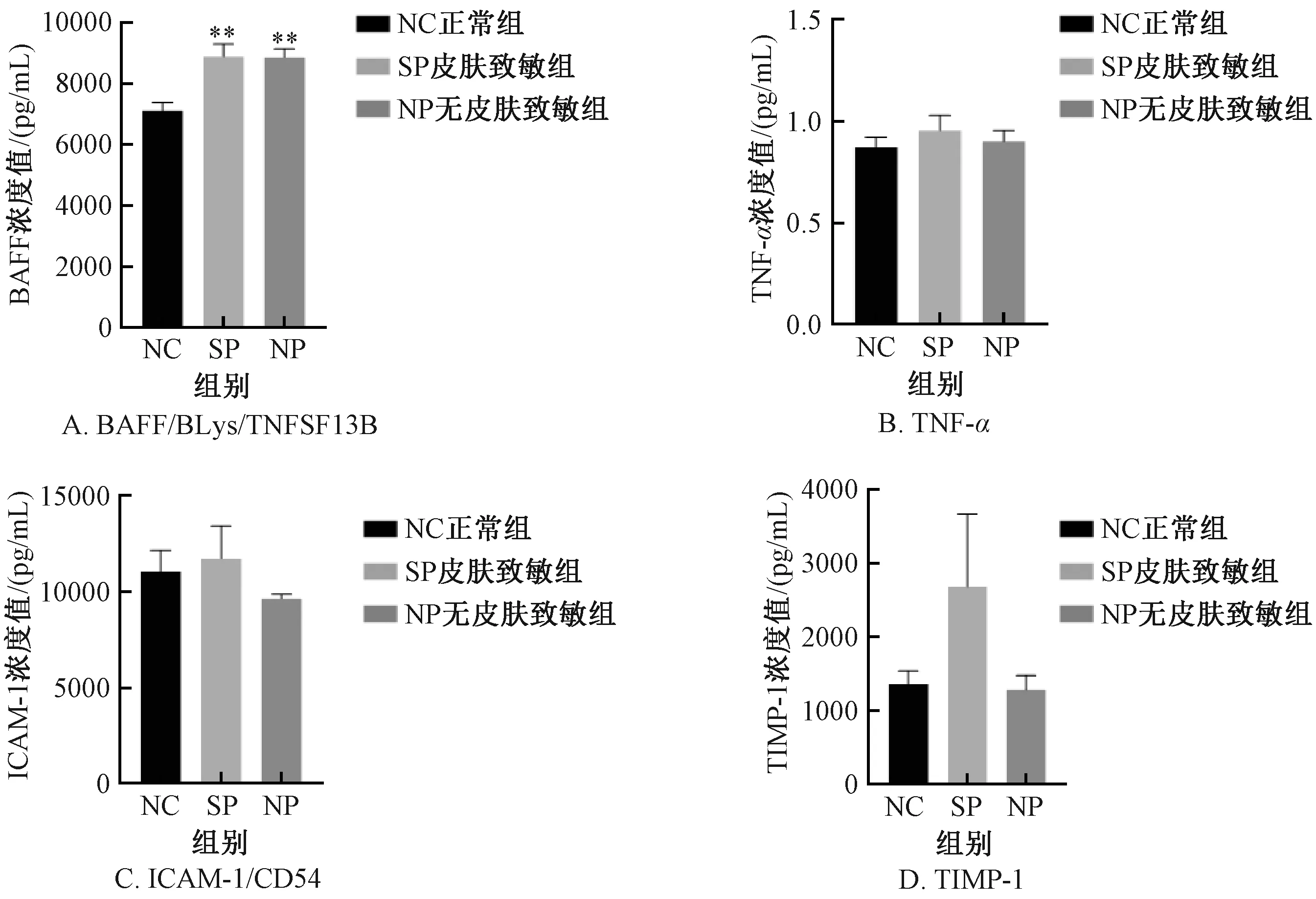
图12 不同实验组小鼠细胞因子的变化Fig.12 Changes of cytokines in mice of different experimental groups
上述结果提示,SP组及NP组均可建立急性实验性结肠炎小鼠模型;综合比较后,SP组小鼠组内差异较小且成模效果好,NP组小鼠组内差异较大;故在采用TNBS诱导建立小鼠急性实验性结肠炎模型时,建议使用皮肤致敏。
3 讨论
本研究基于TNBS的不同给药方式,即是否予皮肤致敏,建立小鼠急性实验性结肠炎模型。目前研究公认直接灌肠诱导急性实验性结肠炎的机制是通过直肠灌注TNBS与乙醇的复合物,引起结肠黏膜中的某些氨基酸或肠内细菌蛋白产生反应,通过半抗原化的交联过程,使得自身蛋白具有免疫原性,产生免疫反应。与皮肤致敏会引起迟发而非持续性的超敏反应相比较,直接灌肠其机制可能是由于TNBS与黏膜中的抗原发生反应,募集免疫效应细胞,形成Th1 T细胞的透壁性结肠炎。在与三硝基苯基(trinitrophenyl,TNP) 半抗原交联的蛋白消失后,免疫效应细胞仍持续受到刺激,从而诱发免疫反应[21]。
当皮肤首次接触致敏剂后,致敏物质通过角质层与表皮细胞结合,表皮层中角质细胞接触致敏物质后产生应激反应,将释放促炎因子[22]。基于此,本研究检测了血清中BAFF/BLys/TNFSF13B、TNF-α、ICAM-1/CD54、TIMP-1细胞因子表达水平。结果表明,与NC组比较,SP组与NP组的TNF-α、ICAM-1/CD54、TIMP-1指标表达水平稍增加或持平,差异无显著性。然而,有研究指出TNBS诱导的急性实验性结肠炎小鼠模型中TNF-α 增加[9],TNBS诱导的大鼠模型中ICAM-1增加[13];临床中IBD患者结肠黏膜中TIMP-1水平升高[15]。推测本研究差异无显著性的原因可能是急性造模期间血清中细胞因子表达水平受时间因素影响。由于急性造模时间较短,这几种炎性细胞因子尚未达峰,从而导致检测结果无显著差异;当然也不能排除检测时间已过峰值[23],后期待检测不同时间点的细胞因子水平,以期获得更为精准的数据。BAFF/BLys/TNFSF13B的结果显示,与NC组比较,SP组与NP组表达均显著增加,与Sutherland等[11]报道的由甲基化BSA (mBSA) 和卵清蛋白 (Ovalbumin, OVA) 所致免疫反应一致。BAFF可能是炎症免疫反应的早期指标之一。由于本研究样本数量较少,且仅使用单次皮肤致敏,未来需大样本进一步确证。
