Ⅰ型变态反应与中耳炎相关性初步研究
2022-07-15史聪张海利许婷樊慧娟
史聪 张海利 许婷 樊慧娟
目前分泌性中耳炎(otitis media with effusion,OME)的病因尚不明确,变态反应对OME的影响是近年来研究热点[1,2]。有研究通过鼓膜注入卵清蛋白(ovalbumin,OVA)成功构建OME小鼠模型,支持中耳接触变应原激活免疫系统产生变态反应,最终诱发中耳积液的产生,甚至提出OME是一种变态反应[3,4]。然而,中耳通过咽鼓管与外界相通,通过上呼吸道途径才最贴近其正常病理生理过程。有研究[5]首次观察到经上呼吸道OVA诱导的变应性鼻炎小鼠模型中约12.5%产生中耳积液。变应性鼻炎(allergic rhinitis, AR)作为上呼吸道变态反应疾病中最常见的疾病[6],常与中耳炎并发,AR患者是分泌性中耳炎的高危群体,其中合并分泌性中耳炎的发病率约为5%~80%[7,8]。研究发现OME存在与变应性鼻炎相似的“Th1/Th2细胞失衡”,从而产生级联反应放大炎症反应[2,9]。故本研究通过上呼吸道致敏的方式构建变应性鼻炎动物模型,观察I型变态反应对中耳的病理生理影响,并探讨变态反应中细胞因子IL-5[10]在中耳组织中的表达。
1 材料与方法
1.1实验动物及分组 选择SPF级BALB/c小鼠(雌性、4~6周龄)18只,称重约17.45~18.60 g,随机分为随机分为对照组A组、实验组B组、实验组C组,每组6只(12耳)。
1.2实验方法
1.2.1变应性鼻炎动物模型的建立 采用OVA全身基础致敏和滴鼻致敏的方式[5,11,12]构建变应性鼻炎动物模型。将100 μg OVA+1 mg AL(OH)3佐剂溶解于PBS 0.2 ml,第1、8、15天将0.2 ml该溶液腹腔注射于实验组B组和实验组C组小鼠体内,注射1次;第16日起,将10 mg/mlOVA每日1次、每侧20 μl局部滴鼻。对照组A组腹腔注射和鼻部激发均使用PBS替代;实验组B组在基础致敏中给予1 mg/ml OVA和AL(OH)3的混合液,自16日起鼻部激发至第29日,第30日处死; 为观察AR对中耳的影响,实验组C组在基础致敏中同法给予1 mg/ml OVA和AL(OH)3的混合液,自16日起鼻部激发至第43日,第44日处死。
1.2.2AR动物模型的评价 根据变应性鼻炎典型的临床症状(即鼻痒、打喷嚏和鼻腔分泌物)的严重程度评估AR 动物模型[13]。每次完成鼻部激发10分钟后观察BALB/c小鼠行为特征,并对变应性鼻炎典型症状进行评分。记录时间自鼻部激发开始,行为症状评分记录四周,每次指定同一时间段及同一人进行评分,评估总分达5分及以上便可视为AR小鼠动物模型建模成功。记分方法:①鼻痒:0分-无;1分-搔鼻2次/分;2分-搔鼻4~6次/分;3分-搔鼻>6次/分;②打喷嚏:0分-无;1分-1~3次/10分;2分-4~9次/10分;3分>10次/10分;③鼻黏液:0分-无;1分-在鼻腔里;2分-流出鼻腔外;3分-涕流满面。
1.2.3中耳组织的观察指标 中耳的评价指标有[14]:①观察鼓膜象的改变;②中耳组织的病理改变;③中耳积液的性质;以出现中耳积液判断为OME。
1.2.4血清IgE表达水平检测 小鼠5%水合氯醛麻醉后,眼眶后静脉丛取血。离心机室温离心15 min,转速为3 000转/分,15 min后收集上清,ELISA试剂盒检测IgE的表达水平。
1.2.5鼻黏膜及听泡组织的采集 小鼠处死后,剥离头部皮肤,剪除外鼻,暴露头骨、鼻骨及听泡等,置于装有PBS的培养皿中。自鼻后孔冲洗鼻腔,于鼻中隔处正中矢状位处剪切开,翻开可见淡黄色的鼻腔黏膜,剥离及冲洗后置于4%多聚甲醛中固定4小时。将听泡周围组织、肌肉分离剪除干净,摘取听泡及咽鼓管骨段,EDTA脱钙液脱钙完全,PBS清洗后于4%多聚甲醛中过夜固定[15]。
1.2.6鼻黏膜及听泡组织HE染色及中耳黏膜厚度测量 将鼻黏膜及听泡的石蜡包块在-20℃冰箱预先保存30 min,切成均匀3 μm厚度粘附于载玻片上,置于摊片烤片机(恒温65℃)约150 min,经二甲苯Ⅰ、Ⅱ、Ⅲ 各10 min脱蜡,梯度酒精从高至低水化,苏木精染色40 s-自来水清洗-1%酒精瞬时分化10 s-伊红染色40 s-自来水清洗。顺酒精梯度及二甲苯从低到高脱水后充分干片后中性树胶封片。中耳组织切片时与鼓膜垂直,每块组织同一位置连续切3片,同部位重复测量3次取平均值。中耳鼓室黏膜有三种细胞类型:单层扁平上皮;扁平上皮(被覆纤毛)以及假复层柱状纤毛上皮。在距咽鼓管由近及远测量近咽鼓管黏膜、中段中耳鼓室黏膜、鼓膜紧张部3处的中耳黏膜厚度(图1)。
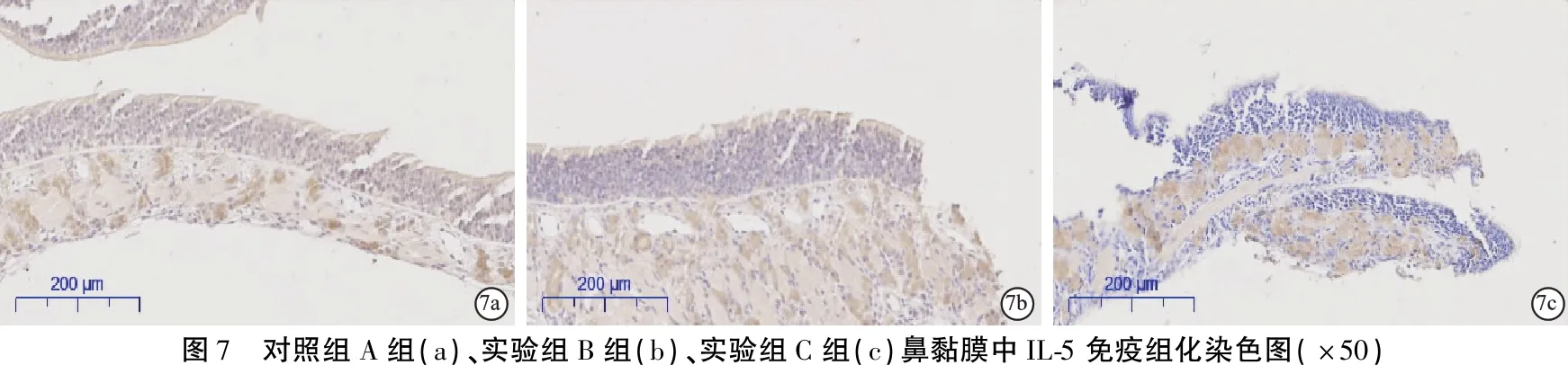
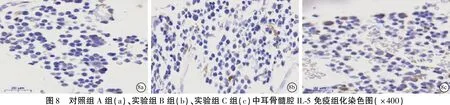
1.2.7免疫组织化学染色法检测IL-5在鼻黏膜及中耳骨髓腔中的表达 鼻黏膜及听泡石蜡块切片、烤片、以及脱蜡水化,将切片置于现配置的盛有柠檬酸盐的高压锅中,高温加热2 min后冷却、浸洗;3%H2O2甲醇溶液避光玻璃器皿里孵育10 min;浸洗画圈后于湿盒滴加二抗同源的山羊血清室温孵育(预实验得出兔抗鼠IL-5多克隆抗体稀释为1∶400)。20 min后一抗孵育4℃过夜。复温、二抗孵育30 min,浸洗后滴加二抗增强液37℃孵育;30 min后DAB显色显微镜下观察组织显色情况;最终封片后切片扫描后进行分析。
2 结果
2.1AR动物模型构建结果 各组小鼠鼻部激发不同时期行为症状学评分见表1,可见,对照组A小鼠四周内日常活动正常,仅偶尔出现滴鼻后刺激性的搔鼻和打喷嚏,无流涕症状,每日评分为0~1分;实验组B组小鼠耳部激发第一周出现搔鼻、打喷嚏,未见流涕,症状评分5.29±0.7分,第二周小鼠搔鼻及打喷嚏次数较前频繁,症状评分5.31±0.75分;症状评分>5分,变应性鼻炎模型构建成功。实验组C组小鼠鼻部激发第一周至第四周内均出现搔鼻、打喷嚏、鼻内流涕,且观察时间内可见2~3只小鼠出现搔耳朵行为,四周症状评分均>5分,变应性鼻炎模型构建成功。
表1 各组小鼠不同观察时期行为症状学评分(分,
滴鼻第1、2周时,实验组B、C组与对照组A症状学评分差异有统计学意义(P<0.001),滴鼻第3、4周时,实验组C组与对照组A组症状学评分有统计学意义,提示实验组B、C组均成功建立AR动物模型。
三组小鼠麻醉后观察鼓膜象:对照组A组6只小鼠鼓膜结构完整,半透明,标志清,光锥明显;实验组B组中5耳可见鼓膜变暗、内陷及充血;实验组C组中8耳鼓膜为淡黄色或琥珀色,可见不同程度的血管纹,其中3耳可见中耳积液,鼓膜完整,说明C组中3耳(25%,3/12)发生OME。
2.2三组血清总IgE表达量 实验组B组血清总IgE表达量为33.35±8.80 ng/ml,实验组C组为182.24±7.69 ng/ml,对照组A组检测阴性,未达到检测范围(检测范围为70~200 ng/ml)。实验B组与C组均检测到血清中IgE的表达增高,实验组C组较B组小鼠IgE表达明显升高(P<0.05)。
2.3鼻腔黏膜HE染色 三组小鼠的鼻黏膜HE染色见图2。对照组A组可见完整的结构清晰的上皮细胞,基底膜连续且分界清晰,固有层可见少量血管、腺泡的分布(图2a);实验组B组鼻黏膜上皮细胞层数增加且排列不齐,固有层增厚可见腺泡分泌增加、少量嗜酸性粒细胞、中性粒细胞以及淋巴细胞浸润(图2b);实验组C组黏膜上皮细胞内细胞层杂乱无章,基底膜界限不清,固有层成纤维细胞增多,大量嗜酸性粒细胞、中性粒细胞及淋巴细胞浸润,增厚明显(图2c)。
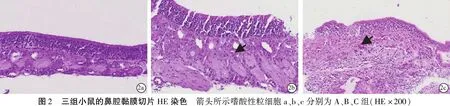
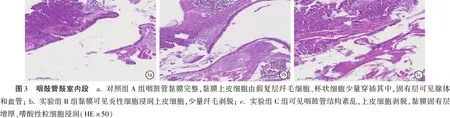
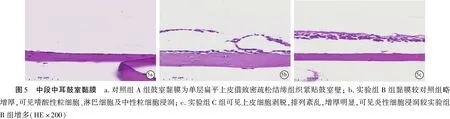
2.4三组中耳黏膜HE染色厚度测量 三组中耳黏膜厚度测量结果见表2,可见,实验组C组较对照组A组近咽鼓管黏膜增厚有统计学意义(P<0.05),中段中耳鼓室黏膜增厚有统计学意义(P<0.05),但鼓膜增厚无统计学意义(P>0.05)。三组中耳粘膜厚度观察结果见图3~6。
表2 三组小鼠三处中耳黏膜的厚度
2.5鼻黏膜及中耳骨髓腔中IL-5的表达 鼻黏膜中IL-5在固有层的腺泡细胞以及嗜酸性粒细胞的胞质中表达(图7),三组中表达阳性细胞计数见表3;中耳骨髓腔内IL-5在嗜酸性粒细胞、淋巴细胞、单核-巨噬细胞的胞浆中表达阳性(图8,表3),可见,实验组C组鼻黏膜IL-5表达阳性细胞数较对照组A组增多,差异有统计学意义(P<0.05);实验组B组与实验组C组、对照组A组之间的差异无统计学意义(P>0.05)。实验组C组中耳骨髓腔表达IL-5的阳性细胞较对照组A组多,差异有统计学意义(P<0.001),实验组B组与实验组C组、对照组A组之间IL-5表达差异无统计意义(P>0.05)。
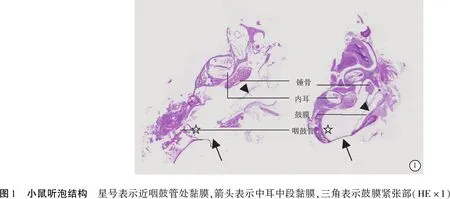
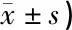
表3 三组鼻黏膜与中耳骨髓腔表达IL-5的阳性细胞数(个,
3 讨论
近年来很多学者对分泌性中耳炎与变态反应的相关性进行了探索,变态反应的侵入是通过鼻-咽鼓管-中耳途径。关于变态反应在OME发生发展机制中的作用,推测有以下几种可能[16]:①致敏原通过咽鼓管侵入,直接作用于中耳,使中耳产生变态反应;②致敏原导致鼻或咽鼓管阻塞,过敏原虽无法进入中耳,但中耳微环境发生改变(压力、缺氧等状态);③致敏原通过鼻-咽鼓管-中耳联合体进入中耳,发生变态反应,此后咽鼓管功能障碍,中耳微环境改变。本研究采用OVA全身基础致敏和上呼吸道局部滴鼻的方式,2周后成功构建变应性鼻炎小鼠模型,且在局部滴鼻第4周观察到中耳积液的发生(3/12耳),充分说明Ⅰ型变态反应可以引发OME。
本研究通过HE染色后观察三组鼻黏膜、咽鼓管以及中耳组织的变化,发现:①从最终黏膜改变结果来看,随着持续的过敏原刺激,该联合体的黏膜改变较一致,即开始的黏膜水肿-黏膜上皮细胞层增多排列紊乱、固有层炎性细胞的少量浸润、腺泡细胞增多-黏液上皮细胞的破坏、脱落以及固有层的成纤维细胞增生、炎性细胞大量浸润,支持鼻-咽鼓管-中耳途径可能是OME的致病途径,且中耳是变态反应的靶器官;②从黏膜改变时间节点来看,实验组B组可观察到咽鼓管及近咽鼓管黏膜细胞水肿和炎性浸润,而中耳鼓室中段黏膜及鼓膜无明显改变;实验组C组清晰可见咽鼓管黏膜明显的结构改变,而且中耳鼓室中段黏膜组织可见水肿。比较中耳近咽鼓管处黏膜、鼓室中段黏膜、鼓膜紧张部三处的中耳黏膜改变程度和先后顺序,作为连接鼻咽部及中耳的唯一通道,近咽鼓管处黏膜的变化最为明显,即咽鼓管内口的改变最明显,提示可能近咽鼓管段及咽鼓管段较先出现变态反应,从而使中耳微环境改变(例如:缺氧、pH值及压力改变)。


Ⅰ型变态反应由IgE介导,激活致敏细胞(肥大细胞和嗜碱性粒细胞),产生IL-4、IL-5等细胞因子,促进Th2细胞的极性表达,Th2类细胞因子IL-4、IL-5表达增多产生变态反应放大作用,从而使Th1/ Th2细胞比例失衡。而且IL-5是变态反应迟发相中参与的重要细胞因子之一,刺激骨髓细胞的发生,趋化调集炎症介质和细胞,破坏黏膜[2]。本研究实验组C组中,鼻黏膜及中耳骨髓中IL-5表达阳性细胞均明显增多,与鼻黏膜及中耳黏膜的炎性破坏呈正比,说明变态反应参与分泌性中耳炎的发生,且激活中耳黏膜的黏膜免疫系统,持续破坏中耳局部微环境。
综合上述观察,从组织结构改变来看,变态反应致中耳的咽鼓管及近咽鼓管段黏膜组织改变明显,说明咽鼓管在中耳炎的发生中不可或缺;从功能来看,中耳骨髓中IL-5阳性细胞的表达增加,说明中耳发生了变态反应。结合这两个方面得出变态反应对中耳的影响可能最开始致敏原通过咽鼓管逆行使近咽鼓管段及咽鼓管处黏膜激活,局部产生变态反应;其后局部黏膜水肿甚至结构改变导致咽鼓管功能障碍,中耳微环境改变,最终导致中耳炎的发生。
综上所述,Ⅰ型变态反应通过鼻-咽鼓管-中耳途径影响中耳,而且持续的变态反应可能会导致中耳局部组织处在高反应状态,变态反应是分泌性中耳炎的危险因素之一。本研究不足之处在于变应性鼻炎模型动物中耳积液的发生率低,未进行听力学检查及咽鼓管功能的检测,后期将进一步研究,并另外增加IL-5拮抗剂反相印证,从而让实验内容更加丰富,结论更加可靠。
