玻璃板上氢氧化亚铁的制备及转化
2022-07-05石月李悦迪王喜贵
石月 李悦迪 王喜贵


摘要: 石蕊溶液在硫酸亚铁和氢氧化钠溶液中会呈现出不同的颜色。通过改变硫酸亚铁溶液和氢氧化钠溶液的滴加顺序,在玻璃板上成功实现氢氧化亚铁的制备及转化。实验能够短时间内在玻璃板上清晰地呈现“白→灰绿→红褐”完整的变色现象,不仅有助于学生加深对氢氧化亚铁还原性的认识,而且有益于激发学生的学习热情以及培养科学探究与创新意识。
关键词: 氢氧化亚铁; 制备与转化; 实验探究
文章编号: 10056629(2022)06008104
中图分类号: G633.8
文献标识码: B
“铁及其化合物”是人教版普通高中化学必修第一册乃至整个高中化学阶段中的重要知识内容,是学习元素化合物的基础,同时也为学生构建“价类”二维认识方式奠定知识基础。《普通高中化学课程标准(2017年版2020年修订)》[1]中对于该节教学提出“制备氢氧化亚铁”的活动建议,旨在让学生通过氢氧化亚铁的制备实验,亲历变色现象,加深对氢氧化亚铁还原性的认知,加快构建物质分类观与转化观。然而,由于氢氧化亚铁极易与空气作用转变成氢氧化铁,严重影响白色沉淀的观察,因此其制备实验成为高中化学课堂中的热点与难点[2]。很多学者和一线教师对氢氧化亚铁的制备实验进行了深入探究,包括改进实验装置、甄选实验试剂、优化操作方法[3~8]等,但依然存在如制备装置复杂、实验步骤繁多、忽视沉淀后续转化而无法观察到完整的变色现象等问题。此外,上述研究由于条件控制较为复杂,因此教师多以演示实验为主,学生探究的积极性不高,无法深度参与,不利于培养学生的科学探究与创新意识。
为了简化实验装置和实验步骤,增强实验的趣味性,同时发展学生的动手实践能力,让他们能够亲自体会神奇的变色现象,进一步理解氢氧化亚铁的还原性,本文利用玻璃板和一些常规仪器及试剂,采用简单的溶液滴加的形式在玻璃板上成功实现氢氧化亚铁的制备及转化,并且能明显观察到沉淀由白到灰绿最后到红褐色的完整实验现象。该方法装置简单、步骤少、用时短,适用于课堂教学,能够满足每个学生亲自动手实验的需要,激发探究兴趣,进而培养科学探究与创新意识;同时通过在没有视觉障碍的玻璃板上直觀地观察到完整的变色现象,学生不仅能掌握氢氧化亚铁的还原性原理,而且能深刻认识到物质是处于不断的变化中,这有助于变化观念的形成与发展。
1 实验方案初步探索阶段
1.1 实验用品
托盘天平、烧杯(100mL)、玻璃棒、容量瓶(100mL)、玻璃板、胶头滴管、滴瓶、研钵、药匙、镊子、试管(10mm×100mm);NaOH固体、FeSO4·7H2O晶体、稀硫酸、蒸馏水、Vc片、石蕊溶液
1.2 操作步骤及现象
1.2.1 配制FeSO4和NaOH溶液
根据电势pH图可知,Fe2+在酸性条件下更稳定[9],因此选用稀硫酸作溶剂,FeSO4·7H2O晶体为溶质,并将Vc片研磨成粉末状加入其中,配制成0.1mol/L的FeSO4溶液。用蒸馏水(未煮沸)配制4mol/L的NaOH溶液。
1.2.2 配制变色溶液
在1号试管中滴入约15滴石蕊溶液,然后加入约20滴FeSO4溶液,混匀后溶液变为红色,编号为溶液1。在2号试管中滴入等量的石蕊溶液,然后加入20滴NaOH溶液,混匀后溶液变为蓝色,编号为溶液2。
1.2.3 布置玻璃板背景
将洁净的玻璃板置于黑色的实验台上。为了更明显地观察实验现象,可把白纸衬于玻璃板下,将玻璃板的底部背景一分为二,一半为黑色,一半为白色(在黑色背景中容易观察到白色沉淀的出现,而在白色背景中容易观察到红色、蓝色、灰绿色、红褐色的变化)。
1.2.4 制备Fe(OH)2沉淀
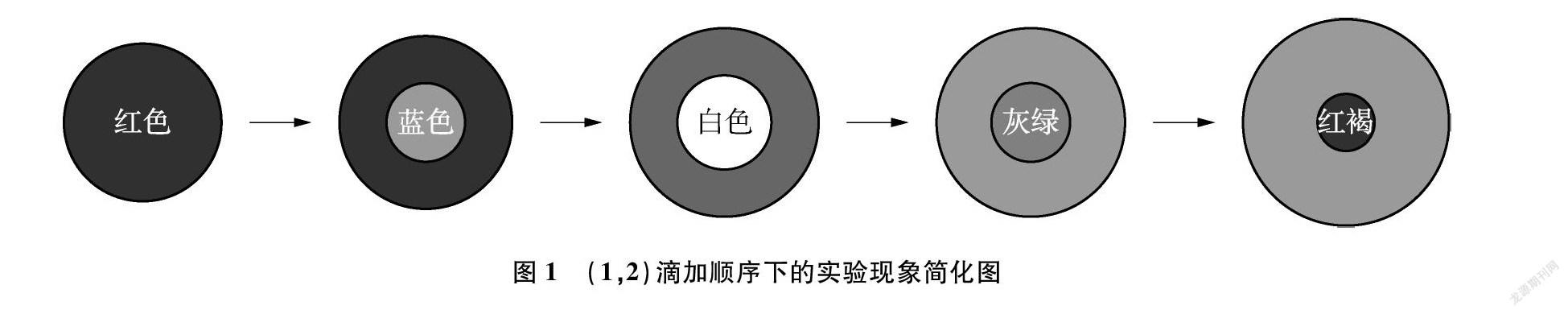
用1号胶头滴管吸取1号溶液在玻璃板的黑、白背景交界线上缓慢滴加1滴溶液,使其尽量保持圆形液滴的状态,此时玻璃板上出现的是1滴红色圆形液滴。再用2号胶头滴管吸取2号溶液缓慢在圆形液滴中央滴加1滴溶液,立即出现白色絮状沉淀。但很快观察到白色沉淀的位置在移动,逐渐从液滴边缘向内部缩回,颜色也由最初的白色转变成灰绿色,最终又转变为一个红褐色的小点。究其原因发现该液滴边缘的溶液显酸性,说明FeSO4溶液中未完全消耗的酸大量聚集在液滴边缘,将Fe(OH)2沉淀从边缘向内部溶解。在反应过程中,Fe(OH)2沉淀逐渐被氧化成红褐色的Fe(OH)3沉淀。为了清晰完整地展现整个实验过程,勾画出如图1所示的简化图。
为了探究溶液的滴加顺序对于Fe(OH)2的形成是否有影响,改变滴加顺序进行探究。
用2号胶头滴管吸取2号溶液在玻璃板的黑、白背景交界线上缓慢滴加1滴溶液,使其尽量保持圆形液滴的状态,此时玻璃板上呈现1滴蓝色圆形液滴。再用1号胶头滴管吸取1号溶液缓慢在圆形液滴中央滴加1滴溶液,立即出现白色絮状沉淀,但很快观察到白色沉淀由内而外逐渐消失,一段时间后,出现灰绿色圆环,最终呈现出不完整的红褐色半圆环。玻璃棒蘸取少量环内溶液,用pH试纸进行测定,发现环内溶液显酸性,进一步证实FeSO4溶液中的酸溶解了Fe(OH)2沉淀,使其呈现圆环形状。将实验现象以简化图(如图2)的形式呈现,便于观察和熟悉整个实验过程。
2 成功制备、转化阶段
2.1 操作步骤及现象
基于上述探究阶段的经验,用酸配制FeSO4溶液虽然可以在一定程度上抑制溶解氧,但最终还是影响了实验效果,因此在探究的基础上作进一步改进。仅将配制FeSO4溶液的溶剂改为蒸馏水,标记为3号溶液;由于NaOH溶液不需要中和FeSO4溶液中多余的酸,因此可以将其浓度降低为1mol/L,标记为4号溶液。其他步骤如同前面的探究实验。但此阶段却在玻璃板上成功实现了氢氧化亚铁的制备及转化。
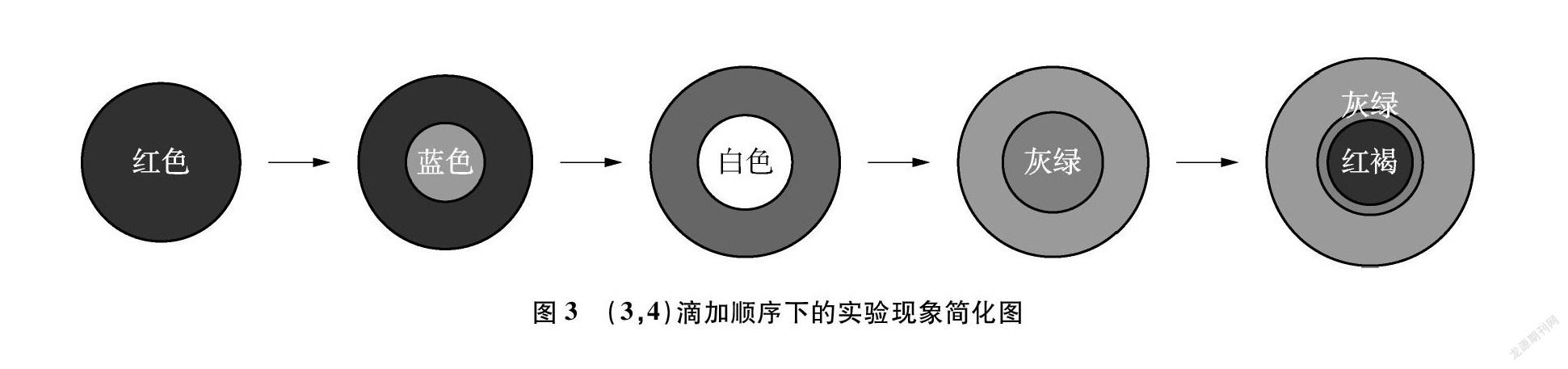
用3号胶头滴管吸取3号溶液在玻璃板的黑、白背景交界线上缓慢滴加3~4滴溶液,使其尽量保持圆形液滴的状态,此时玻璃板上呈现出红色圆形液滴。再用4号胶头滴管吸取4号溶液缓慢滴加1滴于圆形液滴中央,此时明显观察到红色液滴上呈现出蓝色溶液,并且圈层分明。两溶液混合并快速发生反应,在玻璃板上出现似淡红色花朵中央绽放白色花蕊的美丽现象。一段时间后,白色花蕊逐渐转变成灰绿色,最后形成由稳定而坚固的灰绿色环包围下的红褐色花蕊。在短时间内,玻璃板上生长出圈层分明的五彩变色“小花”。为了清晰地观察五彩变色现象,勾画出如图3所示的简化图。
为满足学生对于滴加顺序是否影响白色沉淀生成的好奇心,教师在此基础上引导学生改变3、 4号溶液的滴加顺序,观察玻璃板上是否出现相同的实验现象。
用4号胶头滴管吸取4号溶液在玻璃板的黑、白背景交界线上缓慢滴加3~4滴溶液,使其尽量保持圆形液滴的状态,此时玻璃板上呈现出蓝色圆形液滴。再用3号胶头滴管吸取3号溶液缓慢滴加1滴于圆形液滴中央,明显观察到蓝色液滴上呈现出红色溶液,并且圈层分明。两溶液混合并快速发生反应,在玻璃板上出现似淡蓝色花朵中央绽放白色花蕊的美丽现象。一段时间后,白色花蕊逐渐转变成灰绿色,最后完全转变为红褐色。为了清晰地观察五彩变色现象,勾画出如图4所示的简化图。
2.2 实验结果
上述两组实验表明,改变溶液的滴加顺序,在本实验中并不会影响氢氧化亚铁白色沉淀的出现,也不影响后续完整变色现象的观察,因此,在教学过程中不必细究。但就其实验本身而言,不同滴加顺序下的实验现象略有差异。如图3中出现“稳定坚固的灰绿色环包围下的红褐色花蕊”,而在图4中仅出现“红褐色”的现象,并没有出现前者中的灰绿色环,这是何种原因导致?徐建飞老师在“制备氢氧化亚铁实验方案再探究”一文中指出,灰绿色沉淀可能是由于氢氧化亚铁沉淀吸附溶液中过量的亚铁离子所致[10]。由图3所展现的实验中,硫酸亚铁量较多且分布在液滴外围,液滴中央产生的氢氧化亚铁沉淀吸附了周围未反应完全的亚铁离子而形成稳定而坚固的灰绿色环。而由图4所展现的实验中,硫酸亚铁量较少,因此没有出现如图3所示的现象。
3 实验改进总结
(1) 承载丰富的知识内容,建立完整的知识体系。該实验以回顾旧知为始,将蕴含新知的操作步骤分阶段逐步推进,在加强知识衔接的基础上促进知识体系的完善。首先,利用配制变色溶液这一过程引导学生回顾初中学过的酸碱遇指示剂变色的性质,增强视觉体验的同时促进知识体系的联系与衔接。其次,探究阶段中由不同滴加顺序引起的实验现象的差异证实了氢氧化亚铁遇酸溶解的性质,在探究的过程中自主发现该性质,增强了学生的证据推理能力,并在此基础上优化制备方案。最后,所制氢氧化亚铁在空气中由白至灰绿到红褐色的现象变化,实现了二价铁到三价铁的转化,印证了二价铁的还原性,促进了学生“价类”二维认知方式的构建。在实验探究中,实现了对氢氧化亚铁从性质、制备到转化的感性认知,并注重前后知识的衔接,有利于学生理性地构建完整的知识体系。
(2) 仪器装置简单,操作易行。利用玻璃板取代大部分研究中的试管作为反应发生装置,其独特性在于把氢氧化亚铁的颜色与状态更加直观地呈现在学生眼前。由于步骤简便,只需胶头滴管在玻璃板上进行滴加便可实现,非常适合开展学生实验,将理论知识与实践探究有效结合,培养学生的动手能力,促进科学探究与创新意识核心素养的落实。
(3) 现象直观,趣味性强。本研究的一个创新点在于把氢氧化亚铁的制备置于一个开放体系——玻璃板上进行,使学生能够直观地观察到溶液的流动融合、白色沉淀从出现到灰绿以至红褐的完整变色过程,给予学生以视觉的冲击与体验,切身感受化学反应的独特魅力,增强了实验的趣味性。
(4) 试剂用量少,高效且环保。本实验在制备过程中,只需要几滴溶液就可以明显地观察到实验现象,不仅实验效果良好,更是体现了高效环保的绿色化学理念。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 16.
[2]李俊生, 胡志刚. 对氢氧化亚铁制备的几个疑难问题的研究[J]. 化学教学, 2011, (11): 67~70.
[3]唐悦. 氢氧化亚铁制备实验的探究[J]. 化学教学, 2010, (5): 14~15.
[4]张爱菊, 陶锁军, 张小林. 电解制备氢氧化亚铁除氧方式探究[J]. 化学教学, 2014, (6): 56~57.
[5]张宏艳. 基于X射线衍射分析方法改进氢氧化亚铁制备实验[J]. 化学教学, 2021, (5): 77~81.
[6]杨晓东. 氢氧化亚铁制备实验的再探究[J]. 化学教学, 2015, (2): 56~58.
[7]张元双, 许九奎, 马薇. 氢氧化亚铁的制备与氧化方法实验创新[J]. 中学化学教学参考, 2020, (21): 47~48.
[8]聂素云. 稳定氢氧化亚铁的制备实验改进[J]. 化学教育, 2011, 32(11): 71.
[9]傅献彩, 沈文霞, 姚天扬等. 物理化学(第五版)(下册)[M]. 北京: 高等教育出版社, 2006: 94.
[10]徐建飞, 张平, 杜淑贤. 制备氢氧化亚铁实验方案再探究[J]. 化学教学, 2015, (7): 54~57.
