燕麦蒽酰胺的制备及其促肺癌细胞凋亡机制研究
2022-07-02郁永辉周琳悦刘柯杉李欣萍
郁永辉, 周琳悦, 刘柯杉, 李欣萍, 王 静
(北京工商大学 中加食品营养与健康联合实验室/食品营养与人类健康高精尖创新中心, 北京 100048)
燕麦作为全谷物中一种营养价值较高的全球性栽培物,具有悠久的种植和食用历史[1-2]。 燕麦富含蛋白质、膳食纤维、维生素、矿物质等营养素及黄酮类、多酚类等生物活性成分[3-4]。 燕麦蒽酰胺(avenanthramides, Avns)是燕麦中独特存在的一种醇溶性化合物,自然条件下主要由燕麦中邻氨基苯甲酸及其衍生物和肉桂酸及其衍生物在相应酶作用下脱水缩合而生成[5]。 目前已发现的Avns 已达40余种[6-7],主要分布在燕麦麸皮及糊粉层中。 燕麦蒽酰胺2p(N-4′-羟基肉桂酰-5-羟基邻氨基苯甲酸)、2f(N-4′-羟基-3-甲氧基肉桂酰-5-羟基邻氨基苯甲酸)和2c(N-3′,4′-二羟基肉桂酰-5-羟基邻氨基苯甲酸),又称为Avn A、Avn B 和Avn C,是燕麦中含量较高的3 种主要活性成分[8]。 此外,燕麦蒽酰胺D、E、F、G、H、K、X、Y、Z 九种结构是由邻氨基苯甲酸及其衍生物分别与p-香豆酸、阿魏酸和咖啡酸脱水缩合而成;O、P、Q、L、M、N、R、S、T、U、V、W 十二种结构分别由邻氨基苯甲酸2,4-戊二烯及其邻羟基甲氧基取代物、邻羟基的羟基取代物结合生成[9-10]。 Avns 的天然含量较低,且受生长环境及基因型等因素的影响,含量差异较大,报道显示,Avns的天然含量在2 ~290 mg/kg[11-12]。 本课题组先前的报道表明,发芽过程可改变燕麦籽粒中Avns 合成相关酶活性,参与Avns 合成的羟氨基苯甲酸-N-羟基肉桂酸转移酶(hydroxycinnamoyl-CoA: hydroxyanthranilic acidN-hydroxycinnamon acyltransferase,HHT)活性明显提高,有效促进Avns 的生物转化[7],这为获取足量天然来源的Avns 提供了理论基础。
已有报道显示,Avns 在维持机体健康方面发挥着重要作用,具有良好的抗氧化、缓解炎症、抑制过敏反应、调节肠道菌群及预防肿瘤等功效[7,12]。 研究表明,Avns 的体外抗氧化活性是燕麦中其他酚酸类物质如咖啡酸、阿魏酸的10 ~30 倍[13],并可显著缓解氧化应激导致的神经细胞损伤[14];动物实验和临床研究也证实,富含Avns 饮食有助于降低核转录因子κB(nuclear factor kappa B,NF-κB) 活性并抑制运动等诱发的肌肉组织中促炎因子表达[7];另外,Avns 具有良好的抗过敏活性,Avns 干预可显著抑制肥大细胞等参与的过敏反应[15],临床研究也显示含有Avns 的护肤品可有效降低儿童过敏性皮炎的发生率[16]。 目前,Avns 类似物曲尼司特已被广泛应用于治疗过敏性疾病;Avns 及其代谢产物也是优良的肠道菌群调节剂,Avns 的体内代谢依赖于肠道菌群,同时酚酸类代谢产物又可显著改善机体肠道菌群[7,17];研究也证实Avns 可在抑制结肠癌、肝癌和乳腺癌等癌细胞增殖、促进癌细胞凋亡方面发挥重要作用[18-20],且随着全球癌症患病人数和死亡人数的逐年增加,Avns 在防控肿瘤方面的作用也备受关注。
据国际癌症研究机构统计,肺癌是全球发病率和致死率最高的一种癌症[21],其中非小细胞肺癌(non-small cell lung cancer, NSCLC)在肺癌中占比可达85%[22]。 2015年的统计数据显示,我国肺癌的发病率和死亡率分别为每10 万人中733.3 人和610.2 人,且预计到2030年死亡率还会增加约40%[23-24]。 临床组织样本分析发现,肺癌组织中X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis,XIAP)表达以及核转录因子κB(nuclear factor kappa B,NF-κB)活性均明显高于正常组织,且NF-κB 的激活可上调XIAP 蛋白表达,从而增强XIAP 在NSCLC 细胞中的抗凋亡作用[25-26]。 因此,XIAP 是参与肺癌细胞抗凋亡调控的关键蛋白,抑制XIAP蛋白表达将有助于肺癌防控。 尽管先前的研究已证实Avns 在癌症防控中发挥作用,但其对NSCLC 细胞的调控作用尤其是XIAP 蛋白表达的影响尚未见报道。 本研究拟采用燕麦发芽方式对Avns 进行生物转化,优化其提取条件,重点探究天然Avns 对NSCLC 细胞H1299 和A549 凋亡相关NF-κB/XIAP通路及细胞凋亡的影响,进而揭示天然Avns 参与肺癌防控的潜力及其作用机制,希望为全谷物燕麦特有活性成分Avns 应用于肺癌防控提供理论依据。
1 材料与方法
1.1 材料与试剂
正己烷(分析纯),上海安谱实验科技股份有限公司;无水乙醇(分析纯)、甲醇(色谱纯)、乙腈(色谱纯)、十二烷基硫酸钠(SDS),美国MREDA 公司;标准品Avn A、Avn B、Avn C,美国Sigma 公司;非小细胞肺癌细胞系H1299、A549,南京草之源生物科技有限公司;胎牛血清(FBS)、双抗(青霉素+链霉素)、DMEM 高糖培养基、RPMI 1640 培养基、质量分数为0.25% 胰蛋白酶,美国Gibco 公司;p-p65 抗体、p65 抗体、XIAP 抗体、β-actin 抗体,武汉爱博泰克(ABclonal)生物科技有限公司;CCK-8 检测试剂盒,东仁(DOJINDO)化学科技(上海)有限公司;BCA 蛋白定量试剂盒、Annexin V-FITC/PI 凋亡检测试剂盒,北京索莱宝科技有限公司;0.5 mol/L Tri-HCl 缓冲液(pH 值6.8)、1.5 mol/L Tri-HCl 缓冲液(pH 值8.8),武汉卡诺斯科技有限公司;30%制胶液、甘氨酸、RIPA 组织/细胞快速裂解液,北京索莱宝科技有限公司;TEMED,上海阿拉丁股份有限公司;牛血清白蛋白(BSA),上海源叶科技有限公司;T25 细胞培养瓶、PVDF 膜,美国Thermo 公司;细胞计数板、96 孔板、6 孔板,美国Corning 公司;滤纸,美国BIO-RAD 公司。
1.2 仪器与设备
800C 型磨粉机,上海久品实业科技有限公司;BILON-1000CT 型超声波提取机,上海比朗仪器制造有限公司;JK-MSH-Pro-6A 型六联磁力搅拌器,郑州科达机械仪器有限公司;R-300 型旋转蒸发系统,瑞士步琦有限公司;Freezone 12plus 型冷冻干燥机,美国Labconco 公司;Synergy H1M 型多功能酶标仪,美国Bio Tek 公司;3K15 型高速冷冻离心机,德国Sigma Laborzentrifugen GmbH 公司;LC-20A 型高效液相色谱仪,日本岛津公司;TD6 型台式低速离心机,湖南赫西仪器装备有限公司;伯乐Trans-Blot Turbo 型蛋白转印系统,美国BIO-RAD 公司;YXQLS-50A 型立式压力蒸汽灭菌器,浙江新丰医疗器械有限公司;IX73P1F 型活细胞成像倒置显微镜,日本奥林巴斯公司;ChemiDoc MP 型电泳凝胶成像分体系统,美国BIO-RAD 公司;CytoFLEX S 型流式细胞仪,美国贝克曼库尔特公司。
1.3 实验方法
1.3.1 燕麦米前处理
对燕麦米进行筛选,去除破碎籽粒,用去离子水冲洗两遍,纱布盖好后放入16 ℃生化培养箱中进行发芽培养。 分别在第3 天、第6 天收取发芽后的燕麦米,并保存在-80 ℃冷冻24 h。 冷冻干燥后,将干燥的发芽燕麦米在磨粉机中磨碎并过60 目筛。将过筛后的燕麦粉放入烧杯中,加入燕麦粉2 倍体积的正己烷,磁力搅拌1 h,8000 r/min 离心10 min,倒掉上清液加入新的正己烷,重复以上操作至上清液为无色。 脱脂后的燕麦粉放在通风柜中过夜干燥,干燥后的燕麦粉放在自封袋中,4 ℃保存待用。
1.3.2 燕麦蒽酰胺的提取
精确称取1.00 g 脱脂后的燕麦粉于50 mL 离心管中,按照料液比(g/mL)为1∶20 加入体积分数为80%的无水乙醇,涡旋混匀后将离心管置于设置功率为80 W 的恒温超声波提取机中超声10 min,然后置于50 ℃六联磁力搅拌器中搅拌2 h,常温下离心,得到上清液。 重复操作3 次,并将得到的上清液合并置于旋蒸瓶中,旋蒸至干,用色谱级甲醇复溶并定容至5 mL,4 ℃保存待测。
1.3.3 燕麦蒽酰胺含量检测
采用分析型HPLC(C18 色谱柱150 mm ×3.0 mm,5 μm)对燕麦蒽酰胺进行定性和定量检测,检测条件为流动相A:0.1%乙酸水,流动相B:乙腈,流速0.8 mL/min,柱温箱30 ℃,检测波长340 nm,进样量设置10 μL,梯度洗脱程序:0 ~4 min(体积分数为20%的乙腈),4 ~14 min(体积分数为20% ~60%的乙腈),14 ~15 min(体积分数为60%的乙腈),15 ~21 min(体积分数为60% ~20%的乙腈),21 ~25 min(20%的乙腈)。
1.3.4 燕麦蒽酰胺提取单因素实验
以Avns 含量为评价指标,分别考察超声功率(60、70、80、90 W)、料液比(g/mL)(1 ∶5、1 ∶10、1∶20、1 ∶30、1 ∶40)、乙醇体积 分 数(50%、60%、70%、80%、90%)等不同提取条件对Avns 含量的影响。
1.3.5 燕麦蒽酰胺提取工艺响应面优化试验
在单因素实验基础上,选取超声功率(F1)、料液比(F2)、乙醇体积分数(F3)为3 个考察因素,以Avns 含量为评价指标,进行响应面优化试验,因素水平编码如表1。

表1 响应面试验设计因素及水平Tab.1 Design factors and level of response surface test
1.3.6 肺癌细胞培养及传代
无菌条件下将H1299 细胞或A549 细胞分别培养于含有体积分数为10% 的FBS、1% 双抗的DMEM 培养基和RPMI 1640 培养基中,置于体积分数为5%的CO2培养箱中37 ℃培养。 采用倒置显微镜观察细胞生长情况,细胞密度达到80%以上时经质量分数为0.25%的胰蛋白酶消化进行传代培养。
1.3.7 实验分组方法
设置对照组、燕麦蒽酰胺C 标准品(Avn C)组和燕麦蒽酰胺混合物(Avns)组。 对照组:正常培养。 Avn C 组:标准品Avn C 经DMSO 溶解后,采用DMEM 作为溶媒介将Avn C 稀释成终质量浓度为20、40 mg/mL 的溶液。 Avns 组:Avns 经DMSO 溶解后,采用DMEM 作为溶媒介将提取的Avns 稀释成终质量浓度为20、40 mg/mL 的溶液。 所配制的溶液在后续细胞实验分析中稀释使用。
1.3.8 CCK-8 分析
将生长密度和活力适宜的H1299 细胞或A549细胞用0.25%胰酶消化后进行细胞计数,调整细胞密度至5 ×104个/mL,接种于96 孔板培养24 h,分别加入3 种燕麦蒽酰胺标准品Avn A、Avn B 和Avn C,使终质量浓度为5、10、20、40 μg/mL。 每个浓度设置4 个复孔,同时设置空白组和对照组。 继续培养24 h 后,每孔中加入10 μL CCK-8 试剂培养1 ~4 h,最后用酶标仪在450 nm 处测量吸光度值,用公式计算各组细胞的增殖情况。
1.3.9 Annexin V-FITC/PI 流式细胞检测
对H1299 和A549 细胞处理24 h 后,不同处理组细胞经胰酶消化后,1000 r/min离心5 min 收集细胞,用预冷的PBS 洗涤并1000 r/min 离心5 min 收集细胞后,加入1 ×Binding Buffer 重悬细胞,调整细胞密度至1 ×106个/mL。取100 μL 细胞悬液,加入5 μL Annexin V-FITC 溶液,轻轻混匀,室温避光孵育10 min。 然后加入5 μL PI 染液室温避光孵育5 min,预冷的PBS 补足500 μL 后轻轻混匀,并在1 h 内用流式细胞仪完成检测。
1.3.10 Western blot 检测
对H1299 和A549 细胞干预24 h 后,收集不同处理组细胞,使用蛋白提取试剂盒提取总蛋白。 采用BCA 蛋白定量试剂盒对蛋白样品进行定量,依次进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜质量分数为5%的脱脂奶粉封闭,1∶1000 稀释的p-p65、p65、XIAP 或β-actin 等一抗4 ℃孵育过夜,二抗(1∶10000)室温孵育90 min,最后用ECL 显影液显色并置于凝胶成像系统中获取图像。 以βactin 为内参,采用Image J 软件进行定量分析。
1.4 数据处理
所有实验重复3 次,采用SPSS 17.0 软件进行方差分析,对差异显著的进行邓肯氏多重比较,P<0.05 表示组间存在显著性差异。
2 结果与分析
2.1 Avns 制备条件的优化分析
2.1.1 发芽前后Avns 定性和定量分析
天然燕麦中Avns 含量较低,而发芽是生物转化Avns 的有效方式,经发芽处理后燕麦中Avns 合成相关HHT 活性明显增强,而HHT 可利用游离前体邻氨基苯甲酸和肉桂酸及其衍生物作为底物,进一步催化合成Avns[8,27-29]。 本研究采用高效液相色谱法分析了未发芽、发芽3 d、发芽6 d 燕麦中Avns含量变化,实验结果如表2 和图1。 由表2 可知,Avn C 的保留时间在12.8 min 左右,Avn A 和Avn B的保留时间稍靠后且较接近,分别在14.4 min 和14.8 min 左右。 由图1 可知,未发芽燕麦中Avns 含量较低,3 种含量较高Avn A、Avn B 和Avn C 的提取总量约为12 μg/g,但经过发芽处理后3 种Avns含量明显升高,发芽3 d 和6 d 后其总量分别为513 μg/g和694 μg/g。 因此,后续实验选用发芽6 d的燕麦进行Avns 提取的单因素实验。

表2 标准品Avn A、Avn B 和Avn C 的保留时间Tab.2 Retention time of standard Avns A, B and C
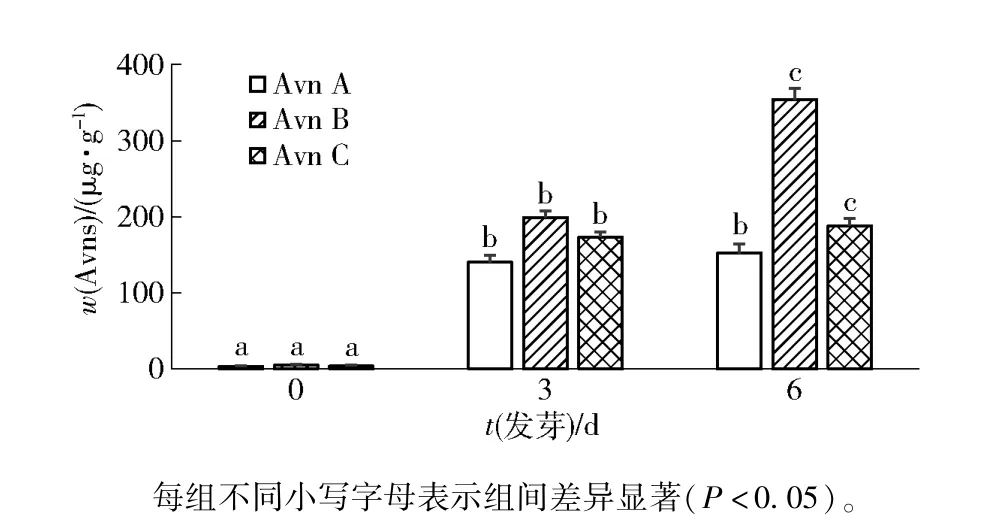
图1 发芽对燕麦中3 种主要Avns 含量的影响Fig.1 Effect of germination on content of three main types of Avns in oat
2.1.2 Avns 提取单因素实验优化结果
2.1.2.1 料液比对Avns 提取量的影响
料液比可能会改变目标物分子间的作用力从而影响提取量,料液比对3 种主要Avns 及其提取总量的影响实验结果如图2。 由图2 可见,本实验中料液比(g/mL)在1∶5 ~1∶20,Avn A、Avn B 和Avn C 三种主要成分及其总提取量有明显增加,继续增加料液比,Avn A、Avn B 和Avn C 提取量均呈现下降趋势。 可能是当料液比(g/mL)为1∶20 时,Avns的提取已较为充分,继续增加料液比会延长浓缩时间,降低Avns 的稳定性,从而造成提取量的损失。本实验结果表明,Avns 提取较为适宜的料液比(g/mL)为1∶20。
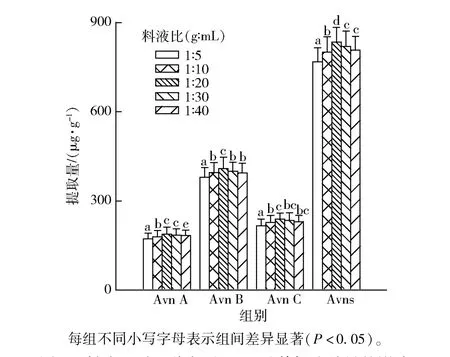
图2 料液比对3 种主要Avns 及其提取总量的影响Fig.2 Effect of solid-liquid ratio on extraction amount of three main types of Avns
2.1.2.2 超声功率对Avns 提取量的影响
超声的空化效应和热效应等会影响样品中目标物的释放与溶出,超声功率对3 种主要Avns 及其提取总量的影响,实验结果见图3 。 由图3 可知,超声功率在60 ~80 W 时,Avn A、Avn B 和Avn C 及三者总提取量均有所提高,并在超声功率为80 W 时达到最高,这可能是超声波的剪切效应和热效应,加速了细胞内物质的释放,从而促进样品中Avns 的浸出。 当超声功率超过80 W,Avns 提取量逐渐降低,其原因可能是超声功率过大会破坏Avns 内部结构,从而不利于其提取。 本部分结果表明,提取Avns 较适宜的超声功率为80 W。
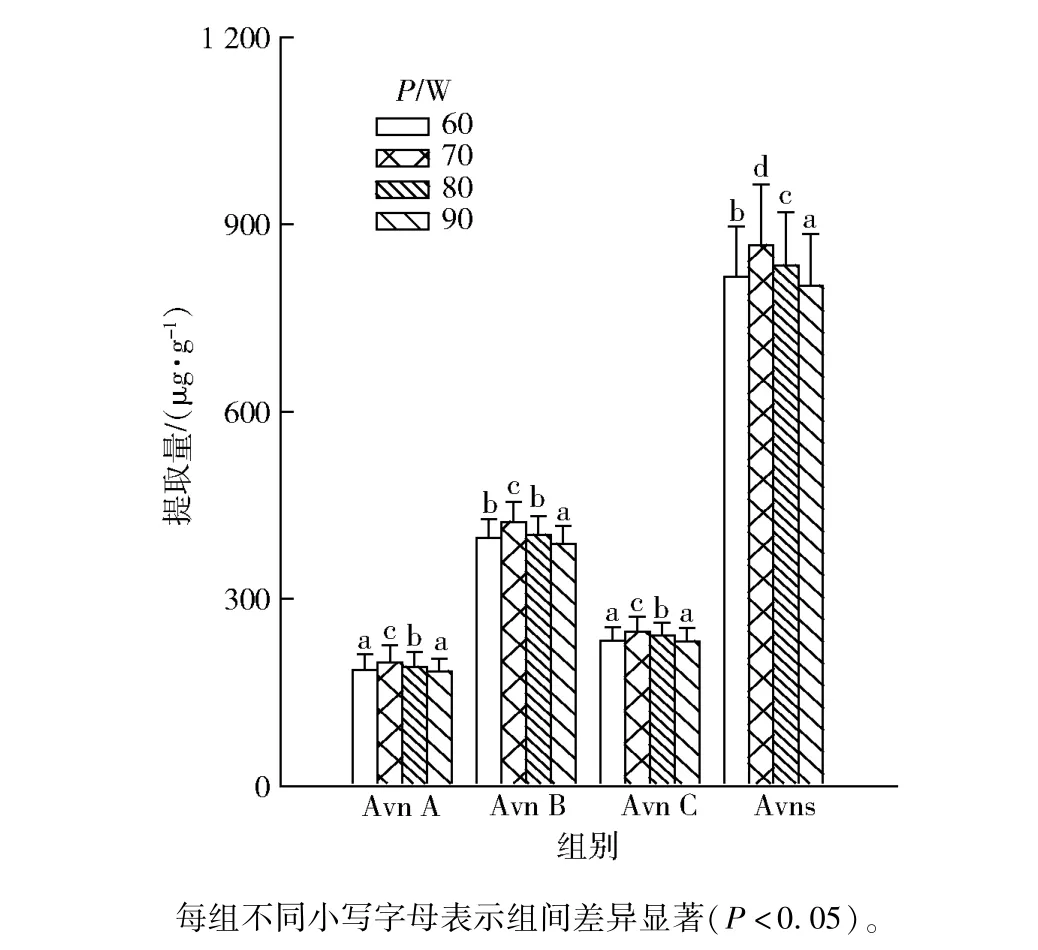
图3 超声功率对3 种主要Avns 及其提取总量的影响Fig.3 Effect of ultrasonic power on extraction amount of three main types of Avns
2.1.2.3 乙醇体积分数对Avns 提取量的影响
乙醇体积分数的大小会影响溶剂的渗透能力,乙醇体积分数对3 种主要Avns 及其提取总量的影响实验结果见图4。 由图4 可知,乙醇体积分数为50% ~90%时,Avn A、Avn B 和Avn C 三种主要成分及其总提取量随着体积分数升高而显著提高,但Avn A 的提取量在乙醇体积分数达到80%后开始降低,原因可能是适宜的乙醇体积分数可充分溶解Avns。 在乙醇体积分数达到80%时提取量的增加趋于稳定,因此确定较为适宜的乙醇体积分数为80%。
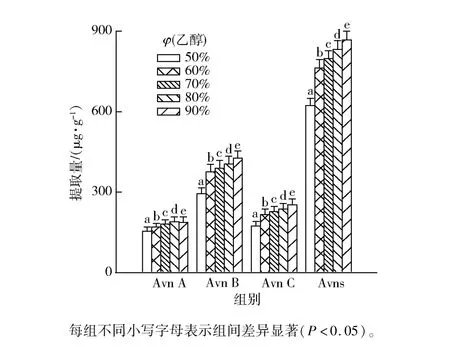
图4 乙醇体积分数对3 种主要Avns 及其提取总量的影响Fig.4 Effect of ethanol volume fractions on extraction amount of three main types of Avns
2.1.3 响应面试验设计与结果分析
单因素实验后进一步选取较为适宜的超声功率、料液比和乙醇体积分数三因素的三水平进行响应面试验设计,响应面试验设计及其结果见表3。
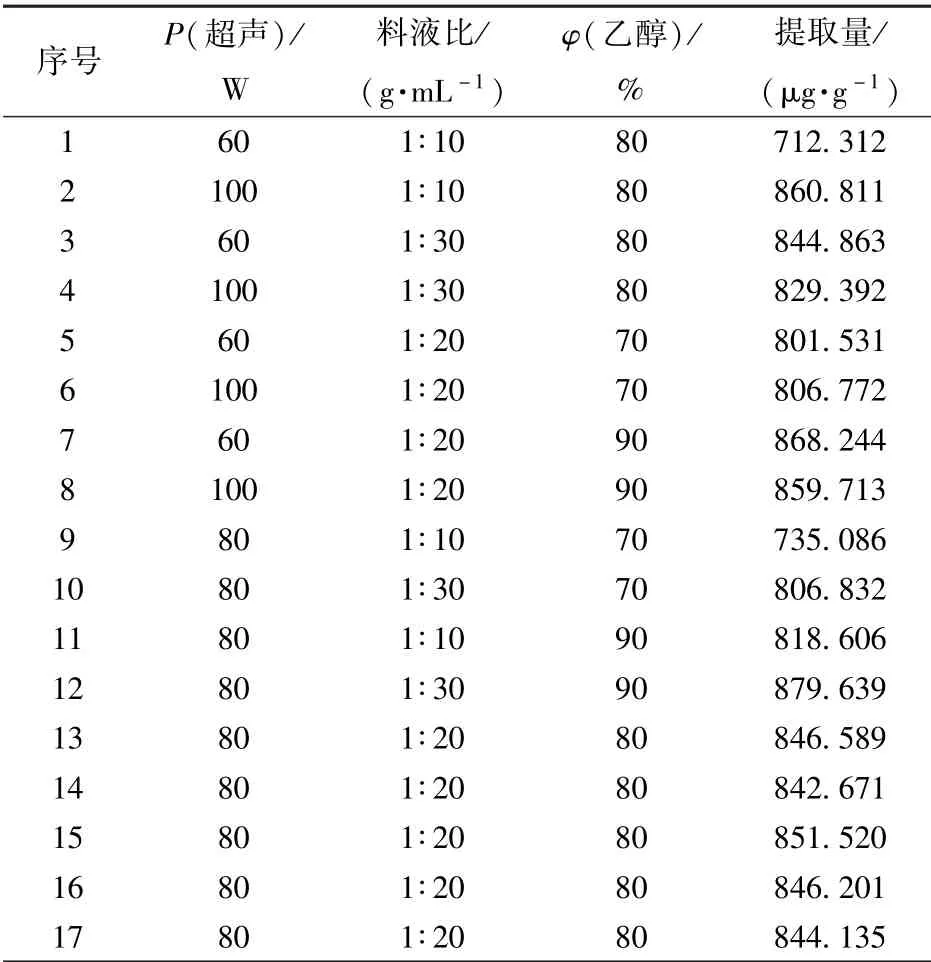
表3 响应面试验设计与结果Tab.3 Response surface experiment design and results
采用软件对试验结果进行拟合。 得到回归方程:
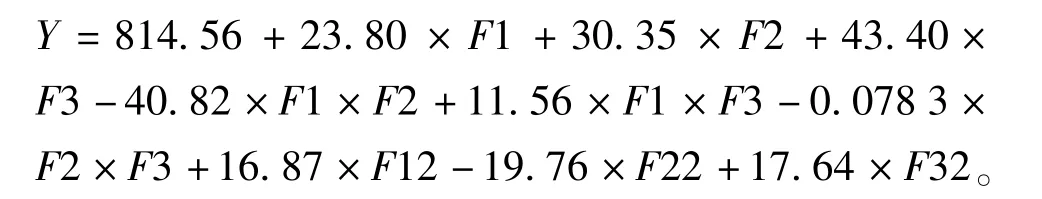
对此回归模型进行各自变量因素的方差分析,结果如表4。
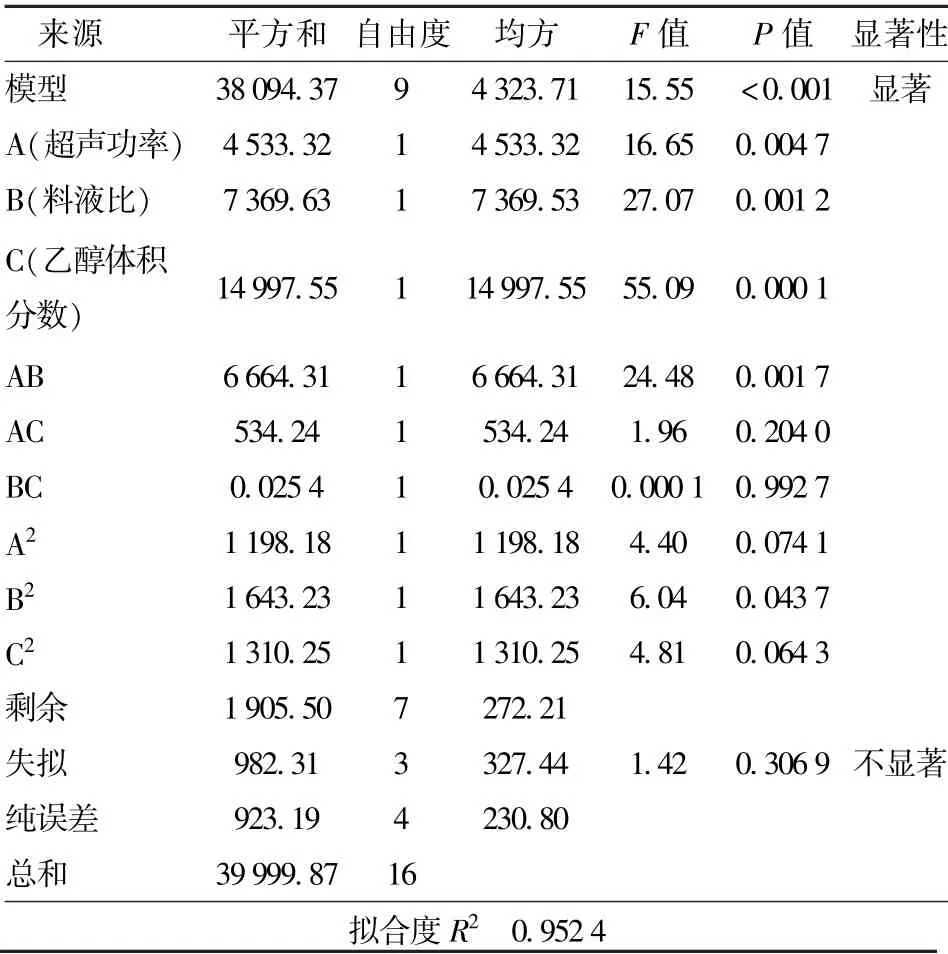
表4 自变量的方差分析Tab.4 Analysis of variance for each independent variable
由表4 可知,3 个因素对提取量的影响由大到小顺序为:体积分数、料液比、超声功率。 该模型P值小于0.001 表明模型极显著并具有可靠性,失拟项为P=0.3069(P>0.05)不显著,说明该模型与实验真实值接近,适合Avns 提取量的分析和预测,表明可以用此模拟方程来分析实验数据和预测实验结果。 响应面分析结果见图5,由图5(a)可知,响应面图曲面陡峭,说明料液比和超声功率的交互作用显著,Avns 的提取量随料液比和超声功率的递增先增大后减小;由图5(b)可知,在同一超声功率条件下,随着乙醇体积分数的增大,Avns 的提取量逐渐提高;如图5(c)所示,在同一料液比条件下,随着乙醇体积分数的增大,Avns 的提取量也逐渐增大。根据回归方程可得,最适提取条件为料液比(g/mL)1∶22.2,超声功率87.6 W,乙醇体积分数84.2%,在此条件下响应面优化结果显示,Avns 提取量可达850.864 μg/g。
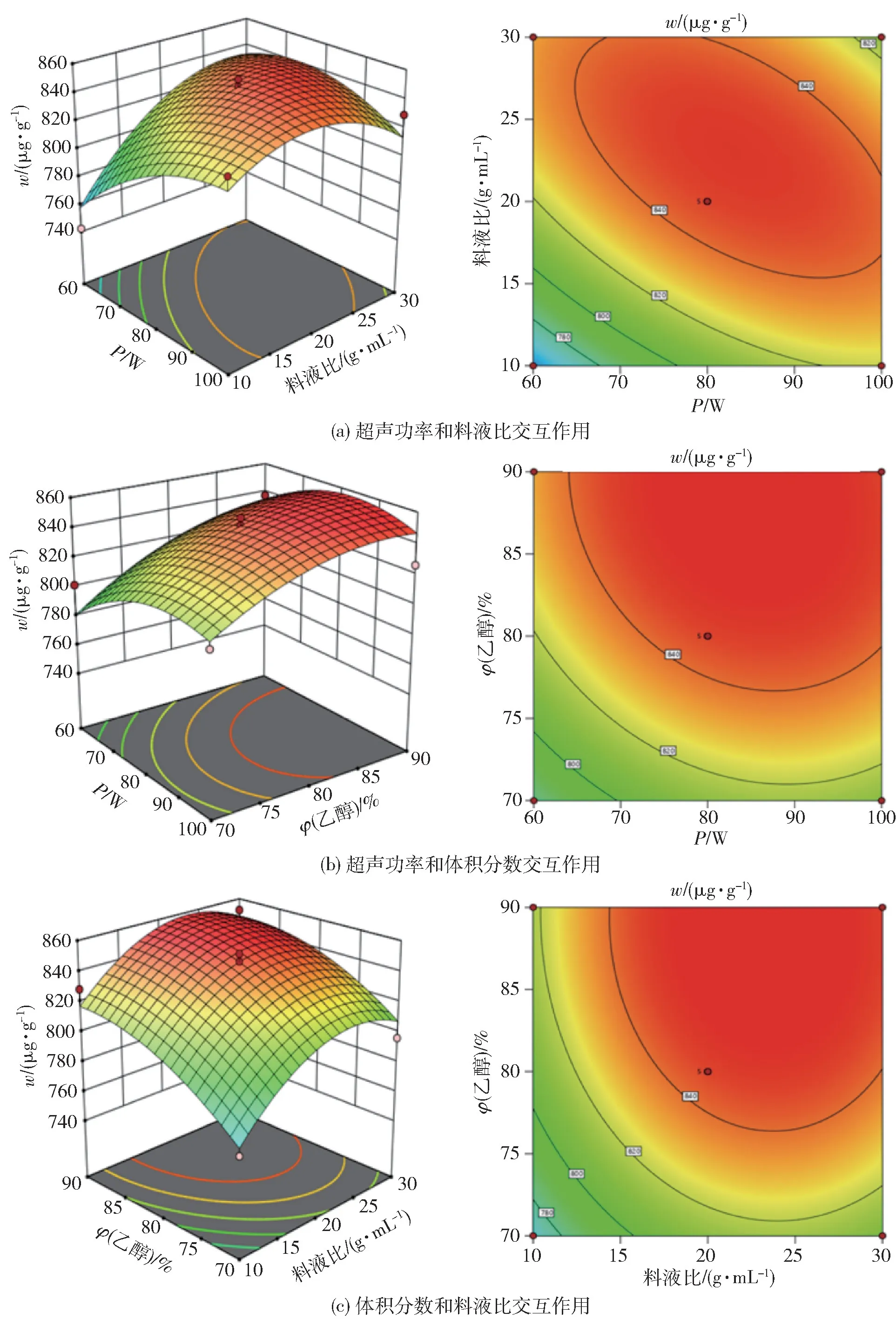
图5 不同因素对Avns 提取量影响的响应面及等高线图Fig.5 Response surface and contour diagram of different factors on extraction amount of Avns
利用优化后的最适条件对Avns 进行提取,以验证试验模型的可靠性,实验结果见表5。 如表5 所示,在料液比(g/mL)1∶22.2,超声功率87.6 W,乙醇体积分数84.2%的条件下,进行3 次平行实验,所得燕麦中Avn A、Avn B 和Avn C 三种主要蒽酰胺成分总量的平均值为849.251 μg/g,与模型结果相近,符合预期提取量值,证明该模型可以用来较好地预测Avns 的提取量。 本研究结果表明,燕麦发芽6 d 后,Avns 最优提取条件为料液比1∶22.2,超声功率87.6 W,乙醇体积分数84.2%,且在此条件下,Avn A、Avn B 和Avn C 的提取总量约为850 μg/g,其提取效果显著优于已报道的采用单纯超声波降解法制备发芽燕麦中的天然Avns[30]。
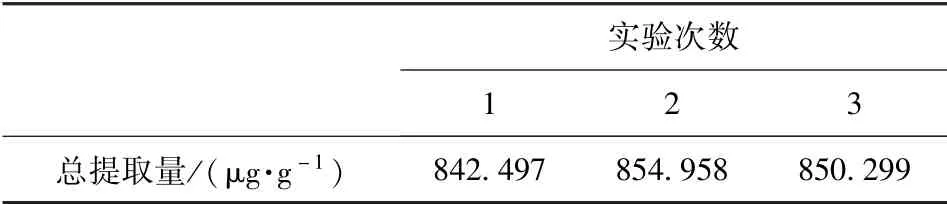
表5 3 次验证实验中Avns 总提取量Tab.5 Avns extraction amount in three validatory experiments
2.2 Avns 促肺癌细胞凋亡机制分析
2.2.1 Avns 处理对NSCLC 细胞活力的影响
为进一步探讨Avns 对肺癌细胞的影响,本实验选取典型的NSCLC 细胞H1299 和A549,分析不同浓度蒽酰胺标准品Avn A、Avn B 和Avn C 对细胞活力的影响,实验结果见图6。 由图6 可知,随着处理浓度的增加,H1299 和A549 细胞的存活率逐渐降低,Avn A 和Avn C 在处理前后的不同浓度下均有显著性差异(P<0.05),而Avn B 在质量浓度达到40 μg/mL 时才呈现出显著性差异。 与Avn A 和Avn B 处理组相比,Avn C 对H1299 和A549 细胞活力的影响更加明显。 实验结果说明Avn A、Avn B和Avn C 对NSCLC 细胞H1299 和A549 的活力均有一定的抑制效果,且Avn C 的活性明显高于Avn A 和Avn B,这也与文献报道的Avn C 具有更好的生物活性相一致[31]。 因此,后续实验采用Avn C 标准品作为阳性对照,分析发芽燕麦中天然Avns 的抗癌活性。
2.2.2 Avns 处理对NSCLC 细胞凋亡相关蛋白表达的影响
XIAP 是肿瘤细胞中重要的抗凋亡蛋白,通常在肿瘤组织中高表达且可通过多种途径抑制肿瘤细胞凋亡,是肿瘤发生的主要诱因之一[32]。 已有报道显示,NF-κB 通路在调控XIAP 蛋白表达方面发挥重要作用,进而影响肿瘤细胞凋亡等[33]。 为进一步探讨发芽燕麦中天然Avns 对NSCLC 细胞凋亡相关蛋白的影响,采用不同浓度的蒽酰胺标准品Avn C 和天然Avns 分别处理NSCLC 细胞H1299 和A549,所得实验结果见图7。 如图7(a)所示,Western blot 分析结果表明,给予标准品Avn C 和天然Avns 处理后,H1299 细胞中NF-κB 通路p65 蛋白磷酸化及XIAP 蛋白表达均发生改变。 与对照组相比,标准品Avn C 和天然Avns 处理均可抑制NF-κB/p65 蛋白磷酸化并下调抗凋亡蛋白XIAP 表达,且呈现出剂量依赖性。 Image J 软件的量化分析结果也表明[图7(b)],Avn C 和天然Avns 处理下调了p-p65和XIAP 蛋白表达,高质量浓度(40 μg/mL)处理组中p-p65 和XIAP 蛋白水平显著降低(P<0.05),且Avn C 作用效果优于同浓度天然Avns。 这可能是因为天然Avns 中成分复杂,生物活性较强的Avn C 含量相 对 不 足。 图7(c)和图7(d) 结 果 表 明, 与H1299 细胞类似,高浓度处理显著下调A549 细胞中p65 蛋白磷酸化和XIAP 蛋白表达(P<0.05),且Avn C 效果优于天然Avns。 本部分结果说明,高质量浓度标准品Avn C 和天然Avns 均可抑制p65 蛋白磷酸化及凋亡相关XIAP 蛋白表达,提示天然Avns 可潜在下调NF-κB/XIAP 通路活性而促进NSCLC 细胞凋亡。
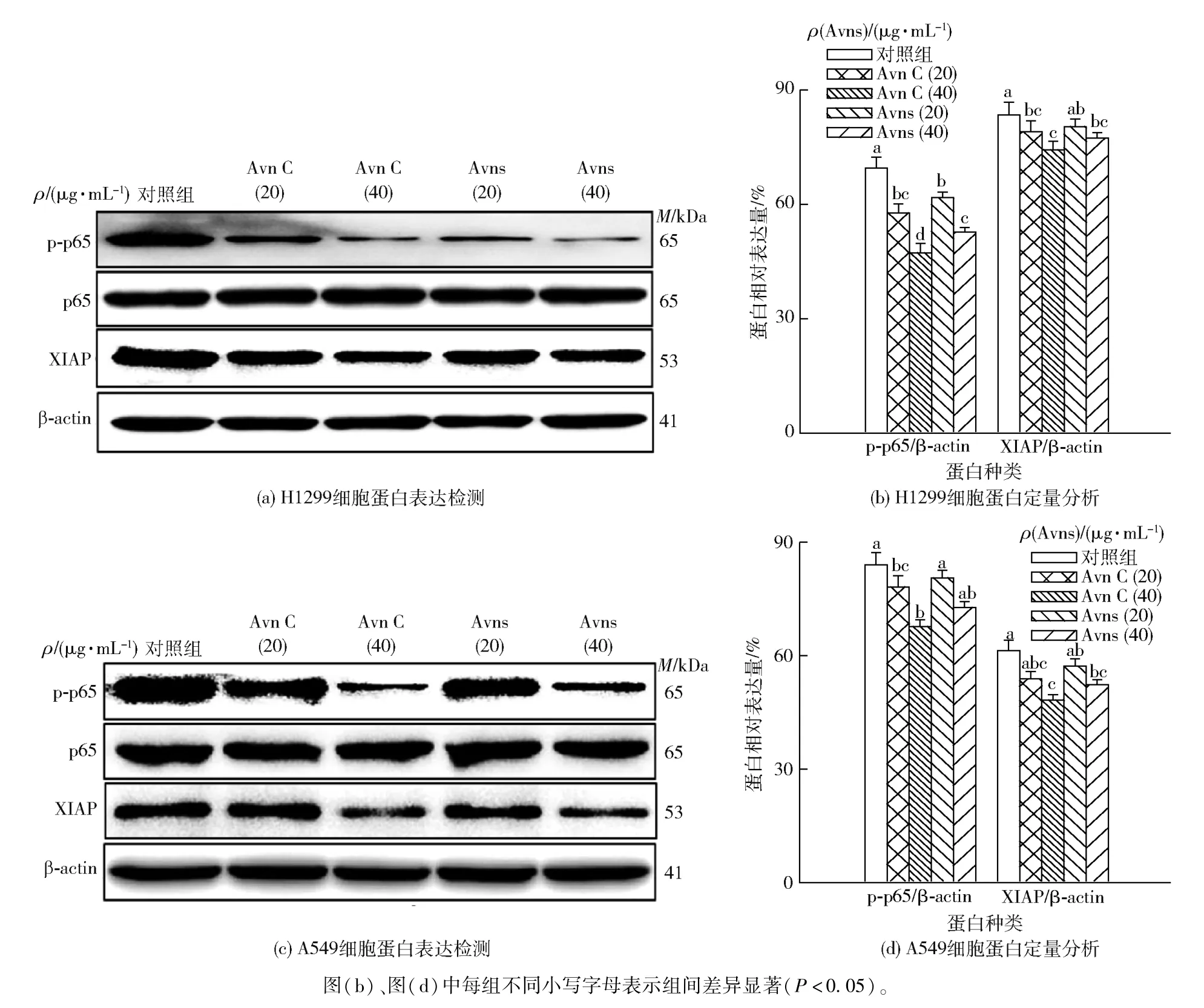
图7 不同Avns 干预处理对NSCLC 细胞凋亡相关蛋白的影响Fig.7 Effect of different Avns treatment on expression of apoptosis related proteins in NSCLC
2.2.3 Avns 处理对NSCLC 细胞凋亡的影响
为进一步揭示Avns 对NSCLC 细胞凋亡的影响,采用流式细胞术分析不同处理组间细胞凋亡情况,实验结果见图8 和图9。 由图8 可知,标准品Avn C 和天然Avns 处理均可促进H1299 细胞凋亡,低质量浓度(20 μg/mL)和高质量浓度(40 μg/mL)理后细胞凋亡率分别约为20%和31%,显著高于对照组;而相应浓度天然Avns 处理后,细胞凋亡率分别约为16%和19%,虽略低于Avn C 处理组,但同样明显高于对照组(P<0.05)。 与H1299 细胞结果相类似,如图9 所示,干预处理后A549 细胞凋亡率均显著高于对照组(P<0.05)。 给予低质量浓度(20 μg/mL)标准品Avn C 和天然Avns 干预时,A549细胞的凋亡率相近;但高质量浓度(40 μg/mL)标准品Avn C 处理后,A549 细胞凋亡率约为42%,而高浓度天然Avns 处理后A549 凋亡率约为28%,虽低于同浓度标准品Avn C 处理组,但也明显高于对照组。 说明天然Avns 处理可剂量依赖性地促进H1299 和A549 细胞凋亡,可作为NSCLC 防控的新型活性天然物质。
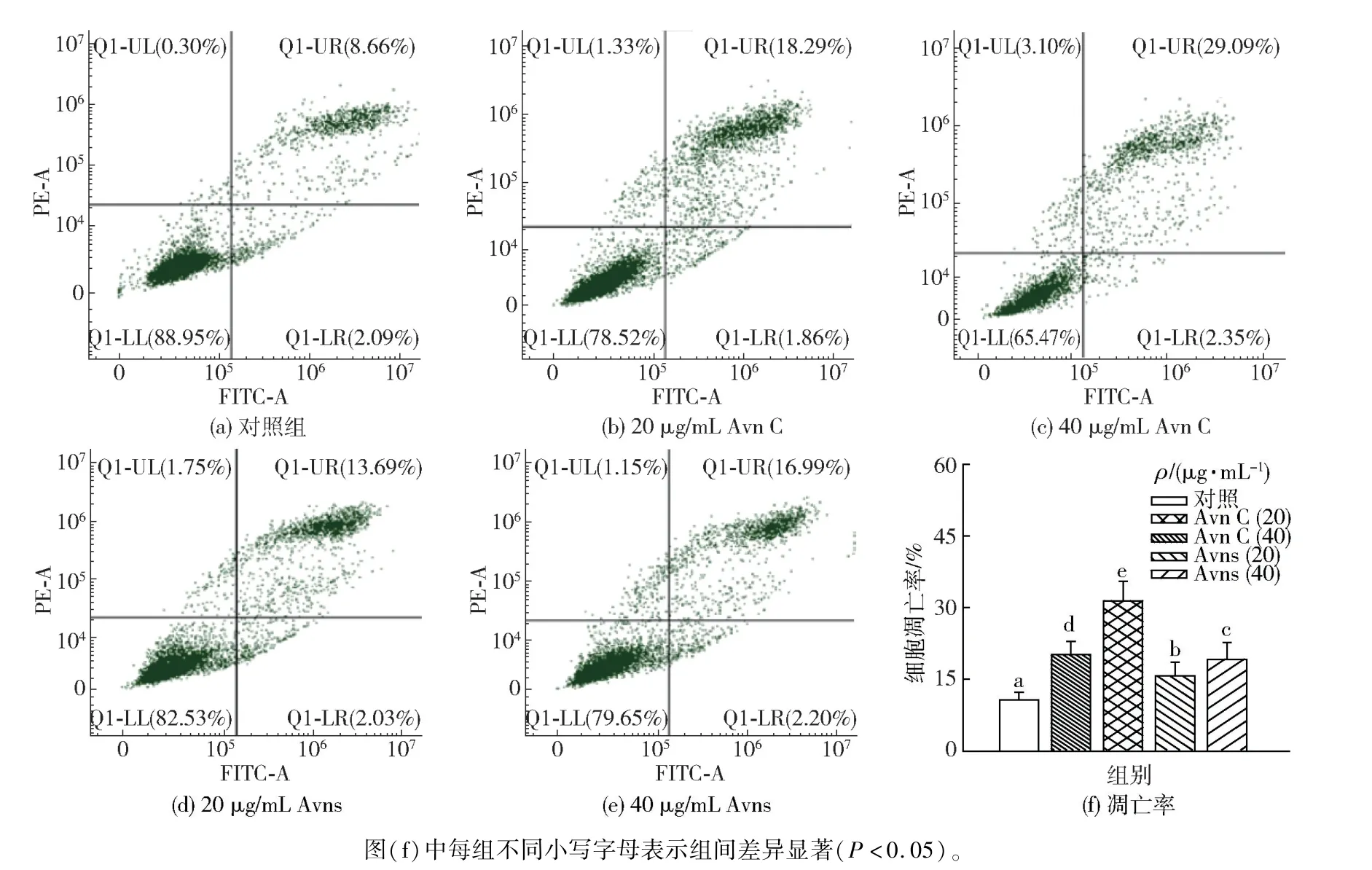
图8 不同Avns 处理对H1299 细胞凋亡的影响Fig.8 Effect of different Avns treatments on cell apoptosis of H1299
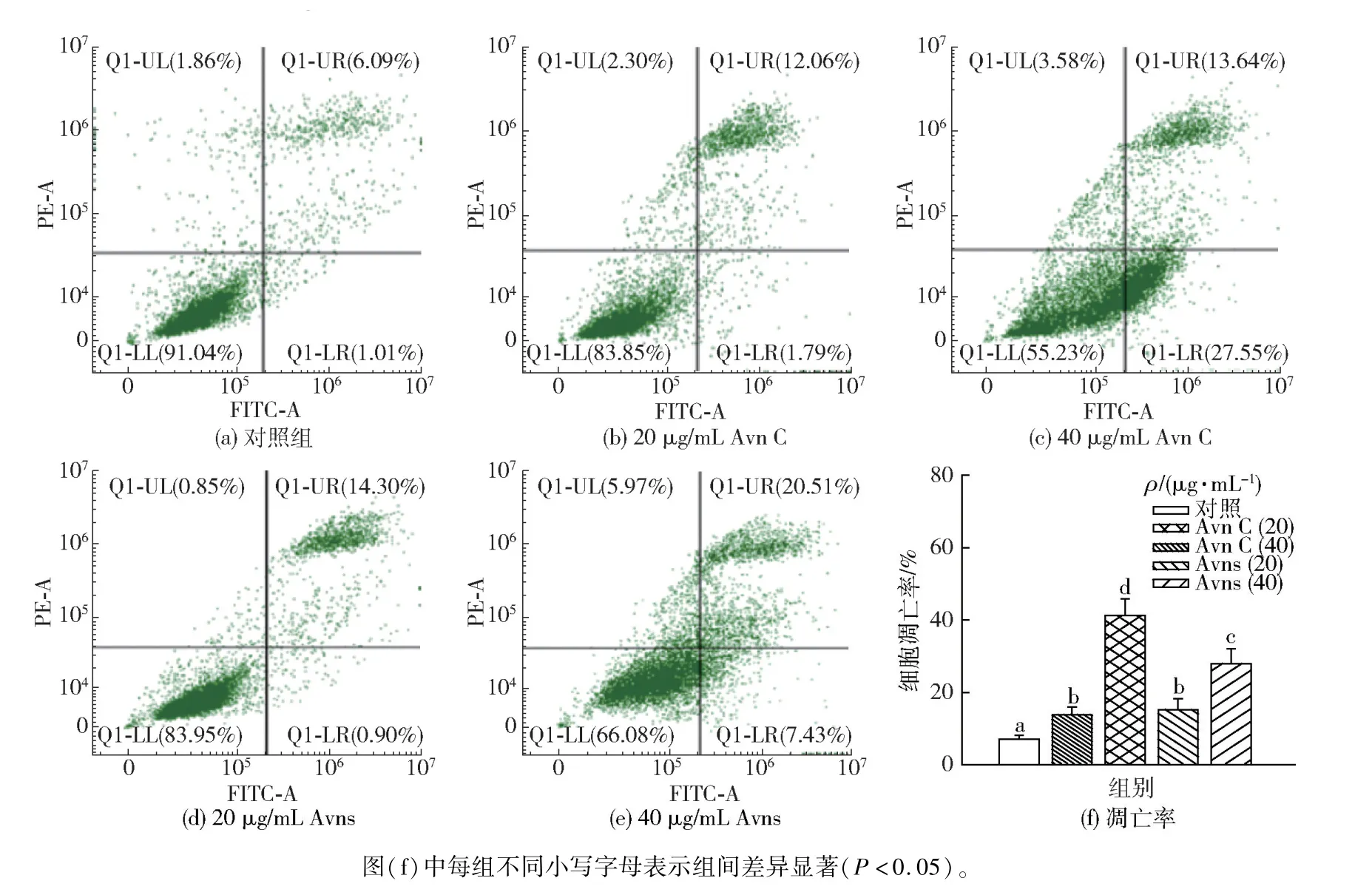
图9 不同Avns 处理对A549 细胞凋亡的影响Fig.9 Effect of different Avns treatments on cell apoptosis of A549
3 讨 论
燕麦中Avns 的天然含量较低,且受种植环境及基因型等影响较大,难以达到发挥健康功效的有效剂量,也成为制约天然Avns 健康作用机制研究的一大障碍。 目前针对谷物活性成分生物转化的研究较多,而谷物发芽是实现活性成分生物转化的有效途径。 发芽技术作为一种自然方式可显著改善谷物食品品质,提升全谷物的营养价值及健康效益,且易于被消费者所接受。 近年来,有关发芽处理的糙米、小麦、大麦及燕麦等研究日渐兴起,并广泛应用于谷物健康食品的生产[34-36],本课题组先前的报道也分析了发芽促进燕麦中Avns 生成的潜在机制[7]。 在燕麦生长过程中可通过莽草酸途径合成L-苯丙氨酸,随后在苯丙氨酸解氨酶(pheylalanine ammonialyas,PAL)的作用下生成反式肉桂酸,并进一步在肉桂酸羧化酶和咖啡酸-O-甲基转移酶的催化下先后生成p-香豆酸、咖啡酸和阿魏酸。 最后,以p-香豆酸、咖啡酸、阿魏酸和邻氨基苯甲酸为底物,在HHT 催化下分别合成Avn A、Avn C 和Avn B[7]。 在燕麦发芽过程中,Avns 合成相关酶PAL 和HHT 活性与未发芽组相比均明显增加,这可能是发芽可促进Avns 生物转化的重要原因。 本研究也表明,发芽有效促进了Avns 的生物转化,与天然燕麦相比,发芽燕麦中3 种主要蒽酰胺成分Avn A、Avn B 和Avn C 含量均显著增加,发芽3 d 和6 d 其含量分别提升约50 倍和70 倍。 因此,发芽是实现Avns 生物转化的有效途径,可为天然Avns 富集提供实验依据。 此外,Avns 提取条件优化分析也表明,采用超声辅助传统有机溶剂法可有效实现发芽燕麦Avns 的提取,在料液比(g/mL)1∶22.2,超声功率87.6 W,乙醇体积分数84.2%的条件下,3 种主要蒽酰胺Avn A、Avn B和Avn C 的总提取量可达849.251 μg/g,可为后续天然Avns 癌症防控作用机制的研究奠定良好基础。
近年来,已有较多研究证实,Avns 具有较好的抗癌活性,且报道多集中于其在结肠癌防控中的作用[18,36-37]。 也有研究显示,Avns 对肝癌、乳腺癌甚至是埃利希固体肿瘤等有预防作用[19-20,38],而肺癌作为全球发病率和死亡率居首的疾病,Avns,尤其是天然来源Avns 对肺癌尤其是NSCLC 的防控作用却鲜有报道。 本研究探讨了发芽后提取的天然Avns对NSCLC 细胞的凋亡调控作用,发现Avns 处理可剂量依赖性地促进H1299 和A549 细胞凋亡。 说明天然来源的Avns 可能通过调控NF-κB/XIAP 通路促进NSCLC 细胞凋亡而发挥肺癌防控功效。
在Avns 防控肿瘤机制方面,报道显示,Avns 有助于下调脂多糖诱导的小鼠腹腔巨噬细胞中环氧合酶-2(cyclooxygenase 2, COX-2)的表达,抑制前列腺素E2(prostaglandin E2, PGE2)的生成,从而预防胃肠道上皮发生癌变并降低癌变细胞的增殖活性[37]。Avns 也可激活结肠癌细胞和肝癌细胞内源性和外源性凋亡途径,下调血管内皮细胞生长因子和低氧诱导因子等蛋白表达,进而诱发细胞凋亡[19,38]。 在癌症尤其是肺癌发生过程中,NF-κB/XIAP 通路发挥重要的抗凋亡活性,肺癌组织中NF-κB 蛋白活性及XIAP 蛋白表达均明显增加,抑制NF -κB/XIAP 通路活性有助于肺癌治疗[39]。 本研究结果表明,Avns 处理可有效抑制H1299 和A549 细胞中NF-κB/p65 蛋白磷酸化,并下调抗凋亡蛋白XIAP表达,进而降低NSCLC 细胞的抗凋亡活性,提示Avns 可潜在下调NF -κB/XIAP 通路活性,促进NSCLC 细胞凋亡并发挥肺癌防控功效,进一步完善Avns 参与肿瘤防控的潜在作用机制。
4 结论
Avns 作为燕麦特有的生物活性成分,在调控人体健康方面可发挥重要作用,且采用发芽方式可显著促进Avns 的生物转化,有效提升燕麦中天然Avns 含量。 经优化提取后的天然Avns 可剂量依赖性地降低NF-κB/p65 蛋白磷酸化及XIAP 蛋白表达,并促进H1299 和A549 细胞凋亡,说明NF-κB/XIAP 通路可能是Avns 的调控新靶点,进而有效下调NSCLC 细胞的抗凋亡活性。 本研究旨在为Avns应用于肺癌防控提供理论依据,为全谷物燕麦尤其是发芽燕麦相关健康产品的开发提供新思路。
