间充质干细胞治疗早产儿支气管肺发育不良的研究进展
2022-06-30黄高展刘春华
黄高展,刘春华
(汕头大学医学院第一附属医院新生儿科,广东 汕头 515041)
随着围产医学及新生儿医学技术的进步,早产儿尤其是超早产儿的存活率不断提高。支气管肺发育不良(bronchopulmonary dysplasia,BPD)作为一种早产儿常见的严重并发症,其发病率也在逐年上升。我国几项多中心研究表明超低出生体重儿或超未成熟儿BPD发生率差异较大,2006—2008年仅19.3%,2011年为48.1%,2019年则高达72.2%[1]。合并BPD的早产儿病死率高,且伴有不同程度的后遗症,给患者家庭及社会带来了巨大的经济负担。临床上通过预防早产,使用温和的机械通气模式,降低吸入氧浓度,肺表面活性物质的治疗和营养支持等一系列措施在BPD的防治上取得一定成效,但目前仍未能有效治愈BPD[2]。间充质干细胞 (mesenchymal stem cells,MSCs)疗法可以调节免疫,减轻肺部纤维化和炎症,增强肺部细胞的再生和修复,降低肺动脉高压,给BPD的治愈带来了希望。本文从BPD的发病机制出发,通过查阅MSCs治疗BPD相关机制研究的文献,结合当前的临床试验对MSCs治疗BPD进行综述与展望。
1 BPD的发病机制
早产儿肺部发育常处于小管晚期或囊状早期,早产使正常肺泡和远端血管发育中断,在产前因素(如胎儿宫内生长受限、宫内感染等)及产后因素(如细菌感染、机械正压通气、氧疗等)的影响下[3],对未发育完全的肺造成进一步损伤,激活了免疫反应[4],引起肺部炎症因子和抗炎因子的紊乱,造成肺部干细胞损伤或耗竭[5],导致肺泡结构简单化和异常肺血管生成,出现了肺部纤维化[6]和动脉高压[7],最终形成BPD,这是一个动态、复杂的过程。
2 MSCs的来源及其治疗机制
MSCs属于多能成体干细胞,具有自我更新、多向分化及低免疫原性的特点,在妊娠组织(胚胎、脐带、胎盘、脐带血)、骨髓、皮肤等组织均有存在[8]。MSCs发挥治疗的机制主要包括以下几方面。(1)MSCs具有定向增殖分化能力,可通过归巢作用促进组织的愈合。MSCs迁移进入损伤的组织、修复损伤组织的机制尚未完全明确,但很可能与MSCs表达的黏附分子与炎症趋化因子通过局部或全身循环迁移到达靶器官并相互作用有关[9]。(2)研究发现MSCs分泌的可溶性蛋白(细胞因子、趋化因子、生长因子、蛋白酶)、外泌体、细胞外囊泡在BPD肺组织的修复和再生中也起了关键作用[10]。Willis等[11]研究发现通过静脉给予MSC外泌体可以改善肺动脉的发育及肺纤维化;Braun等[12]的研究也显示MSC细胞外囊泡可通过抗炎和促血管生成机制促进肺泡发育。MSCs分泌的产物具有免疫原性低、半衰期长、在体内稳定、递送效率高等特性,并且更易于隔离、存储和管理[13],在治疗BPD上有着巨大潜力。(3)MSCs可通过细胞间的相互作用及细胞因子抑制T细胞、B细胞等免疫细胞的增殖发挥免疫调节作用[14]。人类白细胞抗原(human leukocyte antigen,HLA)又称移植抗原,低水平的HLA可规避免疫识别。MSCs表达HLA-Ⅰ类分子(与排斥反应相关)和Ⅱ类分子(与免疫反应相关)的水平较低,可使MSCs更好地逃脱免疫监视[15],降低异体移植的排斥反应。
3 MSCs治疗BPD的临床试验
BPD动物实验研究证实了MSCs治疗能有效改善肺泡结构和血管生成,减轻肺纤维化和肺脉高压等[16]。动物实验的成功对MSCs的临床应用有着较大的启发,目前在美国国家卫生研究院数据库(https://clinicaltrials.gov)上注册的应用MSCs治疗BPD临床试验共有14项(表1)。
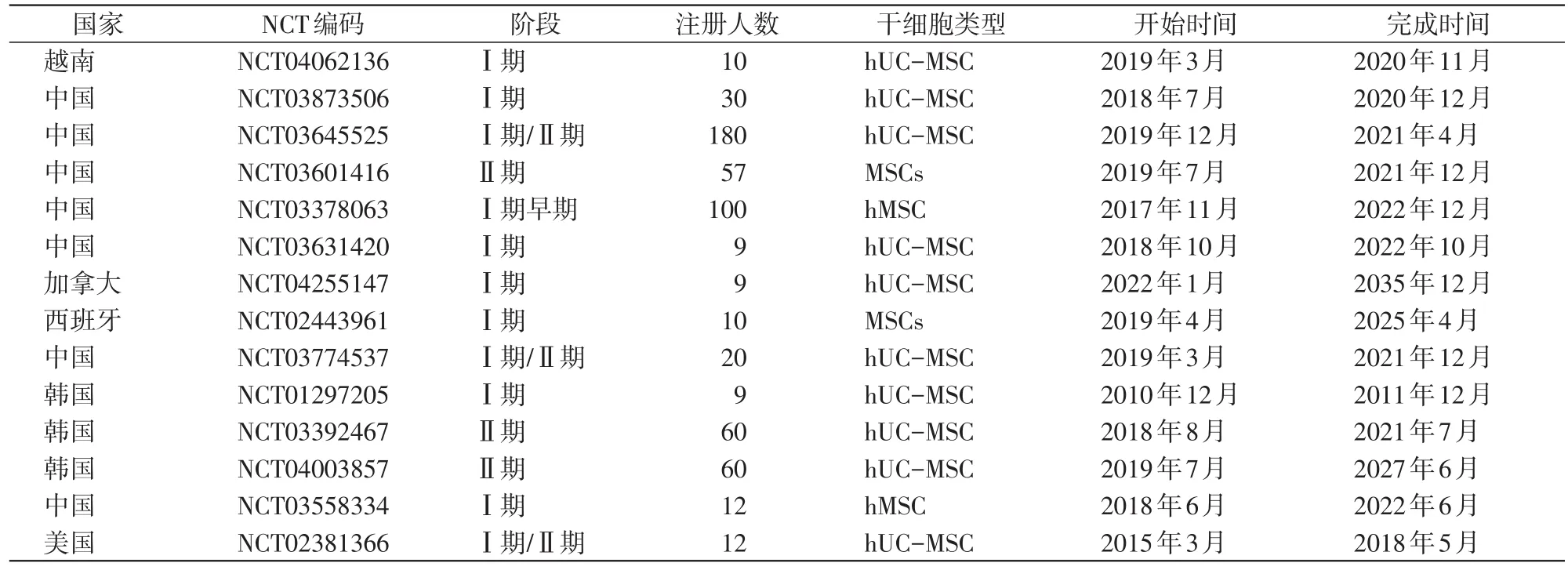
表1 14项MSCs治疗BPD临床试验信息
Chang等[17]在Ⅰ期临床研究中使用不同剂量MSCs治疗BPD患儿以验证其安全性及可行性,在9例高危BPD患儿气管内注入MSCs,其中3例为低剂量MSCs(细胞数为1×107个/kg),6例为高剂量MSCs(细胞数为2×107个/kg),治疗84 d后结果显示,患儿治疗的耐受性良好,且没有严重的副作用;Ahn等[18]在对该9例患儿长达2年的随访中,未发现接受MSCs治疗的患儿有致瘤、致畸等不良后果。王燕等[19]使用hUC-MSC治疗BPD的一项临床研究中,将高危早产儿(共18例)分为试验组(8例)和对照组(10例),试验组患儿出生后7 d、14 d分别给予气管内滴入hUC-MSC(细胞数为1×107个/kg),对照组给予同体积生理盐水,结果显示试验组患儿BPD发生率、平均住院时间、平均用氧时间及1岁内肺炎发生率均比对照组低(P值均<0.05),且肺泡灌洗液中抑制性炎性因子水平也低于对照组(P<0.05)。Powell等[20]也进行了一项类似的临床试验,在12例BPD高危早产儿气管内使用MSCs治疗,其中6例为低剂量MSCs(细胞数为1×107个/kg),6例为高剂量MSCs(细胞数为2×107个/kg),结果也显示患儿的耐受性良好,未发现不良反应。随后Ahn等[21]在Ⅰ期临床研究的基础上,对66例23~28周的高危早产儿进行双盲、随机、安慰剂对照的Ⅱ期临床试验,这些早产儿在出生后第5天至第14天期间伴有呼吸恶化,接受机械呼吸机支持。将66例高危早产儿按胎龄分为23~24周组(n=31)和25~28周组(n=35),按1∶1随机分配接受MSCs治疗(细胞数为1×107个/kg,n=33)或安慰剂治疗(等体积的生理盐水,n=33)。结果显示虽然接受MSCs治疗的患儿气管吸出液中炎性因子显著降低,但MSCs组(17/33,52%)与对照组(18/33,55%)出现死亡或中重度BPD的结局并未得到显著改善;在23~24周患儿的亚组分析中(MSCs组16例,对照组15例),MSCs组出现严重BPD的结局(3/16,19%)较对照组(8/15,53%)则有了显著改善,而在25~28周的亚组分析中出现严重BPD结局并无明显改善。因此,进行一项更大样本量的研究(NCT03392467),旨在了解关于23~24周早产儿使用MSCs治疗的效果。
4 目前的不足及未来展望
MSCs治疗BPD在临床试验中已初步证实其效果是显著的,是最具革命性的下一代治疗手段,在转化应用于临床前需要明确其安全性、适宜的患儿及用药参数。MSCs来源广泛,虽然从自体妊娠组织中提取的MSCs具有低成本,低免疫原性及高生物活性的特点且不涉及伦理问题[22],但仍有部分患儿无相应的条件,需行异体干细胞移植,因此伦理学讨论是必要的[23]。而且制定一个标准化方法收集安全有效的MSCs非常重要,目前已有临床试验使用符合药品生产管理规范的人诱导多能干细胞[24],未来这可能是MSCs来源的最佳方式。超早产(胎龄<27周)及超低出生体重(出生体重<1 000 g)是BPD的独立高危因素[1],这个阶段的患儿肺部处于原始肺泡发育的关键时期,对外界因素极度敏感,出生后需要机械通气等高级生命支持,且目前治疗手段有限,因此更适合使用MSCs进行治疗。MSCs在临床上的用药参数需要个体化,气管内给药较静脉给药副作用少,且对于有创通气的患儿操作方便,这可能是最佳的给药方式;临床试验结果显示不同剂量的MSCs治疗效果良好,最佳的剂量需要结合肺部损伤的程度来决定,伴随着MSCs的消耗,部分患儿可能需要多次使用MSCs治疗才能达到最佳治疗效果;多项动物实验中提示在高氧造成的肺部损伤炎症到达高峰或稳定阶段之前使用MSCs移植效果更好[25],临床试验的结果也支持这一结论,因此临床中治疗BPD越早使用MSCs可能效果越好。随着多中心、大规模、前瞻性临床随机对照试验的进行,未来MSCs疗法将给BPD患儿带来更多福音。
