内镜治疗胃错构瘤性内翻性息肉1例
2022-06-30刘朝晖吴瑞暖郭海建孙大勇
刘朝晖,吴瑞暖,郭海建,孙大勇
(1.深圳市第二人民医院消化内科,广东 深圳 518035;2.深圳市第二人民医院病理科,广东 深圳 518035)
胃错构瘤性内翻性息肉属于罕见胃息肉,目前国际报道例数少,国内目前报道3例[1]。由于其内镜下表现不典型,初诊困难,常常会误诊为囊肿、血管瘤、异位胰腺等其他黏膜下肿物病变,需要术后病理协助诊断。深圳市第二人民医院近期确诊1例胃错构瘤性内翻性息肉并行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),现将其内镜特点、超声内镜特点做一总结,以期为该病的内镜诊断提供临床证据。
1 病例资料
患者女性,41岁,2021年12月19日因“体检发现胃窦肿物6 d”收治深圳市第二人民医院消化内科。门诊胃镜胃窦可见一隆起肿物(图1A),活检钳触之质地软,Cushion征(+)(图1B)。
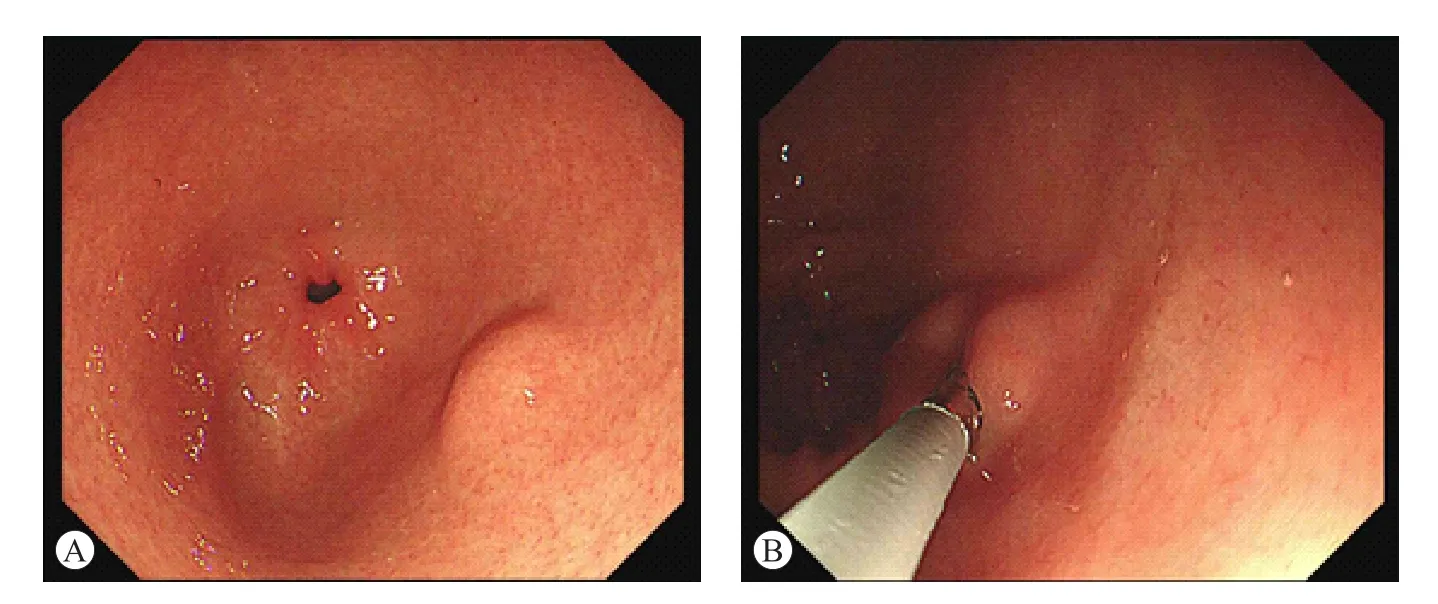
图1 白光内镜下形态及特征
入院后完善超声胃镜检查,小探头超声示黏膜下层可见一混合回声病灶(图2A),大小约9.9 mm×4.7 mm(图2B)。扇扫超声示病灶内未见血流信号(图2C)。遂行内镜下切除(图2D)。术后病理诊断:(胃窦,ESD)符合错构瘤性内翻性息肉,镜下最大径约7 mm,基底切缘及两侧切缘均阴性。术后予禁食、抑酸、营养等治疗,术后无出血、穿孔等并发症。术后第5天顺利出院。

图2 病变术前超声特点及ESD术后标本
2 讨论
胃错构瘤性内翻性息肉是指增生的胃黏膜向黏膜下层生长,累及黏膜下层及黏膜肌层,是胃息肉的一种,临床罕见,约占胃息肉的1%[2]。在发病年龄及性别方面无特异性,无家族积聚现象,多无临床症状,多数患者在胃镜检查中发现并最终确诊[3]。具体发病机制目前不明,可能与增生的黏膜上皮向黏膜下层生长或者黏膜下存在的上皮成分增生等有关[4]。
胃错构瘤性内翻性息肉好发于胃体上部及胃底[5],发生于胃窦部位者少见。该例患者发生于胃窦,属于少见部位发生病灶。根据肉眼形态可分为无蒂型及有蒂型[1]。无蒂型形态呈黏膜下隆起肿物样外观,表面被覆正常上皮,边界不清,需要与黏膜下肿物(如脂肪瘤、平滑肌瘤、间质瘤、血管瘤、异位胰腺等)相鉴别;有蒂型形态呈息肉样隆起,呈山田Ⅲ型或Ⅳ型,或者类似于巴黎分型Ⅰsp型或Ⅰp型,需要和带蒂胃息肉予以区别。由于胃错构瘤性内翻性息肉质地柔软,因此在进行按压时病变会出现塌陷感,即Cushion征(+)(图1B),这有别于平滑肌瘤、间质瘤等质地较硬病变。即便如此,由于内镜下表现不典型,因此白光内镜、色素内镜下诊断困难。
超声内镜下胃错构瘤性内翻性息肉表现为混合回声,低回声区域与高回声区域混杂存在(图2A),病变常常位于黏膜肌层或者黏膜下层[6]。由于内翻上皮分泌的黏液无法排出,就会局部包裹形成类似囊腔样结构,因此超声内镜下常常会出现囊性低回声区域(图2A),这需要与深在性囊性胃炎、异位胰腺、血管瘤进行鉴别。通过彩色多普勒超声可以很好地鉴别血管瘤(图2C)。
胃错构瘤性内翻性息肉属于良性病变,但是>2 cm的病变存在恶性风险(>20%的恶性风险)[6]。同时由于该病术前诊断困难,因此内镜下切除并进行病理确诊是目前采用的治疗方案。由于该病主要位于黏膜肌层或者黏膜下层,极少累及固有肌层,因此采取内镜下黏膜切除术(endoscopic mucosal resection,EMR)或ESD是治疗的主要手术方式,有报道指出对于<2 cm的病灶,可以采取EMR方式进行切除[1],但是关于EMR切除这种病灶的完整性有待进一步观察。ESD的优点在于能够获得完整病灶进行病理评估,Hirasaki等[7]报道1例胃错构瘤性内翻性息肉合并有印戒细胞癌,因此获得手术完整标本对于评价治疗及指导后续治疗非常重要。也有报道认为对于较大病灶者可采用腹腔镜下微创切除[8]。
综上所述,胃错构瘤性内翻性息肉是一种良性、罕见的胃息肉,>2 cm的病灶有恶性风险,内镜表现为Cushion征(+),白光内镜及色素内镜诊断困难,超声内镜对于诊断有一定价值,内镜下切除是该病首选治疗手段,对于内镜无法切除的病变可考虑行外科微创切除,最终诊断依赖于术后病理。完整切除病变是治疗的关键。
