嗜盐四联球菌SNTH-1产多肽发酵条件优化及其呈味、抗氧化特性
2022-06-29马媛媛安飞宇曹恺欣武俊瑞史海粟乌日娜
马媛媛,安飞宇,曹恺欣,赵 越,武俊瑞,史海粟,乌日娜*
(1.沈阳农业大学 食品学院,辽宁 沈阳 110866;2.辽宁省食品发酵技术工程研究中心,辽宁 沈阳 110866)
多肽是各氨基酸残基以不同组合和排列方式构成的从二肽到复杂的线性、环形结构的不同肽类的总称,其中的特异性功能肽,如呈味功能肽及生理活性肽通常由2~50个氨基酸组成[1]。目前,“BIOPEP”数据库已报道了521个呈味功能肽及4 402个生理活性肽,其中包括呈味、抗菌、抗氧化、抗癌、抗衰老、抗炎和降血压等多种生物活性[2],其在食品、日用化工、医药制剂等领域的应用日益广泛,因此受到研究人员的广泛关注,其合成与制备方法更是研究的热点。
目前,多肽多以酶解法制备[3],但存在成本高、酶解条件严格、预处理时氨基酸易被破坏[4]问题等,而发酵是一种更为经济有效的方法,可通过微生物的作用产生生物活性肽和食品级蛋白质水解物,是在工业水平上生产特异性功能肽的理想方法,与酶法制备相比,其产物生物活性强、安全性高且更环保[3,5]。现如今,已开展多项利用微生物法制备特异性功能肽的相关研究,如LI C等[6-8]利用枯草芽孢杆菌(Bacillus subtilis)、植物乳杆菌(Lactobacillus plantarum)发酵制备抗氧化肽;CHEN L等[9]利用瑞士乳杆菌(Lactobacillus helveticus)发酵制备降血压肽;MUHIALDIN B J等[10-11]利用大肠杆菌(Escherichia coli)、干酪乳杆菌(Lactobacillus casei)制备抑菌肽。此外,本课题组前期研究表明,嗜盐四联球菌(Tetragenococcus halophilus)是豆制品发酵过程中的关键优势菌种,其在发酵过程中可分泌大量酶类,将原料蛋白中的大分子蛋白分解成小分子肽及游离氨基酸,其与鲜味肽等特异性功能肽的合成代谢密切相关[12-13]。
因此,本研究以实验室前期从自然发酵豆酱中筛选出的产多肽能力较强的嗜盐四联球菌SNTH-1为研究对象,以大豆蛋白为发酵基质,通过单因素试验、Plackett-Burman(PB)试验、最陡爬坡试验、Box-Behnken响应面试验对其产多肽培养条件进行优化,并对所制备多肽的呈味特性及抗氧化特性进行初步研究,以期为其进一步的应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
嗜盐四联球菌(Tetragenococcus halophilus)SNTH-1(CGMCC.No 23165):分离自辽宁省自然发酵豆酱。
1.1.2 试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)溶液:北京索莱宝科技有限公司;三氯乙酸、氯化钠、氢氧化钠、无水乙醇(均为分析纯):国药集团化学试剂有限公司;四肽(Gly-Gly-Tyr-Arg)标准品(色谱纯):美国Sigma公司。其他试剂均为国产分析纯。
1.1.3 培养基
MRS培养基:蛋白胨10 g/L、乙酸钠(无水)3 g/L、磷酸氢二钾2 g/L、七水合硫酸镁0.575 g/L、一水合硫酸锰0.25 g/L、葡萄糖20 g/L、柠檬酸三钠2.42 g/L、酵母浸粉4 g/L、牛肉浸膏8 g/L、吐温80 1 g/L。121 ℃高压蒸汽灭菌20 min。
参考ZHAO J D等[14]的方法并稍作修改,大豆蛋白液体发酵培养基:大豆蛋白胨10 g/L、乙酸钠(无水)3 g/L、磷酸氢二钾2 g/L、七水合硫酸镁0.575 g/L、一水合硫酸锰0.25 g/L、葡萄糖20 g/L、柠檬酸三钠2.42 g/L、吐温80 1 g/L、氯化钠100 g/L,调整pH值至7.0。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
Eon型酶标仪:美国Biotek公司;UV-2100型紫外可见分光光度计:龙尼柯(上海)仪器有限公司;Insent SA402B型电子舌:日本Insent公司;LX-B50L型立式自动电热压力蒸汽灭菌器:合肥华泰医疗设备有限公司;PHS-3E型pH计:上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 嗜盐四联球菌SNTH-1发酵产多肽培养条件优化单因素试验
微生物发酵法制备多肽的影响因素主要包括微生物种类、培养基种类与组成、接种量、培养时间、pH值、温度等[15]。将甘油管保藏的嗜盐四联球菌SNTH-1按2%(V/V)的接种量接种于MRS培养基中,33 ℃恒温培养48 h,再将其按2%(V/V)的接种量接种于盐度为10%、pH为7.0的大豆蛋白液体发酵培养基,33 ℃条件下培养,考察发酵时间(24 h、32 h、40 h、48 h、56 h)对嗜盐四联球菌SNTH-1产多肽能力的影响。在此基础上,依次考察发酵温度(25 ℃、29 ℃、33 ℃、37 ℃、41 ℃)、接种量(1%、2%、3%、4%、5%)、盐度(3%、5%、7%、9%、11%)、初始pH值(6.0、7.0、8.0、9.0、10.0)对嗜盐四联球菌SNTH-1产多肽能力的影响,确定最佳培养条件。
1.3.2 嗜盐四联球菌SNTH-1发酵产多肽培养条件优化响应面试验
(1)PB试验
在单因素试验结果基础上,以多肽含量为响应值,选取发酵时间(A)、发酵温度(B)、接种量(C)、盐度(D)、初始pH值(E)5个因素的高低水平,利用Design-Expert 8.0.6软件进行PB试验,PB试验因素与水平见表1。

表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments design
(2)最陡爬坡试验
依据PB试验结果,筛选出影响最大的3个因素进行最陡爬坡试验,确定中心点。
(3)Box-Behnken试验
根据Box-Behnken试验设计原理,以多肽含量(Y)为响应值,初始pH值(X1)、盐度(X2)及发酵温度(X3)为考察因素,采用Design-Expert 8.0.6软件,进行响应面优化试验,确定产多肽的最佳培养条件,Box-Behnken试验设计因素与水平见表2。

表2 Box-Behnken试验设计因素与水平Table 2 Factors and levels of Box-Behnken experiments design
1.3.3 多肽含量的测定
参考RUAN S等[16]的方法,并稍作修改。将质量浓度分别为0、2 mg/mL、4 mg/mL、8 mg/mL、10 mg/mL、12 mg/mL、16 mg/mL和20 mg/mL的四肽(Gly-Gly-Tyr-Arg)标准溶液1 mL添加到4 mL双缩脲试剂中,混匀,在室温((25±1)℃)下放置30 min,然后在波长540 nm处测定吸光度值,以四肽的质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制标准曲线,得到标准曲线的回归方程为y=0.014 1x+0.06(R2=0.998)。同理,测定1 mL发酵上清液中的多肽含量。
1.3.4 粗多肽的提取
参考ZHANG Y等[17]的方法并稍作修改。发酵结束后将样品取出,于85 ℃水浴锅中灭酶15 min,再8 000 r/min离心15 min,取发酵液上清过0.45 μm微孔膜除去不溶物和菌体后,收集上清液并冻干作为粗多肽。
1.3.5 嗜盐四联球菌SNTH-1粗多肽滋味特性的测定
分别以响应面试验所确定的最优培养条件、优化前的培养条件、空白培养基作为试验组、对照组、空白组,以电子舌测试由氯化钾和酒石酸配制的人工唾液无味点(Tasteless)组为基准[18],当样品的味觉值低于无味点时说明样品无该味道,反之则有。采用电子舌技术对发酵液的滋味特性(酸味、苦味、涩味、苦味回味、涩味回味、鲜味、厚味、咸味、甜味)进行评估和比较[19]。
1.3.6 嗜盐四联球菌SNTH-1粗多肽DPPH自由基清除率的测定
分别以响应面试验所确定的最优培养条件、优化前的培养条件作为试验组、对照组,测定其抗氧化能力。参考XIE Z J等[20-21]的方法,并稍作修改。配制40 mg/mL的样品溶液,取2 mL粗多肽液于测试管中,加入2 mL 1×10-4mol/L DPPH溶液,混合均匀后室温下避光反应30 min,于波长517 nm处测定吸光度值A1,以体积分数95%乙醇调零,相同条件下测定2 mL体积分数95%乙醇与等体积样品均匀混合后的吸光度值A2,以及DPPH溶液与体积分数95%乙醇等体积混合后的吸光度值A3,计算DPPH自由基清除率,其计算公式如下:

半抑制浓度(50% inhibitory concentration,IC50)表示DPPH自由基清除率为50%时抗氧化肽的质量浓度。通过调整SNTH-1粗多肽的质量浓度,选取DPPH自由基清除率在25%~85%范围的SNTH-1粗多肽质量浓度,再进行线性拟合,即可求得IC50值。
1.3.7 数据分析
所得数据为3次平行实验的平均值,单因素试验结果采用SPSS20.0软件进行差异显著性分析,采用Design-Expert 8.0.6软件进行响应面试验设计分析,采用OriginPro2018进行作图、DPPH自由基清除率的线性拟合。
2 结果与分析
2.1 嗜盐四联球菌SNTH-1发酵产多肽培养条件优化单因素试验
发酵时间、发酵温度、接种量、盐度、初始pH值对嗜盐四联球菌SNTH-1产多肽能力的影响见图1。

图1 培养条件优化单因素试验结果Fig.1 Results of single factor experiment for culture conditions optimization
由图1A可知,随着发酵时间的延长,多肽含量呈先上升后趋于平稳的趋势,发酵前40 h多肽含量显著增加(P<0.05);当发酵40 h时,多肽含量最高,为(12.78±0.16)mg/mL;发酵40 h后多肽含量变化差异不显著(P>0.05)。分析原因可能是发酵前期嗜盐四联球菌SNTH-1处在对数生长期,菌株活性较强,具有较强的产肽能力;当发酵时间>40 h后,菌株达到平台期,多肽含量趋于稳定,这与朱雯娟[22]的研究结果一致。因此,确定最佳发酵时间为40 h。
由图1B可知,随着发酵温度的升高,多肽含量呈先升高后缓慢降低的趋势,且各组间差异显著(P<0.05),当发酵温度为37 ℃时多肽含量最高,为(15.15±0.23)mg/mL。分析原因可能是发酵温度较低时,嗜盐四联球菌SNTH-1的活性差,且蛋白酶酶解速率低,仅有部分大豆蛋白被完全利用,从而影响其产多肽能力[23];虽然较高的发酵温度能提高蛋白酶酶解速率,但会抑制菌株的生长活力,不利于发酵产多肽[24]。因此,确定最佳发酵温度为37 ℃。
由图1C可知,随着接种量的增加,多肽含量呈先升高后趋于平缓的趋势,当接种量<1%时,多肽含量存在显著差异(P<0.05);当接种量>1%时,多肽含量无显著差异(P>0.05);当接种量为3%时达到最高,为(16.43±0.15)mg/mL。分析其原因可能是当接种量较少时,菌体生长缓慢,菌体密度低,发酵培养基中的大豆蛋白未被完全利用,致使多肽含量较低;而较多的接种量,会导致发酵初期菌体生长速度过快,细胞过早老化,发酵培养基中营养物质的匮乏,致使产多肽能力下降[22]。因此,确定最佳接种量为3%。
由图1D可知,随着盐度的增加,多肽含量呈先快速升高后缓慢降低的趋势,各组间存在显著差异(P<0.05),当盐度为5%时达到最高,为(21.45±0.30)mg/mL。分析其原因可能是嗜盐四联球菌SNTH-1作为中度嗜盐菌,适宜的盐度能提高菌株的生长活性,有利于蛋白酶等代谢产物的产生,从而提高产多肽能力[25-26]。因此,确定最佳盐度为5%。
由图1E可知,随着初始pH值的升高,多肽含量总体呈先上升后下降的趋势,各组间均存在显著差异(P<0.05);当初始pH值为8.0时,多肽含量达到最高,为(28.67±0.34)mg/mL。分析其原因可能是pH会影响菌体的细胞膜渗透度和营养离子化程度,从而影响嗜盐四联球菌的生长代谢[27-28]。而嗜盐四联球菌生长时利用葡萄糖产酸,弱碱的环境可与酸综合,缩短延滞期,这与王博[29]的研究结果一致。因此,确定最佳初始pH值为8.0。
2.2 嗜盐四联球菌SNTH-1发酵产多肽培养条件优化响应面试验
2.2.1 PB试验结果
在单因素试验的基础上,以多肽含量为响应值,进行PB试验,试验设计及结果见表3,方差分析结果见表4。

表3 Plackett-Burman试验设计及结果Table 3 Design and results of Plackett-Burman experiments
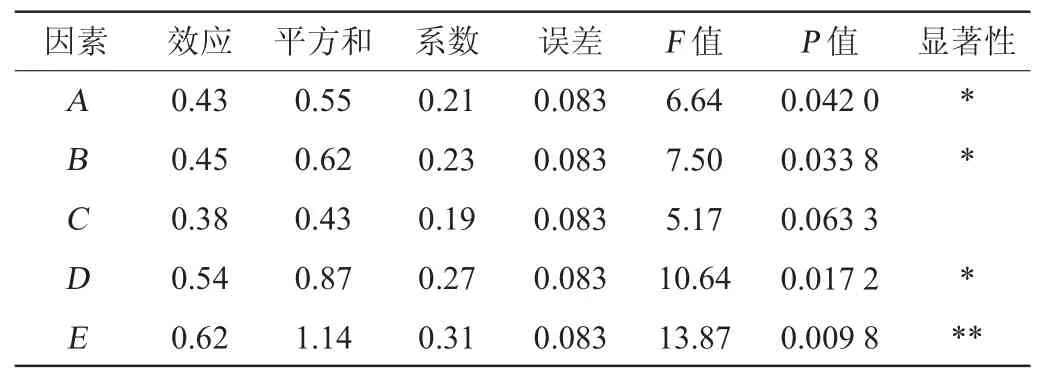
表4 Plackett-Burman试验结果方差分析Table 4 Variance analysis of Plackett-Burman experiments results
由表3及表4可知,各因素对多肽含量影响的顺序为初始pH值>盐度>发酵温度>发酵时间>接种量;初始pH值对多肽含量的影响高度显著(P<0.01),盐度、发酵温度及发酵时间对多肽含量的影响显著(P<0.05),而接种量对多肽含量的影响不显著(P>0.05)。同时,单因素试验结果表明,当多肽含量达到峰值后,即使随着发酵时间的延长,其含量仍保持稳定。因此,选定对嗜盐四联球菌SNTH-1发酵产多肽影响最大的3个因素(发酵温度、盐度、初始pH值)进行最陡爬坡试验。
2.2.2 最陡爬坡试验结果
由PB试验结果可知,初始pH值(X1)、盐度(X2)、发酵温度(X3)均呈显著正效应(P<0.05),应逐步增加。利用最陡爬坡试验,初步确认最大多肽含量区域,有效建立响应面拟合方程。最陡爬坡试验设计及结果见表5。

表5 最陡爬坡试验设计及结果Table 5 Design and results of steepest ascent experiments
由表5可知,当初始pH值为8.0、盐度为5%、发酵温度为37 ℃时,多肽含量达到最高,为29.81 mg/mL。因此,确定初始pH值8.0、发酵温度37 ℃、盐度5%为响应面试验的中心点。
2.2.3 响应面试验设计与结果
采用Design-Expert 8.0.6软件,在PB试验的基础上,以最陡爬坡试验结果为依据,多肽含量(Y)为响应值,确定初始pH值8.0、发酵温度37 ℃、盐度5%为中心点,进行3因素3水平的响应面优化试验,共计17组,设计方案及结果见表6,方差分析结果见表7。

表6 Box-Behnken试验设计及结果Table 6 Design and results of Box-Behnken experiments

表7 回归模型方差分析Table 7 Variance analysis of regression model
运用Design-Expert 8.0.6软件对表6中的多肽含量进行多元线性回归拟合,最终得到回归方程:

由表7可知,模型的P<0.001,表明该二次回归方程模型极显著(P<0.001)。同时失拟项P=0.703 8>0.05,不显著,说明响应面试验结果和数学模型拟合度较高,能较好解释响应中的变异。决定系数R2为0.992 2,说明此方程对试验拟合度结果比较好,误差小;校正决定系数R2Adj为0.982 1,表明能解释试验中98.21%响应值的变化并且试验误差较小,说明此回归模型能对嗜盐四联球菌SNTH-1发酵制备多肽的效果进行较好地分析与预测。另一方面,变异系数(coefficient of variation,CV)=0.91%<10%,说明本试验的置信度良好[30-31],也从另一方面表明此模型的可靠性。由表7亦可知,影响多肽含量的主次顺序依次为X1>X2>X3,即初始pH值>盐度>发酵温度。一次项X1及二次项X12、X22、X32对结果影响极显著(P<0.001),一次项X2及交互项X1X2、X2X3对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
根据曲面的陡峭程度能判断各因素间交互作用对嗜盐四联球菌SNTH-1产多肽能力影响的显著性,曲面越陡峭,影响越显著,反之不显著,也可根据等高线的形状判断显著性[32]。各因素及其交互作用对嗜盐四联球菌SNTH-1产多肽能力影响的响应面及等高线见图2。
由图2可知,初始pH值与盐度、盐度与发酵温度间的交互作用的响应面呈凸面,说明存在最大值,坡度较陡峭,等高线呈闭合的椭圆形,说明各因素间交互作用明显,而初始pH值与发酵温度间交互作用的响应面坡度较平坦,且等高线近似圆形,表明初始pH值和发酵温度间的交互作用对多肽含量的影响没有显著性,该结果与方差分析结果一致。
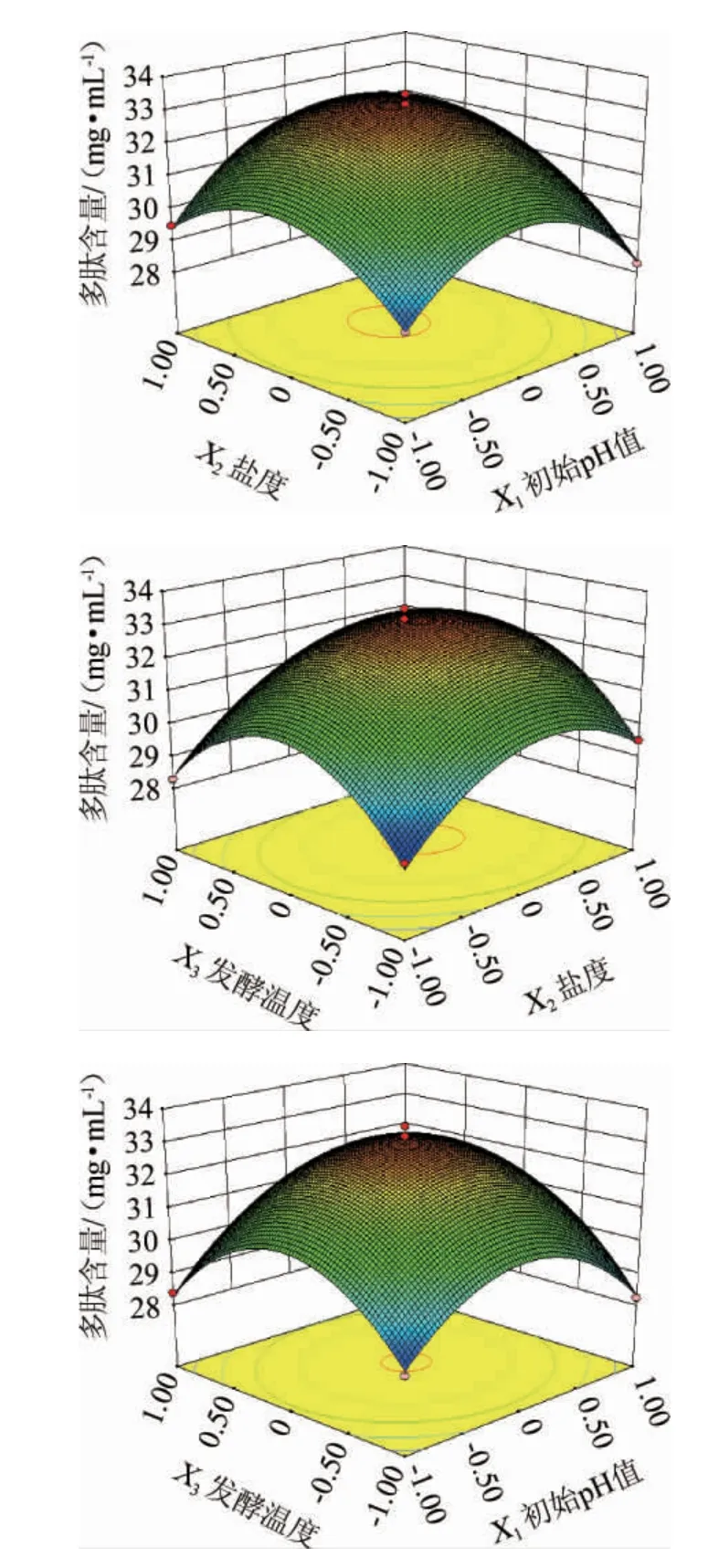
图2 各因素间交互作用对嗜盐四联球菌SNTH-1产多肽含量影响的响应面和等高线Fig.2 Response surface plots and contour lines of interaction between various factors on the contents of peptide produced by Tetragenococcus halophilus SNTH-1
2.2.4 最佳发酵条件的确定
利用响应面优化确定最佳条件为发酵时间40 h、盐度5.23%、发酵温度37.06 ℃、接种量3%、初始pH值8.08。在此条件下,多肽含量预测值为33.15 mg/mL。为便于实际操作,将最佳发酵条件修正为发酵时间40 h、盐度5.2%、发酵温度37 ℃、接种量3%、初始pH值8.1。在此优化条件下进行3次验证试验,多肽含量实际值为(32.96±0.02)mg/mL,与模型预测值接近,说明该回归模型优化出的工艺参数较为准确,具有较高可行性,可实际应用。
2.3 嗜盐四联球菌SNTH-1发酵液呈味肽分析
基于样品基质呈味的复杂性,应用电子舌技术,测定嗜盐四联球菌SNTH-1粗多肽的酸味、苦味、涩味、苦味回味、涩味回味、鲜味、厚味、咸味、甜味,结果见图3。

图3 嗜盐四联球菌SNTH-1产粗多肽呈味特性电子舌测定结果Fig.3 Taste characteristics of crude peptides produced by Tetraplococcus halophilus SNTH-1 determined by electronic tongue
由图3可知,试验组、对照组、空白组的咸味、鲜味的味觉值较高,甜味居中,苦味较低,均高于无味点组,可作为评价风味的有效指标;而酸味、涩味、苦味回味、涩味回味的味觉值低于无味点组,不呈味。试验组的鲜味、厚味、咸味、甜味、苦味的味觉值均高于对照组、空白组,说明优化后的发酵条件增强了嗜盐四联球菌SNTH-1所产粗多肽的鲜味、厚味、咸味、甜味和苦味的表达。而苦味的增加可能是因为嗜盐四联球菌SNTH-1生长所产生的蛋白酶、肽酶等代谢产物,将大分子蛋白降解生成小分子肽和游离氨基酸,释放了易于苦味受体结合的苯丙氨酸、精氨酸、脯氨酸等[33],从而产生苦味。
2.4 嗜盐四联球菌SNTH-1粗多肽的抗氧化能力分析
基于样品基质复杂的生物活性,测定嗜盐四联球菌SNTH-1粗多肽的DPPH自由基清除率,结果见图4。
由图4可知,DPPH自由基清除率与嗜盐四联球菌SNTH-1粗多肽的质量浓度呈正相关,随着多肽质量浓度的增加,DPPH自由基清除率也在逐渐增大,且试验组多肽的DPPH自由基清除率高于对照组,说明优化后的发酵条件提高了嗜盐四联球菌SNTH-1粗多肽的抗氧化性。试验组嗜盐四联球菌SNTH-1粗多肽清除DPPH自由基的IC50值为0.22 mg/mL。HE R等[34]利用枯草芽孢杆菌(Bacillus subtilis)固态发酵制备的菜籽肽清除DPPH自由基的IC50值为0.165 mg/mL;龙久铃等[35]利用米曲霉(Aspergillus oryzae)固态发酵制备的苏麻饼粕肽清除DPPH自由基的IC50值为0.17 mg/mL,略低于嗜盐四联球菌SNTH-1粗多肽的IC50值。综上所述,嗜盐四联球菌SNTH-1所产多肽中可能存在具有抗氧化能力的生理活性肽,具有一定的应用潜力。
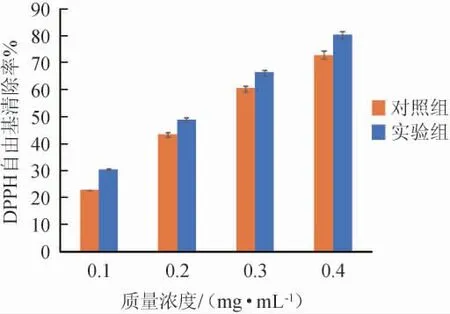
图4 嗜盐四联球菌SNTH-1产粗多肽发酵条件优化前后的DPPH自由基清除率Fig.4 DPPH free radical scavenging rate of crude peptide produced by Tetraplococcus halophilus SNTH-1 before and after fermentation condition optimization
3 结论
本研究以高产多肽的嗜盐四联球菌SNTH-1为研究对象,通过单因素试验、PB试验、最陡爬坡试验及Box-Behnken试验优化确定其产多肽的最优工艺为发酵时间40 h、盐度5.2%、发酵温度37 ℃、接种量3%、初始pH值8.1,该条件下多肽含量为(32.96±0.02)mg/mL,嗜盐四联球菌SNTH-1所产粗多肽的鲜味、厚味、咸味、甜味、苦味及DPPH自由基清除率比优化前均有所提高,且清除DPPH自由基的IC50值为0.22 mg/mL。
