鱼腥草地上部分和根部提取物抑制尖吻蝮蛇毒的比较*
2022-06-08陈峻波余晓东熊艳吴七云陈千姿和七一
陈峻波,余晓东,熊艳,吴七云,陈千姿,和七一
教育部活性物质生物技术工程研究中心/重庆师范大学生命科学学院,重庆 401331
毒蛇咬伤是一个非常严重的公共安全问题,尤其在热带和亚热带地区。全世界每年约发生500多万起蛇咬伤事件,导致9 万多人死亡[1]。在中国,每年约10 万人被毒蛇咬伤,造成约25% ~30%的致残率和5% ~ 10%的死亡率[2]。尖吻蝮Deinagkistrodon acutus隶属蛇亚目蝰蛇科蝮亚科下的一个有毒单型蛇,是中国非常著名的毒蛇之一,主要分布在西南部地区及台湾地区[3]。尖吻蝮蛇毒属于血循环毒,由金属蛋白酶、磷脂酶A2、透明质酸酶、细胞毒素、肌肉毒素等毒液成分组成,蛇伤后造成受害者出现严重的局部损伤,如出血、水肿和伤口部位的组织坏死[4-5]。目前,抗蛇毒血清被认为是一种有效的蛇伤治疗药物,能有效地中和蛇毒引起的全身效应,但对蛇毒造成的局部损害保护有限[6]。同时,抗蛇毒血清生产成本较高,存在过敏反应风险高、储存困难等一些内在缺点[7]。因此,寻求新的蛇伤治疗途径具有重要的现实意义。
近年来,国内外学者发现大量植物提取物或其组分具有抑制蛇毒活性的作用[8-10]。大叶桃花心木Swietenia macrophylla提取物能够抑制三色矛头蝮Bothrops asper肌肉毒素PLA2诱导的肌肉损伤[11];从姜黄根Curcuma longa中分离出的酚类化合物可中和原矛头蝮B. jararaca蛇毒引起的出血活性和响尾蛇Crotalus durissus terrificus蛇毒的致死作用[12];从墨旱莲Eclipta prostrata分离的类固醇可中和响尾蛇蛇毒诱发的各种毒理作用,如致死性、神经毒性、出血等[13];前期研究中,我们发现小叶三点金Desmodium microphyllum[14]和徐长卿Cynan⁃chum paniculatum[15]的提取物能够有效抑制尖吻蝮蛇毒引起的出血、水肿和组织坏死等局部损伤;蛇莓Duchesnea indica乙醇提取物能够抑制尖吻蝮蛇毒蛋白水解酶活性[16]。这些结果表明,植物提取物可以作为一种治疗蛇伤的替代或补充疗法。
鱼腥草Houttuynia cordataThunb 隶属于三白草属多年生开花草本植物,是亚洲地区著名的药用植物和受欢迎的蔬菜[17],因全草带鱼腥味而得名。研究表明,鱼腥草具有多种药理学作用,如抗炎[18-19]、抗过敏[20]、抗糖尿病[21]、抗肥胖[22]、抗氧化[23]、抗癌[24]、抗病毒[25-26]和抗菌活性[27]。在中国的偏远山区,鱼腥草常常被配伍其他中草药,用于蛇伤的治疗。然而,目前尚无文献资料来探讨鱼腥草治疗毒蛇咬伤的有效性和科学性。基于此,本研究以尖吻蝮蛇毒为研究对象,探究鱼腥草地上部分和根部提取物对蛇毒主要酶类活性和体内毒性的抑制作用。
1 材料和方法
1.1 材料
尖吻蝮蛇毒购自湖南乌龙山蛇场,经冷冻干燥后于-20 ℃低温保存备用。使用前,将冻干的蛇毒粉末溶解在磷酸盐缓冲液中,在4 ℃条件下,10 000 r/min 离心10 min,取上清备用。昆明雄性小鼠18~20 g 购自重庆医科大学实验室动物中心,按照标准饲养条件饲养。鱼腥草于2017 年7 月至9月采于重庆市大学城校区,自然干燥后保存。
1.2 试剂与仪器设备
主要试剂:纤维蛋白原,Biosharp 公司;透明质酸钠,XiyaReagent 公司;溴代十六烷基三甲胺,Amresco 公司;丙烯酰胺,甲叉双丙烯酰胺,考马斯亮蓝R250,鼎国生物;肌酸激酶(CK)检测试剂盒,南京建成生物工程研究所;SDS-PAGE电泳上样缓冲液,上海碧云天生物技术有限公司。
1.3 植物提取物的制备
将鱼腥草地上部分与根部分开,分别称取地上部分及根各200 g,加入1 000 mLφ=75%乙醇浸泡1 h,再回流提取3 h。将提取物使用滤纸进行过滤,滤液在旋转真空蒸发器(40 ℃,0.1 MPa)中浓缩去除乙醇,浓缩液经冻干后储存于-20 ℃保存备用。
1.4 抑制蛇毒蛋白水解酶活性测定
蛇毒蛋白水解酶活性根据Okoroma[28]的方法进行检测,以酪蛋白作为底物。称取0.2 g琼脂糖,加入16 mL PBS(0.05 mol/L,pH 7.5),加热至琼脂糖溶解;再加入4 mL 酪蛋白溶液(12.5 mg/mL),混合均匀后倒板,待平板冷却凝固后用打孔器打孔。尖吻蝮蛇毒(20 μg)分别与不同质量比[m(蛇毒)/m(提取物)=1∶5、1∶10、1∶20、1∶50 和1∶100]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min 后点样于点样孔,于37 ℃恒温孵育12 h 后测量透明圈直径大小,实验重复进行3次。酶活性以%表示,以尖吻蝮蛇毒诱导产生的蛋白水解活性定义为100%。
1.5 抑制蛇毒磷脂酶A2活性测定
蛇毒磷脂酶A2活性根据Habermann 等[29]的方法进行测定,以蛋黄液作为底物。称取0.2 g 琼脂糖,加入20 mL 醋酸钠溶液(0.05 mol/L,pH 6.5),加热至琼脂糖溶解;待琼脂糖溶液温度降低至50 ℃左右,加入蛋黄液800 μL(蛋黄液的制备:蛋黄与8.5 mg/mL NaCl 溶液以1∶3 的体积比混合后,于3 000 r/min 条件离心5 min,取上清即得)和CaCl2(0.01 mol/L) 400 μL,混合均匀后倒平板,待平板冷却凝固后用打孔器打孔。尖吻蝮蛇毒(4 μg)分别与不同质量比[m(蛇毒)/m(提取物)=1∶25、1∶50、1∶100 和1∶200]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min 后点样于点样孔,于37 ℃恒温孵育9 h后测量透明圈直径大小,实验重复进行3次。酶活性以%表示,以尖吻蝮蛇毒诱导产生的磷脂酶A2活性定义为100%。
1.6 抑制蛇毒透明质酸酶活性测定
蛇毒透明质酸酶活性根据Singer 等[30]的方法进行测定,以透明质酸为底物。称取2 g 琼脂糖,加入100 mL 醋酸钠缓冲液(50 mmol/L,pH 5.0),溶解后50 ℃孵育备用;称取0.2 g透明质酸钠,加入100 mL 相同缓冲液溶解,与琼脂糖溶液混匀后倒板,待平板冷却凝固后用打孔器打孔。尖吻蝮蛇毒(50 μg)分别与不同质量比[m(蛇毒)/m(提取物)=1∶5、1∶10、1∶20、1∶50 和1∶100]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min后点样于点样孔,37 ℃恒温孵育15 h后,加入7.5 mg/mL 的十六烷基三甲基溴化铵溶液,放置2 h 观察测量透明圈直径大小,实验重复进行3 次。酶活性以%表示,以尖吻蝮蛇毒诱导产生的透明质酸酶活性定义为100%。
1.7 中和蛇毒促凝活性测定
蛇毒促凝活性根据Gené等[31]的方法测定。最小凝结剂量(MCD,minimum coagulant dose)定义为在37 ℃条件下,能够引起血浆在60 s 内凝结所需的毒液剂量。取最小凝结剂量的尖吻蝮蛇毒分别与不同质量比[m(蛇毒)/m(提取物)=1∶10、1∶50、1∶100、1∶200 和1∶300]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min 后,与160 μL 牛血浆混合,于37 ℃下观察凝结时间,实验重复3 次。促凝活性以平均凝结时间(单位:s)表示。
1.8 中和蛇毒纤维蛋白原水解活性测定
蛇毒纤维蛋白原水解活性根据Rodrigues 等[32]的方法进行测定。尖吻蝮蛇毒(2 μg)分别与不同质量比[m(蛇毒)/m(提取物)=1∶5、1∶10、1∶20 和1∶50]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min 后,与20 μL 牛纤维蛋白原(2 μg/μL) 混合均匀后于37 ℃孵育1 h。加入20 μL 0.05 mol/L Tris-HCl 上样缓冲液(pH 6.8,含φ=10%甘油,φ=10%巯基乙醇,20 mg/mL SDS和0.5 mg/mL 溴酚蓝)终止反应,在100 ℃下煮沸3 min,通过φ=12%SDS-PAGE凝胶电泳检测蛇毒纤维蛋白原水解活性。
1.9 中和蛇毒体内出血活性测定
蛇毒诱导出血活性根据Nikai 等[33]的方法测定。最小出血剂量(MHD,minimum hemorrhagic dose)定义为诱导小鼠皮下产生10 mm 出血圈所需的毒液剂量。选取100 只昆明小鼠18~20 g,随机分为10 组。实验组取最小出血剂量的尖吻蝮蛇毒分别与不同质量比[m(蛇毒)/m(提取物)=1∶10、1∶50、1∶100 和1∶200]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min。随后进行小鼠皮下注射,3 h 后,小鼠经乙醚深度麻醉致死,解剖观察皮下出血情况,测量出血圈的直径,实验重复3次。出血活性以%表示,以尖吻蝮蛇毒诱导小鼠产生的出血活性定义为100%,以注射等量生理盐水的小鼠为正常对照组。
1.10 中和蛇毒体内水肿活性测定
蛇毒诱导水肿活性根据Maiorano 等[34]的方法测定。选取70 只昆明小鼠18 ~ 20 g,随机分为7组。实验组取尖吻蝮蛇毒(3 μg)分别与不同质量比[m(蛇毒)/m(提取物)=1∶50、1∶100 和1∶200]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min。随后将混合溶液注射至小鼠右足趾,120 min 后,用游标卡尺测量小鼠右脚掌的厚度,实验重复3次。水肿活性以毒液注射前后的脚掌厚度之间的百分比差表示,以尖吻蝮蛇毒诱导产生的水肿活性定义为100%。
“当官不为民做主,不如回家卖红薯。”对于庸官懒官,老百姓向来深恶痛绝。近年来,党中央对不作为慢作为问题的治理始终没有放松。但无法回避的是,当前仍有少部分党员干部存有着“不求有功,但求无过”“多一事不如少一事”“只要不出事,宁愿不做事”的错误心态,不思进取,得过且过,“当一天和尚撞一天钟”,对待工作更是挑三拣四,消极应付。
小鼠脚掌的肿胀率=[(注射120 min 后脚掌的厚度-注射前脚掌厚度)÷注射前的厚度]×100%。
1.11 中和蛇毒体内组织坏死活性测定
蛇毒诱导组织坏死活性根据Mebs等[35]的方法测定。选取80 只昆明小鼠18 ~ 20 g,随机分为8组。实验组取尖吻蝮蛇毒50 μg 分别与不同质量比[m(蛇毒)/m(提取物)=1∶50、1∶100 和1∶200]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min。随后将混合溶液注射至小鼠右腓肠肌,3 h后,收集血样制备上清,采用CK检测试剂盒对血清中的肌酸激酶进行检测,实验重复3次。组织坏死活性以血清中CK 含量水平表示,以尖吻蝮蛇毒诱导产生的组织坏死活性定义为100%。正常对照组小鼠仅注射等量生理盐水。
1.12 中和蛇毒体内致死毒性测定
蛇毒致死活性根据Alam 等[36]的方法测定。选取100只昆明小鼠18~20 g,随机分为10组。实验组取2 LD50的尖吻蝮蛇毒分别与不同质量比[m(蛇毒)/m(提取物)=1∶12.5、1∶25、1∶50 和1∶100]的鱼腥草地上部分提取物或根部提取物混匀,37 ℃孵育30 min。随后混合液进行小鼠腹腔注射,记录24 h内小鼠的生存状况。致死活性以小鼠生存状况表示,以尖吻蝮蛇毒诱导产生的致死活性定义为100%。正常对照组小鼠仅注射等量生理盐水。
1.13 植物化学成分分析
鱼腥草地上部分和根部提取物物化学成分根据Harborne[37]和Tiwari等[38]的方法进行分析。
1.14 数据分析与处理
数据结果采用平均值±平均值标准误表示。使用SPSS 18.0 软件单向方差分析和GraphPad Prism version 5.00 软件进行了组间差异的显著性统计。P<0.05为差异具有统计学意义。
2 结果与分析
2.1 鱼腥草提取物对尖吻蝮蛇毒主要酶类活性的抑制作用
鱼腥草提取物对尖吻蝮蛇毒蛋白水解酶抑制作用如图1所示,在测定范围内,鱼腥草地上部分提取物能够显著抑制尖吻蝮蛇毒蛋白水解酶活性,且呈剂量效应关系。当蛇毒和鱼腥草地上部分提取物质量比为1∶5、1∶10 和1∶20 时,对蛋白水解酶活性抑制率分别为17%、26%和34%。当蛇毒和地上部分提取物质量比为1∶50 和1∶100 时,尖吻蝮蛇毒蛋白水解酶活性能被完全抑制(抑制率为100%);在相同质量比条件下,根部提取物仅仅抑制了25%和29%的蛇毒蛋白水解酶活性。
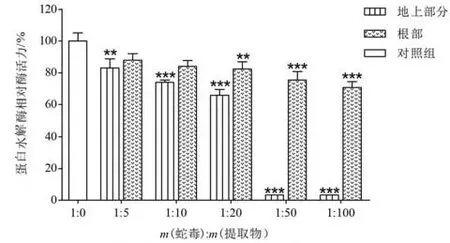
图1 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒蛋白水解酶的抑制作用Fig.1 Inhibitory effect of extracts from aerial part and root of H. cordata on proteolytic enzyme activity from D. acutus venom
鱼腥草提取物对尖吻蝮蛇毒磷脂酶A2活性的抑制作用如图2所示。当蛇毒和鱼腥草地上部分质量比为1∶50 和1∶100 时,蛇毒磷脂酶A2活性抑制率为20%和100%;相比之下,在相同质量比条件下,根部提取物对蛇毒磷脂酶A2活性的抑制率仅为14%和33%。当蛇毒与两种提取物的质量比增加至1∶200时,可100%抑制蛇毒磷脂酶A2活性。
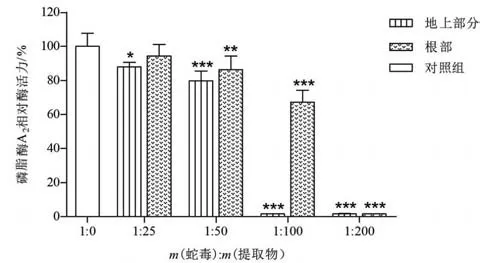
图2 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒磷脂酶A2的抑制作用Fig.2 Inhibitory effect of extracts from aerial part and root of H. cordata on phospholipase A2 activity from D. acutus venom
鱼腥草提取物对尖吻蝮透明质酸酶活性的抑制作用如图3所示,在蛇毒与提取物质量比为1∶5~1∶100 的范围内,鱼腥草地上部分和根部提取物均能显著抑制尖吻蝮蛇毒透明质酸酶活性,且呈浓度效应关系。当蛇毒和鱼腥草地上部分质量比为1∶20时,透明质酸酶活性可被完全抑制(抑制率为100%)。相比之下,当蛇毒和根部提取物质量比为1∶100时,才能完全抑制蛇毒透明质酸酶活性。

图3 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒透明质酸酶的抑制作用Fig.3 Inhibitory effect of extracts from aerial part and root of H. cordata on hyaluronidase activity from D. acutus venom
鱼腥草提取物对尖吻蝮蛇毒诱导血浆凝结的抑制作用如图4所示。不同剂量尖吻蝮蛇毒与牛血浆在37 ℃保温,当蛇毒剂量达10 μg 时,可在60 s内诱导牛血浆凝结,即为尖吻蝮蛇毒MCD。以蛇毒MCD 为实验剂量,检测两种提取物的抑制作用。结果显示,鱼腥草地上部分提取物对尖吻蝮蛇毒的促凝作用表现出剂量效应抑制作用,当蛇毒和鱼腥草地上部分质量比为1∶300时,显著延长了血浆的凝结时间(>300 s)。相比之下,在质量比为1∶100,1∶200和1∶300时,根部提取物的抑制作用均低于地上部分提取物。
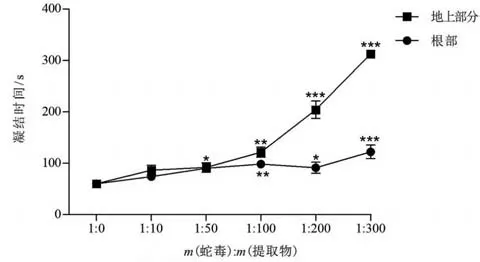
图4 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒促凝活性的中和作用Fig.4 Neutralization of extracts from aerial part and root of H. cordata on procoagulant activity from D. acutus venom
鱼腥草提取物对尖吻蝮蛇毒诱导纤维蛋白原水解活性的抑制作用如图5所示。在SDS-PAGE 凝胶中,牛纤维蛋白原点样孔样品呈现出完整的3条蛋白质条带,分别为Aα、Bβ 和γ 链;当尖吻蝮蛇毒与牛纤维蛋白原在37 ℃孵育30 min 后,Aα 和Bβ 链发生了降解,而γ 链保持完整。在质量比为1∶5~1∶50 的检测范围内,鱼腥草地上部分提取物完全抑制了蛇毒诱导的Bβ链降解,部分抑制了Aα链的降解。相比之下,当蛇毒和根部提取物质量比达到1∶20 或1∶50 的比例时,根部提取物才能完全抑制了Bβ链降解,部分抑制Aα链降解。
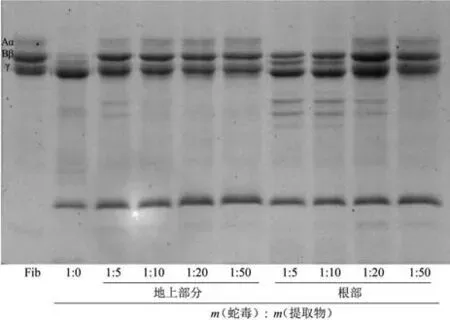
图5 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒纤维蛋白原水解酶的抑制作用Fig.5 Inhibitory effect of extracts from aerial part and root of H. cordata on fibrinogenolytic activity from D. acutus venom
2.2 鱼腥草提取物对尖吻蝮蛇毒体内毒性的中和作用
鱼腥草提取物中和尖吻蝮蛇毒诱导小鼠皮下出血结果如图6所示。不同剂量尖吻蝮蛇毒皮下注射小鼠,测得20 μg 蛇毒可诱导小鼠皮下出现直径为10 mm 的溶血圈,即为尖吻蝮蛇毒MHD。以MHD 为实验剂量,检测两种提取物的抑制作用。结果显示,鱼腥草提取物能有效中和尖吻蝮蛇毒诱导的出血活性,且呈剂量效应关系。当蛇毒和鱼腥草地上部分提取物质量比为1∶200时,能够完全中和尖吻蝮蛇毒诱导的出血活性;在相同质量比条件下,鱼腥草根部提取物能够中和尖吻蝮蛇毒93%的出血活性。
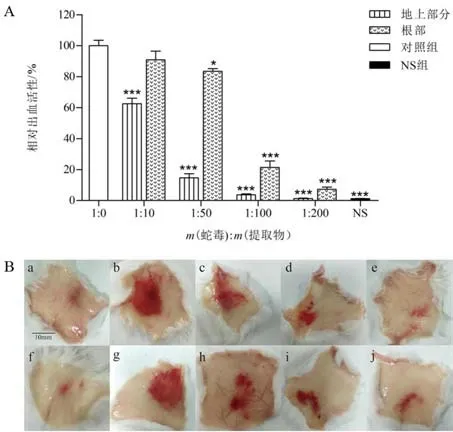
图6 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒出血活性的中和作用Fig.6 Neutralization of extracts from aerial part and root of H. cordata on hemorrhagic activity from D. acutus venom
鱼腥草提取物中和尖吻蝮蛇毒诱导小鼠脚趾水肿结果如图7所示。当小鼠脚趾注射3 μg尖吻蝮蛇毒,120 min 后,能够诱导小鼠脚趾发生显著肿胀,肿胀度达45%。当鱼腥草提取物和尖吻蝮蛇毒提前孵育30 min,蛇毒诱导的水肿活性能够被两种提取物有效抑制,且呈剂量效应关系。当蛇毒和鱼腥草地上部分提取物质量比为1∶200时,蛇毒诱导的水肿活性降低至6%;而在相同质量比条件下,根部提取物能够使蛇毒诱导的水肿活性降低至19%。
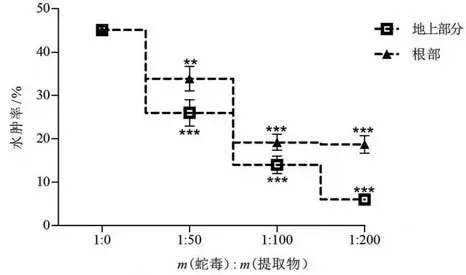
图7 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒水肿活性的中和作用Fig.7 Neutralization of extracts from aerial part and root from H. cordata on edema activity from D. acutus venom
鱼腥草提取物中和尖吻蝮蛇毒诱导小鼠组织坏死结果如图8 所示。鱼腥草提取物和蛇毒孵育后,能够中和蛇毒诱导的CK 活性,且呈剂量效应关系。以注射尖吻蝮蛇毒诱导小鼠产生的CK 活性定义为100%,注射生理盐水小鼠作为正常对照组。当蛇毒和鱼腥草地上部分提取物质量比为1∶200 时,蛇毒诱导的CK 活性能够被完全中和;而在相同质量比条件下,根部提取物能够使尖吻蝮蛇毒诱导的CK活性降低35%。
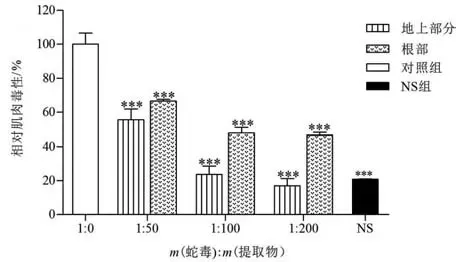
图8 鱼腥草地上部分及根部提取物对尖吻蝮蛇毒肌肉毒性的中和作用Fig.8 Neutralization of extracts from aerial part and root of H. cordata on myotoxic activity from D. acutus venom
鱼腥草提取物中和尖吻蝮蛇毒诱导小鼠致死作用结果如表1所示。小鼠腹腔注射不同剂量尖吻蝮蛇毒,测得LD50为2.88 mg/kg,以2 LD50作为致死剂量。当单独注射尖吻蝮蛇毒时,小鼠在24 h内全部死亡。当蛇毒和鱼腥草地上部分提取物质量比为1∶25,24 h 内小鼠存活率为100%;而在相同质量比条件下,24 h内小鼠存活率仅为50%。此外,当蛇毒和鱼腥草地上部分或根部提取物质量比为1∶50和1∶100时,24 h内所有小鼠均存活。
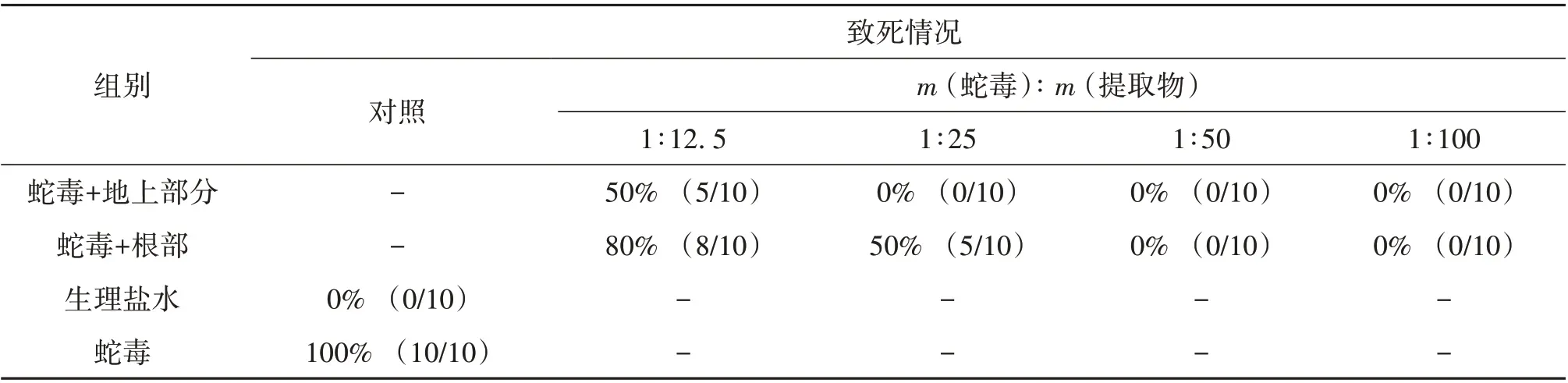
表1 鱼腥草地上部分和根部提取物对尖吻蝮蛇毒诱导致死毒性的保护作用(n=100)1)Table 1 Protective effects of extracts from aerial part and root of H. cordata on lethal toxicity induced by D. acutus venom(n=100)
2.3 鱼腥草提取物植物化学分析
鱼腥草提取物植物化学分析结果如表2 所示。地上部分和根部均存在生物碱、蒽醌和蛋白质,而地上部分还存在黄酮、多酚、单宁、三萜、甾醇和皂苷类物质。
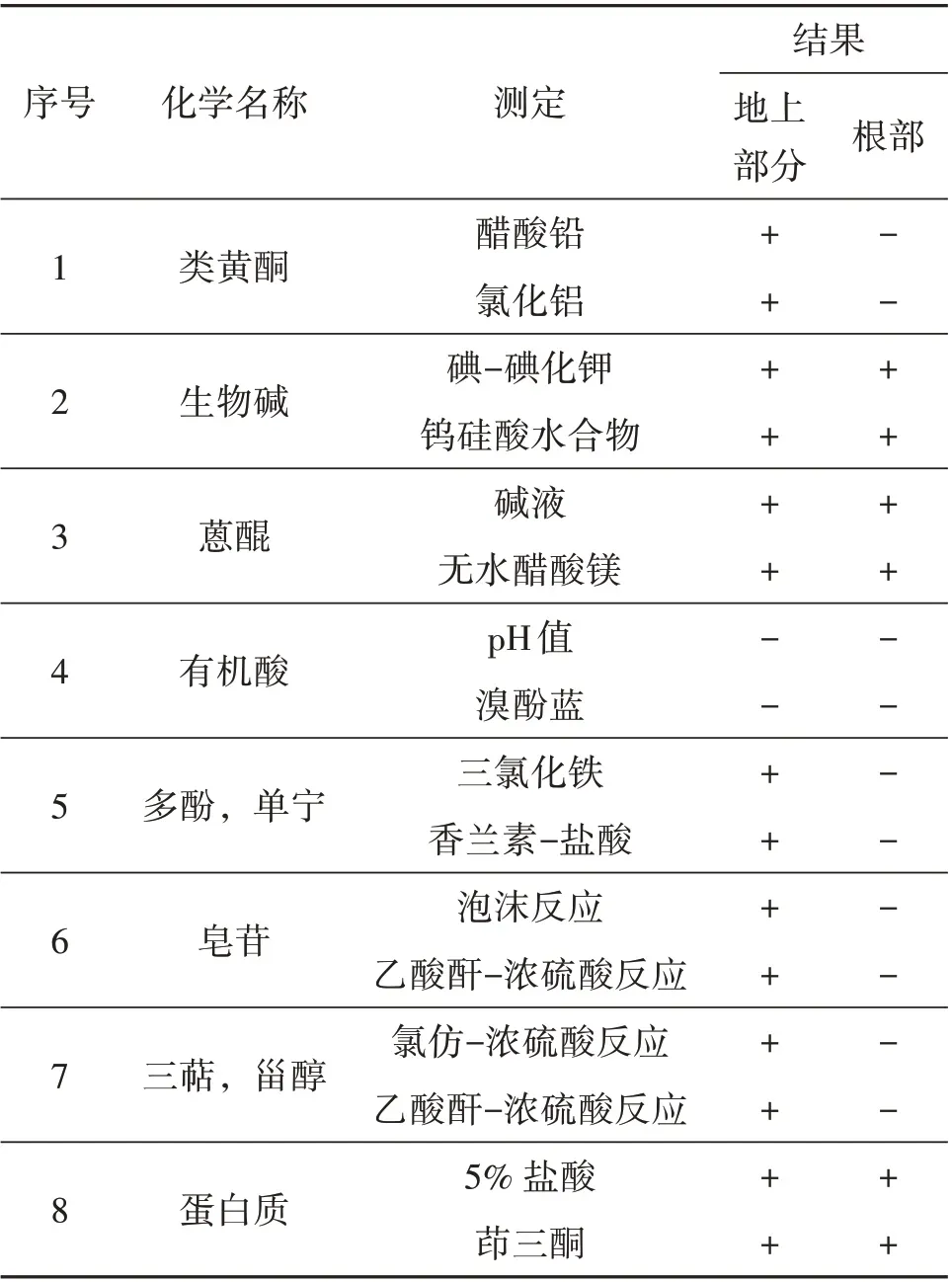
表2 鱼腥草地上部分和根部提取物的初步植物化学组成鉴定1)Table 2 Preliminary phytochemical screening of extracts from aerial part and root of H. cordata
3 讨 论
鱼腥草作为一种常见的中草药,具有清热解毒、利尿消肿、清痈排脓等功效,已被用于治疗多种疾病,包括咳嗽、白带、肾病综合征、单纯性疱疹、痤疮和流感等[17,39-40]。根据民间蛇伤救治案例以及《常用中草药手册》《救急易方》等资料记载,鱼腥草可用于治疗毒蛇咬伤。本研究中,我们首次对鱼腥草地上部分和根部提取物抑制蛇毒作用进行了比较研究。结果表明,鱼腥草地上部分比根部在抑制尖吻蝮蛇毒主要酶类活性和体内毒性方面更为有效。
金属蛋白酶和丝氨酸蛋白酶是尖吻蝮蛇毒中两个关键的蛋白酶,能引起蛇伤动物凝血系统发生变化[41]。蛇毒金属蛋白酶隶属于metzincin家族,具有HEXXHXXGXXH 的Zn2+结合基序,通常表现出纤维蛋白(原)水解和基底膜或细胞外基质降解活性,导致严重的出血,血液凝集和局部组织损伤[42-43]。大多数丝氨酸蛋白酶表现出凝血酶活性并水解纤维蛋白原产生异常的纤维蛋白凝块,该凝块无法被XIII因子进一步交联,从而导致血液不能正常凝结[44-45]。因此,抑制这些酶的活性在蛇伤治疗中起重要作用。研究结果表明,鱼腥草地上部分提取物可以显著地抑制尖吻蝮蛇毒对酪蛋白和纤维蛋白原的水解活性(图1、图5)。同时,高浓度的地上部分提取物显著地抑制了蛇毒诱导的牛血浆凝结活性(图4),抑制效果与生理盐水对照组相同(凝结时间>300 s)。这些结果表明,鱼腥草地上部分提取物对金属蛋白酶和丝氨酸蛋白酶表现出显著的抑制作用。
蛇毒透明质酸酶,俗称的扩散因子,在蛇咬伤部位降解透明质酸等细胞外基质的糖胺聚糖,促进蛇毒成分的扩散和吸附,从而导致局部组织损伤,造成永久性缺陷和/或残疾[46]。研究结果表明,即使在较低浓度下(蛇毒与地上部分提取物质量比为1∶20),鱼腥草地上部分提取物也能显著抑制尖吻蝮蛇毒透明质酸酶活性(图3),提示这可能是鱼腥草治疗尖吻蝮毒蛇咬伤的一种作用机制。
尖吻蝮毒蛇咬伤后,除造成严重出血症状外,还会在毒液注射部位产生其他局部效应,包括水肿和组织坏死。水肿产生的原因主要归因于多种磷脂酶A2和蛇毒金属蛋白酶的协同作用,并由此释放和/或合成的内源性炎症介质所介导[47-49]。组织坏死被认为与磷脂酶A2对肌肉细胞质膜的直接破坏作用或间接作用有关,其中涉及蛇毒金属蛋白酶出血毒素对微脉管系统和肌肉内动脉的缺血性改变[49]。在本研究中,鱼腥草地上部分提取物能显著抑制尖吻蝮蛇毒在体内引起的出血、水肿和组织坏死(图6~图8),表明其对蛇毒磷脂酶A2和金属蛋白酶具有抑制作用。结合体外实验结果,地上部分提取物能显著抑制了尖吻蝮蛇毒磷脂酶A2和蛋白水解酶活性(图1~图2)。这些发现进一步证实鱼腥草地上部分提取物对尖吻蝮蛇毒引起的局部损伤具有显著的保护作用,可作为抗蛇毒血清的辅助疗法。
蛇伤发生后,毒液成分通过相互间的协同作用引起严重的全身系统性损害,导致受害者死亡。在探寻蛇伤解毒剂时,评估致死保护性是一个重要指标。本研究中,用2 LD50尖吻蝮蛇毒作为挑战剂量对小鼠进行腹腔注射。结果显示,当蛇毒与鱼腥草地上部分提取物质量比为1∶25 时,24 h 内所有小鼠存活并健康;当以相同比例的蛇毒和根部提取物处理小鼠,24 h 内小鼠的存活率为50%。这些结果表明鱼腥草提取物可以用于尖吻蝮蛇伤救治,而且地上部分提取物治疗效果优于根部提取物。
大量研究表明,药用植物次生代谢产物可用于治疗毒蛇咬伤,能够发展成为传统抗蛇毒血清的补充疗法[50-53]。其中,黄酮和生物碱可减轻多种蛇毒引起的炎症和出血,类黄酮和类生物碱化合物对蛇毒透明质酸酶具有很强的抑制作用[51]。同时,来源于多种植物中的多酚对蛇毒中的磷脂酶A2、蛋白水解酶、透明质酸酶和L-氨基酸氧化酶具有抑制作用[54]。萜类化合物和酚类化合物可抑制多种蛇毒中的磷脂酶A2[52]。单宁与金属离子和蛋白质相互作用形成复合物,从而抑制蛇毒金属蛋白酶,丝氨酸蛋白酶和磷脂酶A2的活性[55]。此外,从多种植物中分离出的谷甾醇和豆甾醇,对多种蛇毒具有抑制作用[56-57]。我们的分析结果表明,鱼腥草地上部分含有各种植物成分,例如黄酮、生物碱、多酚、单宁、三萜、甾醇、皂苷、蒽醌和蛋白质。相比之下,根部仅包含3 种成分,如生物碱、蒽醌和蛋白质。因此,有理由相信,鱼腥草地上部分有效的抗蛇毒潜力归因于其多样化的植物化学成分。
4 结 论
本研究首次证实了鱼腥草提取物(地上部分和根部)对尖吻蝮蛇毒具有显著的抑制作用,并证实地上部分提取物的疗效比根部提取物更有效。鱼腥草地上部分可作为一种潜在的自然资源用于治疗蛇伤药物的开发。本研究为鱼腥草用于毒蛇咬伤治疗提供了科学依据,但是,鱼腥草中抗蛇毒活性成分的筛选、鉴定和作用机制尚需进一步研究。
