深海放线菌Actinomadura cremea中的生物碱类化合物*
2022-06-08陈传兵胡金姗于鑫章卫民张琪张翠仙
陈传兵,胡金姗,于鑫,章卫民,张琪,张翠仙
1. 广州中医药大学中药学院,广东 广州 510006
2. 广东省微生物研究所/华南应用微生物国家重点实验室/广东省菌种保藏与应用重点实验室/广东省微生物应用新技术公共实验室,广东 广州 510070
海洋放线菌是海洋微生物活性天然产物的重要来源[1-3],主要包括链霉属Streptomyces、微球菌属Micrococcus、马杜拉放线菌属Actinomyces、小单孢菌属Micromonospora和节杆菌属Arthrobacter等[4]。Actinomyces属放线菌多分布于热带和亚热带,但目前此属次生代谢产物的报道主要来源于陆地放线菌属[5],其结构类型主要有生物碱类、聚酮类、萜类、甾醇类和环二肽类等[6-7],药理活性主要为抗肿瘤和抗菌活性。如从A. alkaliterraesp. nov.中分离得到的蒽环类洋红霉素,临床用于治疗肿瘤等疾病[8],其同系物吡柔比星目前临床上对急性粒细胞性白血病、急性淋巴细胞性白血病、神经母细胞瘤和横纹肌肉瘤等治疗使用的化疗药物[9]。Müller 等[10]从海绵来源海洋放线菌Actinomadurasp. SBMs009 中分离得到甾醇类化合物,对小鼠成纤维细胞株(L929)显示出较强的细胞毒活性。Wyche 等[11]从海洋放线菌Actinomadurasp. 中分离得到对产生毒素的艰难梭菌NAP1/B1/027等有极强抑菌作用的ecteinamycin,其MIC 值为59.0 ng/μL。文献调研发现海洋来源马杜拉属放线菌的研究报道较少,为进一步获得结构新颖的海洋微生物次生代谢产物[12-14],本课题组对一株深海来源乳脂色马杜拉放线菌Actinomadura cremea的次生代谢产物进行研究。在A1 培养基的培养条件下,从其菌丝体与菌液的乙酸乙酯部位中,共分离得到13 个生物碱类化合物(图1):3 个色氨生物碱(1~3)、4个(芳香)酰胺类生物碱(4~7)和6 个二酮哌嗪类生物碱(8~13)。其中10个生物碱(1、3、4、7~13)首次从马杜拉放线菌属中发现,所有化合物均首次从放线菌Actinomadura cremea中得到。
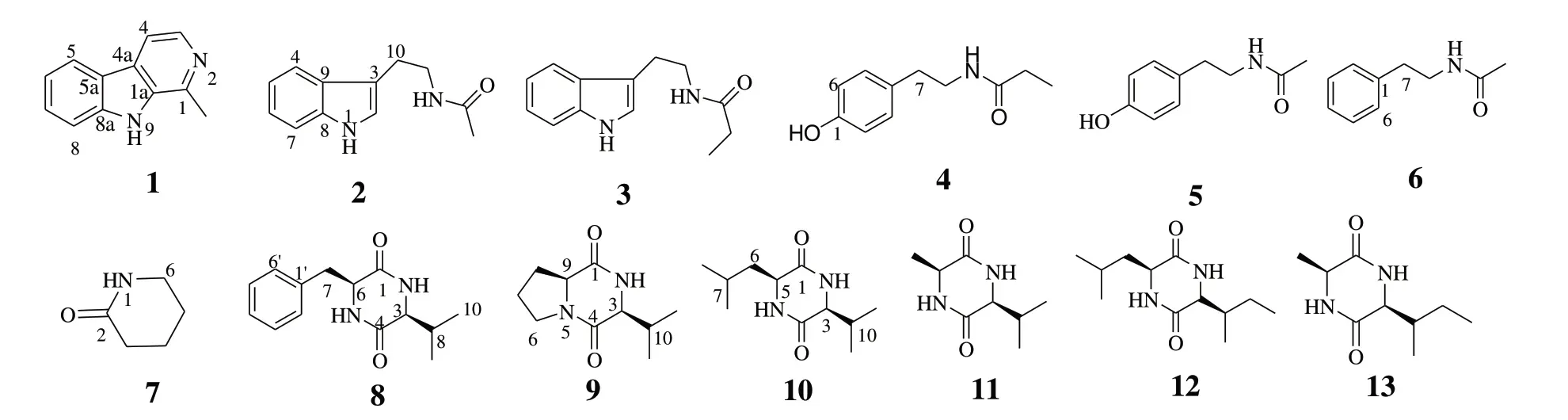
图1 来源于Actinomadura cremea化合物1~13Fig.1 Compounds 1-13 from Actinomadura cremea
1 实验部分
1.1 仪器、试剂与材料
实验中微生物活化、发酵及次生代谢产物提取、分离和结构鉴定的仪器同文献[15]的1.1中仪器部分。本文中的次生代谢产物分离材料色谱柱仅用一种:色谱柱1(日本YMC 公司):YMCPack ODS-A/S 5 μm/12 nm, 250 mm× 10.0 mm;其他分离材料及试剂同文献[15]的1.1中材料与试剂部分。
1.2 菌种材料
马杜拉放线菌Actinomadura cremea于2008 年分离自中国南海北部沉积泥中(E 117°32.357′,N 19°59.304′),水深2 346 m。菌株乳脂色马杜拉放线菌Actinomadura cremea由广东省微生物研究所馈赠,样本编号:线-章-SS7。
1.3 微生物的发酵培养
1.3.1 菌种活化 放线菌线-章-SS7采用A1 培养基进行种子液活化。将纯化菌种接种于装有300 mL A1 培养基的培养瓶(1 L)中,密封。置于28 ℃恒温摇床上培养48 h (165 r/min)。
1.3.2 规模发酵 放线菌线-章-SS7 规模发酵在A1培养基上进行,方法同文献[15]1.3.2部分,共培养66 L。
1.4 次生代谢产物的提取、分离及纯化
生长7 d的菌株采用XAD-7树脂吸附、过滤分为菌体和菌液两部分,次生代谢产物的提取过程见图2;采用硅胶、ODS、Sephadex LH-20 柱色谱及制备HPLC 等进行分离、纯化,得到纯化合物,次生代谢产物的分离及纯化见图3。
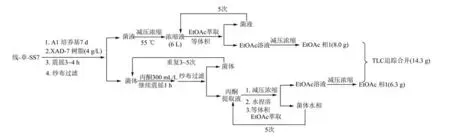
图2 放线菌Actinomadura cremea后处理及乙酸乙酯相的获得Fig.2 EtOAc layer from Actinomadura cremea on the A1 medium
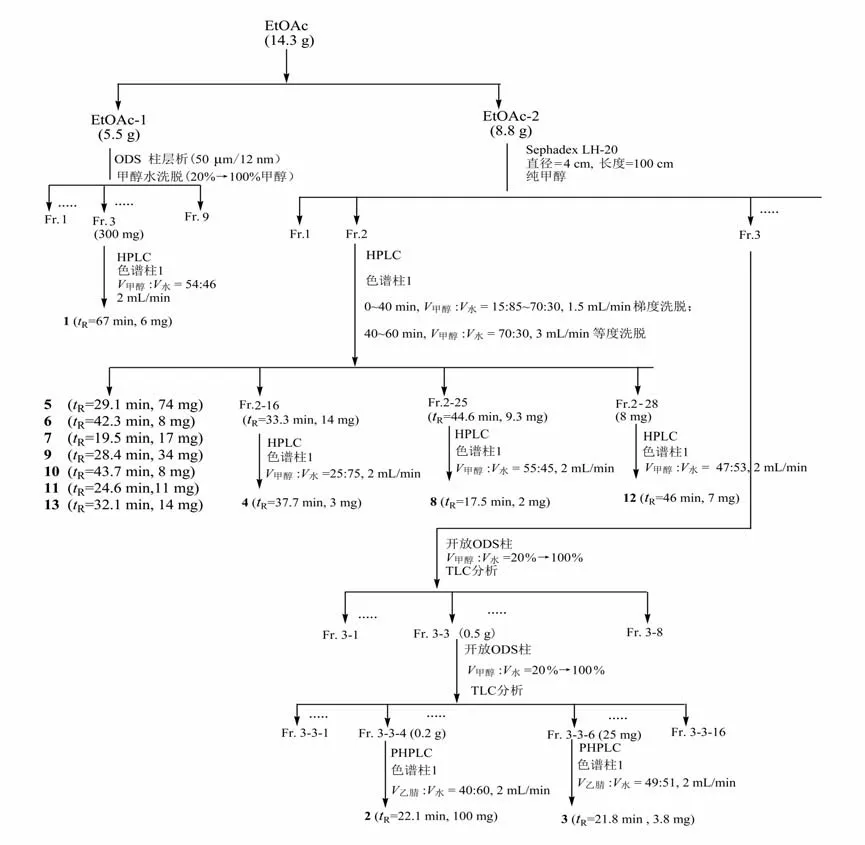
图3 化合物1~13分离流程图Fig.3 The separation flowing chart of 1-13
2 结果与分析
化合物1:黄色固体(MeOH);UV 254 nm 下观察为暗斑。ESI-MS:m/z183[M+H]+,确定其相对分子质量为182,分子式为C12H10N2。1H NMR(400 M,CD3OD)δH:8.51(1H,brs,H-9),8.12~8.14(2H,m,H-3,5),7.93(1H,d,J= 5.6 Hz,H-4),7.57(1H,d,J= 8.4 Hz,H-8),7.53(1H,dt,J=6.8,0.8 Hz,H-7),7.53(1H,m,H-6),2.81(3H,s,H-1’);13C NMR(100 M,CD3OD)δC:142.9(s,C-1),142.7(s,C-8a),137.4(d,C-3),136.2(s,C-1a),130.0(s,C-4a),129.6(d,C-7),122.7(d,C-5),122.6(s,C-5a),120.9(d,C-6),114.2(d,C-4),112.9(d,C-8),19.5(q,C-1’)。以上数据与文献[16-17]报道基本一致,故确定1 为9H-吡啶并[3,4-b]吲哚,即Harmane。
化合物2:黄色固体(MeOH);TLC 中UV 254 nm 下观察为暗斑,365 nm 下检测为橙黄色斑点。ESI-MS:m/z203[M+H]+,确定其相对分子质量为202,分子式为C12H14N2O。1H NMR(400 M,CD3OD)δH:7.51(1H,d,J= 8.0 Hz,H-4),7.30(1H,d,J= 8.0 Hz,H-6),7.05(1H,dt,J= 1.2,8.0 Hz,H-5),6.99(1H,s,H-2),6.96(1H,dt,J= 1.2,8.0 Hz,H-6),3.40(2H,brt,J= 7.2 Hz,H-11),2.87(2H,brt,J= 7.2 Hz,H-10),1.84(3H,s,H-14);13C NMR(100 M,CD3OD)δC:173.2(s,C-13),138.0(s,C-8),128.7(s,C-9),123.3(d,C-2),119.6(d,C-5),119.2(d,C-4),113.2(s,C-3),112.2(d,C-7),41.4(t,C-11),26.1(t,C-10),22.6(q,C-14)。以上数据与文献[18-19]报道基本一致,故确定2为N-乙酰基色胺。
化合物3:黄色固体(MeOH);TLC 中UV 254 nm 下观察为暗斑,365 nm 下检测为橙黄色斑点。ESI-MS:m/z217[M+H]+,确定其相对分子质量为216,分子式为C13H16N2O。1H NMR (400 M,CD3OD)δH:7.55(1H,d,J= 8.0 Hz,H-4),7.31(1H,d,J=8.0 Hz,H-7),7.08(1H,dt,J=0.8,7.2 Hz,H-5),7.05(1H,s,H-2),7.00(1H,dt,J= 0.8,7.2 Hz,H-6),3.46(2H,brt,J= 7.2 Hz,H-11),2.93(2H,brt,J= 7.2 Hz,H-10),2.16(2H,q,J=7.6 Hz,H-14),1.09(3H,t,J=7.6 Hz,H-15);13C NMR(100 M,CD3OD)δC:177.0(s,C-13),138.2(s,C-8),128.8(s,C-9),123.4(d,C-6),122.3(d,C-2),119.5(t,C-5),119.4(d,C-4),113.3(s,C-3),112.2(d,C-7),41.4(t,C-11),30.3(t,C-14),26.3(t,C-10),10.5(q,C-15)。以上数据与文献[19]报道基本一致,故确定3 为N-(2-(1H-吲哚-3-基)乙基)丙酰胺。
化合物4:淡红色固体(MeOH),TLC 中UV 254 nm 下观察为暗斑,浓硫酸-香草醛显蓝灰色。ESI-MS:m/z194[M+H]+,结合NMR 信息确定其相对分子质量为193,分子式为C11H15NO2,不饱和度为5。1H NMR(400 M,CD3OD)δH:7.00(2H,d,J=8.4 Hz,H-3,5),6.68(2H,d,J=8.0 Hz,H-2,6),3.32(2H,t,J=7.2 Hz,H-8),2.66(2H,t,J=7.2 Hz,H-7),2.14(2H,q,J=7.6 Hz,H-11),1.07(3H,t,J=7.6 Hz,H-12);13C NMR(100 M,CD3OD)δC:177.0(s,C-10),156.9(s,C-1),131.3(s,C-4),130.7(d,C-3,5),116.2(d,C-2,6),42.3(t,C-8),35.6(t,C-7),30.2(t,C-11),10.6(q,C-12)。以上数据与文献N-(4-hydroxyphenethyl)propionamide[20]对比基本一致,故确定4为N-(4-羟基苯乙基)丙酰胺。
化合物5:无色固体(MeOH),TLC 中UV 254 nm 下观察为暗斑,浓硫酸-香草醛显蓝灰色。ESI-MS:m/z180[M+H]+,结合NMR 谱数据可推断其分子式为C10H13NO2,不饱和度为5。与化合物4对比发现二者十分相似仅是丙酰基变成了乙酰基。1H NMR(400 M,CD3OD)δH:7.00(2H,d,J=7.2 Hz,H-3,5),6.69(2H,d,J=7.2 Hz,H-2,6),3.30(2H,t,J=7.2 Hz,H-8),2.66(2H,t,J=7.2 Hz,H-7),1.88(3H,s,H-10);13C NMR(100 M,CD3OD)δC:173.2(s,C-9),156.9(s,C-1),131.2(s,C-4),130.7(d,C-3,5),116.2(d,C-2,6),42.4(t,C-8),35.6(t,C-7),22.5(s,C-10)。以上NMR 数据与文献N-acetyltyramine[21-22]基本一致,故确定5为N-乙酰酪胺。
化合物6:白色固体(MeOH),TLC 中UV 254 nm 下观察为暗斑,浓硫酸-香草醛显蓝灰色。ESI-MS:m/z164[M+H]+,结合NMR 谱数据可推断其分子式为C10H13NO,不饱和度为5。化合物6 和5结构十分相似,只是芳香环上比5 少了一个羟基取代。1H NMR(400 M,CD3OD)δH:7.24~7.29(2H,m,H-2,6),7.14~7.23(3H,m,H-3,4,5),3.36(2H,m,H-8),2.76(2H,m,H-7),1.88(3H,s,H-11);13C NMR(100 M,CD3OD)δC:173.2(s,C-10),140.5(s,C-1),129.8(d,C-3,5),129.5(d,C-2,6),127.3(d,C-4),42.1(t,C-8),36.5(t,C-7),22.5(q,C-11)。上述NMR数据与文献N-phenethylacetamide[22-23]对比基本一致,故确定6为N-苯乙基乙酰胺。
化合物7:白色固体(MeOH),ESI-MS:m/z100[M+H]+,结合NMR 谱数据可推断其分子式为C5H9NO,不饱和度为2。1H NMR(400 M,CD3OD)δH:4.61(1H,brs,H-1),3.25(2H,m,H-6),2.28(2H,m,H-3),1.76(4H,m,H-4,H-5);13C NMR(100 M,CD3OD)δC:175.0(s,C-2),43.0(t,C-6),32.0(t,C-3),23.0(t,C-5),21.7(t,C-4)。以上NMR 数据与文献戊内酰胺[24]对比基本一致,故确定7为戊内酰胺。
化合物8:白色固体(MeOH),[α]28D-58.83°(c= 0.02,MeOH)。ESI-MS:m/z247[M+H]+,确定其相对分子质量为246,分子式为C14H18N2O2。1H NMR(400 M,CD3OD)δH:7.20~7.29(5H,m,H-2’~6’),4.31(1H,td,J= 1.2,4.9 Hz,H-6),3.64(1H,dd,J= 0.8,4.6 Hz,H-3),3.23(1H,dd,J= 5.2,13.6 Hz,H-7a),3.03(1H,dd,J= 4.8,13.6 Hz,H-7b),1.64(1H,m,H-8),0.80(3H,d,J= 7.0 Hz,H-9/10),0.43(3H,d,J=6.8 Hz,H-10/9);13C NMR(100 M,CD3OD)δC:169.4(s,C-1),169.4(s,C-4),137.1(s,C-1’),131.5(s,C-3’,5’),129.6(d,C-2’,6’),128.2(d,C-4’),61.2(d,C-3),57.3(d,C-6),40.1(t,C-7),33.3(d,C-8),19.1(q,C-9/10),17.1(q,C-9/10)。以上数据与文献[25-26]报道基本一致,故确定8为环(苯丙-缬)二肽。
化合物9:白色固体(MeOH),[α]28D-119.34°(c=0.1,MeOH)。ESI-MS:m/z197[M+H]+,确定其相对分子质量为196,分子式为C10H16N2O2。1H NMR(400 M,CD3OD)δH:4.20(1H,m,H-3),4.03(1H,m,H-9),3.54(1H,m,H-6a),3.51(1H,m,H-6b),2.48(1H,m,H-10),2.32(1H,m,H-9),3.54(1H,m,H-6a),3.51(1H,m,H-6b),2.48(1H,m,H-10),2.32(1H,m,H-8a),2.01(1H,m,H-8b),1.95(1H,m,H-7a),1.90(1H,m,H-7b),1.09(3H,d,J= 7.2 Hz,H-11/12),0.93(3H,d,J= 6.8 Hz,H-11/12);13C NMR(100 M,CD3OD)δC:172.6(s,C-4),167.6(s,C-4),61.5(d,C-9),60.0(d,C-3),46.2(t,C-6),29.9(d,C-10),29.5(t,C-8),23.3(t,C-7),18.8(q,C-11/12),16.7(q,C-11/12)。以上数据与文献[27-28]报道基本一致,故确定9 为环(脯-缬)二肽。
化合物10:白色固体(MeOH),[α]28D-28.54°(c= 0.16,MeOH)。ESI-MS:m/z213[M+H]+,确定其相对分子质量为212,分子式为C11H20N2O2。1H NMR(400 M,CD3OD)δH:3.94(1H,m,H-3),3.76(1H,m,H-3),2.22(1H,m,H-11),1.87(1H,m,H-8),1.75(1H,m,H-7a),1.60(1H,m,H-7b),1.03(3H,d,J= 6.4 Hz,H-12/13),0.93~0.98(9H,m,H-12/13,9,10);13C NMR(100 M,CD3OD)δC:171.3(s,C-1),169.7(s,C-4),61.5(d,C-3),54.3(d,C-6),46.0(t,C-7),33.7(d,C-11),25.3(d,C-8),23.6(q,C-9/10),21.8(q,C-9/10),19.3(q,C-12/13),17.8(q,C-12/13)。以上数据与文献[29]报道基本一致,故确定10为环(亮-缬)二肽。
化合物11:白色固体(MeOH),[α]28D-24.56°(c=0.2,MeOH)。ESI-MS:m/z171[M+H]+,确定其相对分子质量为170,分子式为C8H14N2O2。1H NMR(400 M,CD3OD)δH:4.03(1H,m,H-6),3.83(1H,m,H-3),2.26(1H,m,H-8),1.44(3H,d,J=6.8 Hz,H-7),1.04(3H,d,J=6.8 Hz,H-9,可与H-10交换),0.94(3H,d,J=6.0 Hz,H-10,可与H-9 交换);13C NMR(100 M,CD3OD)δC:171.4(s,C-1),169.3(s,C-4),61.4(d,C-3),51.7(d,C-6),33.3(d,C-8),21.1(q,C-7),19.1(q,C-9/10),17.2(q,C-9/10)。以上数据与文献[30]报道基本一致,故确定11为环(丙-缬)二肽。
化合物12:白色固体(MeOH),[α]28D-32.26°(c= 0.025,MeOH)。ESI-MS:m/z227[M+H]+,确定其相对分子质量为226,分子式为C12H22N2O2。1H NMR(400 M,CD3OD)δH:3.95(1H,ddd,J= 1.2,4.8,9.2 Hz,H-3),3.85(1H,dd,J=1.2,4.0 Hz,H-6),1.93(1H,m,H-12a),1.25(1H,m,H-12b),1.02(3H,d,J= 6.8 Hz,H-14),0.93(3H,d,J= 6.8 Hz,H-13),0.93~0.96(6H,m,H-9/ H-10);13C NMR(100 M,CD3OD)δC:171.2(s,C-1),169.6(s,C-4),60.9(s,C-3),54.3(d,C-6),45.8(d,C-7),40.5(t,C-11),25.9(t,C-12),25.3(t,C-8),23.6(q,C-9/10),21.8(t,C-9/10),15.7(t,C-14),12.1(q,C-13)。以上数据与文献[31]报道基本一致,故确定12为环(亮-异亮)二肽。
化合物13:白色固体(MeOH),[α]28D-26.70°(c=0.28,MeOH)。ESI-MS:m/z185[M+H]+,确定其相对分子质量为184,分子式为C9H16N2O2。1H NMR(400 M,CD3OD)δH:4.03(1H,m,H-6),3.90(1H,m,H-3),1.96(1H,m,H-8),1.51(1H,m,H-10a),1.26(1H,m,H-10b),1.43(3H,m,H-7),1.01(3H,m,H-9),0.95(3H,m,H-11);13C NMR(100 M,CD3OD)δC:171.3(s,C-1),169.2(s,C-4),60.9(d,C-3),51.6(d,C-6),40.2(d,C-8),25.6(t,C-10),20.9(q,C-7),15.6(q,C-9),12.2(q,C-11)。以上数据与文献[32]报道基本一致,故确定13 为环(丙-异亮)二肽。
3 结 论
本课题组对一株深海来源乳脂色马杜拉放线菌Actinomaduracremea 的次生代谢产物进行了研究。从其A1 培养基的菌丝体与菌液的乙酸乙酯部位中,共分离得到13 个生物碱类化合物(图1),结构类型涉及3 个色氨类生物碱(1~3)、4 个(芳香)酰胺类生物碱(4~7)和6 个二酮哌嗪类生物碱(8~13)。化合物1、3、4、7~13 首次从Actino⁃madura属中发现,所有化合物均首次从海洋放线菌Actinomadura cremea中得到,说明此菌富含丰富的生物碱类次生代谢产物。
文献研究表明1 对卤虫有极强的致死活性测试,其致死率为94.6%[17]。同时研究该化合物的系列衍生物的生物活性[32]发现1-(benzo[d][1,3]dioxol-5-yl)-6- methoxy-2-(4-(trifluoromethyl)-bnzyl)-9H-pyrido[3,4-b]indol-2-ium bromide 具有极强的抗菌活性,其对耐甲氧西林金黄色葡萄球菌的杀菌能力比磷霉素钠和氨苄西林钠等药物还要强,最小抑菌浓度为50 nmol/mL。Stark 等[25]报道了剂量/反应函数关系用于测定二酮哌嗪的苦味,更准确地描述了人类对二酮哌嗪的苦味感知。化合物2 和5 具有较强的清除自由基的能力,其IC50分别是(131.3±1.8)和(64.7±0.5)μg/mL[33]。Lee 等[34]报道5 还具有抑制ADP-、collagen-或u46619-诱导血小板聚集,有抗血栓作用。刘海滨等[35]研究表明9 和12 在50 μg/mL 下对肝癌细胞HepG-2 的抑制率分别为17%、32%,对前列腺癌细胞LNCaP 抑制率分别为53%、43%,且化合物8、9 和12 具有一定的细胞毒活性。Lee 等[36]报道了9 作为一种抗EPCR 脱落试剂,对PMA 介导和CLP 介导的EPCR 脱落具有潜在的抑制作用。而Fdhila 等[37]报道了9 具有抗鳗弧菌的作用(MIC=0.05 μg/mL)。龙聪等[38]研究也表明8 和12 对Hep G2细胞株均表现出一定的生长抑制活性,其IC50分别为88 和105 μg/mL。Xu等[39]研究表明化合物10有较弱的抗菌活性。韩冰等[30]研究表明化合物8、11 和13 显示出具有细胞周期G0/G1期抑制活性,是首次报道此类化合物具有细胞周期抑制活性。由此可以看出放线菌不仅次生代谢产物结构类型多样,生理活性也十分丰富。
