建构“化学键”认知模型的教学实践
2022-05-30陈廷俊
陈廷俊


摘要:梳理化学键理论的建立和发展脉络,研究必修阶段化学键理论的学习要求,按照“宏观辨识离子键与共价键的存在、微观探析离子键与共价键的实质、深刻理解离子键与共价键的关系”的认知顺序进行教学实践;提出化学键教学要正确认识化学键理论模型与实物模型的不同功能,认真厘清离子键和共价键的区别和联系等观点。
关键词:化学键;离子键;共价键;认知模型
文章编号:1008-0546(2022)12-0062-04
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.12.016
一、化学键理论的建立和发展脉络
化学键是区别于分子间作用力的一种粒子间强烈的相互作用。化学键主要包括离子键、共价键和金属键,无论是阴阳离子的相互吸引与排斥、原子间的电子云重叠、金属阳离子和自由电子的相互作用,其本质都是静电作用,不同的只是作用方式和程度有所差异。化学键理论能够从微观层面较好地认识物质分类、解释物质性质与结构的关系、理解化学反应本质与能量变化,是落实宏观辨识与微观探析的核心理论。
从贝采里乌斯(1812年)的电化二元学说→富兰克兰(1852年)的原子价→维尔纳(1893年)的配位理论→科赛尔(1916年)的离子键→路易斯(1916年)的共价键→海特勒和伦敦(1927年)的价键理论(VB法)→鲍林与斯莱特(193 1年)的杂化轨道理论→马利肯(1932年)的分子轨道理论→比约克斯腾和耶格尔(1949年)的化学键理论。[1,2]人们对化学键的认识由模糊到清晰、静态到动态、定性到定量,经历了不断发展和完善的过程,理论体系日趋完善。同时,随着X射线、波谱、扫描隧道显微镜等技术应用于研究分子结构,人们对化学键的认识越来越深入,已经能够捕捉到化学键形成的过渡状态和分子结构,离揭开粒子的真实运动状态越来越近。
二、必修阶段化学键理论的学业质量水平
2017年版(2020年修订)普通高中化学课程标准必修内容要求:认识构成物质的微粒之间存在相互作用,结合典型实例认识离子键和共价键的形成,建立化学键概念,能判断简单离子化合物和共价化合物中的化学键类型。知道分子存在一定的空间结构。认识化学键的断裂和形成是化学反应中物质变化及能量变化的主要原因。[3]金属键、共价键的本质与分子空间构型、化学键特点及物质性质等将在选修模块学习。学业质量水平为:【水平1-2】能从物质的组成、构成微粒、主要性质等方面解释或说明化学变化的本质特征;【水平2-1】能从构成物质微粒、化学键等方面说明常见物质的主要性質;能用模型、符号等方式对物质的结构及其变化进行综合表征。
必修阶段,化学键安排在元素周期表(律)之后,[4]其目的是引导学生从元素在周期表中的位置分析原子结构,通过原子得失电子趋势认识粒子间的相互作用,从微观视角分析离子键和共价键的形成过程,理解化学反应本质。鉴于此,教学时可选择学生熟悉的典型离子(共价)化合物为研究对象,根据学生的认知规律和知识逻辑,按照“宏观辨识离子键与共价键的存在、微观探析离子键与共价键的实质、深刻理解离子键与共价键的关系”的认知顺序,让学生从宏观辨识走向微观探析,用证据揭示化学键的强烈相互作用的本质内涵,通过原子结构特点分析形成化学键的类型,运用符号进行表征并解释物质性质和反应本质,体会化学键的应用价值。
三、必修“化学键”课堂教学片段
1.宏观辨识离子键与共价键的存在
【师】展示元素钠、氯的相关物质图片:Na、Na2O、Na2O2 NaOH、NaCl、HCl、CI2等。
【生】思考交流。以Na生成NaCl、HCl为例,说出其实验现象以及NaCl、HCl的物理性质。
【师生】Na在Cl2中燃烧发出黄色火焰,产生大量白烟;纯净的H2在CI2中安静燃烧,发出苍白色火焰,集气瓶口产生白雾。常温下,NaCl是固体、易溶于水;HCl是气体、极易溶于水。
【师】请解释NaCI、HCl的水溶液能导电,熔融的NaCl能导电而液态的HCl不导电的原因。
【生】NaCl、HCl的水溶液,熔融的NaCl导电是因为其电离产生了自由移动的离子,而液态的HCl不导电说明其没有电离出自由移动的离子。
【师生】图1是Na+和CI形成NaCl的堆积模型。每个Na+结合6个Cl-,每个Cl-结合6个Na+;图2是由图1抽象出的NaCl晶胞(最小结构单元)模型;图3是未加热前同一层中Na+和Cl-的排列情况,Na+和Cl-不能自由移动;图4是高温下,Na+和CI-可以自由移动。
【师】由上面分析知,NaCl是由Na+和CI构成的,Na+和cr之间存在强烈的相互作用——离子键,离子键使得Na+和CI不能自由移动;当其溶于水或熔融时,离子键被破坏,Na+和CI能自由移动。HCl由分子构成,H和Cl之间存在强烈的相互作用——共价键,当其溶于水时,共价键被破坏,而液态时共价键没有被破坏。
设计意图:从学生熟悉的物质和实验现象引入粒子间存在相互作用(离子键和共价键),以NaCl、HCl的导电性实验作为证据,启发学生思考宏观现象背后的微观结构,以此激发学生的学习兴趣并培养其宏观辨识与微观探析、模型认知与证据推理等化学核心素养。
2.微观探析离子键与共价键的实质
【师】请从微观视角解释NaCl、HCl的形成过程。
【生】画出H、Na、Cl的原子结构示意图,交流讨论。
【师生】根据原子核外电子排布知,钠原子容易失去最外层1个电子达到8电子稳定结构,氯原子容易得到1个电子达到8电子稳定结构。当钠原子将最外层1个电子转移给氯原子时,钠原子变成带1个单位正电荷的Na+,氯原子变成带1个单位负电荷的Cl-。带相反电荷的Na+与CI相互吸引,但由于双方原子核、核外电子之间又存在斥力,Na+与CI不可能无限接近。当引力等于斥力时,Na+与CI处于一种静电平衡状态,形成化合物NaCl(见图5),形成过程用电子式表示为:Nax7-C1:~}Na+[x Ci:]一。这种带相反电荷离子之间的相互作用称为离子键,由离子键构成的化合物称为离子化合物。
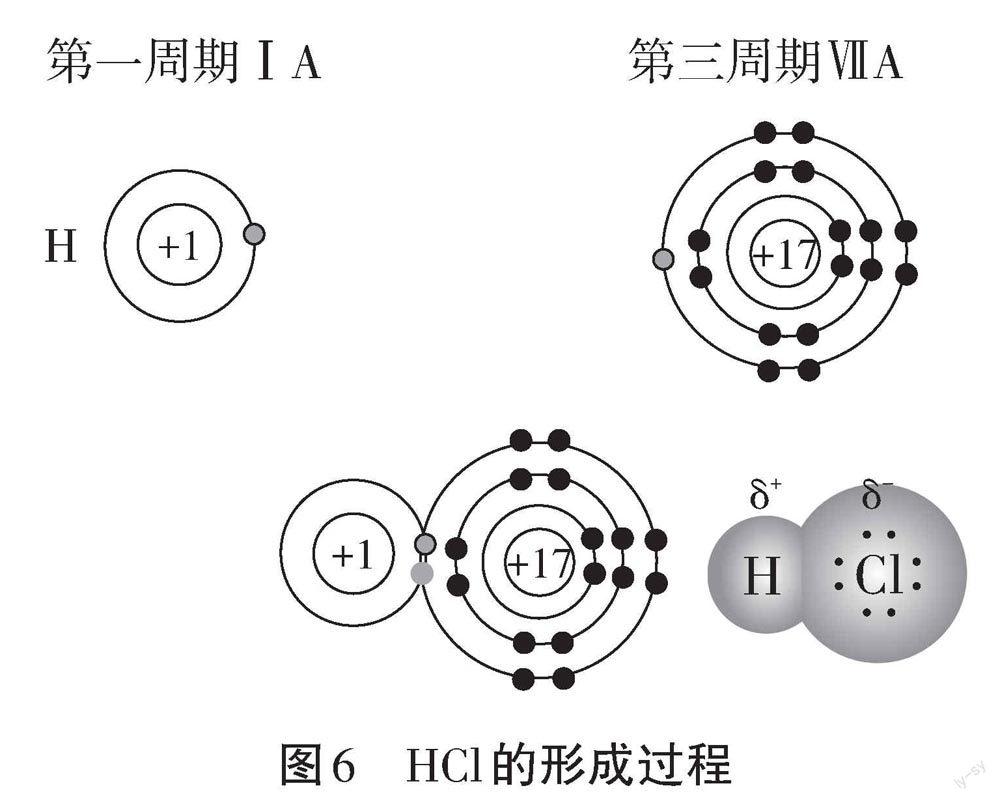
【师生】氢原子、氯原子都不容易从对方获得电子。当氢原子将1个电子和氯原子最外层的1个电子形成共用电子对,围绕双方原子核高速运动,氢原子和氯原子都达到稳定结构,从而形成HCl分子(见图6),形成过程用电子式表示为:Hx+.Cl: -~H i Cl:。原子间通过共用电子对所形成的相互作用称为共价键,以共用电子对形成分子的化合物称为共价化合物。
【师】氢原子和氯原子对共用电子对的影响程度是否相同?
【生】氯原子得电子能力比氢原子强,共用电子对偏向氯原子、偏离氢原子,氯原子带部分负电荷(一1价)、氢原子带部分正电荷(+1价),共用电子对发生偏移的共价键为极性共价键(极性键)。
【师】请根据H2(g)+Cl2(g)=2HCl(g)反应的能量变化示意图(见图7),[3]从化学键变化的视角分析化学反应的本质。
【生】交流讨论。化学反应的实质是旧化学键断裂和新化学键形成的过程。断裂化学键要吸收能量,形成化学键要释放能量。
【师】2015年,美国科学家利用X射线激光第一次看到了化学键形成的过渡状态:两个原子开始形成一个弱键,处在变成一个分子的过程中,催化剂能抓住CO分子和氧原子,让它们彼此靠近,更容易地结合形成CO2分子(见图8)。设计意图:从Na、Cl、H的原子结构特点,分析NaCl、HCl的形成过程,揭示离子键和共价键的实质、运用符号正确表征其形成过程,从化学键视角认识物质分类、性质与结构的关系,理解化学反应与化学键的内在联系。
3.深刻理解离子键与共价键的关系
【师】请推测形成离子键、共价键的元素的原子结构特点。
【生】活泼金属(IA、ⅡA)与活泼非金属(ⅥA、ⅦA)元素之间趋于形成离子键,非金属元素原子间趋于形成共价键。稀有气体原子因为最外层达到稳定结构,单质中不存在化学键。
【师】除了根据原子结构最外层电子判断元素原子形成化学键的类型,化学家还通过电负性来判断离子键和共价键。
【资料卡片】元素的电负性(见表1):判断金属性和非金属性强弱的依据,电负性越大,原子得电子的能力越强。经验规律:如果两成键元素之间的电负性差值大于1.7,它们通常形成离子键;小于1.7通常形成共价键。
【生】根据表1电负性数值计算CsF、NaCl、MgCI2、AICl3、HCl中成键原子的电负性差值(填人表2),并通过经验规律来判断形成的化学键类型。
CsF、NaCl、MgCl2、AICI3、HCl中成键原子的电负性差值分别为3.1、2.1、1.8、1.5、0.9。依据电负性经验规律,得出AICl3、HCI是通过共价键形成的。
【师】提供文献资料:CsF、NaCl、MgCI:、AICl,、HCl离子键百分数分别约为92%、67%、55%、43%、19%。[6]当成键原子离子键成分较大时,通常当作离子键;当成键原子共价键成分较大时,通常当作共价键。离子键可以看作是极性很强的共价键,此时共用电子对基本为得电子能力强的原子独有。
设计意图:离子键、共价键是两种不同的化学键,其主要区别是成键粒子和成键方式,但二者并不是绝对分割的。因此,提供电负性数据与物质离子键百分数,让学生通过数据理性分析离子键与共价键的关系,深刻理解共价键(非极性键、极性键)和离子键的内在变化规律。
四、教学思考
1.正确认识化学键理论模型与实物模型的不同功能
化学键的理论模型是从微观视角对粒子间相互作用的本质分析,为了帮助学生理解抽象的理论模型,教学时通常采用实物模型来模拟化学键。如,填充(比例)模型、球棍模型、晶胞模型,以及各种图式(原子或离子结构示意图、电子式、结构式、电子云等)。这些实物模型主要是通过直观模拟来帮助学生理解微粒间的相互作用,化抽象为具体、变微观为宏观。教师在使用时要注意静态模型与真实运动状态之间的差异,引导学生通过观察静态模型去想象粒子动态的成键过程。如,电子式只是一种简化的图式,实际上每个电子的具体运动状态要用4个量子数表示,共用电子对要通过电子云重叠来描述,切不可让学生形成实物模型就是粒子真实运动状态的错误认识。
2.认真厘清离子键和共价键的区别和联系
离子键和共价键是成键粒子和成键方式不同的两种化学键,具有各自独特的属性和特点,二者并不是绝对独立分割的,这是电子的真实运动状态所决定的。系统认识化学键,需要准确理解共价键和离子键之间的区别和联系,电子云重叠形成共价键,阴、阳离子相互作用形成离子键,在阴、阳离子的相互吸引和排斥过程中也存在电子云的重叠。电负性差值和离子键百分数(表1、表2)说明离子键和共价键没有绝对的界限。从非极性键到极性键,共用电子对受成键原子的作用程度在改变,从无偏移到发生偏移,当极性键强到几乎完全为一方原子獨有时就变成了离子键。可见,离子键和共价键是相对而言的,没有100%的离子键,从非极性键一极性键一离子键是成键原子得失电子能力的具体反映。
3.系统建构必修学习阶段化学键的认知模型
人们认识物质世界总是遵循从特殊到一般、从宏观到微观、从现象到本质的顺序。化合物中不同原子(离子)间的数目比,宏观表现为化合价,微观则是电子得失或电子对偏移。根据化学键类型可以判断化合物类型,这是物质分类的延伸,大多数盐、活泼金属氧化物、强碱通过离子键构成,属于离子化合物,熔融状态能够电离;非金属氧化物、弱碱、酸、大多数有机物通过共价键形成,属于共价化合物,熔融状态不能导电。因此,必修阶段化学键教学要按照“元素位置→元素原子结构→得失电子趋势→粒子间的相互作用→化学键类型→物质类别→物质性质→化学反应本质”的认识思路,从宏观辨识(物质性质、物质类别、成键元素),微观探析(成键微粒、成键本质、反应实质),符号表征(电子式、结构式、模型)等角度系统建构化学键的认知模型(见图9),让学生真正理解化学键的本质和价值。
参考文献
[1]杨承印.化学键理论的发展概况[J].化学教育,1997(7):11-13.
[2]朱玉军,李宗和.化合价的历史演变[J].化学教育,2009(11):80-82.
[3] 中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社.2020.
[4]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.化学(必修第一册)[M].北京:人民教育出版社, 2019.
[5]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.化学(选择性必修1)[M].北京:人民教育出版社.2020.
[6] 北京师范大学,华中师范大学,南京师范大学.无机化学(第四版上册)[M].北京:高等教育出版社,2002.
