EGFR-TKIs在晚期NSCLC中的耐药机制及临床应对策略的研究进展
2022-05-30焦赵爽王萍
焦赵爽 王萍
2020年,我国肺癌新发病例82 万、死亡71 万,居各类癌症首位[1]。非小细胞肺癌(non-smallcell lung cancer,NSCLC)是肺癌最主要的亚型,约占85%[2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)基因是NSCLC 最常见的驱动基因,约占51.4%[3]。酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs),能竞争结合ATP 结合位点,阻断EGFR磷酸化,促进细胞凋亡。2003年首个EGFR-TKI 吉非替尼(Gefitinib)获FDA 批准用于治疗晚期NSCLC,由此开启了肺癌的精准医疗时代。针对EGFR突变阳性的患者,EGFR-TKIs显著提高了患者的疗效、改善生活质量。然而大多数患者在服用一段时间后不可避免的发生耐药,疾病再次进展。不同EGFR-TKIs 耐药机制不尽相同,可分为EGFR依赖性和非依赖性。因此,EGFR-TKIs 治疗过程中,再次组织活检、血浆基因监测有助于发现特定的耐药机制,指导有效的临床干预。本文旨在对近年来EGFR-TKIs 耐药机制及耐药后可行的治疗策略进行综述,为晚期NSCLC 治疗提供参考。
1 EGFR 突变概述
EGFR突变主要集中在18~21 外显子,其 中19del 和L858R 最为常见(约90%),这部分患者对EGFR-TKIs 响应较好,故常称为经典突变。除此之外,还有一些占比较小且种类繁多的非经典突变,包 括G719X、E709X、18del、19ins、20ins、S768I、T790M、L861Q 等,占所有EGFR突变的10.7%~16%[4]。此类患者除T790M 和20ins 外,对一代和二代EGFR-TKIs 均敏感。T790M 和20ins 是传统的耐药位点,T790M 阳性患者首选第三代EGFR-TKIs。20ins 是非经典突变中最常见的突变 类型,约占所有EGFR突变的4%~10%[5],除A763_Y764insFQEA 外,对EGFR-TKIs 均表现为耐药。针对20ins 突变的患者,当前仅埃万妥单抗获FDA 批准用于化疗失败后的二线治疗[6]。此外,正在研发的Poziotinib(NCT05045404)、Mobocertinib(NCT04535557)以及国产新药 PLB1004(CTR20201030)等,针对20ins 突变均展现出较好的抑制活性。
2 EGFR 依赖性耐药机制及应对策略
2.1 获得性T790M 突变
被称为“关守突变(gatekeeper mutation)”的T790M 是一/二代EGFR-TKIs 获得性耐药的最常见类型,约占50~60%[7]。AURA3 试验[8]中,T790M 阳性的肺腺癌患者,与化疗相比,二线奥希替尼治疗可显著延长PFS(10.1vs4.4 个月)。FLAURA 研究[9]中,一线使用奥希替尼,中位PFS达18.9 个月,患者总生存期达40 个月以上,显著高于一代TKIs 的30.6 个月。
针对T790M 突变的第三代EGFR-TKIs,除奥希替尼外,还有阿美替尼、伏美替尼、艾维替尼、BPI-7711 等,见图1、表1。近期,阿美替尼和伏美替尼已先后获NMPA 批准用于T790M 突变的晚期NSCLC 患者的二线治疗,而拉泽替尼在T790M突变的NSCLC 的Ⅰ/Ⅱ期试验中也显示出良好的安全性和抗肿瘤活性(总缓解率为57.9%,疾病控制率为89.5%)[10],为T790M 耐药突变的晚期NSCLC 患者提供更多的选择。
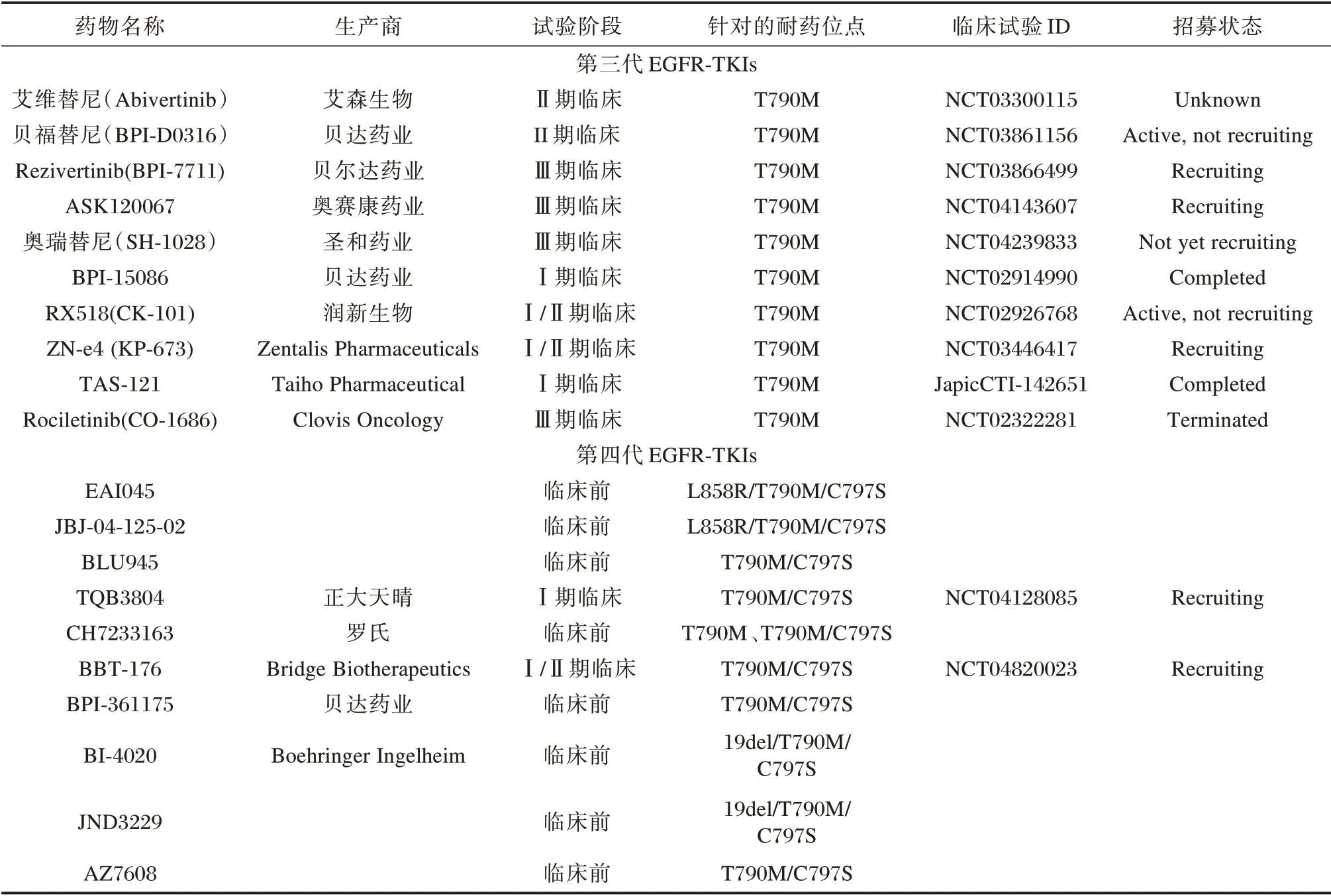
表1 针对特定EGFR 耐药突变而研发的新型第三代、四代EGFR-TKIs(尚未获批)Table 1 New third-and fourth-generation EGFR-TKIs developed for specific EGFR resistance mutations(not yet approved)

图1 已获批上市的EGFR-TKIs 盘点Figure 1 Summary of EGFR-TKIs that have been approved for the treatment of advanced NSCLC
2.2 C797X 突变
C797X(主要是C797S)突变是目前报道的奥希替尼最常见的EGFR依赖性耐药机制。在AURA3 试验[8]中,二线奥希替尼治疗进展的患者中14%~25%检测出C797S 突变。而一线奥希替尼进展后C797S 突变的发生率较低,仅7%[9]。这些患者仍保留了T790M 突变,表现为EGFR敏感突变/T790M/C797S 三重突变[11]。研究显示,66%的T790M/C797S 突变表现为顺式突变(位于相同等位基因),而34%为反式突变[12]。目前对于C797S耐药突变的应对策略主要分为三个方面:首先,在不存在T790M 突变的情况下,仅表现为C797S 的NSCLC 患者仍对一/二代EGFR-TKIs 敏感;其次,当T790M 与C797S 为反式突变(在不同等位基因)时,可将三代TKIs 与一代或二代联用。Arulananda 等[13]首次报道了1 例二线奥希替尼治疗后出现T790M/C797S 反式突变,改用奥希替尼联合吉非替尼治疗后,病情迅速得到缓解;然而,当T790M/C797S 为顺式突变时,患者对现有的EGFR-TKIs 均表现出耐药性[14]。除奥希替尼外,据报道其他三代EGFR-TKIs,如Lazertinib[10]、olmutinib、abivertinib 等,也对C797S 突变耐药。针对三代EGFR-TKIs 的耐药问题,第四代EGFR 靶向药正在研发或已处于临床试验当中,如JBJ-04-125-02 体内实验显示对L858R、L858R/T790M 及L858R/T790M/C797S 突变均具有较强的抑制作用,且能单药使用,具有良好的应用前景[15]。值得注意的是,ALK抑制剂布加替尼对C797S 介导的耐药也具有良好的体内活性[16]。
2.3 其他EGFR 依赖性耐药机制
G796X 是另一种少见的EGFR 三级突变,目前报道的主要为G796R/S/D。G796X 是一种被称为“溶剂前沿(solvent-front)”的突变,通过干扰TKIs 附着,而使其无法发挥抗肿瘤作用。Klempner[17]等报道了1 例二线奥希替尼治疗后出现EGFRL858R/T790M/cis-G796S 突变。Lin[18]等计算机模拟显示G796 突变干扰了奥希替尼与EGFR激酶结构域的苯基芳环结合,从而诱发耐药。研究发现在缺乏T790M 突变的情况下,G796X 突变表现为对一/二代TKIs 敏感,而T790M 与G796X 共存时,则表现为EGFR-TKIs 耐药。在临床工作中,本团队首次发现1 例二线奥希替尼治疗进展后出现EGFRL858R/T790M/cis-G796S/del 多重突变(如图2),改用化疗+贝伐单抗后,患者病情趋于稳定。

图2 二线奥希替尼耐药后出现EGFR L858R/T790M/cis-G796S/del 多重突变Figure 2 EGFR L858R/T790M/cis-G796S/del multiple mutations after second-line osimertinib resistance
在奥希替尼治疗进展的后续分析中,研究者还观察到其他与耐药相关的EGFR罕见突变,如L718Q、G724S、L769X、L792H 等,这些突变主要集中在EGFR的18 和20 号外显子,有趣的是,在无T790M 突变共存时,它们对一/二代EGFR-TKIs敏感。另有研究报道,三代TKIs,如奥希替尼、rociletinib[19],二线治疗进展后出现了EGFR野生型等位基因的扩增。Watanabe[20]等报道了一项临床前研究,体外实验显示HSP90 抑制剂能克服EGFR蛋白过表达介导的三代EGFR-TKIs(奥希替尼和TAS-121)耐药。
3 非EGFR 依赖性耐药机制及应对策略
3.1 MET 扩增
间质表皮转化因子(Mesenchymal-epithelial transition factor,MET)基因扩增作为NSCLC 原发驱动基因时发生率较低,仅2%~4%,但却是EGFRTKIs 治疗过程中最常见的非EGFR依赖性耐药原因,其耐药机制可能与STAT、MAPK 和PI3K-Akt 等旁路激活有关。Wang[21]等发现,对于EGFR-TKIs 治疗进展后出现MET扩增的患者,可联合克唑替尼。值得注意的是,MET14 号外显子跳跃突变(METexon 14 skipping)常作为原发驱动基因,在肺腺癌中约占3%~4%,而继发于EGFR-TKIs 治疗进展后者却不多见。Suzawa[22]等最新报道了1 例EGFRL858R 的肺腺癌患者,一线厄洛替尼治疗进展后出现T790M 和METexon 14 skipping 突变,奥希替尼联合克唑替尼取得了较好的临床疗效。
3.2 HER2 扩增
AURA3[8]和FLAURA[9]研究中奥希替尼耐药后分别有5%和2%的患者出现人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER2)基因扩增。针对HER2扩增介导的EGFRTKIs 耐药,EGFR-TKIs 和HER2抑制剂联用可能使患者获益。一项临床前研究[23]显示,HER2扩增驱动的耐药细胞系对奥希替尼联合T-DM1(曲妥珠单抗-药物偶联物)敏感。
3.3 RAS-RAF-MEK、PI3K-Akt 通路激活
RAS-RAF-MEK 位于EGFR信号通路的下游,激活后能促进细胞增殖且不受EGFR 调控。该通路的异常活跃与KRAS突变或扩增、NRAS突变、BRAFV600E 突变等有关。体外实验[24]显示,MEK抑制剂司美替尼或CI-1040 联合吉非替尼能克服ERK 通路持续激活介导的TKIs 耐药。此外,Ho[25]等也发现在BRAFV600E 介导的奥西替尼耐药中联用康奈非尼(BRAFV600E 抑制剂)时效果显著。PI3K-Akt 旁路是另一条重要的EGFR-TKIs 耐药通路,可被PIK3CA突变或扩增和PTEN失活激活。PIK3CA扩增或突变占一代EGFR-TKIs 耐药的3~5%,和奥希替尼耐药的5~12%[26]。体外研究表明,PI3K 抑制剂的联合使用是此类患者的有效治疗策略[27]。
3.4 其他罕见基因改变
二线奥希替尼耐药后,在4~7%的患者中发现了罕见的驱动基因融合,包括RET(RET-ERC1、RET-CCDC6、RET-NCOA4),BRAF(BRAF-AGK、BRAF-ESYT2、BRAF-PCBP2、BRAF-BAIAP2L1),NTRK1-TPM3,ROS1-GOPC和FGFR3-TACC3等[26]。研究显示[28],奥希替尼联合BLU-667(RET抑制剂)对RET融合介导的EGFR-TKIs 耐药的患者有效,提示不同的TKIs 联用或许能绕开这些耐药机制而发挥抗肿瘤作用。
3.5 组织学和表型转化
组织学转化是EGFR-TKIs 重要的获得性耐药机制,常表现为肺腺癌患者接受EGFR-TKIs 治疗后,组织学类型转变为小细胞癌(SCLC),即SCLC 转化。一代EGFR-TKIs 耐药的患者中14%发生了SCLC 转化[29]。而一线或二线奥希替尼治疗时,SCLC 转化发生率相似为4~15%。与基因突变不同,明确组织学转化的发生与否必需依赖再次活检而非血浆分析。SCLC 转化的机制目前尚不清楚,但有研究显示,抑癌基因RB1、TP53可能发挥重要作用。Offin[30]等发现,EGFR/RB1/TP53突变共存时18%的患者发生了SCLC 转化,而仅EGFR突变的患者中却没有观察到SCLC 转化的发生。因此,血浆基因分析时发现RB1或TP53基因改变的患者,在无其他明确耐药机制存在的情况下,应考虑SCLC 转化的可能。
癌细胞通过丢失E-钙粘蛋白而失去上皮特征,导致波形蛋白表达增加并转化为间充质表型,即上皮间质转化(EMT)。最新研究显示[31],EMT与EGFR-TKIs 获得性耐药有关。多种调节因子参与EMT 的发生,其中SNAIL、ZEB 和TWIST 家族发挥重要作用[32]。Yochum[33]等发现TWIST1 过表达与一代和三代EGFR-TKIs 耐药有关,随后的体内实验证明TWIST1 抑制剂harmine 能有效克服EMT 介导的EGFR-TKIs 耐药。
4 前景与展望
EGFR-TKIs 在EGFR突变的晚期NSCLC 患者的治疗中取得了显著成效。但耐药是其不可避免的临床结局。尽管临床前研究在克服耐药性方面取得了显著进展,但铂类化疗仍是目前唯一指南推荐的用于奥希替尼耐药的治疗手段。
当前EGFR-TKIs 耐药机制及临床应对策略仍是研究的热点。连续的血浆基因监测可能有助于更早识别获得性EGFR依赖性和非依赖性耐药突变的发生,且不受空间异质性的影响。但与组织样本不同的是,血浆监测可能存在灵敏度低、无法发现组织学转化等问题。针对奥希替尼耐药的第四代EGFR-TKIs,如EAI045、JBJ-04-125-02 和BLU-945等,以及不同抑制剂的联合使用,如吉非替尼与其他靶向药物(如MEK 抑制剂等),表现出了显著的肿瘤抑制活性,但有效性和安全性仍需在真实世界中得到进一步验证。因此,未来还需要更多的研究,以丰富我们对肿瘤异质性以及获得性耐药的复杂致癌信号通路的理解,从而指导临床决策,预测并最终规避疾病进展。
