过氧化物消毒剂消毒效力验证
2022-05-28李晓婷靳朝晖曲晓蒙秦焕美潘亚华
*李晓婷 靳朝晖 曲晓蒙 秦焕美 潘亚华
(北京民海生物科技有限公司 北京 102600)
采用实验室消毒剂效力硬表面测试方法,使用标准试验微生物在使用浓度下将消毒液覆于表面,在规定时间内,确定挑战菌对数减少情况,证明消毒液在需要作用的表面能够有效降低微生物水平的能力,确定消毒剂的有效性和适用性。
1.环境菌株筛选
生产车间环境控制尤为重要,本次验证根据洁净区常见微生物的种类以及出现的频率、耐消毒剂程度选择环境常见代表菌[1],对近1年厂区内所有洁净区环境监测出现的未知菌进行菌种鉴定,鉴定出的种属有革兰氏阴性杆菌(G-)、革兰氏阳性球菌(G+),对环境常见菌的种属及出现频率进行统计如下:
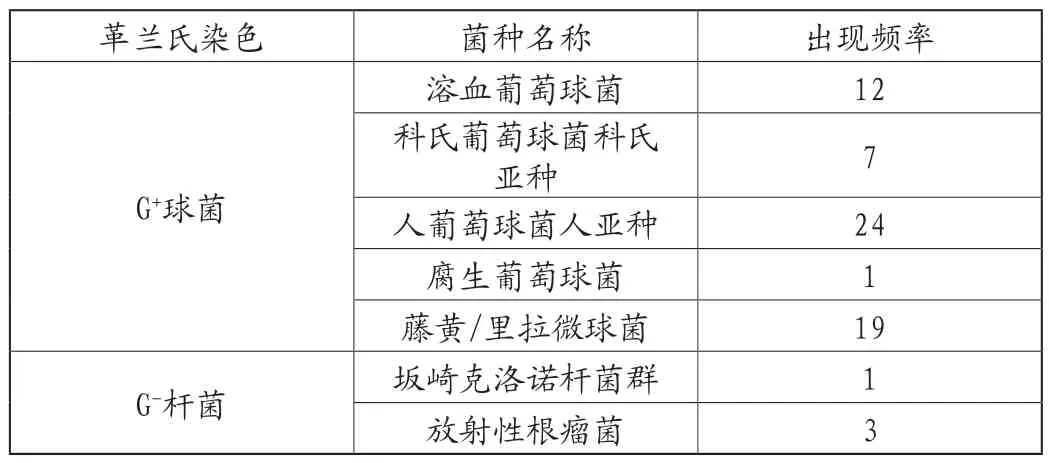
表1 环境常见菌的种属及出现频率表
根据车间环境菌出现频率和种属选择人葡萄球菌人亚种(G+)和放射性根瘤菌(G-)进行杀毒效果测试。
2.试验验证方法
此次验证采用载体喷雾法[2]。采用实验室消毒剂效力硬表面测试方法,使用标准试验微生物在使用浓度下将消毒液覆于表面,在规定时间内,确定挑战菌对数减少情况,证明消毒液在需要作用的表面能够有效降低微生物水平的能力,确定消毒剂的有效性和适用性。
洁净区涉及的常见材料有不锈钢、PVC、软帘、硬帘、玻璃、彩钢板,选取此6种材质进行试验,同时参照清洁卫生管理要求,用消毒剂作表面消毒湿润5min,以确认复方过氧化物的消毒效力。
本次试验选取标准菌株中较难杀灭的枯草芽孢杆菌、黑曲霉、白色念珠菌和环境菌中出现频次较高的人葡萄球菌人亚种、放射性根瘤菌进行验证。
(1)物料信息
①消毒剂
复方过氧化物消毒剂:纯化水=1:19(20倍稀释)。
②中和剂
本方案采用化学中和法[2]。在消毒剂与微生物作用达到规定时间的终点时,加入足量中和剂将残留消毒剂迅速中和,使其不再持续抑制或杀灭微生物的方法。
中和剂用于消除试验微生物与消毒剂的混悬液中以及微生物表面上残留的消毒剂(即:在一定的反应时间后终止消毒剂对微生物的杀灭作用)。根据“过氧化氢消毒液的中和剂筛选试验研究(1001-7658(2010)02-0132-03)杨洪等”选取10g/L硫代硫酸钠[3](例:硫代硫酸钠10g,注射用水定容至1L。)作为中和剂。
(2)试验前准备
①材料的准备
A.培养基:胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)、沙氏葡萄糖琼脂培养基(SDA)。B.稀释液:灭菌的0.9%氯化钠溶液。C.载体:不锈钢、PVC、软帘、硬帘、玻璃、彩钢板,6种材质板:长×宽:15cm×15cm的材质板各3块。D.中和剂:10g/L硫代硫酸钠溶液,0.22μm滤膜除菌过滤后备用。E.TPS:胰蛋白胨1.0g、氯化钠8.5g,用900mL纯化水溶解,并调节pH值在7.0±0.2,最终用纯化水定容至1000mL,121℃、30min湿热灭菌后使用。F.挑战菌株:枯草芽孢杆菌、白色念珠菌、黑曲霉、人葡萄球菌人亚种(G+)、放射性根瘤菌(G-)。G.消毒剂:使用纯化水配制成适宜浓度,装入无菌喷瓶中备用。H.其他试验设施和条件:已校验的1.0mL灭菌移液枪及所配枪头;1次性10mL刻度吸管;生物安全柜;振荡器;培养箱;记号笔;无菌酒精;无菌擦片;棉拭子。
②菌悬液制备[4-5]
A.芽孢菌悬液的制备。取QC储备的枯草芽孢杆菌第2代菌种,接种于胰酪大豆胨液体培养基,于30~35℃培养18~24h,即为第3代培养物。用10.0mL吸管吸取5.0~10.0mL第3代的18~24h胰酪大豆胨液体培养物,接种于平皿中胰酪胨大豆琼脂培养基表面,将其摇动使菌液布满胰酪胨大豆琼脂培养基的表面,再将多余肉汤培养物吸出,将平皿置于30~35℃温箱内,培养5~7d。固定染色在显微镜(油镜)下进行镜检。当芽孢形成率达95%以上时制备芽孢悬液。芽孢液于80℃水浴10min以杀灭残余的细菌繁殖体,待冷至室温后于2~8℃冰箱中备用。芽孢悬液在使用时,应先进行活菌培养计数。实验用菌悬液的含菌量根据计数结果和实验要求进行调配。
B.白色念珠菌悬液的制备。取QC储备的白色念珠菌第2代菌种,接种于沙氏葡萄糖琼脂培养基,于20~25℃培养2~3天,即为第3代培养物。试验时,取第3代斜面培养物在沙氏葡萄糖琼脂斜面上连续传代,方法与第3代相同,制备第4代培养物。
C.黑曲霉悬液的制备。取QC储备的黑曲霉第2代菌种,接种于沙氏葡萄糖琼脂培养基,置20~25℃培养箱中培养5~7天,即为第3代培养物。取第3代平板培养物接种于沙氏葡萄糖琼脂培养基平皿中,20~25℃培养5~7天。即为第4代培养物。
D.人葡萄球菌人亚种(G+)、放射性根瘤菌(G-)。取QC冻存的人葡萄球菌人亚种菌种(或放射性根瘤菌),接种于胰酪大豆胨液体培养基,于30~35℃培养18~24h。用10.0mL吸管吸取5.0~10.0mL的18~24h胰酪大豆胨液体培养物,接种于胰酪胨大豆琼脂培养基表面,将其摇动使菌液布满胰酪胨大豆琼脂培养基的表面,再将多余肉汤培养物吸出,将平皿置于30~35℃温箱内,培养18~24h。培养物用10.0mL吸管加10.0mL稀释液于平皿中,以L棒轻轻推刮下菌苔。吸出第一批洗下的菌悬液,再向瓶内加5.0mL稀释液,重复洗菌一遍。将第一和第二批洗下的菌悬液集中于一含玻璃珠的无菌三角烧瓶中,振摇5min,打碎菌块,使成均匀的菌悬液。注:以上菌悬液制备完成后在2~8℃储存,当天使用不得过夜。
③菌片制备
用清洁剂清洁每一材质板,并用纯水仔细润洗;用75%乙醇消毒后晾干备用。在每种材质板上标记直径为10mm圆形区域,每个区域认为是一个载体片,在Nd和Nc染菌。吸取0.01mL菌悬液点接到载体片表面,并用接种环使菌液在表面充分铺展开来(1×106~5×106CFU/片)。
每种材质按上图染菌,孔间间距≥5cm。以等边三角形排列。
3.结果和讨论
(1)中和剂效力确认

表2 中和剂效力试验结果
①中和剂毒性组NC
用于验证中和剂本身是否会对微生物产生抑制/杀灭作用。吸取0.1mL浓度为1×106~5×106cfu/mL的试验菌悬液于试管内,加入0.4mL TPS(模拟代替消毒液),混匀。加入4.5mL中和剂,作用10min。计数得NC。
②中和产物毒性组NT
中和剂与消毒剂混合之后形成的体系称为“中和产物”,本组用于验证中和产物是否会对微生物产生抑制/杀灭作用。吸取0.1mL浓度为1×106~5×106cfu/mL的试验菌悬液于试管内,吸加4.9mL中和产物溶液(以0.4mL消毒剂加4.5mL中和剂,作用10min配制而成)于试管内,混匀。作用10min,计数得NT。
③对照组N0
菌数对照,用于验证在无任何抑菌效果条件下(使用TPS)相应的微生物数量,该数值用于与前2组结果的对比评判。吸取0.1mL浓度为1×106~5×106cfu/mL的试验菌悬液于试管内,吸加0.4mLTPS于试管内,混匀。加入4.5mL稀释液,作用10min,计数得N0。
④中和剂验证计算
记录每个稀释度1.0mL样品的菌落数。选取一个合适梯度的读数,该梯度的2块平板的读数(记为a和a’)都应处于30cfu至300cfu之间(霉菌为10cfu至100cfu之间)。然后用以下公式计算NC、NT和N0,中和剂毒性试验记为NC,中和剂效力试验记为NT,对照组试验记为N0:
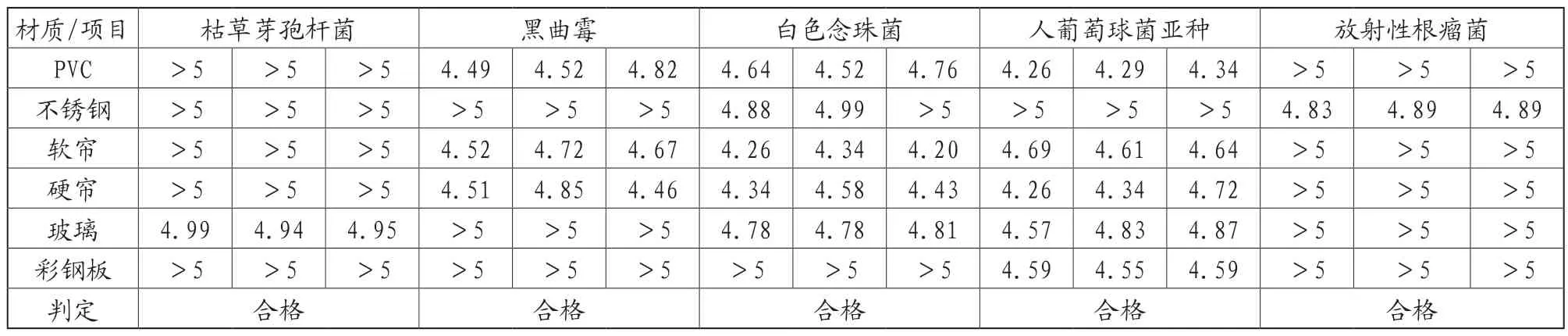
表3 挑战菌水平下降对数单位结果统计表

其中:d=稀释液的稀释系数;NC=log10中和剂毒性测试中初始混合液菌浓度;NT=log10中和剂效力测试中初始混合液菌浓度;N0=log10对照组测试中初始混合液菌浓度。
⑤可接受标准[6]
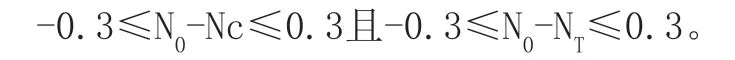
(2)硬面测试
将每种菌所染载体片分开进行试验。每批试验以同一浓度消毒剂溶液(或TPS)对Nd(Nc)组菌片进行均匀喷雾。
操作:将消毒剂喷洒在载体菌片的表面,作为消毒剂效力测试试验(Nd);将TPS溶液喷洒在载体片的表面,作为阳性对照(Nc);另选取未染菌的载体片,将TPS溶液喷洒在载体片表面,操作与阳性对照试验完全一致,作为阴性对照。阴性对照试验结果不允许有菌生长。
待试验菌(或TPS)与消毒剂相互作用至规定时间,立即用无菌拭子擦拭各消毒后的载片区域,然后再将拭子头折断投入相应的预装有5mL中和剂(对于Nd组)或者5mL稀释液(对于Nc组)的试管中,中和10min后,通过充分震荡的方法将拭子上的微生物全部洗脱至试管中。
然后移取1mL试管中的液体到已标记过的培养皿中做平板计数,每管接种2个平皿。对于菌数对照组,则按照10倍稀释的操作依次稀释3~4支试管(预装有4.5mL稀释液)并根据预计菌液浓度选择不少于2个稀释梯度进行平板计数。
白色念珠菌倒置于20~25℃培养1~3天,霉菌应将平板正置于20~25℃培养3~7天,芽孢倒置于30~35℃培养3~7天,人葡萄球菌人亚种(G+)倒置于30~35℃培养1~3天,放射性根瘤菌(G-)倒置于30~35℃培养1~3天,抛弃那些长的太多不能计数的平板,将剩余的平板计数。
(3)计算与结果表达
①记录每个梯度1.0mL样品的菌落数(a,a’)。a和a’的平均值都应处于30cfu至300cfu之间(霉菌为10cfu至100之间),然后用以下公式计算Nc和Nd,即每个载体平面上恢复生长的菌落数的对数值。
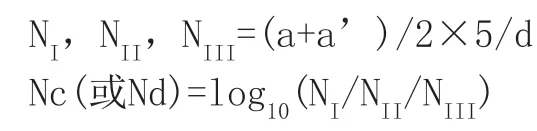
其中:d=稀释液的稀释系数;NI,NII,NIII阳性对照或消毒剂测试中每个菌片上恢复生长的菌落数;Nc=log10阳性对照中每个菌片上的菌落数;Nd=log10消毒剂测试中每个菌片上的菌落数。
②用以下公式计算Log下降值。Log下降值=Nc-Nd;若下降值超过了5,一律以>5来表示。计算每一种测试菌株的Log下降值。
③可接受标准。硬面测试为载体定量杀灭试验,即在一定的接触时间内,消毒剂能够使挑战菌水平下降3个对数单位。
(4)讨论
本次验证为过氧化物消毒剂在实验室的消毒效力研究。通过消毒剂消毒效力验证后再进行洁净区现场消毒效果的验证,以确认消毒剂对不同消毒对象(环境、产品和工艺)的有效性及适用性。
4.结论
通过消毒剂灭活效果验证可知,中和剂以及中和剂与消毒剂的中和产物对挑战菌种生长无不良影响,在一定的接触时间内消毒剂能够使挑战菌水平下降3个对数单位,表明该消毒剂消毒效力能满足日常消毒使用。
