黄芩苷对血栓栓塞致急性肺栓塞大鼠NF-κB信号通路抑制作用的实验研究
2022-05-07蔡娟娟苏玲玲徐俪颖
蔡娟娟,黄 静,苏玲玲,徐俪颖
(1浙江中医药大学·浙江 杭州 310000;2宁波大学医学院附属医院·浙江 宁波 315300;3浙江中医药大学附属第一医院·浙江 杭州 310006)
急性肺栓塞(acute pulmonary embolism,APE)是指因为血栓、脂肪、空气等形成的栓子堵塞肺动脉系统,引发肺循环障碍从而影响呼吸功能,最终造成致命性危害的常见临床疾病[1]。栓子阻碍血液可造成氧化应激损伤,引起肺动脉高压,加之栓子可刺激血管内皮,易引起炎症反应进一步恶化病情。流行病学调查显示,APE发病率随年龄增加而增长,尤其是高龄女性,>75岁的女性其发病率大于0.5%[2]。APE患者临床表现复杂多样,且无典型临床特征,易被误诊、漏诊,大部分患者死亡后才被确诊,严重危害APE患者的生命安全。
目前,对于APE临床上常采用抗凝、溶栓等治疗方法,治疗效果尚佳,但仍有出血等风险。黄芩苷是中药黄芩的主要活性成分,黄苓味苦、性寒,归肺、胆、脾、大肠、小肠经,有清热燥湿、泻火解毒、止血、安胎等功效,临床应用广泛。据相关文献报道,以黄芩为君药的复方制剂已达477种[3]。黄芩苷具有多种药理作用,在清除自由基、抑制炎症反应、促进肿瘤细胞凋亡、保护缺血再灌注损伤心肌和大脑等方面均具有良好效果[4]。黄芩苷可以通过抑制NF-κB信号通路的激活改善大肠杆菌诱导的急性肺损伤,降低肺组织Wet/Dry ratio和MPO活性以及IL-1β、TNF-α、IL-6等炎性细胞因子的产生[5]。虽然有报道称黄芩苷在预防急性肺损伤方面有相应效果,但在预防急性肺栓塞中的作用研究甚少[6]。本研究旨在探讨分析黄芩苷对自体血栓栓塞致APE大鼠的影响和对NF-κB信号通路的调控作用。
1 材料
1.1 实验动物 SPF级健康雄性Sprague-Dawley(SD)大鼠60只,体质量(250±20)g,动物生产许可证号SCXK(沪)2017-0015,上海斯莱克动物实验有限公司提供。实验期间,各组大鼠均采用标准颗粒饲料喂养,自由进食、饮水,环境恒温,温度(22±2)℃,湿度50%~60%,光照每12 h明暗交替,换风次数15~20次/h。由浙江鹰旸医药研发有限公司饲养。实验饲养室许可证号SYXK(浙)2021-0033。
1.2 药物及试剂 黄芩苷(CY11274):北京凯瑞基。超氧化物歧化酶(SOD,IC-SOD-Ra)试剂盒、髓过氧化物酶(MPO,IC-MPO-p)试剂盒、丙二醛(MDA,IC-MDA-Ge)试剂盒:IC/IBL;NF-κB p65(D14E12)、p-NF-κBp65(Ser536)(93H1)、IκBα(L35A5)、p-IκBα(Ser32/Ser36):美国CST。
1.3 实验仪器 Micro17R低温高速离心机:Thermo Fisher Scientific;AE2000显微镜:Microscopy Solutions by Motic;Tanon-1600凝胶成像仪、VE180C电泳槽、VE186转膜仪:天能集团;610020-9Q化学发光仪:上海勤翔科学仪器有限公司。
2 方法
2.1 实验分组、APE模型制备及给药 60只SD大鼠随机分为Sham组、APE组、黄芩苷低剂量组、黄芩苷中剂量组、黄芩苷高剂量组,每组各12只。酒精鼠尾消毒后,头皮针(内径1.1 mm)尾静脉取血,待血液凝固后,在70 ℃的水浴锅中水浴10 min制成血栓栓子(1.1 mm×2 mm),生理盐水清洗3遍后置于试管中,然后加入2 mL生理盐水,4 ℃冷藏备用。仰卧固定大鼠,腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉大鼠,左颈部剪毛并进行消毒,行纵切口,暴露颈外静脉,在肺动脉中插入导管针,注入30个血栓栓子+2 mL生理盐水后缝合伤口。Sham组不注入血栓栓子,仅注入等量生理盐水,其余操作同上。黄芩苷低剂量组:皮下注射1 mg/kg黄芩苷;黄芩苷中剂量组:皮下注射2 mg/kg;黄芩苷高剂量组:皮下注射4 mg/kg黄芩苷;Sham组:皮下注射等量DMSO;APE组:皮下注射等量DMSO;均在造模前2 h注射[7]。
2.2 观察指标及测定
2.2.1 肺动脉压(mPAP)、右心室压力(RVP)测定 各组大鼠血栓输入4 h后,2%戊巴比妥钠(50 mg/kg)腹腔注射,各组大鼠麻醉后,分离右侧颈外静脉,插入聚苯乙稀管(0.9 mm),依次经过右心房、右心室、肺动脉,测定并记录各组大鼠的RVP和mPAP。
2.2.2 血气分析 处死大鼠前采用颈动脉插管,取5 mL血放入抗凝管中,注意密封,全自动血气分析机对各组大鼠动脉血进行血气分析,分别监测氧分压(PaO2)和二氧化碳分压(PaCO2)。
2.2.3 肺湿干重比(Wet/Dry ratio)及肺脏病理观察 处死大鼠后,取右肺组织称重后,在80 ℃恒温烘箱中干燥24 h,再进行称重,两次重量比为Wet/Dry ratio,可用来评价肺组织水肿情况。取大鼠左侧肺组织采用生理盐水冲洗,置于10%甲醛固定,常规制备5 μm切片。采用HE染色并进行显微镜观察。剩余左肺组织,液氮冷冻,以备后续检测分析。
2.2.4 肺组织氧化应激指标检测 依据试剂盒说明按步骤测定肺组织SOD、MPO的活性及MDA含量。
2.2.5 WB检测肺组织NF-κBp65、p-NF-κBp65I、Iκ-Bα、p-IκBα蛋白的表达 取肺组织,RIPA裂解液裂解提取总蛋白,肺组织蛋白浓度用BCA法测定;随后取适量样本,5% SDS-PAGE分离胶中电泳(80 V),随后转至PVDF膜;将膜置于5%脱脂奶粉的封闭液中,摇床振荡1.5~2 h后采用TBST洗涤3次,将膜放入一抗稀释液(anti-NF-κBp65、p-NF-κBp65I、κ-Bα、p-IκBα)的孵育盒中4 ℃震荡过夜,然后加入相应二抗孵育2 h,结束后TBST洗膜3次;化学发光、显影、定影;扫描胶片,用chemi capture软件对蛋白条带定量分析。

3 结果
3.1 各组大鼠mPAP、RVP、动脉血气分析结果比较 见表1。
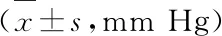
表1 各组大鼠mPAP、RVP、PaO2、PaCO2比较
3.2 各组大鼠肺组织Wet/Dry ratio结果分析 见表2。

表2 各组大鼠肺组织Wet/Dry ratio结果的比较
3.3 各组大鼠肺脏病理观察结果 肺组织HE染色结果显示:Sham组大鼠肺组织未见明显病理性变化;APE组大鼠肺组织呈一定病理学损伤,肺细胞形态呈不规则状,肺泡内和间质水肿出血并伴有炎细胞浸润,黄芩苷处理组大鼠肺组织与APE组相比,肺组织病理性损伤程度有所改善。见图1。
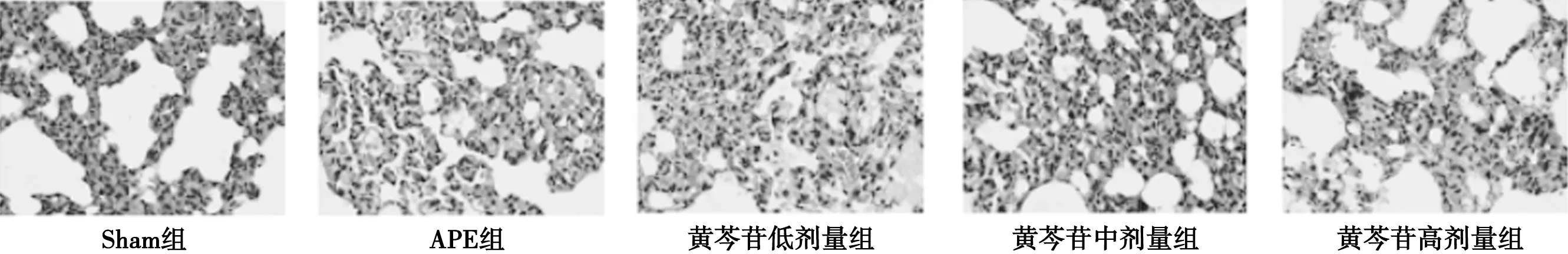
图1 各组大鼠肺组织病理检测结果(HE,×400)
3.4 各组大鼠肺组织氧化应激指标比较 见表3。

表3 各组大鼠肺组织SOD、MPO活性及MDA含量的比较
3.5 各组大鼠肺组织NF-κBp65、p-NF-κBp65、IκBα、p-IκBα蛋白表达的Western blot检测结果与Sham组比较,APE组肺组织p-IκBα蛋白表达明显降低P<0.01),NF-κBp65、p-NF-κBp65蛋白的表达明显上调(P<0.01),IκBα蛋白表达水平无显著变化(P>0.05);与APE组比较,黄芩苷低剂量组NF-κBp65、IκBα、p-IκBα、p-NF-κBp65蛋白表达未发生变化(P>0.05),黄芩苷中剂量组、黄芩苷高剂量组p-NF-κBp65蛋白的表达显著减少(P<0.05或P<0.01),p-IκBα蛋白表达显著增加(P<0.01),NF-κBp65、IκBα蛋白的表达水平变化不明显(P>0.05)。见图2。
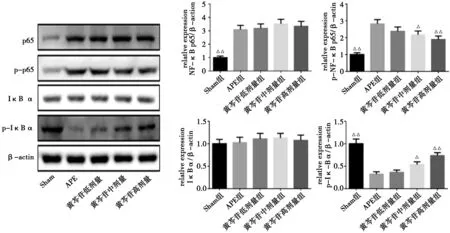
注:与APE组比较,△P<0.05,△△P<0.01
4 讨论
APE发病率较高,在心血管疾病的发病率中高居第三,仅低于动脉粥样硬化和高血压,常表现为血栓栓塞,占90%以上[8]。APE患者临床表现缺乏特异性,易被忽略,主要有呼吸困难急促、胸痛、昏厥、咯血等症状,与患者栓塞部位、栓子数量、大小以及自身有无基础性心、肺疾病等有关[9]。早期研究提出[10],由肺血栓致APE的基本要素包括血流淤滞、血液高度凝集以及血管壁损伤三大因素;随着进一步研究表明,APE可由多种因素引起。发生APE时机体主要病理改变包括气体交换功能和肺部血液动力学的变化,肺栓塞处流量下降,肺动脉压增加,无效腔扩大,肺内血流分布变化,通气/血流比例失调,气体交换功能正常运行;进一步释放血管收缩物质等致支气管痉挛,破坏肺泡表面活性物质,进一步造成肺不张,肺血管阻力上升;肺动脉压力升高以及右室后负荷骤然增加,可增高右室壁压力,致右心扩张甚至衰竭[11]。
目前,临床上APE的治疗主要以抗凝溶栓为主,治疗效果较为满意,但存在出血等问题。黄芩苷是黄芩根部提取而来的产物,为黄酮类化合物,具有显著的抗炎抑菌、清除氧自由基、抗变态反应等作用,被广泛应用于临床心血管疾病的救治[12]。黄芩苷可清除羟、烷自由基,进而抑制由此导致的卵磷脂质体代谢和线粒体脂质过氧化,减轻H2O2造成的细胞损伤,具有保护心肌缺血作用[13]。Caspase-3是NF-κB的下游调控因子,参与肺细胞凋亡途径,黄芩苷可通过抑制NF-κB释放,减少Caspase-3、8活化以及减轻线粒体肿胀,保护受损肺组织,发挥抑制肺细胞凋亡作用[14]。
本研究使用自体血栓栓塞建立APE大鼠模型,实验过程中采用改良的经颈静脉栓塞法,栓子稳定,可控性强,可有效确保大鼠模型的均一性[15]。本研究结果显示黄芩苷高剂量组mPAP、RVP水平显著低于APE组(P<0.05),提示高剂量的黄芩苷可降低APE大鼠mPAP、RVP水平,有效改善肺动脉高压症状。APE患者常伴有低氧血症,PaO2降低是其主要症状,临床上PaO2、PaCO2水平可作为检测APE的判断依据。本研究中黄芩苷中剂量组、黄芩苷高剂量组PaO2水平高于APE组(P<0.05),说明给予一定剂量的黄芩苷可升高APE大鼠的PaO2,改善其通气/血流比例,可有效纠正机体缺氧状态,促进气体交换功能的恢复;而各组大鼠间PaCO2差异无统计学意义(P>0.05),说明给予黄芩苷治疗不会引起CO2严重潴留。
各组大鼠肺组织HE染色结果显示,APE组大鼠肺组织呈一定病理学损伤,肺细胞形态呈不规则状,肺泡和肺泡间质水肿、出血以及伴有炎症细胞浸润,而黄芩苷组大鼠肺组织与APE组相比,肺组织病理性损伤程度有所改善,提示黄芩苷可在一定程度上改善肺组织损伤。本研究中APE+黄芩苷高剂量组Wet/Dry ratio低于APE组(P<0.05),说明给予高剂量的黄芩苷,可有效缓解肺组织水肿症状。可以通过监测MDA可反映脂质过氧化程度,监测SOD活性水平以反应心肌抗脂质过氧化能力;MPO是一种可破坏细胞膜结构的红血素蛋白,可以通过监测其含量来观察组织过氧化损伤程度[16]。发生APE时,肺动脉壁、肺组织均存有炎症反应,与内膜增生、血栓溶解有关,在本次实验中黄芩苷中剂量组、黄芩苷高剂量组MPO活性水平及MDA含量都明显下降(P<0.05或P<0.01),黄芩苷高剂量组SOD活性水平明显上升(P<0.01),说明高剂量黄芩苷可增加机体抗氧化能力,抑制炎症反应。
NF-κB升高与肺部炎症反应有关,可加重肺组织损伤,NF-κB在哺乳动物中有五种亚型,可相互作用调节下游基因表达;IκB激酶复合物(IKK)是NF-κB最经典的激活途径,炎症因子刺激细胞后将其活化,IκB蛋白磷酸化后再泛素化修饰,后被降解为NF-κB二聚体转运至细胞核,和特定序列相结合,进行转录调节[17]。本研究中,黄芩苷中剂量组、黄芩苷高剂量组肺组织中p-NF-κBp65蛋白的表达水平极显著下降(P<0.05或P<0.01),p-IκBα蛋白表达水平极显著上升(P<0.01),NF-κBp65、IκBα蛋白的表达水平均无显著变化(P>0.05);提示一定剂量的黄芩苷可通过下调NF-κB信号通路和p-NF-κBp65蛋白表达水平,上调p-IκBα蛋白水平,进一步保护受损肺组织。
综上所述,黄芩苷抑制NF-κB信号通路,使p-IκBα蛋白表达水平上调,使p-NF-κBp65蛋白表达下调,剂量依赖性改善血栓栓塞致APE大鼠的mPAP、RVP水平,提高PaO2,改善肺组织损伤程度,调高机体抗氧化能力,对受损肺组织起到保护作用。
