基于UHPLC-QTOF-MS/MS和TCMIP的牡丹皮治疗慢性肾炎活性成分筛选及作用机制分析
2022-05-06秦月雯赵能武
张 瞳,秦月雯,王 萍*,赵能武
基于UHPLC-QTOF-MS/MS和TCMIP的牡丹皮治疗慢性肾炎活性成分筛选及作用机制分析
张 瞳1, 2,秦月雯2,王 萍2*,赵能武1*
1.贵州中医药大学,贵州 贵阳 550025 2.中国中医科学院中药研究所,北京 100700
基于超高效液相色谱-四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time of flight mass spectrometry,UHPLC-QTOF-MS/MS)技术和中医药整合药理学研究平台(Chinese Medicine Integrated Pharmacology Research Platform,TCMIP)v2.0筛选牡丹皮治疗慢性肾炎的活性成分,并初步分析其作用机制。采用UHPLC-QTOF-MS/MS,分别在正、负离子扫描模式下对牡丹皮化学成分进行定性分析;基于TCMIP v2.0收集牡丹皮的候选靶标谱和慢性肾炎的基因集;基于TCMIP v2.0平台构建上述靶标间的蛋白间相互作用(protein-protein interaction,PPI)网络,根据网络特征值确定核心靶标;通过DAVID v6.8软件(http://david.abcc.ncifcrf.gov/)进行基因本体论(genetic ontology,GO)功能分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,筛选与慢性肾炎相关的通路作为核心通路;圈定核心通路对应靶标的化学成分,统计每个成分的靶点数量、靶点频次、成分含量;根据统计结果确定牡丹皮治疗慢性肾炎的核心成分;利用Cytoscape 3.8.0软件构建“成分-靶标-通路”多维关联网络。在正、负离子模式下共鉴定了牡丹皮中73个化学成分;通过分析PPI相互作用网络获得123个核心节点;KEGG富集分析确定了17条慢性肾炎相关通路;通过靶点数量、频次和响应值综合筛选得到13个核心成分。牡丹皮中的13个核心成分可能通过调控核因子-κB(nuclear factor-κB,NF-κB)通路、肾素分泌通路、磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路等17条通路治疗慢性肾炎,为进一步研究牡丹皮治疗慢性肾炎的作用机制奠定了数据基础。
牡丹皮;慢性肾炎;整合药理学;活性成分;作用机制;UHPLC-QTOF-MS/MS;没食子酸;芍药苷;丹皮酚
慢性肾炎属于炎性、免疫性疾病,具有起病形式多样化、病理类型复杂、病情进展缓慢及病程迁延难愈等特点。临床常用类固醇疗法治疗,但该法极有可能导致类固醇依赖[1]。中医学者将慢性肾炎纳入中医学“肾风”“尿浊”“水肿”“肾消”“肾劳”等范畴,在饮食不节、七情内扰、劳累过度、外邪侵袭等内外因共同作用下,导致气阴两虚伴血瘀兼湿热。气虚不能化生津液,阴虚则津液不足,气阴两虚而虚象亦重,久病难愈而耗伤气阴,因而导致或加重气阴两虚证[2]。气阴两虚则致湿热、瘀血、浊毒积聚阻于肾经,进一步加重肾脏的负担,从而导致肾小球及肾小管不同程度的损伤和萎缩,目前以补益脾肾、利水渗湿、滋阴清热、活血化瘀为主要治则[3]。牡丹皮是毛茛科芍药属植物牡丹Andr.的干燥根皮,味苦、辛,性微寒,归心、肝、肾经,具有清热凉血、活血化瘀的功效,用于热入营血、温毒发斑、吐血衄血、夜热早凉、无汗骨蒸、经闭痛经、跌扑伤痛、痈肿疮毒[4]。牡丹皮是中医临床上治疗慢性肾炎的常用药[5]。临床常用于治疗慢性肾炎的复方有六味地黄丸、牡丹散、萆薢散等,这些复方都含有牡丹皮,起到清热凉血、活血化瘀的作用,可治疗慢性肾炎病程中湿热、血瘀等证。而关于其治疗慢性肾炎的药效物质基础及其多成分、多靶点、多途径的网络调节机制尚未见报道。因此,本研究利用超高效液相色谱-四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time of flight mass spectrometry,UHPLC-QTOF-MS/MS)明确牡丹皮的成分组成,并基于中医药整合药理学研究平台(Chinese Medicine Integrated Pharmacology Research Platform,TCMIP)对牡丹皮治疗慢性肾炎的主要药效成分和作用机制进行分析,识别其可能的药效成分群及作用靶点、通路,旨在为进一步深入研究牡丹皮治疗慢性肾炎的机制和临床用药提供科学依据。
1 材料与方法
1.1 仪器
超高效液相色谱仪(UPLC-H-Class)、四极杆飞行时间质谱仪(Xevo G2-S QTOF),美国Waters公司;JP-500C型高速多功能粉碎机,永康市久品工贸有限公司;CPA225D型电子天平,德国赛多利斯公司。
1.2 试药
牡丹皮饮片(批号119110153)购自山东鲁南制药股份有限公司提供,由中国中医科学院中药研究所何希荣主管药师鉴定为牡丹Andr.的干燥根皮(符合《中国药典》2020年版的相关要求)。对照品没食子酸(批号201221027)、芍药苷(批号21051210)、丹皮酚(批号21031065)购自成都曼思特生物科技有限公司,质量分数均≥98%;质谱级甲醇、乙腈、甲酸,Fisher Scientific公司;蒸馏水,深圳屈臣氏蒸馏水有限公司
1.3 化学成分确定
1.3.1 供试品溶液的制备 精密称取牡丹皮饮片粉碎(过4号筛),取粉末1.0 g,精密称定,置于5 mL量瓶中,加入70%甲醇溶液至刻度,摇匀,超声处理40 min(功率150 W、频率40 kHz),离心(3000 r/min)10 min,取上清液,过0.22 µm微孔滤膜,取续滤液,即得。
1.3.2 混合对照品溶液的制备
分别取没食子酸、芍药苷、丹皮酚约2 mg,精密称定,分别置于2 mL量瓶中,加70%甲醇分别制成1.095、1.265、0.975 mg/mL的母液。分别精密量取以上母液各0.2 mL至2 mL量瓶中,加70%甲醇稀释并定容至刻度,即得混合对照品溶液。
1.3.3 色谱条件 色谱柱为Waters UHPLC HSS T3(100 mm×2.1 mm,1.8 µm);流动相为0.1%甲酸-水(A)和0.1%甲酸-乙腈(B),梯度洗脱,洗脱程序:0~4 min,2.0%~5.0% B;4~6 min,5.0%~6.5% B;6~9 min,6.5%~10.0% B;9~13 min,10.0%~13.0% B;13~20 min,13.0%~20.0% B;20~21 min,20.0%~24.0% B;21~26 min,24.0%~28.0% B;26~26.5 min,28.0%~31.0% B;26.5~31 min,31.0%~36.0% B;31~33 min,36.0%~60.0% B;33~33.5 min,60.0%~98.0% B。体积流量0.5 mL/min,进样量为2.0 µL,柱温40 ℃。
1.3.4 质谱条件 质谱分析采用了四极杆飞行时间质谱,Xevo G2-S QTOF ESI离子源,电离方式为正负离子模式(ESI−和ESI+),正离子毛细管电压0.5 kV,负离子毛细管电压2.5 kV,样品锥孔电压40 V,离子源温度100 ℃,脱溶剂温度为450 ℃,雾化气温度450 ℃,锥孔气体积流量为50 L/Hr,溶媒挥散体积流量为900 L/Hr,质量扫描范围/50~1500。碰撞能量正离子模式下低碰撞能量为40 eV,高碰撞能量为60 eV;负离子模式下低碰撞能量为60 eV,高碰撞能量为80 eV。液质系统由Masslynx 4.1软件控制,并进行数据采集和图谱处理。
1.3.5 数据分析 通过Waters UNIFI数据处理软件对Continuum模式采集到的准分子离子峰信息进行分析,将原始质谱数据导入UNIFI软件中,选择误差为−5×10−6~5×10−6的分子式与ETCM数据库中牡丹皮化合物信息匹配,对化合物进行初步鉴定,选择目标化合物的二级碎片离子信息,与现有文献报道提供的保留时间、裂解规律等信息进行比对,进一步确认化合物的成分及结构。将汇总结果在MassLynx V4.1软件中通过提取离子及文献信息的方法人工鉴定并进行成分归属。
1.4 候选靶标的收集
1.4.1 化合物靶点的预测分析 基于鉴定所得的牡丹皮成分,通过查找数据库(PubChem、Chemspider)或运用ChemDraw软件下载或绘制结构式[结构式保存成UNIFI软件匹配格式的摩文件(mol格式)],建立牡丹皮成分库。
TCMIP v2.0平台的靶标预测是运用未知药物与已知药物化学结构相似原理,使用OpenBabel软件进行成分化学指纹特征的提取,并采用Tanimoto系数定义的相似度计算方法进行相似性打分,其中Tanimoto score≥0.8则相似性强。在“中药靶标预测”界面中,导入牡丹皮化学成分的mol文件,为提高靶标预测的可靠性,选取相似性分数≥0.8的靶标作为候选靶标,导出去重获得牡丹皮的候选靶标群。
1.4.2 疾病候选靶标的收集 基于TCMIP v2.0的疾病相关分子集及其功能挖掘模块,根据慢性肾炎的临床表型合集,以临床表现的英文词条为检索词(表1),建立慢性肾炎相关基因集。
1.5 蛋白间相互作用(protein-protein interaction,PPI)网络信息
TCMIP v2.0平台整合了Reactome(https:// reactome.org/,version 65)、HPRD(Human Protein Reference Database,http://www.hprd.org/,Release 9)、MINT(Molecular INTeractionDatabase,https://mint.bio.uniroma2.it/,updated in August 2011)、InAct(IntActMolecular Interaction Database,https://www.ebi.ac.uk/intact/,version: 4.2.12)、DIP(Database of Interacting Proteins,https://dip.doe-mbi.ucla.edu/ dip/,updated in Feb 13,2017)等数据库的PPI数据[6],可对药物与证候的PPI做全面的分析,利用该平台,可获得牡丹皮与慢性肾炎的PPI相互作用信息。
表1 慢性肾炎的检索词
Table 1 Search words of related chronic kidney disease
疾病名称表型疾病名称表型 albuminuria蛋白尿kidney disease induced by mesangial系膜增生性肾病 chronic renal failurechronic tubulointerstitial nephritis慢性肾衰竭慢性肾小管间质肾炎proliferationminimal change glomerulonephritis 微小病变肾小球肾炎 decreased numbers of nephrons肾单位数目减少nephritis, interstitial间质性肾炎 diabetic nephropathy糖尿病肾病pyelonephritis肾盂肾炎 focal glomerulosclerosis局灶性肾小球硬化renal diseases肾脏疾病 glomerulonephritis肾小球肾炎renal failure肾衰竭 glomerulopathy肾小球疾病renal fibrosis肾纤维化 glomerulosclerosis肾小球硬化renal inflammation肾脏炎症 glycosuria糖尿症renal injury肾损伤 hyperplasia of the leydig cells间质细胞增生renovascular hypertension肾血管性高血压 increased blood urea nitrogen血尿素氮增加
1.6 网络构建与分析及可视化
基于TCMIP v2.0平台中医药关联网络挖掘模块,选择“证候-方剂”功能,上传牡丹皮与慢性肾炎的候选靶标群。基于二者潜在靶标间的PPI相互作用计算网络特征值,以“连接度(degree)”的2倍中位数为卡值,获得核心节点(hubs)后,以核心节点的“连接度”“紧密度(closeness)”“介度(betweenness)”的中位数为卡值,选取同时满足3个卡值的节点作为网络的核心靶标[6]。通过DAVID v6.8软件(http://david.abcc.ncifcrf.gov/)进行基因本体论(genetic ontology,GO)功能分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,筛选与慢性肾炎相关的通路作为核心通路。将核心通路、筛选到的核心靶标与化学成分对应并统计每个成分的靶点数量、靶点频次和成分频次。根据频次和UHPLC-QTOF-MS/MS响应值筛选核心成分。将得到的核心成分所包含的靶标作为潜在核心靶点。通过Cytoscape 3.8.0软件对“成分-靶标-通路”多维关联网络图进行可视化。
2 结果
2.1 化学成分分析
牡丹皮样品正负离子模式基峰离子流图见图1。通过Waters UNIFI软件匹配后,将UNIFI导出的结果进行初步筛选,响应值大、误差小、加合离子多的成分匹配度高,故保留误差<5×10−6,响应值大于5000的成分。根据UNIFI自动识别、文献报道和在线及离线质谱数据库的比对,对成分进行鉴定,结果见表2、3。
单萜类是芍药属植物的主要活性成分。本研究中鉴定了29个单萜及其苷类成分,分别是8--脱苯甲酰芍药苷(8--debenzoylpaeoniflorin)、4--丁基芍药苷(4--butylpaeoniflorin)、4--甲基没食子酰氧基芍药苷(4--methylgalloyloxypaeoniflorin)、4--甲基芍药苷(4--methylpaeoniflorin)、4--甲氧基芍药苷(4--methyloxypaeoniflorin)、4-邻甲基苯甲酰芍药苷(4--methylbenzoyl-paeoniflorin)、9--丁基芍药苷(9--butylpaeonidanin)、9--丁氧基芍药苷(9--butyloxypaeonidanin)、苯甲酰芍药苷(benzoylpaeoniflorin)、苯甲酰氧芍药苷(benzoyloxypaeoniflorin)、没食子酰芍药苷(galloylpaeoniflorin)、没食子酰氧基芍药苷(galloyloxypaeoniflorin),牡丹皮苷(mudanpioside)A、B、C、D、E、H、I、J、G,芍药苷(paeoniflorin)、芍药苷A(paeonidanin A)、芍药苷B(paeoniflorin B)、芍药苷内脂(albiflorin)、芍药苷酮(paeoniflorigenone)、芍药内酯B(paeonilactone B)、氧化芍药苷(oxypaeoniflorin)、氧化芍药碱(oxypaeonidanin)。经MassLynx软件分析,正离子模式下,峰18、19、20鉴定的化合物分子式均确定为C23H28O11,其中峰18相对丰度最高并有明显的/449 [M-H-CH2O]−环氧类结构特征碎片峰,与对照品比对裂解规律和保留时间,结合文献确定峰18、19、20分别为芍药内酯苷、牡丹皮苷I、芍药苷[7]。
芍药属植物中含有大量的没食子酸和没食子酸衍生物,本研究中鉴定了没食子酸及其7个衍生物,分别是葡萄糖没食子鞣苷(glucogallin)、没食子酸甲酯(methyl gallate)、1,3,4-三没食子酰葡萄糖(1,3,4-trigalloylglucose)、1,2,3,4-四没食子酰葡萄糖(1,2,3,4-tetragalloylglucose)、1,2,3,4,6-五合金葡萄糖(1,2,3,4,6-pentagalloylglucose)、1,3,6-三邻没食子酰葡萄糖(1,3,6-tri--galloylglucose)、1,2,4,6-四没食子酰葡萄糖(1,2,4,6-tetragalloylglucose)。正离子模式下,通过与对照品比对裂解规律和保留时间确定峰30为没食子酸,10号峰具有相同的碎片/169 [M-H]−和125 [M-H-CO2]−,鉴定为没食子酸甲酯(methyl gallate)。峰43准分子离子峰为167.069 7 [M+H]+,分子式为C9H10O3,与对照品比对裂解规律和保留时间,鉴定为丹皮酚(paeonol)。根据丹皮酚的裂解规律,鉴定到7个丹皮酚衍生物,包括丹皮酚苷(paeonoside),芹菜皂苷(apiopaeonoside),牡丹苷(suffruticoside)A、C、D、E,2,5-二羟基-4-甲基苯乙酮(2,5-dihydroxy-4-methylacetophenone)。由于峰27、28观测到的碎片信息有限,不能归属具体化合物,推测为methyl vanillate和牡丹苷A、C。鉴定到的化合物中大部分为没食子酸和丹皮酚的衍生物,为验证UNIFI匹配结果,相同条件下检测没食子酸和丹皮酚混合对照品,保留时间和裂解规律与UNIFI匹配结果一致。

图1 牡丹皮基峰离子流图
2.2 核心靶标的PPI网络分析
依据“2.1”项中鉴定到的成分,在TCMIP v2.0平台上共收集到牡丹皮候选靶标1001个,慢性肾炎相关靶标300个,PPI网络核心节点123个。将牡丹皮治疗慢性肾炎的123个核心靶点上传至STRING v11.0数据库,并运用Cytoscape 3.8.0软件进行网络构建和可视化,度值取大于2倍中位数,得到核心靶点的PPI网络,见图3。PPI网络中有丝分裂原激活蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)、核因子-κB抑制因子(nuclear factor-κB inhibitor,NF-κBIA)、白细胞介素6(interleukin 6,IL6)、白细胞介素1β(interleukin 1 beta,IL1B)等18个靶点出现在在网络中,表明其在PPI网络中发挥重要作用,可视为牡丹皮治疗慢性肾炎的关键靶标。
2.3 多维关联网络可视化分析
2.3.1 牡丹皮治疗慢性肾炎靶点的GO功能分析和KEGG通路富集分析 将这123个靶点导入David,对相关靶点蛋白进行GO功能注释分析,包含细胞组分、分子功能和生物过程3个方面,选取值最小的前10个进行做图呈现,如图4所示,这些蛋白在细胞组分方面主要参与氧化还原酶复合物、线粒体内膜、线粒体呼吸体等过程;在分子功能方面主要参与蛋白质丝氨酸/苏氨酸激酶活性、配体-活化、泛素蛋白连接酶结合等功能;在生物过程方面主要涉及细胞对肽类激素刺激的反应、有机化合物氧化产生能量等过程;推测牡丹皮滋阴补肾、活血化瘀功效可能与以上功能过程相关。
表2 正离子模式下牡丹皮的化学成分鉴定
Table 2 Identification of chemical components of Moutan Cortex in ESI+
峰号tR/minm/z误差(×10−6)响应值加和离子分子式化合物名称分类与负离子模式对应峰号实测值理论值 1 1.28394.170 6376.136 95−0.47630+NH4, +K, +NaC16H24O108-O-debenzoylpaeoniflorin单萜类 2 2 1.85344.169 7326.13655−2.04350+NH4C16H22O73-O-β-D-glucopyranosyl-4-methoxyaceto- phenone其他48 3 1.86268.103 7267.096 75−1.475 569+HC10H13N5O4adenosine核酸类 4 4 2.29240.123 0222.089 21−0.22114+NH4C12H14O4diethyl phthalate其他 5 2.66362.145 2344.110 73 1.74866+NH4C15H20O9mudanoside C苷类15 6 2.79355.063 8332.074 35 0.72785+NaC13H16O10glucogallin没食子酸衍生物 6 7 3.11345.153 8344.147 12−1.77552+HC16H24O8mudanpioside G单萜类 8 8 3.64482.151 1464.116 61 1.46033+NH4, +K, +NaC18H24O14mudanoside B苷类 7 9 4.02183.101 5182.094 29−0.43550+HC10H14O3deoxypaeonisuffrone萜类 10 6.98185.044 5184.037 17 0.518 909+HC8H8O5methyl gallate有机酸 9 11 8.54291.086 4290.079 04 0.2143 880+HC15H14O6(−)-catechin/(+)-catechin黄酮类11 8.54139.038 4138.031 69−4.110 328+HC7H6O3p-hydroxybenzoic acid有机酸类21 12 8.98519.147 8496.158 08 0.924 009+Na, +K, +NH4C23H28O12oxypaeoniflorin单萜类12 1310.22549.157 4526.168 64−0.89041+Na, +K, +NH4C24H30O13mudanpioside E单萜类14 1411.06351.105 2328.115 82 0.411 755+Na, +KC15H20O8paeonoside苯乙酮 1511.59227.090 8226.084 12−2.72108+HC11H14O5butyl gallate酯类 1611.66483.147 2460.158 08−0.256 112+Na, +H, +KC20H28O12apiopaeonoside苯乙酮16 1711.73645.201 0622.210 90 1.419 000+Na, +KC26H38O17suffruticoside E苯乙酮17 1812.48498.197 3480.163 16 0.7194 509+NH4, +K, +NaC23H28O11albiflorin单萜类18 1912.62503.152 8480.163 16 0.870 317+Na, +KC23H28O11mudanpioside I单萜类 2013.31498.197 2480.163 16 0.346 951+NH4C23H28O11paeoniflorin*单萜类 2113.32512.212 6494.178 81−0.18380+NH4, +NaC24H30O114-O-methylpaeoniflorin单萜类38 2213.66666.203 6648.169 03 1.140 233+NH4, +K, +NaC30H32O16galloyloxypaeoniflorin单萜类19 2313.96183.065 7182.057 91 3.058 536+HC9H10O42,3-dihydroxy-4-methoxyacetophenone苯乙酮20 2414.29153.054 1152.047 34−3.67772+HC8H8O3resacetophenone苯乙酮22 2514.50654.130 3636.096 26 0.37489+NH4, +K, +NaC27H24O181,3,4-tri-galloylglucose没食子酸衍生物23 2614.85533.162 7510.173 73−0.523 158+Na, +K, +NH4C24H30O124-O-methyloxypaeoniflorin单萜类35 14.85533.162 7510.173 73−0.523 158+Na, +K, +NH4C24H30O12oxypaeonidanin单萜类34 2715.18183.065 8182.057 91 3.615 532+HC9H10O4methyl vanillate没食子酸衍生物 2815.57635.158 7612.169 03 0.7107 872+Na, +KC27H32O16suffruticoside A苯乙酮27 15.57635.158 7612.169 03 0.7107 872+Na, +KC27H32O16suffruticoside C苯乙酮27 2916.08806.142 4788.107 22 1.729 182+NH4, +H, +K, +NaC34H28O221,2,3,4-tetragalloylglucose没食子酸衍生物26 3016.35171.028 4170.021 52−2.39783+HC7H6O5gallic acid*有机酸 5 3116.54635.158 6612.169 03 0.554 735+Na, +H, +KC27H32O16suffruticoside D苯乙酮28 3217.22650.207 9632.174 12−0.1124 145+NH4, +H, +K, +NaC30H32O15galloylpaeoniflorin单萜类29 3317.53319.117 4318.110 34−0.618 911+HC17H18O6paeoniflorigenone单萜类
续表2
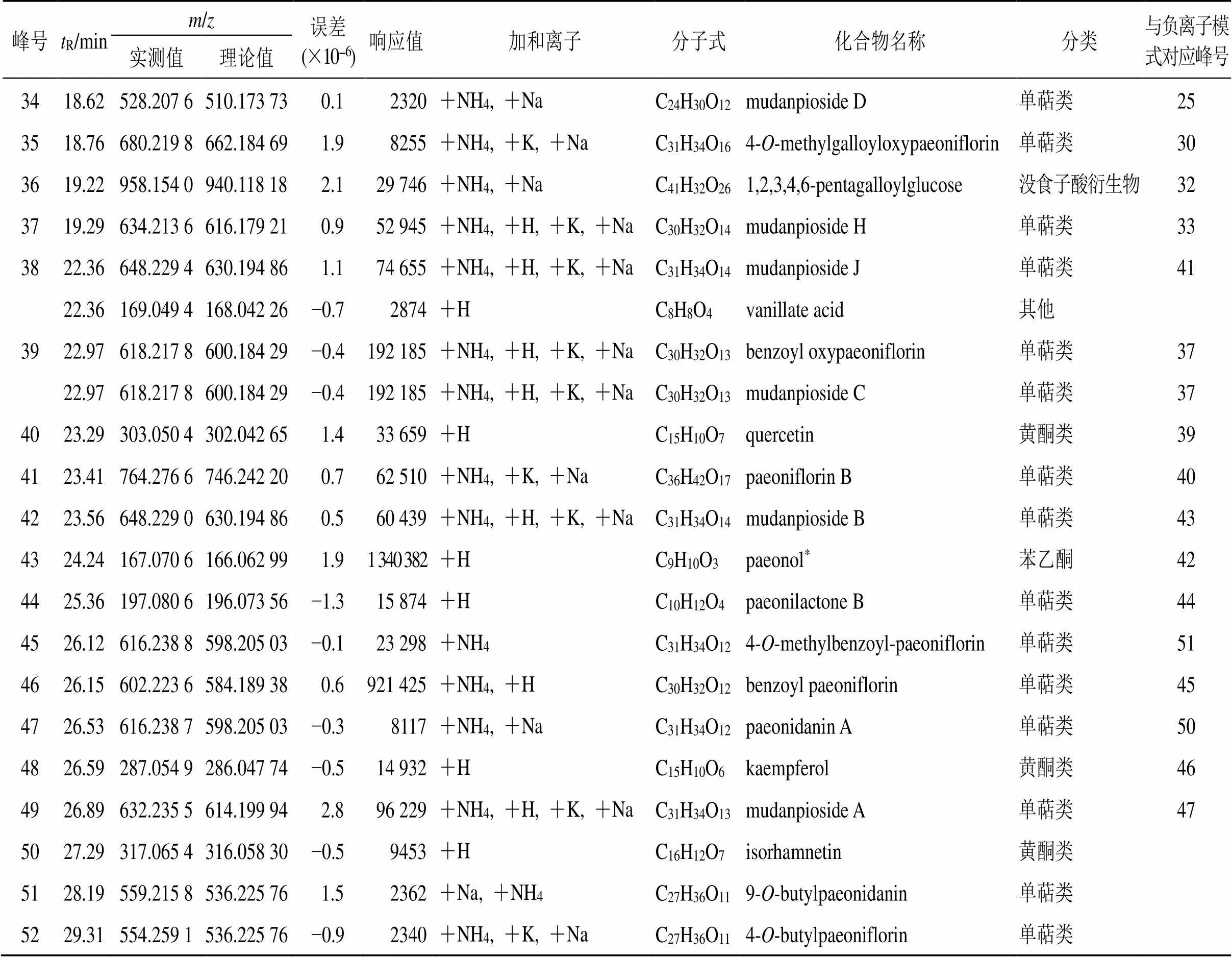
峰号tR/minm/z误差(×10−6)响应值加和离子分子式化合物名称分类与负离子模式对应峰号 实测值理论值 3418.62528.207 6510.173 73 0.12320+NH4, +NaC24H30O12mudanpioside D单萜类25 3518.76680.219 8662.184 69 1.98255+NH4, +K, +NaC31H34O164-O-methylgalloyloxypaeoniflorin单萜类30 3619.22958.154 0940.118 18 2.129 746+NH4, +NaC41H32O261,2,3,4,6-pentagalloylglucose没食子酸衍生物32 3719.29634.213 6616.179 21 0.952 945+NH4, +H, +K, +NaC30H32O14mudanpioside H单萜类33 3822.36648.229 4630.194 86 1.174 655+NH4, +H, +K, +NaC31H34O14mudanpioside J单萜类41 22.36169.049 4168.042 26−0.72874+HC8H8O4vanillate acid其他 3922.97618.217 8600.184 29−0.4192 185+NH4, +H, +K, +NaC30H32O13benzoyl oxypaeoniflorin单萜类37 22.97618.217 8600.184 29−0.4192 185+NH4, +H, +K, +NaC30H32O13mudanpioside C单萜类37 4023.29303.050 4302.042 65 1.433 659+HC15H10O7quercetin黄酮类39 4123.41764.276 6746.242 20 0.762 510+NH4, +K, +NaC36H42O17paeoniflorin B单萜类40 4223.56648.229 0630.194 86 0.560 439+NH4, +H, +K, +NaC31H34O14mudanpioside B单萜类43 4324.24167.070 6166.062 99 1.91 340 382+HC9H10O3paeonol*苯乙酮42 4425.36197.080 6196.073 56−1.315 874+HC10H12O4paeonilactone B单萜类44 4526.12616.238 8598.205 03−0.123 298+NH4C31H34O124-O-methylbenzoyl-paeoniflorin单萜类51 4626.15602.223 6584.189 38 0.6921 425+NH4, +HC30H32O12benzoyl paeoniflorin单萜类45 4726.53616.238 7598.205 03−0.38117+NH4, +NaC31H34O12paeonidanin A单萜类50 4826.59287.054 9286.047 74−0.514 932+HC15H10O6kaempferol黄酮类46 4926.89632.235 5614.199 94 2.896 229+NH4, +H, +K, +NaC31H34O13mudanpioside A单萜类47 5027.29317.065 4316.058 30−0.59453+HC16H12O7isorhamnetin黄酮类 5128.19559.215 8536.225 76 1.52362+Na, +NH4C27H36O119-O-butylpaeonidanin单萜类 5229.31554.259 1536.225 76−0.92340+NH4, +K, +NaC27H36O114-O-butylpaeoniflorin单萜类
*表示与对照品对照
>*contrast with reference
表3 负离子模式下牡丹皮的化学成分鉴定
Table 3 Identification of chemical components of Moutan Cortex in ESI−
峰号tR/minm/z误差(×10−6)响应值加和离子分子式化合物名称分类与正离子模式对应峰号实测值理论值 1 1.01 129.019 5 130.026 61 1.0 3914−HC5H6O4mono-methyl maleate其他 2 1.27 421.135 6 376.136 95 1.1 78 315+HCOO, −HC16H24O108-O-debenzoylpaeoniflorin单萜类 1 3 1.36 243.062 5 244.069 54 1.0 5689−HC9H12N2O6uridine苷类 4 1.78 312.094 9 267.096 75 −0.1 4557+HCOO, −HC10H13N5O4adenosine核酸类 3 5 2.07 169.014 5 170.021 52 1.4 368 271−HC7H6O5gallic acid*有机酸30 6 2.76 331.067 2 332.074 35 0.3 131 591−HC13H16O10glucogallin没食子酸衍生物 6 7 3.70 463.109 6 464.116 61 0.6 359 064−HC18H24O14mudanoside B苷类 8 8 6.18 389.145 6 344.147 12 0.7 41 232+HCOO, −HC16H24O8mudanpioside G单萜类 7 9 6.94 183.030 1 184.037 17 0.9 308 411−HC8H8O5methyl gallate有机酸10 10 7.47 407.098 6 408.105 65 0.7 6576−H, +HCOOC19H20O10iriflophenone 2-O-β-D-glucopyranoside其他 11 8.49 289.072 0 290.079 04 0.7 363 297−HC15H14O6(−)-catechin/(+)-catechin黄酮类11 12 8.94 495.151 6 496.158 08 1.6 817 506−H, +HCOOC23H28O12oxypaeoniflorin单萜类12 13 9.66 635.089 4 636.096 26 0.7 49 799−HC27H24O181,3,6-tri-o-galloylglucose没食子酸衍生物 1410.20 525.161 4 526.168 64 0.1 156 684−H, +HCOOC24H30O13mudanpioside E单萜类13
续表3

峰号tR/minm/z误差(×10−6)响应值加和离子分子式化合物名称分类与负离子模式对应峰号 实测值理论值 1510.85 343.103 6 344.110 73 0.5 4690−H, +HCOOC15H20O9mudanoside C苷类 5 1611.64 505.156 7 460.158 08 0.9 82 120+HCOO, −HC20H28O12apiopaeonoside苯乙酮16 1711.70 667.209 1 622.210 90 0.0 27 131+HCOO, −HC26H38O17suffruticoside E苯乙酮17 1812.48 525.161 2 480.163 16 −0.3 1 651 766+HCOO, −HC23H28O11albiflorin单萜类18 1913.63 647.162 1 648.169 03 0.6 514 497−HC30H32O16galloyloxypaeoniflorin单萜类22 2013.93 181.050 2 182.057 91 −2.3 1305−HC9H10O42,3-dihydroxy-4-methoxyacetophenone其他23 2114.01 137.024 3 138.031 69 −0.8 1 0742−HC7H6O3p-hydroxybenzoic acid有机酸11 2214.24 151.040 2 152.047 34 1.0 31 191−HC8H8O3resacetophenone苯乙酮24 2314.47 635.088 6 636.096 26 −0.6 244 630−HC27H24O181,3,4-tri-galloylglucose没食子酸衍生物25 2414.64 525.162 1 480.163 16 1.3 56 959+HCOOC23H28O11paeoniflorin*单萜类 2514.82 555.172 7 510.173 73 1.5 146 011+HCOO, −HC24H30O12mudanpioside D单萜类34 2616.06 787.099 7 788.107 22 −0.3 640 440−HC34H28O221,2,3,4-tetragalloylglucose没食子酸衍生物29 2716.33 611.161 6 612.169 03 −0.2 515 478−HC27H32O16suffruticoside A苯乙酮28 16.33 611.161 6 612.169 03 −0.2 515 478−HC27H32O16suffruticoside C苯乙酮28 2816.51 611.161 5 612.169 03 −0.4 152 321−H, +HCOOC27H32O16suffruticoside D苯乙酮31 2917.20 631.166 8 632.174 12 −0.1 752 109−HC30H32O15galloylpaeoniflorin单萜类32 3018.74 661.176 7 662.184 69 −1.0 58 294−HC31H34O164-O-methylgalloyloxypaeoniflorin单萜类35 3119.03 787.097 3 788.107 22 −3.4 11 271−HC34H28O221,2,4,6-tetragalloylglucose没食子酸衍生物 3219.08 939.107 2 940.118 18 −3.9 2 600 278−HC41H32O261,2,3,4,6-Pentagalloylglucose没食子酸衍生物36 3319.28 615.170 4 616.179 21 −2.4 283 752−HC30H32O14mudanpioside H单萜类37 3420.38 509.164 7 510.173 73 −3.4 10 154−HC24H30O12oxypaeonidanin单萜类26 3521.12 509.166 7 510.173 73 0.6 16 351−HC24H30O124-O-methyloxypaeoniflorin单萜类26 3621.99 181.050 3 122.036 78 −1.7 27 703+CH3COOC7H6O2benzoic acid有机酸 3722.96 599.176 8 600.184 29 −0.3 622 339−H, +HCOOC30H32O13benzoyl oxypaeoniflorin单萜类39 22.96 599.176 8 600.184 29 −0.3 622 339−H, +HCOOC30H32O13mudanpioside C单萜类39 3823.19 493.170 4 494.178 81 −2.2 5037−HC24H30O114-O-methylpaeoniflorin单萜类21 3923.28 301.035 5 302.042 65 0.4 73 260−HC15H10O7quercetin黄酮类40 4023.41 791.239 0 746.242 20 −1.7 116 065+HCOO, −HC36H42O17paeoniflorin B单萜类41 4123.56 629.187 6 630.194 86 0.0 153 850−H, +HCOOC31H34O14mudanpioside J单萜类38 4224.27 165.056 0 166.062 99 1.8 45 160−HC9H10O32,5-dihydroxy-4-methylacetophenone苯乙酮43 24.27 165.056 0 166.062 99 1.8 45 160−HC9H10O33-hydroxy-4-methoxyacetophenone其他 4324.79 689.207 1 630.194 86 −2.3 4204+CH3COOC31H34O14mudanpioside B单萜类42 4425.35 195.066 3 196.073 56 0.0 43 837−HC10H12O4paeonilactone B单萜类44 4526.16 629.187 4 584.189 38 −0.3 1 548 784+HCOO, −HC30H32O12benzoyl paeoniflorin单萜类46 26.16 629.187 4 630.194 86 −0.3 1 548 784−HC31H34O14mudanpioside J单萜类 4626.59 285.040 5 286.047 74 0.3 34 905−HC15H10O6kaempferol黄酮类48 4726.89 659.197 3 614.199 94 −1.2 104 800+HCOO, −HC31H34O13mudanpioside A单萜类49 4827.19325.129 3326.136 55 0.12099−HC16H22O73-O-β-D-glucopyranosyl-4-methoxyacetophenone其他 2 4928.14 551.213 3 552.220 68 −0.3 11 458−HC27H36O129-O-butyloxypaeonidanin单萜类 5028.86 657.217 3 598.205 03 −2.4 3 276+CH3COOC31H34O12paeonidanin A单萜类47 5129.16 657.216 5 598.205 03 −3.7 2 283+CH3COOC31H34O124-O-methylbenzoyl-paeoniflorin单萜类45 5229.38 611.233 7 552.220 68 −1.3 6 278+CH3COOC27H36O124-O-butyloxypaeoniflorin苷类 5329.90 287.222 6 242.224 58 −0.5 4 614+HCOOC15H30O2pentadecanoic acid其他 5434.73 455.353 0 456.360 35 −0.1 102 657−H, +HCOOC30H48O3betulinicacid三萜类 5535.00 453.337 8 454.344 70 0.8 29 446−H, +HCOOC30H46O3mudanpinoic acid A三萜类 5636.40 431.317 7 432.323 96 2.4 513 757−HC27H44O4octadecyl caffeate其他 57 36.75 621.440 0 576.440 00 −0.8 37 344+HCOOC35H60O6daucosterol三萜类
*表示与对照品对照
*contrast with reference

图3 牡丹皮治疗慢性肾炎的PPI核心网络
以<0.05为筛选条件,共富集到87条通路,经过进一步查询文献,从中筛选出19条与慢性肾炎可能相关的通路,包括Toll样受体信号通路、T细胞受体信号通路等炎症相关通路,也包括磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、NF-κB信号通路等肾纤维化相关通路,提示牡丹皮可能主要通过这些通路起到抗炎、抗氧化、保护肾脏细胞的作用。见表4。

图4 核心靶点GO功能分析
2.3.2 牡丹皮治疗慢性肾炎的核心成分筛选 将筛选到的核心靶点与靶点所对应的化学成分进行靶点数量统计,选取频次大于频次中位数的成分再除去响应值<4000的成分,剩下的13个作为核心成分,分别是没食子酸、腺苷、没食子酸甲酯、2,3-二羟基-4-甲氧基苯乙酮、槲皮素、丹皮酚、乙酰香草酮、2,5-二羟基-4-甲基苯乙酮、儿茶素、白桦酸、芍药苷、牡丹皮苷F、牡丹皮苷G。主要为苯乙酮类、单萜苷类和没食子酸及其衍生物。“成分-靶标-通路”多维关联网络图见图5。
3 讨论
慢性肾脏疾病是一种慢性进行性发展的疾病,肾小管上皮细胞和血管内皮细胞受损后引起促炎因子的释放,这些因子会促进细胞外基质(extracellular matrix,ECM)的分泌,受损的上皮细胞、内皮细胞和活化的成纤维细胞释放基质金属蛋白酶(matrix metalloproteinase,MMP),成纤维细胞的活化造成大量ECM沉积,导致持续的慢性炎症,肾脏受到持续的损伤后,组织修复/再生异常导致其不能被完全修复,致使正常组织被纤维组织替代、丧失功能,最终引起肾功能衰竭。
表4 19条与慢性肾炎可能相关的通路
Table 4 Information of 19 related pathways
编号通路富集靶点数P值 hsa04024:cAMP signaling pathway182.35×10−8 hsa04062:chemokine signaling pathway176.17×10−8 hsa04620:Toll-like receptor signaling pathway131.57×10−7 hsa04020:calcium signaling pathway117.77×10−4 hsa04068:FoxO signaling pathway132.03×10−6 hsa04750:inflammatory mediator regulation of TRP channels114.69×10−6 hsa04022:cGMP-PKG signaling pathway131.14×10−5 hsa04151:PI3K-Akt signaling pathway191.42×10−5 hsa04066:HIF-1 signaling pathway102.86×10−5 hsa04621:NOD-like receptor signaling pathway 83.58×10−5 hsa04660:T cell receptor signaling pathway103.97×10−5 hsa04010:MAPK signaling pathway157.42×10−5 hsa04662:B cell receptor signaling pathway 81.39×10−4 hsa04630:Jak-STAT signaling pathway111.43×10−4 hsa04152:AMPK signaling pathway101.99×10−4 hsa04150:mTOR signaling pathway 73.82×10−4 hsa04064:NF-kappa B signaling pathway 85.89×10−4 hsa04540:gap junction 86.32×10−4 hsa04924:renin secretion 76.52×10−4

图5 “成分-靶标-通路”多维关联网络图
本研究运用UHPLC-QTOF-MS/MS联合UNIFI数据库,以及根据已有文献资料建立的牡丹皮化学成分库,在正、负离子2种扫描模式下,比较全面地预测了牡丹皮中的主要活性成分。ETCM数据库中牡丹皮化合物多数为没食子酸、芍药苷、丹皮酚衍生化合物,所以选用这3种对照品与UNIFI分析结果比对。明确活性成分后,进一步结合TCMIP平台对牡丹皮治疗慢性肾炎的分子机制进行了初步分析,得到了牡丹皮治疗慢性肾炎可能的13个关键活性成分,34个核心靶点和17条核心通路。其中,多个成分均有文献报道具有确切的抗炎、抗肾纤维化作用。
牡丹皮中没食子酸和没食子酸甲酯在慢性肾病长期治疗中具有肾脏保护作用,可调节NF-κB、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)等通路起到抗炎作用,在多柔比星诱导的大鼠慢性肾炎模型中通过抑制MMP-2,诱导超氧化物歧化酶升高,从而有效地抑制慢性肾炎中的炎症反应,增加肾脏重量和肾小球体积[8]。
牡丹皮中芍药苷类化合物芍药苷、牡丹皮苷F、牡丹皮苷G可降低促炎细胞因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β和IL-6的表达。有研究报道芍药苷可以治疗系膜增生性肾小球肾炎(mesangial proliferative glomerulonephritis,MPGN)大鼠血脂异常,同时显著降低24 h尿蛋白并促进肾功能,减轻系膜细胞增殖和炎症[9]。
黄酮类化合物儿茶素、槲皮素除了具有抗炎、抗氧化作用外,还可以通过激活肾上皮细胞中的Na⁺, K⁺-2Cl−协同转运蛋白1提高Cl−含量,促进上皮细胞Na+通道对Na+的重吸收减少,降低了体积依赖性升高的血压,有效缓解慢性肾炎过程中血瘀症状。腺苷参与了传入和传出动脉血管张力的调节,以及与肾素-血管紧张素系统的相互作用,证明腺苷信号传导也参与肾小球反馈机制、钠重吸收和对急性损伤(如缺血)的适应性反应[10]。
三萜类化合物白桦脂酸对腺嘌呤致慢性肾炎大鼠的转化生长因子-β(transforming growth factor β,TGF-β)、结缔组织生长因子、纤连蛋白、I型胶原蛋白和羟脯氨酸等肾纤维化指标起到逆转作用,白桦脂酸的肾保护和抗纤维化作用的生化机制可能是通过抑制促纤维化蛋白的产生,从而阻碍肾组织损伤并改善肾功能,具有肾保护潜力和抗纤维化活性[11]。
牡丹皮中还含有大量的丹皮酚及丹皮酚衍生物2,5-二羟基-4-甲基苯乙酮、去甲丹皮酚乙酰香草酮、2,3-二羟基-4-甲氧基苯乙酮等。这类化合物可以可抑制IL-1β诱导的NF-κB活化及PI3K和Akt磷酸化,可能通过调控PI3K/Akt通路来治疗慢性肾炎,且有研究报道抑制PI3K激活会减弱ECM积累,而抑制Akt会导致梗阻性肾病中肌成纤维细胞标志物减少[12-13]。一些间充质转化(epithelial-mesenchymal transition,EMT)调节剂,如Bmi1和胆绿素还原酶通过PI3K/Akt途径参与缺氧诱导的肾小管间质纤维化的治疗[14]。
PPI网络中显示,18个靶点在PPI网络中发挥重要作用,可视为牡丹皮治疗慢性肾炎的关键靶标。其中NFKBIA是NF-κB通路中重要的抑制剂。NF-κB是一种重要独特的核转录因子,有研究证明NF-κB可转录诱导黏附因子和单核细胞趋化因子,吸引单核细胞到炎症部位,同时转录一些炎症因子(IL-1β、TNF等)扩大炎症反应,促进肾纤维化的发展[15]。MAPK3是丝裂原活化蛋白激酶,在MAPK信号通路中发挥重要作用,有研究证明抑制p38 MAPK的表达可以减轻肾损伤[16]。MAPK作为TGF-β的下游通路,过度激活可能促进梗阻肾脏和TGF-β1处理的肾小管上皮细胞中的EMT过程[17]。有研究证明灵芝酸可通过抑制TGF-β/Smad和MAPK信号通路治疗单侧输尿管梗阻(unilateral uretera obstruction,UUO)诱导的肾纤维化[18]。本研究中MAPK3、NF-κBIA、IL6、IL1B等18个靶点在PPI网络中处于关键位置,牡丹皮活性成分主要通过这18个核心靶点发挥治疗慢性肾炎的作用。
“成分-靶标-通路”关联网络分析显示,牡丹皮活性成分可能通过调节趋化因子信号通路、Toll样受体信号通路、T细胞受体信号通路、B细胞受体信号通路、NF-κB信号通路、NOD样受体信号通路这6条通路发挥抗炎和清热作用。同时可能通过cAMP信号通路、PI3K/Akt信号通路等通路发挥抗纤维化和活血化瘀的作用。
综上所述,本研究运用UHPLC-QTOF-MS/MS技术结合中药整合药理学平台信息,分析了牡丹皮治疗慢性肾炎可能作用的靶点通路,初步阐述了牡丹皮滋阴补肾、活血化瘀的物质基础,为后续相关的机制研究和临床用药提供参考,还需通过进一步的实验研究加以验证。
利益冲突 所有作者均声明不存在利益冲突
[1] Iijima K, Sako M, Kamei K,.Rituximab in steroid-sensitive nephrotic syndrome: Lessons from clinical trials [J]., 2018, 33(9): 1449-1455.
[2] 王世荣.孙郁芝教授治疗慢性肾小球肾炎经验撷要 [J].中国民间疗法, 2014, 22(11): 12-14.
[3] 徐义峰, 王钰, 董辛, 等.基于数据挖掘的国医大师治疗慢性肾小球肾炎用药规律分析 [J].中医药临床杂志, 2021, 33(11): 2137-2141.
[4] 中国药典[S].一部.2020: 172.
[5] 徐义峰, 王钰, 董辛, 等.基于数据挖掘的国医大师治疗慢性肾小球肾炎用药规律分析 [J].中医药临床杂志, 2021, 33(11): 2137-2141.
[6] 许海玉, 刘振明, 付岩, 等.中药整合药理学计算平台的开发与应用 [J].中国中药杂志, 2017, 42(18): 3633-3638.
[7] 王镇方, 赵阳, 庞旭, 等.利用UPLC-Q-TOF-MSE快速分析四物汤中的化学成分 [J].中国中药杂志, 2013, 38(21): 3702-3708.
[8] Peng C C, Hsieh C L, Wang H E,.Ferulic acid is nephrodamaging while gallic acid is renal protective in long term treatment of chronic kidney disease [J]., 2012, 31(3): 405-414.
[9] Liu B H, Lin J, Bai L X,.Paeoniflorin inhibits mesangial cell proliferation and inflammatory response in rats with mesangial proliferative glomerulonephritis through PI3K/AKT/GSK-3β pathway [J]., 2019, 10: 978.
[10] Oyarzún C, Garrido W, Alarcón S,.Adenosine contribution to normal renal physiology and chronic kidney disease [J]., 2017, 55: 75-89.
[11] Sharma A, Thakur R, Lingaraju M C,.Betulinic acid attenuates renal fibrosis in rat chronic kidney disease model [J]., 2017, 89: 796-804.
[12] Zhang X L, Liang D, Fan J Y,.Zinc attenuates tubulointerstitial fibrosis in diabetic nephropathy via inhibition of HIF through PI3K signaling [J]., 2016, 173(2): 372-383.
[13] Rodríguez-Peña A B, Grande M T, Eleno N,.Activation of Erk1/2 and Akt following unilateral ureteral obstruction [J]., 2008, 74(2): 196-209.
[14] Zeng R, Yao Y, Han M,.Biliverdin reductase mediates hypoxia-induced EMT via PI3-kinase and Akt [J]., 2008, 19(2): 380-387.
[15] Chen J L, Hartono J R, John R,.Early interleukin 6 production by leukocytes during ischemic acute kidney injury is regulated by TLR4 [J]., 2011, 80(5): 504-515.
[16] Gava E, Samad-Zadeh A, Zimpelmann J,.Angiotensin-(1-7) activates a tyrosine phosphatase and inhibits glucose-induced signalling in proximal tubular cells [J]., 2009, 24(6): 1766-1773.
[17] Sholokh A, Klussmann E.Local cyclic adenosine monophosphate signalling cascades-roles and targets in chronic kidney disease [J]., 2021, 232(1): e13641.
[18] Zhang X L, Liang D, Fan J Y,.Zinc attenuates tubulointerstitial fibrosis in diabetic nephropathy via inhibition of HIF through PI3K signaling [J]., 2016, 173(2): 372-383.
[19] Rodríguez-Peña A B, Grande M T, Eleno N,.Activation of Erk1/2 and Akt following unilateral ureteral obstruction [J]., 2008, 74(2): 196-209.
[20] Zeng R, Yao Y, Han M,.Biliverdin reductase mediates hypoxia-induced EMT via PI3-kinase and Akt [J]., 2008, 19(2): 380-387.
[21] Dou F, Liu, Y T; Liu L M,Aloe-emodin ameliorates renal fibrosis via inhibiting PI3K/Akt/mTOR signaling pathwayand[J]., 2019, 22(3): 218-229.
Screening and mechanism analysis of active components ofin treatment of chronic nephritis based on UHPLC-QTOF-MS/MS and TCMIP
ZHANG Tong1,2, QIN Yue-wen2, WANG Ping2, ZHAO Neng-wu1
1.Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China 2.Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
To screen the active components of Mudanpi () in the treatment of chronic nephritis based on ultra-high performance liquid chromatography-quadrupole time of flight mass spectrometry (UHPLC-QTOF-MS/MS) and Chinese Medicine Integrated Pharmacology Research Platform (TCMIP v2.0).The mechanism of action was analyzed.UHPLC-QTOF-MS/MS was used to qualitatively analyze the chemical components ofin positive and negative ion scanning mode, respectively; The candidate target spectrum ofand the gene set of chronic nephritis were collected based on TCMIP v2.0; The protein-protein interaction (PPI) network between the above targets was constructed based on TCMIP v2.0 platform, and the core targets of the network was determined according to the network eigenvalues.Gene ontology (GO) functional analysis and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were carried out by DAVID v6.8 software (http://david.abcc.ncifcrf.gov/), the pathways associated with chronic nephritis was selected as the core pathway; The chemical components of the corresponding targets of the core pathways were delineated, and the number of targets, target frequency and component content of each component were counted; the core components ofin the treatment of chronic nephritis were determined according to the statistical results.Cytoscape 3.8.0 software was used to construct the “component-target-pathway” multi-dimensional association network.A total of 73 chemical constituents inwere identified in positive and negative ion modes; 123 core nodes were obtained by analyzing the PPI interaction network; 17 pathways associated with chronic nephritis were enriched by KEGG enrichment analysis; 13 key active ingredients were obtained through comprehensive screening of response values.The 13 key active components inmay treat chronic nephritis by regulating 17 pathways such as nuclear factor-κB (NF-κB) signaling pathway, phosphatidylinositol-3-hydroxykinase (PI3K)/protein kinase B (Akt) signaling pathway, etc.The results lay a certain foundation for further research on the mechanism ofin the treatment of chronic nephritis.
; chronic nephritis; integrative pharmacology; active ingredients; mechanism of action; UHPLC-QTOF-MS/MS; gallic acid; paeoniflorin; paeonol
R284;R285
A
0253 - 2670(2022)09 - 2756 - 12
10.7501/j.issn.0253-2670.2022.09.019
2022-01-20
中国中医科学院科技创新工程(C12021A04904)
张 瞳,在读硕士研究生,从事中药药理学研究。Tel: (010)64014411 E-mail: T249454@163.com
通信作者:王 萍,博士,研究员,从从事中药血清药物化学、中医方证代谢组学及脑卒中的发病机制研究。E-mail: hudielanwp@sina.com
赵能武,教授,主要从事民族医药及药用植物研究工作。E-mail: zhaonw1001@163.com
[责任编辑 潘明佳]
