基于糖类成分探究黄精炆制前后差异
2022-05-06詹慧慧姚方程魏惠珍陈西勇陈华师金浩鑫
詹慧慧,姚方程,易 斌,魏惠珍, ,陈西勇,吕 尚,陈华师,金浩鑫,饶 毅, *
基于糖类成分探究黄精炆制前后差异
詹慧慧1,姚方程2,易 斌2,魏惠珍1, 3,陈西勇2,吕 尚1,陈华师2,金浩鑫3,饶 毅1, 3*
1.江西中医药大学,江西 南昌 330004 2.建昌帮药业有限公司,江西 抚州 344700 3.中药固体制剂制造技术国家工程研究中心,江西 南昌 330006
基于黄精炆制前后糖类成分变化差异探讨黄精炆制后“减毒增效”的作用机制。采用UV(紫外分光光度)法,测定黄精炆制前后的总多糖含量;采用高效液相色谱-蒸发光散射检测器(HPLC-ELSD)法测定黄精炆制前后游离糖含量;采用高效凝胶渗透色谱-示差折光检测器(HPGPC-RI)法分析黄精炆制前后的多糖相对分子质量;采用高效液相色谱-紫外检测器(HPLC-PDA)法对黄精多糖的单糖组成进行测定分析。黄精炆制后,总多糖含量下降约60%;游离糖中蔗糖含量降低35%,果糖含量升高22倍,葡萄糖含量升高4.4倍;炆制后相对分子质量2个峰均降低1~5倍;黄精炆制前后多糖均由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖组成,生黄精单糖组成物质的量比为甘露糖-鼠李糖-葡萄糖-半乳糖-阿拉伯糖(10∶6∶25∶7∶1);炆制后物质的量比为7∶5∶1.7∶14∶1。炆法炮制对黄精糖类成分影响较大,炆制后多糖发生水解及结构发生改变,从而使黄精麻舌感消失,药效增强。
炆黄精;黄精多糖;多糖含量;游离糖;相对分子质量;单糖组成
黄精为百合科滇黄精Coll.et Hemsl.、黄精Red、多花黄精Hua的干燥根茎,是我国常用大宗药材之一,具有补气养阴、健脾、润肺、益肾等功效[1],其药效显著,应用范围广泛[2]。目前已有黄精颗粒、黄精饮料[3-4]等多种剂型上市。现代药理研究表明,黄精具有抗衰老、保护心肌细胞、抗疲劳、抗肿瘤、提高免疫力、调血糖、调血脂等药理作用,其药效的物质基础通常为多糖类成分[5-8]。《中国药典》2020年版[1]亦是以总多糖作为黄精的质量评价指标。
孟诜等[9]在《食疗本草》一书对黄精有“蒸之若生,则刺人咽喉”的记载,可知黄精生用对喉舌具有一定刺激性,接触过生黄精或其汁液的皮肤会产生瘙痒的感觉,久闻其生味,有刺目之感。故现代临床用药多为制黄精。药典中黄精炮制方法为酒制,九蒸九晒[10]也是黄精传统炮制方法之一。此外,中药炮制四大帮之一的建昌帮独创的炆法炮制黄精传承十二道古法炮制工艺,颇具特色。江南药界至今还流传着“药不过樟树不灵,药不过建昌不行”的谚语。炆黄精与酒黄精、九蒸九晒黄精虽在本质上均为生黄精反复蒸煮而成,但炆黄精在工具、时间及辅料都有其独特之处,故无论在化学成分还是药理方面黄精炮制后均存在差异。吴丰鹏等[11]测定了黄精九蒸九晒前后的总多糖含量及单糖组成结果表明黄精九蒸九晒后总多糖含量降低,单糖组成物质的量比发生较大改变;万晓莹等[12]测定黄精酒制前后的相对分子质量及免疫活性表明炮制后相对分子质量差异较大且免疫活性增强;冯婧等[13]通过比较不同炮制方法黄精的多糖得率和体外抗氧化实验结果表明黄精炮制后抗氧化活性增强;林雨等[14]也通过黄精九蒸九晒后化学成分变化差异结果,表明九蒸九晒黄精后化学成分显著变化;杨华杰等[15]研究发现炆黄精相较于酒黄精、九蒸九晒黄精具有更强的抗疲劳及抗氧化作用。
炆即“煴”,出自《集韵》[16],即没有火焰的微火慢煮。所谓炆法是指将净药材以水浸透后,装入陶制炆药坛内,加入清水及辅料,置糠火中用文火慢慢煨煮至熟的制法,属水火共制法。炆制后的黄精黑色如漆,气味香醇,补益效果极佳。目前炆黄精的研究尚停留在采用GC-MS法、HPLC法测定炆黄精的非糖类化学成分[17-18]或单糖和寡糖类成分[19]的研究,尚未有对于炆黄精多糖成分的研究。故本实验以炆黄精为研究对象,采用UV法测定黄精炆制前后总多糖的含量、HPLC法测定黄精炆制前后游离糖的含量;HPGPC法分析炆制前后相对分子质量变化以及柱前衍生化(PMP-HPLC)方法对单糖组成进行研究。基于黄精炆制前后糖类成分变化探讨炆制后黄精“减毒增效”机制,以期为炆黄精药效研究提供物质基础数据。
1 仪器与材料
1.1 仪器
CS101-2E电热鼓风干燥箱,重庆万达仪器有限公司;HH-S6恒温水浴锅,巩义市予华仪器有限责任公司;MS205DU AB104-N十万分之一天平,瑞士Mettler-Toledo公司;Milli-Q超纯水仪,美国Millipore公司;CTL550台式低速大容量离心机,湖南湘立科学仪器有限公司;UV-2550紫外-可见分光光度计、Shimadzu LC-20AT高效液相色谱仪-紫外检测器、LC-20AD高效凝胶色谱仪-示差折光检测器,日本岛津公司;Waters 2695-Alltech ELSD 2000-高效液相色谱仪-蒸发光散射检测器,美国Waters公司。
1.2 材料
1.2.1 对照品 鼠李糖(质量分数99.9%,批号111683-201502)、葡萄糖(质量分数99.9%,批号110833-201707)、木糖(质量分数99.9%,批号111508-201605)、甘露糖(质量分数99.4%,批号140651-201504)、半乳糖(质量分数99.5%,批号190090-201501)、阿拉伯糖(99.5%,批号111506- 200202)、果糖(质量分数99.7%,批号BCY- 000366)、蔗糖(质量分数99.7%,批号GBW10067)、右旋糖酐相对分子质量(p,技术峰位相对分子质量,多糖相对分子质量的表述方式之一)标准(套)[对照品右旋糖酐D3p9750、右旋糖酐D4p13 050、右旋糖酐D5p36 800、右旋糖酐D6p64 650、右旋糖酐D7p135 350、右旋糖酐D2000p2 000 000,批号140637-201203]均由中国食品药品检定研究院提供。
1.2.2 试剂 乙腈,色谱纯,美国Anaqua安可化学;盐酸、硫酸、甲醇、无水乙醇、石油醚、乙醚、丙酮、三氯甲烷、正丁醇,分析纯,上海品究化工有限公司;氯化钠、硫酸钠、氢氧化钠等其他试剂,西陇科学股份有限公司;麻姑酒,批号F006- 210701,酒精度15.5%,江西郑记麻姑酒业有限公司,检验结果符合黄酒《GB/T13662-2018》出厂项目要求。
1.3 样品信息
本研究所用黄精药材均由江西省建昌帮药业有限公司提供,经由江西中医药大学付小梅教授鉴定为黄精属百合科黄精Red、滇黄精Coll.et Hemsl.、多花黄精Hua的干燥根茎。炆黄精饮片是参照《江西省中药饮片炮制规范》及《建昌帮炮制规范》项下炆黄精炮制方法制得,黄精药材编号为M1~M20,炆黄精编号为S1~S20。饮片基本信息见表1。
表1 黄精、炆黄精样品信息
Table 1 Sample information of Polygonati Rhizoma and stewed Polygonati Rhizoma
基原生黄精炆黄精 编号产地生长年限/年编号来源 黄精M1河南南阳西峡米坪7S1M1炆制成品 M2河南南阳西峡西坪 S2M2炆制成品 M3河南南阳西峡双龙镇 S3M3炆制成品 M4湖北十堰李家坡 S4M4炆制成品 M5湖北十堰郭家湾 S5M5炆制成品 M6湖北十堰大羊圈 S6M6炆制成品 M7湖北十堰西沟 S7M7炆制成品 M8湖北十堰陈家湾 S8M8炆制成品 M9湖北十堰庙湾 S9M9炆制成品 M10湖南双凤乡 S10M10炆制成品 M11湖南油洋乡 S11M11炆制成品 M12湖南罗子山 S12M12炆制成品 M13湖南安化 S13M13炆制成品 M14湖北十堰曹家湾 S14M14炆制成品 M15河南南阳西峡石界河 S15M15炆制成品 M16湖南高桥乡 S16M16炆制成品 滇黄精M17云南5S17M17炆制成品 M18贵州 S18M18炆制成品 多花黄精M19浙江5S19M19炆制成品 M20江西 S20M20炆制成品
2 方法与结果
2.1 炆法炮制工艺
取原药,去除杂质,洗净,用清水漂约1 d,取出,沥干水,放入炆药罐内,每罐装药2/3(黄精10 kg,加水10 L,麻姑酒2 kg),加入温水,上盖,移至围灶内,堆放干糠,点燃后炆1 d,至药熟汁尽,取出,干燥;用麻姑酒喷洒均匀,闷润,待吸尽后,蒸6 h,焖1夜,至转黑色时,取出,干燥至半干,切斜厚片,干燥。
2.2 黄精、炆黄精总多糖含量与游离糖含量测定
2.2.1 黄精炆制前后总多糖含量测定
(1)葡萄糖标准曲线的绘制:精密称取无水葡萄糖对照品适量置100 mL量瓶中,加水溶解并稀释定容至刻度,摇匀,制得无水葡萄糖溶液质量浓度为0.33 mg/mL。精密量取上述对照品溶液0.l、0.2、0.3、0.4、0.5、0.6 mL,分别置10 mL具塞刻度试管中,各加水至2.0 mL,摇匀。在冰水浴中缓缓滴加0.2%蒽酮-硫酸溶液至刻度,混匀,放冷后置水浴中保温10 min,取出,立即置冰水浴中冷却10 min,取出,以相应试剂为空白。照紫外-可见分光光度法,在582 nm波长处测定吸光度()值。以葡萄糖质量浓度为横坐标(),值为纵坐标()进行线性回归,得回归方程=35.912+0.050 8,2=0.997 8,结果表明葡萄糖在33~198 μg/mL线性关系良好。
(2)黄精总多糖含量测定:取60 ℃干燥至恒定质量的本品细粉约0.25 g,精密称定,置圆底烧瓶中,加80%乙醇150 mL,置水浴中加热回流1 h,趁热滤过,残渣用80%热乙醇洗涤3次,每次10 mL,将残渣及滤纸置烧瓶中,加水150 mL,置沸水浴中加热回流1 h,趁热滤过,残渣及烧瓶用热水洗涤4次,每次10 mL,合并滤液与洗液,放冷,转移至250 mL量瓶中,加水至刻度,摇匀。精密量取l.0 mL,置10 mL具塞干燥试管中,加水至2.0 mL,摇匀,在冰水浴中缓缓滴加0.2%蒽酮-硫酸溶液至刻度,混匀,放冷后置水浴中保温10 min,取出,在582 nm波长处测定值。从标准曲线上读出供试品溶液中含无水葡萄糖的质量,计算,即得。取(M12、M18、M19)3批生黄精药材及对应的炆黄精饮片(S12、S18、S19),按上述方法制备供试品溶液,测定,将测得值带入标准曲线,计算多糖含量,即得。多糖含量测定结果见表2。
2.2.2 黄精及炆黄精游离糖含量测定
(1)对照品溶液的制备:分别精密称取减压干燥至恒定质量的果糖、葡萄糖、蔗糖对照品适量,置于同一10 mL量瓶中,加水溶解并稀释定容至刻度,摇匀。制得果糖质量浓度为1.107 mg/mL、葡萄糖质量浓度为0.518 mg/mL、蔗糖质量浓度为0.712 mg/mL的混合对照品溶液。
(2)供试品溶液的制备:精密称取本品细粉0.20 g,加50 mL超纯水,密塞,称定质量,加热回流30 min后,放冷,再称定质量,用超纯水补足减失的质量,摇匀,过0.22 μm水相微孔滤膜,即得供试品溶液。
(3)色谱条件:仪器为Waters2695-Alltech ELSD 2000-高效液相色谱仪-蒸发光散射检测器;色谱柱为Sepax HP-Amino(250 mm×4.6 mm,5 μm);流动相为乙腈-水(85∶15);柱温30 ℃;体积流量1.0 mL/min;漂移管温度80 ℃;载气体积流量2.0 mL/min。
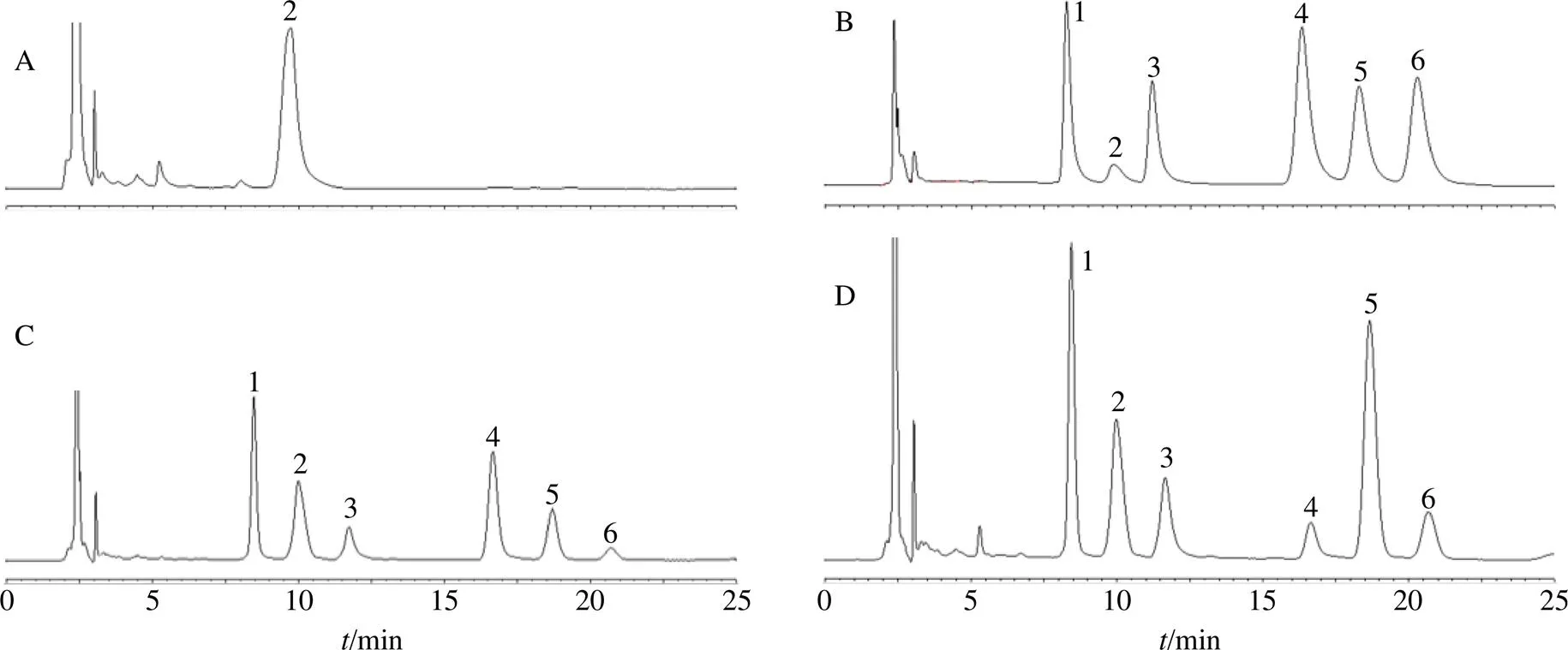
(4)样品测定:取M12、M18、M19 3批生黄精药材及对应的炆黄精饮片(S12、S18、S19),按上述方法制备供试品溶液,按上述色谱条件测定,色谱图见图1,计算结果见表2。
w
A-空白溶剂 B-混合对照品 C-生黄精药材 D-炆黄精饮片
A-blank solvent B-mixed reference substances C-rawD- stewed
图1 黄精炆制前后游离糖HPLC图谱
Fig.1 HPLC of free sugars before and after stewed of
表2 黄精炆制前后多糖及游离糖含量测定结果(n = 2)
Table 2 Results of polysaccharide contents and free sugar contents before and after stewed of Polygonati Rhizoma (n = 2)
基原规格编号质量分数/% 总多糖蔗糖果糖葡萄糖 黄精生黄精M1210.502.431.610.67 炆黄精S124.091.4525.952.59 滇黄精生黄精M1811.603.191.090.58 炆黄精S184.692.1430.992.22 多花黄精生黄精M1912.173.043.060.82 炆黄精S194.861.9638.714.36
2.3 黄精及炆黄精Mp测定
2.3.1 对照品溶液的制备 称取已知p的右旋糖酐p标准(套)D3、D4、D5、D6、D7、D2000系列对照品适量,用0.05 mol/L硫酸钠水溶液(流动相)溶解制成10 mg/mL的对照品溶液。
2.3.2 供试品溶液的制备 分别精密称取黄精药材、炆黄精饮片粗粉50 g,置圆底烧瓶中,加石油醚(沸点60~90 ℃)150 mL,66 ℃回流提取4 h脱脂。样品挥干溶剂后加150 mL乙醚浸提过夜,进一步脱脂。挥干溶剂加入150 mL 80%乙醇84 ℃回流4 h。样品倒去上层液,置于烘箱60 ℃烘干至恒定质量,得脱脂黄精。
取上述脱脂黄精,加400 mL超纯水,100 ℃水浴2 h,取上层液。再加超纯水300 mL,100 ℃水浴2 h。合并2次上层液,浓缩至100 mL,加入适量80%乙醇,沉淀过夜。取醇沉后的上层液,浓缩,加适量80%乙醇,沉淀过夜,重复2次。将3次沉淀物,用丙酮清洗,置于烘箱中60 ℃烘干至恒定质量,得黄精粗多糖。
取上述制备黄精粗多糖,分别加适量超纯水复溶,按4∶1比例加入Sevage[三氯甲烷-正丁醇(4∶1)]试剂,充分震摇,4000 r/min离心(离心半径为10 cm)20 min,弃去下层变性蛋白沉淀,取上清液,重复2次以上操作,干燥,得脱蛋白的多糖。加入少许适量的活性炭颗粒与沸石,于电热套上加热至微沸,保持微沸约1 h,除去色素,得精多糖。
精密称定上述制备的精多糖适量,以0.05 mol/L硫酸钠水溶液溶解并稀释摇匀,得2.5 mg/mL的供试品溶液。
2.3.3 色谱条件 仪器为LC-20AD-高效液相色谱仪-示差折光检测器,Lab Solutions含GPC软件;色谱柱为Shodex Ashipak GF-7M HQ(300 mm×7.6 mm,9 μm);流动相为0.05 mol/L硫酸钠水溶液;体积流量0.5 mL/min;柱温40 ℃;进样量10 μL;示差折光检测器池温40 ℃。
2.3.4 样品测定 取M12、M18、M19 3批生黄精药材及对应的炆黄精饮片(S12、S18、S19),按“2.3.2”项下方法制备供试品溶液,按“2.3.3”项下色谱条件测定,色谱图见图2,计算结果见表3。
通过对黄精及炆黄精中总多糖、游离糖含量、多糖相对分子质量大小测定,炆制前后变化见表4,炆制后黄精中总多糖及蔗糖的含量因水解作用降低,作为水解产物的果糖和葡萄糖含量随之增大;另外,多糖无甜味,但果糖和葡萄糖为目前市场公认的甜味剂,此研究结果与黄精炆制后甜味增加一致。此外,水解作用会破坏糖苷键,将多糖水解为相对分子质量较小的结构单位单糖,本研究结果中作为水解产物的果糖和葡萄糖的含量增加,从侧面印证了黄精多糖在炆法炮制过程中,多糖发生了较为剧烈的水解。

A-标准品图谱 B-标准曲线 C-生黄精与炆黄精Mp测定图谱 D-空白溶剂Mp测定图谱
表3 黄精炆制前后多糖Mp及其分布(n = 2)
Table 3 Molecular weight and distribution of Polygonati Rhizoma polysaccharides before and after stewed (n = 2)
基原规格编号重均相对分子质量(Mw)/104数均相对分子质量(Mn)/104分布系数(Mw/Mn) 峰1峰2峰1峰2峰1峰2 黄精生黄精M1290.9354.09360.0053.6691.521.12 炆黄精S1221.6421.4644.9221.2624.391.56 滇黄精生黄精M18102.6094.98756.7274.3611.811.14 炆黄精S1837.4196.0525.0121.7831.091.21 多花黄精生黄精M19151.9849.28022.8906.1906.391.49 炆黄精S1927.4341.80814.1860.9691.931.86
表4 黄精炆制前后总多糖、游离糖含量及相对分子质量变化
Table 4 Changes in total polysaccharide content, free sugar content and molecular weight before and after stewed of Polygonati Rhizoma
样品质量分数/%Mp 总多糖蔗糖果糖葡萄糖峰1峰2 生黄精11.42±0.852.89±0.401.92±1.390.69±0.121 151.76±324.0061.20±27.73 炆黄精4.55±0.401.85±0.3631.88±6.433.06±1.14288.32±79.8131.08±25.55
2.4 黄精及炆黄精单糖组成分析
2.4.1 对照品溶液制备 取减压干燥至恒定质量的甘露糖、鼠李糖、葡萄糖、阿拉伯糖、半乳糖适量,置于同一10 mL量瓶中,加水稀释并定容至刻度,制得含有甘露糖105.8 μg/mL、鼠李糖105.5 μg/mL、葡萄糖102.4 μg/mL、阿拉伯糖107.4 μg/mL、半乳糖104.9 μg/mL的混合对照品溶液。
2.4.2 供试品溶液制备 精密称取本品0.30 g,置索氏提取器中,加80%乙醇适量,加热回流提取4 h,弃去液体,药渣挥干乙醇,滤纸筒拆开置于烧杯中,加水100 mL,回流1 h,混匀,离心,吸取上清液1.0 mL,置西林瓶中,加3.0 mol/L盐酸溶液0.5 mL,封口,混匀,110 ℃水解3 h,放冷,用3.0 mol/L氢氧化钠溶液调节pH值至中性。吸取400 μL,加0.5 mol/L 1-苯基-甲基-5-吡唑啉酮(PMP)甲醇溶液与0.3 mol/L氢氧化钠溶液各400 μL,混匀,70 ℃水浴反应100 min。再加0.3 mol/L盐酸溶液500 μL,混匀,用三氯甲烷洗涤3次,每次5 mL,弃去三氯甲烷液,水层离心,即得。
2.4.3 色谱条件 仪器为Shimadzu LC-20AT高效液相色谱仪-紫外检测器;色谱柱为Agilent Eclipse XDB-C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.02 mol/L乙酸铵水溶液(20∶80);检测波长250 nm;体积流量1.0 mL/min;柱温30 ℃。
2.4.4 精密度试验 取1个批次生黄精药材(M19)与炆黄精饮片(S19),按最终确定“2.4.2”项下方法制样,按“2.4.3”项下色谱条件连续分析6次,计算甘露糖、鼠李糖、葡萄糖、半乳糖及阿拉伯糖5个峰的相对保留时间和相对峰面积的RSD分别为0.26%、0.44%、0.24%、0.22%、0.18%和0.92%、2.86%、1.19%、0.57%、2.23%,均低于3%,说明仪器精密度良好。
2.4.5 稳定性试验 取1个批次生黄精药材(M19)与炆黄精饮片(S19),按最终确定“2.4.2”项下方法制样,于0、2、4、8、12、24 h按“2.4.3”项下色谱条件分析,计算甘露糖、鼠李糖、葡萄糖、半乳糖及阿拉伯糖5个峰的相对保留时间和相对峰面积的RSD分别为0.21%、0.25%、0.24%、0.24%、0.25%和1.46%、2.49%、1.39%、0.94%、2.24%,样品溶液稳定。
2.4.6 重复性试验 取1个批次生黄精药材(M19)与炆黄精饮片(S19),按最终确定“2.4.2”项下方法平行制样6份,按“2.4.3”项下色谱条件进行分析,计算甘露糖、鼠李糖、葡萄糖、半乳糖及阿拉伯糖5个峰的的相对保留时间和相对峰面积的RSD分别为0.48%、0.75%、0.66%、0.72%、0.70%和1.77%、1.54%、2.38%、1.09%、1.58%,结果表明该方法重复性好。
2.4.7 加样回收率试验 精密称取1个批次生黄精药材(M19)与炆黄精饮片(S19)0.15 g,9份,置索氏提取器中,加80%乙醇适量,加热回流提取4 h,弃去液体,药渣挥干乙醇,滤纸筒拆开置于烧杯中,分别按照各单糖含量的80%、100%、120%加入5种单糖对照品,加水100 mL,回流1 h,混匀,离心,吸取上清液1.0 mL,置西林瓶中,加3.0 mol/L盐酸溶液0.5 mL,封口,混匀,110 ℃水解3 h,放冷,用3.0 mol/L氢氧化钠溶液调节pH值至中性。吸取400 μL,加0.5 mol/L PMP甲醇溶液与0.3 mol/L氢氧化钠溶液各400 μL,混匀,70 ℃水浴反应100 min。再加0.3 mol/L盐酸溶液500 μL,混匀,用三氯甲烷洗涤3次,每次5 mL,弃去三氯甲烷液,水层离心,即得供试品溶液。按“2.4.3”项下色谱条件分析。计算甘露糖、鼠李糖、葡萄糖、半乳糖及阿拉伯糖5个峰的平均加样回收率分别为95.68%、97.48%、99.14%、97.57%、99.60%,RSD分别为2.42%、2.56%、2.18%、2.67%、2.55%,表明该方法准确度好。
2.4.8 样品测定 取上述20批生黄精药材及对应的炆黄精饮片,按上述供试品溶液制备方法制备供试品溶液,按上述色谱条件,注入高效液相色谱仪测定,色谱图见图3,测定结果见表5。
2.5 黄精及炆黄精单糖组成聚类分析
利用Hiplot可视化平台,对黄精及炆黄精单糖组成进行聚类分析,结果如图4所示,可以明显看出,生黄精药材与炆黄精饮片明显分为2大类(A类生黄精;B类炆黄精),随着热图中颜色的增加,表明单糖物质的量比的值越大,说明黄精炆制前后存在明显差异。生黄精药材中葡萄糖物质的量比占比最高,炆制后半乳糖物质的量比占比最高,可能是高温加热使得糖发生了异构化反应所致[20],但具体反应机制还需进一步研究。如表6所示,炆制前后黄精甘露糖、鼠李糖以及阿拉伯糖平均物质的量比变化无显著性差异,而黄精炆制前后葡萄糖的物质的量比显著降低,半乳糖物质的量比明显升高,说明炆法炮制对于多糖的单糖组成发生了改变,进一步影响多糖的生物活性。
A-空白图谱 B-5个单糖混合对照品图谱 C-生黄精 D-炆黄精 1-甘露糖 2-PMP试剂峰 3-鼠李糖 4-葡萄糖 5-半乳糖 6-阿拉伯糖
表5 黄精炆制前后单糖组成物质的量比(n = 2)
Table 5 Substance ratio of monosaccharides Polygonati Rhizoma before and after stewed (n = 2)
样品单糖组成及物质的量比样品单糖组成及物质的量比 甘露糖鼠李糖葡萄糖半乳糖阿拉伯糖甘露糖鼠李糖葡萄糖半乳糖阿拉伯糖 M10.209 60.118 70.500 40.151 80.019 5S10.253 40.162 40.058 20.493 00.033 1 M20.277 60.122 30.397 50.178 30.024 3S20.279 40.152 10.061 00.470 30.037 1 M30.204 80.095 10.522 00.157 30.020 7S30.341 30.130 40.065 20.431 60.031 4 M40.213 60.090 70.527 80.148 10.019 9S40.321 20.145 20.064 00.435 30.034 2 M50.258 30.096 80.464 90.160 00.020 0S50.281 80.131 90.071 00.478 10.037 2 M60.267 10.067 40.550 10.100 80.014 5S60.279 80.123 30.080 30.474 30.042 4 M70.291 60.265 70.245 40.147 80.049 5S70.351 70.239 00.056 70.318 30.034 3 M80.311 80.112 50.454 60.106 40.014 7S80.338 80.150 40.077 10.393 90.039 8 M90.282 20.093 30.441 20.157 70.025 6S90.366 50.136 90.064 30.397 20.035 2 M100.417 70.130 40.437 50.283 60.030 9S100.288 70.163 30.054 40.457 10.036 4 M110.463 70.169 70.450 30.195 20.021 1S110.350 60.170 90.058 70.384 80.034 9 M120.333 20.112 90.410 50.128 10.015 2S120.339 10.157 20.054 30.416 30.033 1 M130.334 00.078 00.429 80.141 50.016 7S130.259 70.098 60.036 60.383 60.021 5 M140.274 00.104 30.478 90.127 80.014 9S140.319 60.157 20.080 70.405 60.036 8 M150.215 40.119 50.442 30.190 90.031 8S150.279 20.164 80.062 50.454 50.039 0 M160.241 70.231 40.409 60.093 60.023 8S160.328 00.146 00.107 10.381 40.037 5 M170.039 00.095 30.711 50.140 50.013 6S170.088 90.196 30.049 40.641 60.023 9 M180.021 20.346 20.554 40.146 00.032 3S180.076 70.249 90.040 50.594 00.038 8 M190.032 90.145 80.574 90.234 40.012 0S190.016 00.173 50.274 50.504 80.031 3 M200.050 00.189 30.494 40.240 00.026 2S200.064 00.252 90.064 20.573 00.045 9
3 讨论
3.1 黄精炆制“麻舌感”消除机制分析
关于黄精生用产生“麻舌感”的描述,历代医籍均有记载[21-22]。有文献表明[23]黄精产生麻舌感的主要成分为黏液质,是一类由黄精多糖与某类蛋白质形成的复合物(凝聚素)。据民间临床应用反馈,炆黄精口感、色泽俱佳,无麻舌刺激之感。通过对黄精炆制前后总多糖含量测定结果表明,炆黄精总多糖含量明显低于生黄精,推测是在炆制过程中,黏液质成分被破坏,从而麻舌感减轻。此外本实验对黄精及炆黄精游离糖含量进行了测定,发现黄精炆制后游离糖含量显著升高,游离糖尤其是果糖具有较高甜度,可以起到改善口感,调和诸味的作用,在一定程度上也降低了药材对喉舌的刺激性。

A-生黄精 B-炆黄精
表6 黄精炆制前后单糖组成平均物质的量比比较
Table 6 Comparison of the average substance ratio of monosaccharide composition before and after stewed of Polygonati Rhizoma
规格平均物质的量比 甘露糖鼠李糖葡萄糖半乳糖阿拉伯糖 生黄精0.236 9±0.122 00.139 3±0.070 20.474 9±0.091 10.161 5±0.048 00.022 4±0.008 9 炆黄精0.261 2±0.108 20.165 1±0.041 00.074 0±0.049 60.454 4±0.079 20.035 2±0.005 6
3.2 黄精炆制后增效机制分析
有关药理药效实验表明[24-28],黄精炮制后确实可增强其补益之效。黄精多糖[7]具有抗氧化、抗疲劳、提高免疫力等作用,是黄精的主要活性成分。有研究报道[29]多糖药效的发挥与其相对分子质量有关,相对分子质量过大或过小均无法被人体有效利用,通常是中等相对分子质量多糖药效最佳[11]。现阶段常有学者以物理法、降解法、和衍生化法等手段[29]人为地降低多糖相对分子质量。本研究中采用HPGPC法对黄精炆制前后多糖相对分子质量分布进行测定,结果表明生黄精多糖相对分子质量w主要分布在40 930~92 800,与万晓莹等[12]测定黄精酒制前后的相对分子质量结果存在差异,推测可能是由于品种不同。黄精炆制后多糖相对分子质量w主要分布在9300~18 080,呈显著下降趋势,说明黄精中大相对分子质量多糖经炆制后发生了水解,服用后人体吸收率提高,推测此为黄精炮制后“滋阴润肺,补肾壮阳”之效增强的机制之一。
《神农本草经》[30]曾云:“(黄精)多年不老,白发更黑,齿落更生”;《名医别录》[31]也指出黄精“补中益气,久服轻身,延年不饥”。作为药食同源的中药材,黄精可有效延缓衰老,历来有“仙人余粮”的美誉。
本实验采用HPLC-PDA结合衍生化方法进行黄精多糖炆制前后的单糖组成,测定结果表明生黄精多糖的单糖组成平均物质的量比为甘露糖-鼠李糖-葡萄糖-半乳糖-阿拉伯糖(10∶6∶25∶7∶1);炆制后黄精多糖的单糖组成平均物质的量比为7∶5∶1.7∶14∶1。吴丰鹏等[11]测定了黄精九蒸九制前后的总多糖含量及单糖组成,同时测定了体外抗氧化活性发现炮制后多糖含量较生品降低了72%(炆黄精降低60%),半乳糖物质的量比同样显著提高,且抗氧化活性增强,说明黄精炆制或九蒸九制化学成分变化趋势相似,但炆黄精可更大程度保留多糖成分;炆制后黄精多糖葡萄糖物质的量比降低,半乳糖物质的量比升高,因此,可推测黄精炆制可使抗氧化(抗衰老)作用增强。
3.3 小结与展望
炆黄精作为建昌帮主打5大炆药之一,其历史悠久,疗效显著,老少皆宜。对炆黄精的开发利用不仅具有极大的市场价值,也有利于传统中医药文化的传承与发扬。因此本研究以炆黄精为研究对象,系统分析了炆制前后多糖含量、相对分子质量及单糖组成,对黄精炆制药效变化机制进行初步探讨,可为后续找寻炆黄精药效物质基础,完善相应质量标准等提供思路。多糖为具有复杂空间构型的大分子化合物[32],本实验仅通过上述研究内容尚不足以阐明黄精多糖的结构与药效关系,还需要进一步对多糖糖苷键类型、分子链及空间构象等进行更深入的探究,从而为炆黄精及其相关衍生产品的深度开发奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部.2020: 319.
[2] 程喜乐, 曲寿河, 纪宏媛, 等.黄精性味归经及功效应用的古今演变 [J].中华中医药杂志, 2021, 36(5): 2704-2708.
[3] 孙修成, 王哲靖, 毛丹丹, 等.复合黄精饮料的配方及工艺优化 [J].食品工业, 2021, 42(1): 103-108.
[4] 李惠.速溶黄精茶加工工艺研究 [D].合肥: 安徽农业大学, 2012.
[5] 陈宇, 周芸湄, 李丹, 等.黄精的现代药理作用研究进展 [J].中药材, 2021, 43(1): 240-244.
[6] 任洪民, 邓亚羚, 张金莲, 等.药用黄精炮制的历史沿革、化学成分及药理作用研究进展 [J].中国中药杂志, 2020, 45(17): 4163-4182.
[7] 赵文莉, 赵晔, Tseng Y.黄精药理作用研究进展 [J].中草药, 2018, 49(18): 4439-4445.
[8] 党艳妮, 黄壮壮, 苏英英, 等.基于网络药理学的黄精抗肿瘤成分筛选研究 [J].药物评价研究, 2020, 43(3): 468-472.
[9] 孟诜,张鼎.食疗本草 [M].北京: 人民卫生出版社, 1984: 10.
[10] 秦宇雯, 张丽萍, 赵祺, 等.九蒸九晒黄精炮制工艺的研究进展 [J].中草药, 2020, 51(21): 5631-5637.
[11] 吴丰鹏, 李芹英, 吴彦超, 等.九蒸九制对黄精多糖结构功能的影响 [J].食品工业科技, 2021, 42(2): 42-46.
[12] 万晓莹, 刘振丽, 宋志前, 等.黄精炮制前后多糖的相对分子质量分布和免疫活性比较 [J].中国实验方剂学杂志, 2021, 27(15): 83-90.
[13] 冯婧, 胡娟娟, 何先元, 等.不同炮制方法对渝产黄精体外抗氧化作用的影响 [J].中国药业, 2020, 29(19): 25-30.
[14] 林雨, 佘亮, 魏馨瑶, 唐美玲, 等.黄精炮制前后的化学成分变化及其减毒增效研究 [J].中药材, 2021, 43(6): 1353-1359.
[15] 杨华杰, 龚千锋, 于欢, 等.黄精不同炮制品抗疲劳及抗氧化作用比较研究 [J].江西中医药, 2018, 49(2): 64-67.
[16] 宋·丁度, 宋刻集韵 [M].第2版.北京: 中华书局, 2005: 46.
[17] 殷海霞, 邬秋萍, 平欲晖, 等.HPLC法同时测定黄精中5-羟基麦芽酚、5-羟甲基糠醛和黄精碱A的含量 [J].中国药师, 2018, 21(9): 1683-1686.
[18] 吴毅, 李娟娟, 郭磊, 等.基于GC-MS和UPLC-Q-TOF-MS的炆黄精的化学成分识别 [A] // 中国药学会第二届药物检测质量管理学术研讨会资料汇编[C].北京: 中国药学会, 2015: 293-299.
[19] 张艳雪, 周巧, 张学兰,等.黄精炮制前后寡糖与单糖类成分含量变化与转化机制研究 [J].中药材, 2020, 43(2): 318-322.
[20] 王雷.半乳糖激酶和半乳糖异构酶的生物化学研究 [D].济南: 山东大学, 2010.
[21] 李中立.本草原始 [M].北京: 人民卫生出版社, 2007: 3.
[22] 清·汪绂.医林篡要[M].江凌, 孙尧其, 应晓燕, 等注.北京: 中国中医药出版社, 2005: 156.
[23] 马兴民.新编中药炮制法 [M].西安: 陕西科学技术出版社, 1988: 310.
[24] 张莹, 钟凌云.黄精炮制前后对小鼠免疫功能的影响 [J].江苏中医药, 2010, 42(10): 78-79.
[25] 李迪民, 符波, 施杰, 等.黄精炮制前后黄精多糖药理作用的研究 [J].新疆医学院学报, 1997, 20(3): 18-20.
[26] 陈靓雯, 柯晓燕.古法炮制多花黄精提取物抗疲劳作用研究及其机制探讨 [J].科学技术创新, 2019(4): 3-4.
[27] Wang Y J, Liu N, Xue X,.Purification, structural characterization andimmunoregulatory activity of a novel polysaccharide from[J]., 2020, 160: 688-694.
[28] 王淳, 宋志前, 宁张弛, 等.黄精炮制二氯甲烷组分Maillard反应产物及抗氧化活性研究 [J].中草药, 2019, 50(3): 604-610.
[29] 廖振胜, 张娜, 杨宇成, 等.多糖溶解性改善方法研究进展 [J].食品与发酵工业, 2020, 46(24): 292-299.
[30] 梁·陶弘景原撰郭秀梅, 王少丽主编.本草经集注(影印本) [M].北京: 学苑出版社, 2013: 255.
[31] 梁·陶弘景撰尚志钧辑校尚元胜, 尚元藕, 黄自冲整理.名医别录(辑校本) [M].北京: 中国中医药出版社, 2013: 19.
[32] 谭西, 周欣, 陈华国.植物多糖构效关系研究进展 [J].中国中药杂志, 2017, 42(21): 4104-4109.
Exploring the differences ofbefore and after stewing based on carbohydrate components
ZHAN Hui-hui1, YAO Fang-cheng2, YI Bin2, WEI Hui-zhen1, 3, CHEN Xi-yong2, LYU Shang1, CHEN Hua-shi2,JIN Hao-xin3, RAO Yi1, 3
1.Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China 2.Jianchangbang Pharmaceutical Limited Company, Fuzhou 344700, China 3.National Engineering Research Center for Manufacturing Technology of Traditional Chinese Medicine Solid Preparation, Nanchang 330006, China
Based on the differences in the changes of carbohydrate components before and after the stewed of Huangjing (), the mechanism of “detoxification and efficiency enhancement” after the stewed ofwas discussed.The UV method was used to determine the total polysaccharide content before and after the stewed of; The free sugar content before and after the stewed ofwas determined by HPLC-ELSD; The relative molecular mass of polysaccharides before and after the stewed ofwas analyzed by the HPGPC-RI method; The monosaccharide composition ofpolysaccharides was determined and analyzed by HPLC-PDA.After stewing, the content of total polysaccharides decreased by about 60%; The content of sucrose in free sugar decreased by 35%, the content of fructose increased by 22 times, and the content of glucose increased by 4.4 times; the two peaks of relative molecular mass decreased by 1-5 times after steaming polysaccharide before and after the stewed ofs composed of mannose, rhamnose, glucose, galactose, arabinose, and the molar ratio of the monosaccharide ofwas mannose-rhamnose-glucose-galactose-arabinose (10:6:25:7:1); The molar ratio after stewing was 7:5:1.7:14:1.The stewed method has a great influence on the carbohydrate components of, and the polysaccharide will be hydrolyzed and the structure will be changed after stewed so that the numbness ofon the tongue disappears and the medicinal effect is enhanced.
stewed;polysaccharides; polysaccharide content; free sugars; relative molecular weight; monosaccharide composition
R283.1
A
0253 - 2670(2022)09 - 2687 - 10
10.7501/j.issn.0253-2670.2022.09.011
2021-11-18
江西省中管局科技项目(2020B0385)
詹慧慧(1996—),女,硕士研究生,从事药物质量控制研究。Tel: 16679095248 E-mail: 1376017584@qq.com
通信作者:饶 毅,博士生导师,教授,从事中药质量控制研究。Tel: 13807041192 E-mail: raoyi99@126.com
[责任编辑 郑礼胜]
