口腔清洁护理用品安全评估指南
2022-04-27
前言
本文件按照GB/T 1.1-2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别专利的责任。
本文件由口腔清洁护理用品工业协会提出。
本文件由全国口腔护理用品标准化技术委员会牙膏分技术委员会(SAC/TC492/SC1)归口。
本文件起草单位:黑龙江省轻工科学研究院、北京宝洁技术有限公司、云南白药集团健康产品有限公司、广州薇美姿实业有限公司、上海美加净日化有限公司、无限极(中国)有限公司、好来化工(中山)有限公司、联合利华(中国)有限公司、狮王日用化工(青岛)有限公司、淮安纵横生物科技有限公司、广州质量监督检测研究院。
本文件主要起草人:孙东方、王莹、郑伟、高鹰、刘文玉、陈敏珊、施裔磊、高艳、何琪莹、赖顺果、刘婧、笪成柱、刘香梅、丁恺、李一清、张恒。
本文件为首次发布。
1 范围
本文件规定了口腔清洁护理用品(牙膏和漱口水)成品和原料安全评估的术语和定义、一般性原则、程序及要求。
本文件适用于口腔清洁护理用品(牙膏和漱口水)成品和原料及其带入的风险物质的安全评估。
本文件只适用于牙膏和漱口水。
2 规范性引用文件
下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 2760 食品安全国家标准 食品添加剂使用标准
GB 22115 牙膏用原料规范
GB/T 22731 日用香精
GB 30616 食品安全国家标准 食品用香精
GB/T 35919 口腔清洁护理用品分类和术语
3 术语和定义
GB/T 35919界定的以及下列术语和定义适用于本文件。
3.1 口腔清洁护理用品 oral care and cleansing products
以洗刷、含漱、涂擦、喷洒、刮擦、贴或者其他类似的方法,使用于人的牙齿、口腔黏膜或义齿,以达到清洁、减轻不良气味、修饰、维护,使之保持良好状态的日用产品。
[来源:GB/T 35919-2018,2.2.1]
注:本文件专指牙膏和漱口水。
3.2 危害 hazard
化学物(原料或风险物质)在暴露情况下对人体产生不良影响的属性。
3.3 风险 risk
暴露条件下,某化学物(原料或风险物质)对使用者产生有害作用或不良反应的可能性及特征。
3.4 风险评估 risk assessment
系统性、科学性地分析因接触危害因素或条件而对健康产生有害作用或不良反应的可能性的过程,通常包括危害识别、剂量-反应关系评估、暴露评估和风险表征四个步骤。
3.5 毒理学关注阈值 threshold of toxicological concern;TTC
化学物暴露阈值,在该暴露水平下,预计不存在危害人类健康的风险。
3.6 定量构效关系 quantitative structure activity relationship;QSAR
用数学、统计学和计算机建模等手段定量研究化学物的结构、理化性质与其生物活性之间的关系。
3.7 交叉参照 read-across
用一种或一组化学物质(源化学物质)的毒性终点信息预测另一种或一组化学物质(目标化学物质)相同毒性终点的过程。目标化学物和源化学物是“相似”的,通常基于结构相似性和/或相同的作用模式或机制。
3.8 剂量 dose
直接与机体的吸收部位(消化道、粘膜、皮肤等)接触,可供吸收的化学物的量。
3.9 未观察到有害作用的剂量 no observed adverse effect level;NOAEL
受试物在规定的试验条件下与机体接触后,用现有的技术手段或观察指标,未观察到机体任何与受试物有关的有害作用的最高剂量或浓度。
3.10 观察到有害作用的最低剂量 lowest observed adverse effect level;LOAEL
受试物在规定的试验条件下与机体接触后,引起实验动物组织形态、功能、生长发育等有害效应的最低剂量或浓度。
3.11 基准剂量 benchmark dose;BMD
化学物引起某种特定的、较低健康风险发生率(一般在1%~10%之间)所需要的剂量。
3.12 证据权重 weight of evidence;WoE
一种对多个来源的信息或科学证据进行分析比较,按信息或证据的数据质量和相关性等评估其权重,从而进一步综合得出结论的方法。
3.13 证据权重预期无致敏剂量 weight of evidence no expected sensitizing induction level;WoE NESIL
根据证据权重原则,得到的不产生诱导致敏效应的最高剂量或浓度。
3.14 有阈值化学物 threshold compounds
在一定的暴露剂量以下,对动物或人不发生有害作用的化学物,包括非致突变物和非遗传毒性致癌物。
3.15 无阈值化学物 non-threshold compounds
已知或假设大于零的所有剂量都能诱导出有害作用的化学物,包括致突变物和遗传毒性的致癌物。
3.16 全身暴露量 systemic exposure dosage;SED
通过某暴露途径进入动物或人的体循环的化学物的预计量。
注:单位以mg/kg·bw/d表示。
3.17 安全边际 margin of safety;MoS
动物毒性试验得到的NOAEL与预期的全身暴露量之间的比值。
3.18 可接受致癌风险度 acceptable risk for cancer
能为社会公认并能为公众接受的终生致癌风险概率,通常为10-6或10-5,可因时间、地点、条件和公众的接受能力而不同。
3.19 T25(剂量描述参数)
对自发肿瘤发生率进行校正后,有25%的试验动物在机体某部位发生肿瘤的剂量。可由慢性毒性/致癌性试验得出。
3.20 每日允许摄入量 acceptable daily intake;ADI
人终生每日从食物或饮水中摄入某种化学物质,对健康无任何已知不良反应的剂量。
3.21 每日耐受剂量 tolerable daily intake;TDI
经过长期(通常是整个生命周期)摄入某种物质,对健康无任何已知不良反应的剂量。
4 安全评估所需资料
4.1 原料的理化性质资料
4.1.1 原料的名称,包括通用名、别名、商品名、INCI名、CAS号或EINCES号等。
4.1.2 化学结构式、分子式及相对分子量等。
4.1.3 原料的纯度信息,如果原料中含有杂质或残留物,应提供其浓度,或原料的质量控制要求。
4.1.4 原料的物理性状,如固体(粉末、颗粒、团块)、膏状、凝胶、液体、挥发性气体及其颜色、气味、味道、熔点、沸点、燃点等。
4.1.5 溶解性,包括原料的水溶性或脂溶性,以及溶剂种类等。
4.1.6 脂水分配系数,为化合物在脂相和水相间达到平衡时的浓度比值,通常是以化合物在有机相中的浓度为分子,在水相中的浓度为分母,以10为底的对数形式(Log Pow)表示。
4.1.7 其他理化性质,如pH值、比重、闪点、pK值等。
4.1.8 原料的稳定性资料。
4.1.9 原料应用情况,包括该原料拟用或已用于口腔清洁护理用品中的使用目的或功效、最高浓度,在其他消费品、工业品中的应用情况等。
4.1.10 复配原料,应提供所有成分的基本信息和配比资料,包括主要成分、防腐剂、抗氧化剂、螯合剂、缓冲剂、溶剂,其他添加剂以及可能带入的风险物质等。
4.1.11 矿物来源原料相关资料,包括起始材料、加工过程、组成成分的物理和化学性质、卫生学指标、防腐剂等添加剂。
4.1.12 植物来源原料相关资料,包括植物的通用名,学名(属名和种名),原料使用的植物的部位(如叶、花、果等),原料制剂的种类(提取液、汁、油等),加工和纯化过程,可能残留的蛋白含量和/或I型致敏原等,如果是提取液,还应说明包含的溶剂和有效成分的含量。
4.1.13 动物来源原料相关资料,包括来源动物的名称、产地、原料器官或部位、加工工艺、可能残留的蛋白含量和/或I型致敏原、原料形态、卫生学指标等。
4.1.14 生物工程来源原料相关资料,应提供制备过程,所用微生物的种类、毒性,及可能产生的毒素、添加的防腐剂、稳定剂等。
4.1.15 香精原料相关资料,包括符合相关标准的证明文件,供应商信息及原料的MSDS等。香精香料应符合GB/T 22731或 GB 30616或国际日用香料协会(IFRA)标准等。
4.2 毒理学资料
4.2.1 急性毒性资料,主要指急性经口或经皮毒性试验资料。
4.2.2 刺激性/腐蚀性资料,包括皮肤和/或眼刺激性/腐蚀性动物测试资料,或经权威机构(如OECD(见附录B),国内外监管部门等)认可的体外替代试验资料等。
4.2.3 皮肤致敏性资料,例如豚鼠最大值试验(GPMT)资料,或豚鼠局部封闭涂皮试验(Buehler试验)资料,或局部淋巴结试验(local lymph node assay,LLNA)资料,或经权威机构(如OECD,国内外监管部门等)认可的体外替代试验资料等。
4.2.4 遗传毒性资料,至少应包括一项基因突变试验和一项染色体损伤试验资料。
4.2.5 重复剂量毒性资料,例如28天或90天或24个月经口或经皮重复染毒试验资料等。可根据原料的用途及可能的暴露途径提供相应毒性资料。
4.2.6 发育及生殖毒性资料,包括致畸试验、生殖毒性试验资料等。
4.2.7 致癌性资料,如慢性毒性/致癌性结合试验资料等。
4.2.8 其他毒理学资料。
4.2.9 当上述毒性终点的试验数据缺乏时,可以通过动物替代方法,如体外试验,定量构效关系(QSAR),化学物分组/交叉参照(chemical grouping/read-across),毒理学关注阈值(TTC),计算机模型(in silico)等方法预测相关终点的毒性或提供相应的信息,作为数据直接用于安全评估。
4.3 人体安全性资料
4.3.1 人体安全性试验资料,如人体试用试验资料、人体皮肤累积刺激试验(Cumulative irritation test, CIT)资料、人体重复损伤性斑贴试验(Human Repeated Insult Patch Test,HRIPT)资料、人体临床试验资料等。
4.3.2 人群流行病学资料,包括人群流行病学调查、人群监测以及临床不良事件报告、事故报告等相关资料。
4.4 国际权威机构公布的毒理学数据、安全限值和安全评估结论等
详见6.4.2。
5 毒理学研究方法
5.1 优先采用OECD指南方法,如果采用的方法和OECD指南方法不同,需阐明科学上的原因。
5.2 如果存在OECD验证过的动物试验替代方法(Alternatives to Animal Testing),应优先考虑采用OECD验证过的动物试验替代方法。
5.3 毒理学研究也可以采用国内外政府承认的药品、医疗器械、食品、化妆品、化学品等行业的方法。
5.4 毒理学研究还可以通过其他动物替代方法来完成,如定量构效关系(QSAR),化学物分组/交叉参照(chemical grouping/read-across),毒理学关注阈值(TTC),计算机模型(in silico)等方法。
6 原料的安全评估
6.1 安全评估
安全风险评估由危害识别(hazard identification)、剂量-反应关系评估(dose-response assessment)、暴露评估(exposure assessment)和风险表征(risk characterization)四部分组成。
6.2 安全评估程序
6.2.1 危害识别(hazard identification)
根据原料的理化性质、毒理学试验数据和动物替代方法数据、人体安全性资料等信息,判定该原料对人体健康产生危害的可能性。
6.2.1.1 健康危害效应分类
健康危害效应主要包括:
a)急性毒性:包括经口或经皮吸收后产生的急性毒性效应;
b)刺激性/腐蚀性:包括皮肤和/或眼刺激性/腐蚀性效应;
c)致敏性:主要为皮肤致敏性。当原料是植物或动物来源原料时,还需对可能残留的蛋白和/或致敏原等进行I型致敏反应评估;
d)遗传毒性:包括基因突变和染色体损伤效应等;
e)重复剂量毒性:连续暴露后对组织和靶器官所产生的功能或器质性改变;
f)发育和生殖毒性:对亲代的生殖功能及对子代发育过程的有害作用,包括引起胎儿发育畸形的改变等;
g)致癌性:长时间暴露后引起肿瘤的可能性。
6.2.1.2 危害识别的判定
危害识别的判定内容主要包括:
a)危害识别主要根据原料的毒理学资料和人体安全性资料等来判定。按照通用的毒理学判定原则对原料的急性毒性、皮肤和/或眼刺激性/腐蚀性、致敏性、遗传毒性、重复剂量毒性、发育和生殖毒性、致癌性等毒性终点进行评估,确定该原料的主要毒性特征及程度;
b)根据原料的人体安全性试验资料、人群流行病学资料等相关信息,判断其可能对人体产生的危害效应;
c)在对原料的危害识别进行判定时,还应考虑到原料的纯度和稳定性、其可能与终产品中其他组分发生的反应、以及原料中的风险物质的毒性等;
d)对于复配原料,应对其所有组分的危害效应或整体危害效应进行识别。
6.2.2 剂量-反应关系评估(dose-response assessment)
剂量-反应关系评估用于确定原料的毒性反应与暴露剂量之间的关系。有阈值化学合物和无阈值化学合物的剂量-反应关系评估采取以下不同的方式。
6.2.2.1 有阈值原料的剂量-反应关系评估
对于有阈值的原料,其剂量-反应关系评估内容包括:
a)确定原料的NOAEL值。根据重复剂量毒性试验结果,确定该原料的未观察到有害作用的剂量(NOAEL)。如果重复剂量毒性试验未能确定该原料的NOAEL,也可以通过确定其观察到有害作用的最低剂量(LOAEL)或基准剂量(BMD)进行剂量-反应关系评估;
b)对于可能存在皮肤致敏风险的原料,可通过确定该原料的证据权重预期无致敏剂量(weight of evidence no expected sensitization induction level,WoE NESIL)进行安全评估。
6.2.2.2 无阈值原料的剂量-反应关系评估
对于无阈值原料的致癌性,可通过基准剂量下限值BMDL10或剂量描述参数T25等进行剂量-反应关系评估。
6.2.3 暴露评估(exposure assessment)
通过对原料暴露于人体的部位、使用量、频率以及持续时间等的评估,确定其暴露水平。
6.2.3.1 暴露评估应考虑的因素
暴露评估过程中应考虑的因素包括:
a)原料拟使用的口腔清洁护理用品类型,如牙膏或漱口水;
b)原料拟用于口腔清洁护理用品中的使用目的或功效;
c)原料的暴露部位或途径,对于口腔清洁护理用品来说,指口腔粘膜和嘴唇;
d)原料在成品中的浓度;
e)口腔清洁护理用品用完冲洗后,原料在口腔内的滞留情况。例如对成人消费者,一般牙膏以5%计,漱口水以10%计;
f)暴露频率,包括间隔使用或每天使用的次数等;
g)暴露持续时间,包括驻留或用后冲洗等。口腔清洁护理用品一般均为用后冲洗的产品;
h)日暴露量,应考虑单次暴露量和每日的使用频率。如果产品的使用说明中已经给出了确切的单次用量和日使用频率,其日用量应为单次用量乘以日使用频率。如果产品的使用说明没有给出单次用量和使用频率,则一般牙膏的日用量(成人)以2.75 g/d计,漱口水的日用量(成人)以21.62 g/d计,成人体重按60 kg计。儿童的使用量需根据产品使用说明和/或实际使用情况进行特殊考量和计算;
i)暴露对象的特殊性,如婴幼儿、儿童、孕妇、哺乳期妇女等。例如,漱口水不建议5岁以下儿童使用;
j)其他因素,如误用或意外情况下的暴露等。
6.2.3.2 全身暴露量(SED)的计算
根据原料的使用量,按公式(1)计算:
SED=A×c×Rf1×Rf2
(1)
式中:
SED——全身暴露量,单位为毫克每千克体重每天(mg/kg·bw/d);
A——产品单位体重每日总使用量,单位为毫克每千克体重每天(mg/kg·bw/d)。
注:按照产品标签中明示的使用量计(即产品每日总用量/体重)。若产品标签没有相关信息,一般牙膏的日用量(成人)以2.75 g/d计,漱口水的日用量(成人)以21.62 g/d计,成人体重按60 kg计。儿童的使用量、低于成人用量但体重也轻于成人,需根据产品使用说明和/或实际使用情况进行特殊考量和计算。
c——原料在成品中的浓度,单位为质量百分率(%);
Rf1——成品使用后原料在口腔内的滞留系数,单位为质量百分率(%);
注:针对成人以牙膏5%、漱口水10%计。儿童口腔内的保留系数远远大于成人,需做特殊考量和计算。
Rf2——经口的生物有效率,单位为质量百分率(%);
注:指残留在口腔中的原料经口摄入后,被消化系统吸收的比例。如果对某化学物有试验数据,需以实际试验数据计。没有试验数据时,一般以100%计。
6.2.3.3 局部暴露量计算
即消费者暴露水平CEL(consumer exposure level)按公式(2)计算:
(2)
式中:
CEL——消费者暴露水平,单位为微克每平方厘米(μg/cm2);
DA——有皮肤致敏风险的物质的接触量,单位为微克每天(μg/d)。
注:可由成品中有致敏风险物质的含量、成品的每天使用量等参数推算。
Rf——滞留系数,单位为质量百分率(%);
注:一般牙膏以5%计,漱口水以10%计;
SSA——暴露于口腔清洁护理用品的皮肤表面积,单位为平方厘米(cm2)。
注:包括口腔和嘴唇,以216.8cm2计。
6.2.4 风险表征(risk characterization)
6.2.4.1 有阈值原料的风险特征描述
6.2.4.1.1 安全边际(margin of safety,MoS)
6.2.4.1.1.1 计算MoS
对于有阈值的化学合物,可以通过计算其安全边际(margin of safety,MoS)进行评估。按公式(3)计算:
(3)
式中:
MoS——安全边际;
NOAEL——未观察到有害作用的剂量,单位为毫克每千克体重每天(mg/kg·bw/d);
SED——全身暴露量,单位为毫克每千克体重每天(mg/kg·bw/d)。
注:如不能获得NOAEL值,也可以用LOAEL或BMD值代替。当用LOAEL值或来自28天重复剂量试验的NOAEL值计算MoS时,应增加相应的不确定因子(一般为3)。
6.2.4.1.1.2 风险性的判定原则
在通常情况下, 当原料的MoS大于或等于100(MoS≥100)时,可以判定是安全的。该安全阈值(MoS)100同样适用于儿童。如原料的MoS<100,其可能有一定的风险,需通过优化暴露模型或数据等进一步评估。100是默认的不确定因子(UF),由种间差异10和种内差异10相乘所得。当有化学物的毒代动力学等数据时,可以对该数值进行调整。
6.2.4.1.2 AEL/CEL比值
6.2.4.1.2.1 可接受暴露水平AEL (acceptable exposure level)
对于有潜在皮肤致敏风险的原料,根据WoE NESIL和SAF。AEL按公式(4)计算:
(4)
式中:
AEL——可接受暴露水平,单位为微克每平方厘米(μg/cm2);
WoE NESIL——证据权重预期无致敏剂量,单位为微克每平方厘米(μg/cm2);
SAF——致敏评估因子,通常为10~1000,牙膏和漱口水为100。
6.2.4.1.2.2 风险性的判定原则
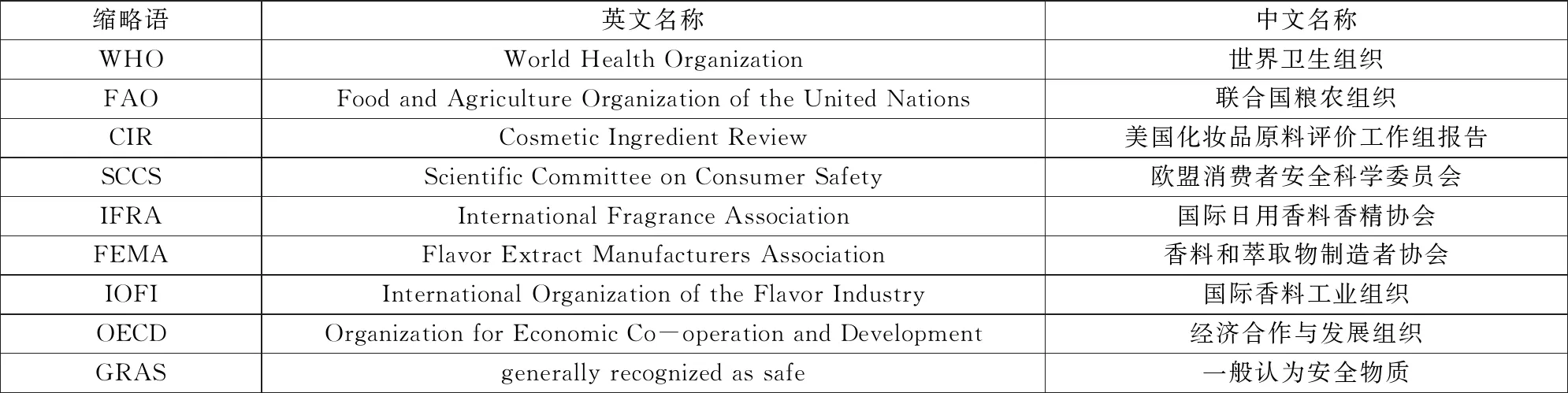
当AEL≥CEL时,判定该原料无致敏风险。当AEL 6.2.4.2 无阈值原料的风险特征描述 对于无阈值的原料,可通过计算其终生致癌风险度(lifetime cancer risk,LCR)进行风险程度的评估。 6.2.4.2.1 LCR的计算 6.2.4.2.1.1 T25(HT25) 按照公式(5)将动物试验获得的T25转换成人T25(HT25): (5) 式中: T25——对自发肿瘤发生率进行校正后,诱发25%实验动物的机体某部位出现肿瘤的剂量,单位为毫克每千克体重每天(mg/kg·bw/d); HT25——由试验获得T25转换的人T25,单位为毫克每千克体重每天(mg/kg·bw/d); BW——体重,单位为千克(kg)(默认的成人体重为60 kg)。 6.2.4.2.1.2 终生致癌风险 根据计算得出的HT25以及暴露量按公式(6)计算终生致癌风险(LCR): (6) 式中: LCR——终生致癌风险; SED——全身暴露量,单位为毫克每千克体重每天(mg/kg·bw/d)。 6.2.4.2.1.3 风险性的判定原则 如果该原料的终生致癌风险度等于或低于可接受致癌风险度,则认为其引起肿瘤发生的风险性较低,可以安全使用。如果该原料的终生致癌风险度高于可接受致癌风险度,则需优化暴露模型或数据等进一步评估。 当有基准剂量下限值BMDL10数据时,也可以采用该数据对无阈值的原料进行风险表征。 不同原料的安全评估应按如下原则: a)当按照GB 22115的规定使用限用成分、准用防腐剂和准用色素时,在进行安全评估时可不要求该成分的毒理学数据; b)当使用牙膏产品原料清单中的物质时,在进行安全评估时可不要求该成分的毒理学数据; c)当不按照GB 22115的规定使用限用成分、防腐剂和色素时,或使用GB 22115和牙膏产品原料清单中未列的成分时,需要提供相应的毒理学资料和/或其他相关安全评估资料,并由具有资质的专业人员评价其安全性。 6.4.1 一般资料要求 可用于原料安全评估的一般资料包括但不限于: a)急性经口或经皮毒性资料; b)刺激性/腐蚀性资料,包括皮肤和/或眼刺激性/腐蚀性试验资料,或经权威机构(如OECD,国内外监管部门等)认可的体外替代试验资料等(当有口腔粘膜刺激性/腐蚀性资料时,也可直接作为该毒性终点资料提供); c)皮肤致敏性资料,包括皮肤致敏动物试验资料,或经权威机构(如OECD,国内外监管部门等)认可的体外替代试验资料等; d)重复剂量毒性资料,包括28天或90天或24个月经口或经皮重复染毒试验资料等; e)遗传毒性资料,至少应包括一项基因突变试验和一项染色体损伤试验资料; f)致癌性资料,如慢性毒性/致癌性综合试验等; g)发育及生殖毒性资料,包括致畸试验、生殖毒性试验等; h)其他毒理学资料; i)人体安全性资料; j)当上述毒性终点的试验数据缺乏时,可以通过动物替代方法,如体外试验,定量构效关系(QSAR),化学物分组/交叉参照(chemical grouping/read-across),毒理学关注阈值(TTC), 计算机模型(in silico)等方法预测相关终点的毒性或提供相应的信息,作为数据直接用于安全评估。根据待评估原料的特性以及其与已评价成分化学结构及特性的相似性情况,可减免相应数据资料。这种情况下,评估人员应该在评估报告中阐明其科学理由。 6.4.2 可直接用于口腔清洁护理用品原料安全评估的毒理学数据、安全限值和安全评估结论 国内外权威机构已建立相关限值或已有相关评估结论的原料,可直接采用其安全限值或评估结论,无需按上述要求对各毒性终点分别提供数据。国内外权威机构已发表的原料毒理学数据,可作为相关毒性终点资料直接用于安全评估。如不同权威机构的数据、限值或评估结论不一致,则根据数据的可靠性和相关性,科学合理的采用相关信息。可接受的毒理学数据、安全限值和安全评估结论可来自: a)世界卫生组织(WHO),联合国粮农组织(FAO)已经公布的每日允许摄入量(ADI)、每日耐受剂量(TDI)及其他安全评估结果; b)国内外政府发布的,或国内外政府的安全评估机构、毒理学数据库发布的毒理学数据或安全评估结论; c)美国化妆品原料评价工作组(CIR)和欧盟消费者安全科学委员会(SCCS)发布的毒理学数据和/或安全评估结论; d)国际日用香精香料协会(IFRA)、香料生产者协会(FEMA)、国际香料工业组织(IOFI)发布的毒理学数据和/或安全评估结论; e)经济合作与发展组织(OECD)发布的毒理学数据和/或安全评估结论,如参考剂量(Reference Dose,RfD)等; f)国际权威机构已公布的其他毒理学数据和安全性结论,如一般认为安全物质(GRAS)、具有悠久食用历史的原料等。 g)国内相关原料清单,如GB 2760和新资源食品名单的原料等食品原料清单、药食同源原料清单、保健食品原料清单等。 6.5.1 适用原则 TTC方法的适用原则: a)TTC方法适用于毒理学资料不完整的物质的安全评估,包括目的性添加的原料,以及由原料带入的物质等的安全评估; b)TTC方法不适用于黄曲霉素类、氧偶氮基化合物、亚硝基化合物、多氯联苯类、金属或金属化合物、无机物、二恶英及类似物、激素、有很强生物蓄积性物质、放射性物质、蛋白质、不可溶的粒子、纳米材料等化合物的评估; c)TTC方法暂不适用于局部毒性如皮肤刺激性的评估,但相关内容可根据最新科学进展等进行更新或调整。 6.5.2 TTC值的确定 当原料的毒理学数据缺乏时,可以采用TTC值进行安全评估。针对具有潜在遗传毒性(基于数据或警示结构)的化合物,TTC值可按每人0.15 μg/d(成人)计,按单位体重计为0.0025 μg/kg·bw/d。当原料物质无遗传毒性时,则可根据化学物的Cramer分类采用相应的限值。其中,Cramer Ⅲ类物质TTC值按90 μg/d(成人)计,按单位体重计为1.5 μg/kg/d;Cramer Ⅰ类物质TTC值按1 800 μg/d(成人)计,按单位体重计为30 μg/kg/d。按单位体重计的TTC值同样适用于儿童。上述限值将根据国际最新TTC的指南文件或科学进展进行更新或调整。 6.5.3 风险判定 根据化合物在人体的暴露量及化合物的特性,若化合物的暴露量大于相应的TTC值,则其风险性应予以关注。 化学物分组/交叉参照(chemical grouping/read-across)方法的相关内容如下: a)化学物分组/交叉参照(chemical grouping/read-across)方法适用于原料和风险物质的安全评估。当化学物在某特定的人体健康终点上缺乏数据时,该方法可用于其安全评估; b)交叉参照(Read-Across)方法通常基于化学物之间的结构相似性和/或相同的作用模式或机制等。其中,基于构效关系的交叉参照(SAR-based Read-Across)方法是目前发展最完善并应用最广的交叉参照方法。当化学物缺乏毒理学数据时,可利用与其具有相同/相似代谢途径、化学/生物反应性和理化性质的结构类似物的数据,通过交叉参照,预测该化学物相同终点的毒性; c)交叉参照方法可用于填补毒性终点如遗传毒性、重复剂量毒性、生殖和发育毒性、致癌性及皮肤致敏性等的数据缺失; d)交叉参照方法可以对原料建立相应的安全限值,从而进行安全评估。当原料的暴露量大于安全限值时,其风险性应予以关注; e)若数据源自交叉参照方法,则需提供相关信息,例如类似物相似性、交叉参照数据质量、不确定性分析等。 7.1 成品是成分的组合,成品的安全评估,应基于其原料成分的毒理学评价。 7.2 在评价成品的安全性时,应综合考虑下述信息: a)应根据成分是否列于相关原料清单(如GB 22115和牙膏产品原料清单)及其毒理学信息(包括试验数据、替代方法数据、及国内外发布的数据和安全评估结论等),结合成品的使用方式、剂量、残留等暴露水平,对成品中的原料成分进行安全评估; b)产品的人体临床研究数据、消费者试用试验数据、人体安全试验数据等; c)已上市类似配方产品的安全使用历史、不良反应统计数据、流行病调查数据等; d)安全评估人员应在综合考虑上述信息的基础上,对具体配方具体分析,判断是否需要考察成品的口腔耐受性。当以上信息不足以支持成品口腔耐受性时,可实施相关测试,如体外试验或人类志愿者的附加试验等。对口腔软组织安全性的测试,可以考虑2D或3D体外模型试验,或从临床上观测对口腔软组织的影响(Clinical Oral Soft Tissue Study)等。对口腔硬组织安全性的测试,可以考虑牙膏磨擦值的测试(Relative dental abrasivity,RDA/Profilometry)或从临床上观测对硬组织的影响等。 7.3 在进行临床研究或消费者试用试验等人体研究之前,应事先对受试成品进行安全评估,以满足伦理的要求。 7.4 成品理化稳定性的评估,考察内容如下: a)考察成品的化学稳定性,确认成分之间是否存在相互作用,是否存在危害; b)考察成品的物理稳定性,保证在运输、储存过程中不会发生改变; c)考察拟用容器的物理稳定性,以及与产品的相容性。 7.5 成品微生物学质量的评估,考察内容如下: a)在研发阶段用微生物挑战试验的形式,评估产品的防腐效能; b)在日常生产中进行微生物分析,确保成品的微生物学质量稳定合格。 7.6 对上市后产品安全性的监测,包括追踪上市后产品的安全性,记录和归档在产品使用中出现的与产品相关的不良人体反应(包括正常使用和不当使用时发生的不良反应,消费者投诉以及后续随访)等,必要时需重新评估产品的安全性。 在完成原料或成品的安全评估后,应以报告的形式阐述科学论证过程。报告的相关要求包括但不限于: a)安全评估报告应包括评估人员的资质情况; c)必要时,安全评估报告可提出适宜的风险控制措施和建议,以供风险管理的决策者参考; d)安全评估报告的内容应符合附录A的要求。其中,新原料的安全评估可符合附录A的A.1部分要当产品中没有使用新原料时,其产品安全评估报告可只提供附录A的A.2部分内容。毒理学数据或结论等若采纳自国内外权威机构,描述时可参考附录B缩略语部分以简化描述。 安全评估人员应符合以下要求: a)具有毒理学、医学、药学、化学或生命科学等相关专业知识,了解口腔产品的原料和/或产品配方等的安全评估要求和使用方法,并具有5年以上相关专业从业经历; b)能够查阅和分析毒理学、化学等相关试验报告和文献信息,解读、总结和应用相关数据; c)能够公平、客观、科学的分析产品的安全性,在全面分析所有可获得的数据和暴露条件的基础上,开展安全评估工作; d)能定期接受相应的专业培训,学习安全评估的相关知识,了解和掌握新的安全评估理论、技术和方法,并用于实践。 附录A (规范性) 口腔清洁护理用品安全评估报告包含的内容 A.1口腔清洁护理用品原料的安全评估报告 A.1.1 原料的基本信息和理化性质资料 根据文中(4.1)提供相应的原料信息: a)原料的名称,INCI名、CAS号或EINCES号等; b)化学结构式、分子式及相对分子量等; c)原料的物理性状; d)原料的纯度信息; e)溶解性; f)脂水分配系数; g)其他理化性质,如pH值、比重、闪点、pk值等; h)原料的稳定性; i)特殊原料如香料、植物来源原料等的相关信息,如加工工艺等,具体参照(4.1.10~4.1.15)。 A.1.2 原料的微生物学指标 (可作为附件或备查) A.1.3 原料的应用情况 包括该原料拟用于口腔清洁护理用品中的使用目的或功效、最高使用浓度,在其他消费品中的应用情况等。 A.1.4 原料的安全评估 原料的安全评估包括: a)危害识别; b)剂量-反应关系评估; c)暴露评估; d)风险特征描述。 A.1.5 安全评估结果分析和总结 包括对安全评估中采用资料的可靠性和科学性分析、评估中的不确定性分析等。如在评估过程中对不同的毒理学数据有取舍,需阐明原因。 A.1.6 安全评估结论 原料在当前使用浓度和暴露途径情况下,可安全用于相应产品。如使用时有附加条件或特殊警示,应一并标出。 A.1.7 安全评估人员的资质和签名 安全评估人员的相关信息内容包括: a)安全评估人员的资质或简历介绍(可以附件形式提供); b)安全评估人员的姓名、单位、联系方式; c)安全评估人员的签名及日期。 A.1.8 附录 A.2口腔清洁护理用品成品的安全评估报告 A.2.1 产品安全评估的结论性综述 A.2.2 产品信息 产品信息内容包括: a)产品的名称和品类(牙膏或漱口水); b)产品的使用目的和方法; c)产品的目标人群; d)其他与产品安全评估相关的信息。 A.2.3 产品配方 A.2.4 产品的安全评估 产品的安全评估内容包括: a)产品的暴露模型参数,包括暴露途径、日均使用量、使用频率、滞留系数、暴露面积等; b)产品配方成分和风险物质的毒理学安全评估,包括化学物的安全使用依据或安全限值、暴露量和安全边际(MoS)的计算和讨论、及相关科学依据支持等; c)产品的口腔耐受性讨论,安全评估人员对具体配方具体分析,通过综合考虑成分的毒理学性质、人体数据、安全使用历史,与已上市产品配方的相似性等信息,阐述是否需要考察成品的口腔耐受性。如果通过附加试验评估,需提供试验结果的讨论。 A.2.5 安全评估结果分析和总结 包括对安全评估中采用资料的可靠性和科学性分析、评估中的不确定性分析等。如在评价过程中对不同的毒理学数据有取舍,需阐明原因。 A.2.6 风险控制措施和建议 标签上明示的警示语、注意事项及使用说明,包括法律、法规、强制性标准中针对特殊成分需要标注的内容等。 A.2.7 安全评估结论 A.2.8 安全评估人员的资质和签名 安全评估人员的相关信息内容包括: a)安全评估人员的资质或简历介绍(可以附件形式提供); b)安全评估人员的姓名、单位、联系方式; c)安全评估人员的签名及日期。 A.2.9 附录(可作为附件或备查) A.2.9.1 产品在可预见的储存条件下的稳定性资料。 A.2.9.2 产品的微生物挑战试验结果。 A.2.9.3 包装材料的稳定性。 A.2.9.4 其他有关信息,如文献、支持性数据和结论等。 附录B (资料性) 缩略语 文件中出现的缩略语见表B.1。 表B.1 缩略语6.3 不同原料的安全评估原则
6.4 原料安全评估的数据要求
6.5 安全评估的TTC方法
6.6 安全评估的化学物分组/交叉参照方法
7 口腔清洁护理用品成品的安全评估
8 口腔清洁护理用品安全评估结果的报告
9 安全评估人员的要求