皮蛋清抗氧化肽制备工艺优化及体外抗氧化性
2022-04-26陈伟玲陈邦栋廖惠青覃海桑梁文静
陈伟玲,陈邦栋,廖惠青,覃海桑,梁文静
(贺州学院食品与生物工程学院,广西 贺州 542899)
皮蛋是我国传统名特产蛋制品,常使用清料法制备,即使用腌制液浸泡新鲜鸭蛋28~42 d以获得皮蛋。皮蛋具有风味独特、蛋清棕褐透亮、蛋黄色层分明等优点[1]。常见的腌制皮蛋方法有包埋法、浸渍法等,主要是利用氢氧化钠作用于蛋内蛋白质,使其发生变性生成凝胶态[2−4]。自由基能使人体内正常细胞受损,导致机体损伤而出现衰老、癌症等疾病的发生。利用绿色、天然、健康的材料制备抗氧化活性物质清除自由基是目前研究的主流,比如姜黄素[5]、茶多酚[6]、花青素[7]和抗氧化性多肽等。有研究发现,抗氧化性多肽能够清除部分体内自由基,保护机体免受自由基的影响,维持细胞的正常结构和功能,如猴头菇多肽[8]、核桃多肽[9]、蚕豆多肽[10]等。对新鲜蛋制品中多肽制备及活性鉴定已有大量研究,比如:利用碱性蛋白酶、胰蛋白酶、中性蛋白酶处理新鲜鸡蛋清或鸭蛋清,制备具有抗氧化性的功能多肽[11−14]。然而,针对皮蛋清的综合利用和功能活性的开发研究较少。
本文利用清料法腌制成熟的皮蛋清为原料,采用风味蛋白酶水解技术,通过响应面优化以确定皮蛋清抗氧化性多肽的最佳制备工艺参数,并测定了多肽的抗氧化活性,旨在为皮蛋的功能性研究提供理论依据和数据支持,为皮蛋清的进一步开发利用提供研究背景。
1 材料与方法
1.1 材料与仪器
新鲜鸭蛋 购于广西贺州市平桂区农户;氢氧化钠(NaOH)、盐酸(HCl)、1,1-二苯基-2-三硝基苯肼(DPPH)、邻苯三酚、乙醇、甲醛、H2O2、水杨酸、铁氰化钾、硫酸西 分析纯,百灵威公司;风味蛋白酶(50000 U/g)、维生素C(VC) 美国sigma公司。
HH-4数显恒温水浴锅 常州澳华仪器有限公司;UV-2600紫外分光光度计 日本岛津;5804R高速冷冻离心机 德国艾本德仪器公司;Alpha1-2真空冷冻干燥机 德国Martin Christ公司;KJELTEC 8200凯氏定氮仪 丹麦福斯公司。
1.2 实验方法
1.2.1 皮蛋清的制备 蛋重65~75 g鸭蛋数枚,流水清洗干净表面脏物,自然晾干备用。按1:1.5(w/v)比例配制腌制液,比例如下,NaOH 4.5%、NaCl 3.5%、CuSO40.1%、ZnSO40.1%、红茶末0.1%。将晾干后的鸭蛋浸入腌制液中,浸泡四周后出缸,流动水清洗表面后用液体石蜡包裹皮蛋,后熟两周[15]。取完整无变质的皮蛋数枚,去掉蛋壳和蛋黄,收集蛋清备用。
1.2.2 皮蛋清抗氧化多肽的酶解工艺 将皮蛋清和蒸馏水按一定比例混合后,添加适量风味蛋白酶,调节pH,置于恒温水浴锅中进行酶解反应,反应结束后沸水中灭酶10 min,过0.45 μm微滤膜后得到皮蛋清抗氧化肽粗提液,55 ℃下旋蒸除去多余水分,冷冻干燥后得到多肽粉并置于−18 ℃下保存[16]。
1.2.3 皮蛋清抗氧化肽制备单因素实验 选取酶解温度(40、45、50、55、60 ℃)、酶解时间(2.5、3、3.5、4、4.5 h)、物料比(1:4、1:6、1:8、1:10、1:12 g/mL)、pH(5.0、5.5、6.0、6.5、7.0)和酶添加量(0.4%、0.6%、0.8%、1.0%、1.2 %)为单因素。固定酶解参数为:反应温度50 ℃,酶解时间4 h,物料比1:10 g/mL,pH6.0,酶添加量0.6%,分别改变其中一个单因素进行实验,测定水解度和DPPH自由基清除率,得出最佳反应参数。
1.2.4 响应面优化试验 在单因素实验结果的基础上,选取三因素三水平试验设计,以物料比(X1)、酶解时间(X2)、酶用量(X3)为考察因素,水平设置如表1,以水解度(Y1)和DPPH自由基清除率(Y2)为响应值,得出酶解最佳工艺组合参数。

表1 响应面试验因素水平设计Table 1 Factors and levels design of response surface methodology
1.2.5 水解度的测定 酶解液水解度的测定采用甲醛滴定法[17]进行,具体如下:称取5.00 g水解样品于100 mL容量瓶中,加水至刻度,混匀。静置备用。吸取上述稀释液20 mL置于200 mL烧杯中,加水60 mL,用氢氧化钠标准滴定溶液(0.05 mol/L)滴定至pH8.2,记录消耗氢氧化钠标准滴定溶液的体积。向上述溶液中准确加入10 mL中性甲醛溶液,混匀。再用氢氧化钠标准滴定溶液继续滴定至pH9.2,记录加入甲醛滴定所消耗氢氧化钠标准滴定溶液的体积。同时制作试剂空白实验。水解样品中氨基氮的含量计算公式:

式中:X试样中氨基酸态氮的含量,g/100 g;V1测试试样稀释液加入甲醛后消耗标准碱液的体积,mL;V2测定空白试样消耗标准碱液的体积,mL;V3稀释液的体积,mL;C 氢氧化钠的浓度,mol/L;0.014,与1 mL氢氧化钠标准滴定溶液(1.0 mol/L)相当的氮的质量。
取1.00 mL水解液进行湿法消化处理,凯氏定氮仪定氮,DH的结果计算公式如下:

式中:DH为蛋白质水解度,%;m1为测定出的-NH2含量,g/mL;m2为蛋白质的N含量,g/mL。
1.2.6 DPPH自由基清除率 DPPH自由基清除率的测定根据文献[18]进行,具体如下:称取适量冷冻干燥粉末溶于蒸馏水中,调整浓度为10 mg/mL,取2 mL溶解液,加入2 mL 1.32×10−5mol/L的DPPH乙醇溶液,充分混匀,置于517 nm下测定吸光度,以未加入样品的DPPH乙醇溶液作空白。DPPH自由基清除公式计算如下:

式中,A0表示空白对照吸光度,A1表示样品吸光度。
1.2.7 还原力的测定 还原力的测定参考OYAIZU等[19]建立的方法,具体如下:取不同含量酶解液,加入2 mL 0.2 mol/L磷酸缓冲液(pH6.6)和2 mL 1%的铁氰化钾溶液,50 ℃保温20 min后再加入2 mL 10%的三氯乙酸溶液,混合后以3000 r/min离心10 min,取上清液2 mL,加入2 mL蒸馏水以及0.4 mL 0.1%的三氯乙酸溶液,室温反应10 min后,测定其在700 nm处的吸光值,以VC作阳性对照。
1.2.8 O2−·清除率的测定 取0.05 mol/L Tris-HCl缓冲液(pH8.2)4.5 mL,置于25 ℃水浴中预热20 min,分别加入不同含量酶解液和0.4 mL 25 mmol/L邻苯三酚溶液,混匀后于25 ℃水浴中反应5 min,加入1 mL 8 mol/L HCl终止反应,于299 nm处测定吸光度(Ai),空白对照组以相同体积的蒸馏水代替样液(A0),以维生素C作阳性对照,清除率计算如式[20]。

1.2.9 ·OH清除率的测定 采用Fenton反应,利用H2O2与Fe2+混合产生·OH,在该体系中加入水杨酸捕捉羟基自由基并产生有色物质,该物质在510 nm处有最大吸收[21]。加入不同含量酶解液,2 mL 6 mmol/L FeSO4,2 mL 9 mmol/L水杨酸,2 mL 6 mmol/L H2O2混匀,37 ℃水浴中加热30 min,于510 nm处测定样品吸光度(Ai),将体系中的样品改为加入4 mL蒸馏水,测定空白对照吸光度(A0),向体系中加入2 mL蒸馏水代替6 mmol/L H2O2时,测定样品本底吸光度(Aj),其中每个质量的样品浓度做3个平行,以维生素C作阳性对照。

1.3 数据处理
采用Origin 8.5、Design Expert 8.0软件对本试验数据进行统计分析,每组数据进行3次,并表示为平均值±标准差。
2 结果与讨论
2.1 单因素实验
2.1.1 酶解温度对水解度和DPPH自由基清除率的影响 图1反映的是温度对水解度和DPPH自由基清除率的影响,二者均随温度的增加呈先上升后下降的趋势,均在50 ℃时取得最大值。这是因为在一定范围内,随着温度的升高,蛋白酶活性提高,蛋白质水解度增加,而温度的进一步升高会使蛋白酶失活,因此在温度大于50 ℃时,水解度和DPPH自由基清除率降低。综合以上水解度和DPPH自由基清除率的结果,发现蛋白酶的最适水解温度为50 ℃,故选择酶解温度50 ℃进行后续实验。

图1 酶解温度对皮蛋清水解度和DPPH自由基清除率的影响Fig.1 Effects of hydrolysis temperature on the DH and DPPH free radical scavenging rate
2.1.2 酶解pH对水解度和DPPH自由基清除率的影响 图2反映酶解液pH对水解度和DPPH自由基清除率的影响,在pH6.0时水解度和DPPH自由基均取得最大值。在不同pH下的DPPH自由基清除率不同。这是因为pH过高或过低会造成蛋白酶失活或导致蛋白酶结构被破坏,造成蛋白酶酶解效率下降,水解度和DPPH自由基清除率下降。综上所述,试验中蛋白酶的最适pH为6.0,故选择pH6.0进行后续实验。
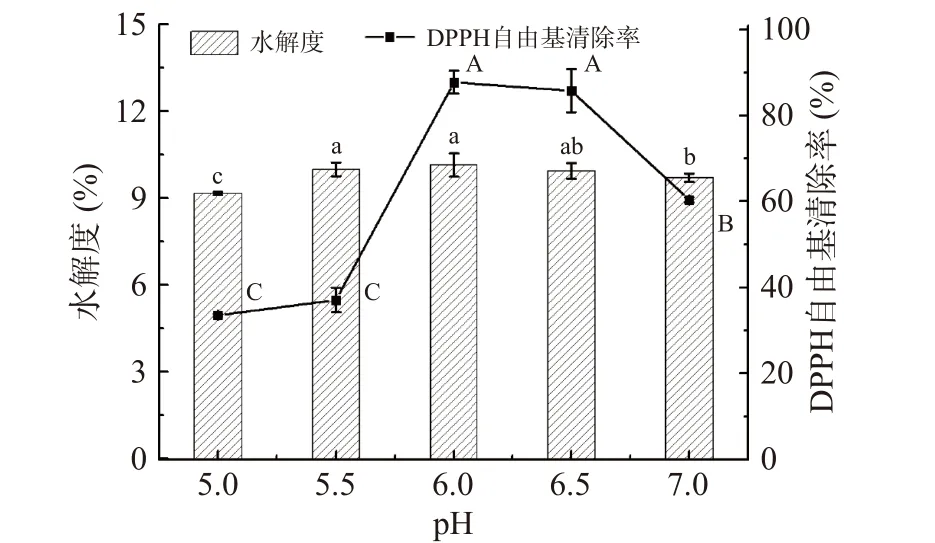
图2 酶解pH对皮蛋清水解度和DPPH自由基清除率的影响Fig.2 Effects of hydrolysis pH on the DH and DPPH free radical scavenging rate
2.1.3 酶解时间对水解度和DPPH自由基清除率的影响 酶解时间对水解度和DPPH自由基清除率的影响如图3所示,随酶解时间的延长,水解度和DPPH自由基清除率均呈先上升后下降的趋势,在酶解4 h时水解度和DPPH自由基清除率达到最大值,但DPPH自由基清除率在4~4.5 h时下降。这可能是由于随着酶解时间的延长,酶解程度逐渐加深,而酶解时间过长,会导致皮蛋清酶解过度,造成抗氧化活性肽的降解或生成低活性的氨基酸,使得DPPH自由基清除率降低[22]。综上所述,选择酶解时间为4 h进行后续实验。

图3 酶解时间对皮蛋清水解度和DPPH自由基清除率的影响Fig.3 Effects of hydrysis time on the DH and DPPH free radical scavenging rate
2.1.4 物料比对水解度和DPPH自由基清除率的影响 物料比对水解度和DPPH自由基清除率的影响结果如图4所示。由图4可知,随着物料比的增大,DPPH自由基清除率呈先增加后降低的趋势,与水解度均在物料比1:10 g/mL时取得最大值。这是因为随着物料比的增加,皮蛋清与蛋白酶接触充分,从而酶解效率提高,而随着物料比的进一步增加,底物与蛋白酶被稀释,接触机率减少,导致酶解不完全[23]。综上所述,选择物料比为1:10 g/mL进行后续实验。

图4 酶解物料比对皮蛋清水解度和DPPH自由基清除率的影响Fig.4 Effects of solid to liquid ratio on the DH and DPPH free radical scavenging rate
2.1.5 酶用量对水解度和DPPH自由基清除率的影响 酶用量对水解度和DPPH自由基清除率的影响如图5所示。由图5可知,酶添加量为0.6%时,水解度和DPPH自由基清除率取得最大值。当酶添加量为0.6%时,DPPH自由基清除率显著高于其它组别(P<0.05),酶添加量大于0.6%时,DPPH自由基清除率差异不显著(P>0.05);酶添加量为0.4%和0.6%组的水解度无显著差异(P>0.05),但显著高于酶添加量0.8%、1.0%和1.2%组别的水解度(P<0.05),而酶添加量0.8%、1.0%和1.2%组别的水解度无显著差异(P>0.05)。这是因为随着酶用量的增加,皮蛋清与蛋白酶接触更充分,而随着蛋白酶用量的增加,会使皮蛋清水解过度。蛋白酶用量超过了与皮蛋清充分反应所需量时,皮蛋清不会发生更为强烈的水解,同时水解产生的活性肽及活性官能团并不会增多[24]。综上所述,选择酶用量为0.6%进行后续实验。

图5 酶用量对皮蛋清水解度和DPPH自由基清除率的影响Fig.5 Effects of the addition of enzyme on the DH and DPPH free radical scavenging rate
2.2 响应面优化设计试验结果
因蛋白酶需在特定pH和温度下发挥作用,实验发现风味蛋白酶的最适酶解环境为pH6.0和温度50 ℃,故选择酶解时间、酶用量以及物料比作为响应面优化因素。在单因素基础上进行了三因素三水平响应面优化设计,设计方案、结果和方差分析如表2~表4所示。采用Design Expert 8.0对酶解时间、酶用量和物料比进行多元回归拟合,得出回归方程为:


表2 Box-Behnken试验方案及结果Table 2 Experimental design and results for Box-Behnken analysis
表3与表4结果显示拟合的二次回归方程极显著,其中,水解度Y1的决定系数R2=0.9762,F=31.92,P<0.0001,Y2的决定系数R2=0.9905,F=81.27,P<0.0001,模型拟合度高,证明所建立模型可行性高。其中,一次项X1和X2、交互项中X1X2和X2X3、二次项X12、X22、X32对水解度影响具有显著性(P<0.05),且对水解度影响较高的因素依次为:酶解时间(X2)、物料比(X1)和酶用量(X3)。而一次项X1、X2和X3、交互项中X1X3和二次项X12、X22、X32对DPPH自由基清除率影响具有显著性(P<0.05),且对于DPPH自由基清除率影响较高的因素依次为:物料比(X1)>酶用量(X3)>酶解时间。

表3 水解度回归方程方差分析Table 3 Analysis of variances for the developed regression equation for degree of hydrolysis

表4 DPPH自由基清除率回归方程方差分析Table 4 Analysis of variances for the developed regression equation for scavenging capacity of DPPH free radical
2.3 响应面分析
响应面分析图可用于评价各项指标对水解度和DPPH自由基清除率的影响,其中,响应曲面坡度可用于反映各单因素对响应值的影响[25−26]。三维曲面图的弧度可以说明因素对响应指标的影响程度,弧度越大,影响越大[27]。图6与图7反映的是试验范围内两因素的交互作用,水解度响应面试验中(图6)显示酶用量对物料比和酶解时间的交互作用显著(图6a、图6b),DPPH自由基清除率响应面试验(图7)显示物料比和酶用量的交互作用显著(图7b),与表2和表3中的方差分析一致。

图6 水解度响应面的3D图Fig.6 3D Plot of degree of hydrolysis with response surface
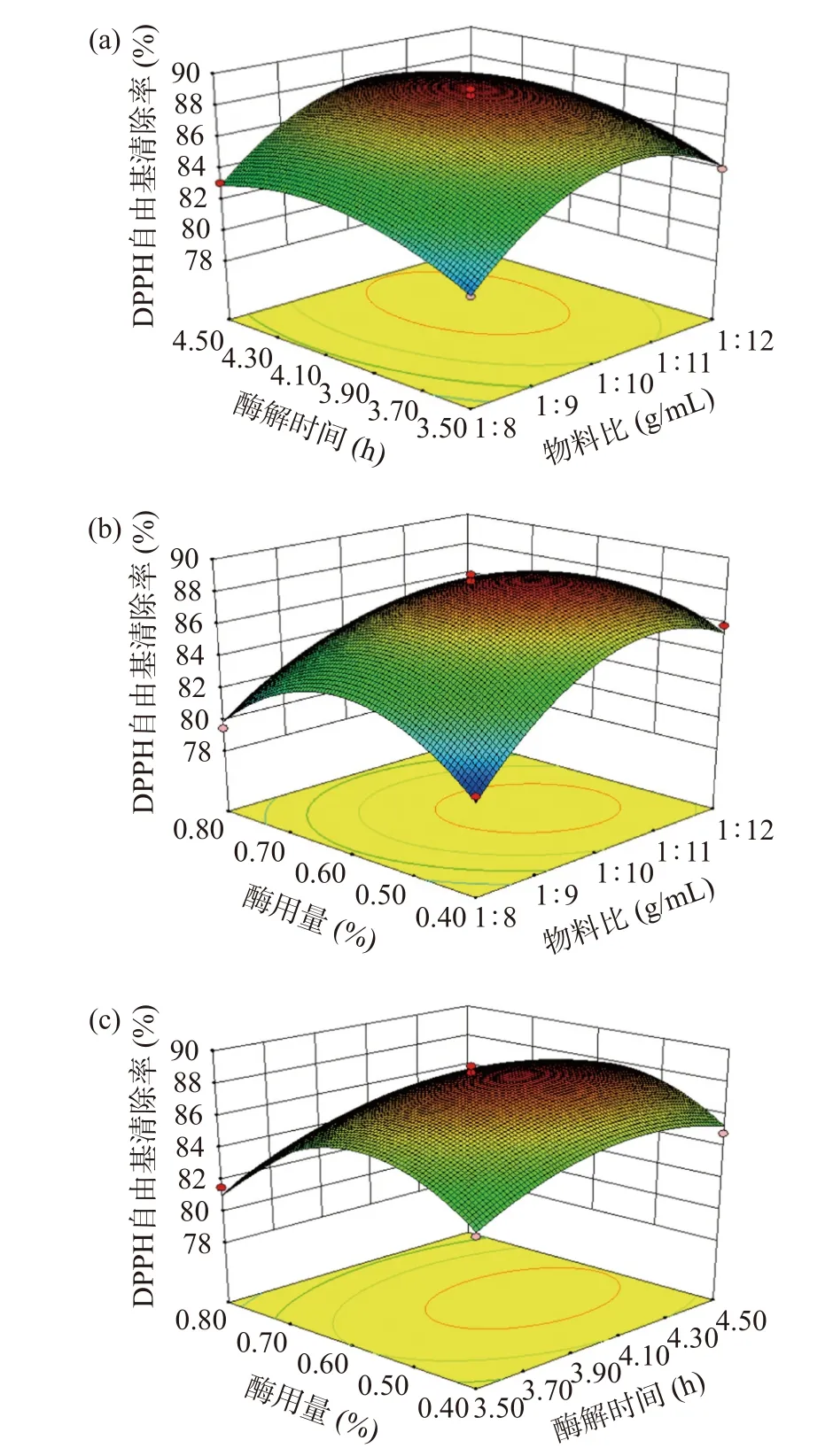
图7 DPPH自由基清除率响应面3D图Fig.7 3D Plot of scavenging capacity of DPPH free radical
2.4 皮蛋清抗氧化多肽制备工艺优化及验证
经响应面法优化工艺,采用Design Expert 8.0软件和回归方程分析可知皮蛋清抗氧化肽制备最佳工艺为:物料比1:10.43、酶添加量0.57%、酶解时间4.11 h,为方便实际生产,对最佳工艺参数进行了整合,设置为:物料比1:10.4、酶添加量0.57%、酶解时间4.1 h,以此条件进行验证实验,重复5次,得到水解度为11.23%,与预测值(11.50%)相差0.27%,DPPH自由基清除率为89.76%,与预测值(90.73%)相差0.97%,误差较小,此条件下可行。
2.5 皮蛋清酶解液的体外抗氧化性分析
在最优酶解工艺条件酶解皮蛋清获得酶解液,对酶解液的体外抗氧化性进行了测定,包括还原力、O2−·清除率和·OH清除率。
2.5.1 还原力分析 能够提供电子的抗氧化性物质具有还原力,其作用机理是能将三价铁离子还原为二价铁离子,而二者进一步反应生成普鲁士蓝,并在700 nm处有最大吸收峰,吸光值越大,抗氧化能力越强[28]。经风味蛋白酶水解后的皮蛋清还原力如图8所示,在测试的浓度范围内,酶解液的还原力随样品量的升高而逐渐增加,但与VC的还原力相比,酶解液的还原力较低,可能是酶解液中具有还原性的多肽含量较低。杨瑾等[14]利用碱性蛋白酶酶解鸭蛋清,发现样品含量为5 mg/mL时,其还原力为0.56~0.65,而本实验在添加1 mL酶解液(10.4 mg/mL)时的还原为0.599±0.045。说明利用风味蛋白酶水解后的皮蛋清多肽还原力低于碱性蛋白酶水解的新鲜鸭蛋清酶解液,可能是因为皮蛋经过腌制后,蛋清内蛋白质被碱水解,部分具有抗氧化性的结构或官能团被破坏。

图8 皮蛋清酶解液还原力Fig.8 Reducing power for enzymatic hydrolysate of preserved egg white
2.5.2 O2−·清除率分析 O2−·能发生歧化反应产生·OH和过氧化氢而对各种酶的活性有影响,破坏细胞膜和DNA结构,导致正常机体的细胞功能受损[24]。皮蛋清酶解液的O2−·清除能力变化如图9所示,随着样品量的增加清除能力明显增强,当样品添加量为10.4 mg/mL时,清除率为66.78%±2.71%。与VC清除率相比,酶解液清除率较低。分析酶解液与VC的IC50值可知,酶解液的清除O2−·的IC50值为7.98 mg/mL,VC的IC50值为0.073 mg/mL。与碱性蛋白酶水解新鲜鸭蛋清酶解液的O2−·清除率相比,风味蛋白酶处理后的皮蛋清水解液清除率较低[29]。可能是不同蛋白酶水解方式和作用位点不同,且皮蛋清经过长时间碱浸泡,蛋白质已提前水解。

图9 蛋清酶解液O2−·清除率Fig.9 Scavenging capacity of preserved egg white hydrolysis on O2−·
2.5.3 ·OH清除率分析 由图10可知,在测定的梯度范围内,随着皮蛋清酶解液和VC含量的增加,二者的·OH清除能力明显增加。与VC的清除率相比,蛋清酶解液的清除率较低,当酶解液加入量为10.4 mg/mL时,其清除率为79.63%±2.67%。分析酶解液与VC的IC50值可知,酶解液的清除·OH的IC50值为4.63 mg/mL,VC的IC50值为0.053 mg/mL。同时,皮蛋清酶解液与碱性蛋白酶处理新鲜鸡蛋清或鸭蛋清得到的酶解液相比,清除·OH的能力并无显著差异[30−31]。

图10 蛋清酶解液·OH清除率Fig.10 Scavenging capacity of preserved egg white hydrolysis on ·OH
3 结论
利用风味蛋白酶水解皮蛋清制备抗氧化性多肽,在单因素实验的基础上,以水解度和DPPH自由基清除率为响应值对物料比、酶解时间和酶用量为进行响应面优化试验设计,得出最佳水解条件为:物料比1:10.4、酶解时间4.1 h和酶用量0.57%。最佳水解条件下的水解度为11.23%,DPPH自由基清除率为89.76%。抗氧化性实验分析显示皮蛋清酶解液具有一定的抗氧化性。本文仅对利用风味蛋白酶水解皮蛋清制备抗氧化性多肽工艺及抗氧化性进行了研究,但其功能特性和结构特性等其他方面有待进一步深探。
