泗顶矿区剖层土固氮微生物群落结构和丰度
2022-04-24张海春韦姣腾刘可慧1于方明
李 艺,张海春,刘 媛,韦姣腾,王 聪,梁 映,刘可慧1,**,于方明*
泗顶矿区剖层土固氮微生物群落结构和丰度
李 艺1,2,张海春3,刘 媛2,韦姣腾2,王 聪2,梁 映2,刘可慧1,3**,于方明1,2*
(1.广西师范大学,珍稀濒危动植物生态与环境保护教育部重点实验室,广西 桂林 541004;2.广西师范大学环境与资源学院,广西 桂林 541004;3.广西师范大学生命科学学院,广西 桂林 541004)
以广西柳州泗顶矿区的上游区、下游区和尾矿区12个剖层土(每个区域分为4层)为研究对象,采用高通量测序技术和荧光定量PCR技术,分析了剖层土中固氮微生物的群落结构、丰度和多样性特征.结果表明,变形菌门在各区域剖层土中均为优势菌门,所占比例超过70%;α-变形菌纲在上游区和下游区剖层土中均为优势菌纲.上游区、下游区和尾矿区剖层土固氮微生物H基因丰度的范围分别为3.02×106~1.17×107、2.55×106~7.78×106和8.19×105~3.14×106基因拷贝数/g (干土).主要影响H基因丰度的土壤环境因素是土壤氮(总氮、铵态氮和硝态氮)和磷(总磷和有效磷)的含量.矿区固氮微生物群落组成的差异性主要由土壤铅、锌和镉含量的变化所引起,上游区剖层土的Shannon指数和ACE指数显著高于下游区和尾矿区,表明上游区剖层土固氮微生物群落的多样性和丰富程度相对较高.另外,土壤钾、钙和钠含量的变化对固氮微生物群落的ACE指数和NMDS1指数也产生了不同程度的影响.研究结果表明土壤环境因子变化影响了矿区剖层土固氮微生物的群落结构、丰度和多样性.研究为矿区的氮素调控、生态恢复和重建提供了理论依据.
矿区;固氮微生物;剖层土;群落结构;H基因丰度
采矿业在带来巨大经济利益的同时也造成了矿区生态退化,产生了大量的矿业废弃地,因此对矿区及其周边废弃地进行生态恢复迫在眉睫.一般而言,矿区的生态恢复包括废弃地的植被修复与复垦、土壤肥力修复以及植被演替[1].在矿区及周边土壤肥力修复过程中,由于土壤理化性质差,有机质、水分、养分等缺乏,成为生态恢复与重建的主要限制因子[2-3].其中,土壤氮素的极端不足又是养分不足中的核心问题[4].
氮在所有生物体的生长发育过程中具有不可替代的作用,是蛋白质和核酸等关键细胞成分合成所必需的元素[5].因此,氮循环在重金属污染严重的矿区生态恢复过程中具有重要作用.作为氮循环中重要的环节之一,生物固氮是陆地生态系统外部氮源输入的最大自然来源;并且可以在缺乏人为氮源输入时维持生态系统的可持续性[7-8].生物固氮由固氮酶催化,固氮酶由两个多亚基的金属蛋白酶组成,分别是D和K基因编码的钼铁蛋白和H基因编码的铁蛋白组成[6];其中,H基因作为标记基因,被广泛用于检测环境中固氮微生物的存在[5,9].固氮微生物广泛存在于土壤环境中,如变形菌门(Proteobacteria),蓝藻菌门(Cyanobacteria),拟杆菌门(Firmicutes)和疣微菌门(Verrucomicrobia)等[10-13].并且,固氮微生物的丰度、多样性和群落组成会随着土壤环境的变化而产生变化[14].
广西被誉为“有色金属之乡”,拥有各类矿山6800多座[15],生物固氮在矿区及周边生态系统的恢复和重建中发挥着重要作用.研究表明,土壤微生物在矿区碳、氮循环和能量流动过程中起着关键作用[16].而土壤pH值、养分含量、金属浓度、含水率和覆土深度等被认为是矿区及周边固氮微生物群落多样性和丰度的主要限制因子[17-20].因此,提高固氮微生物的多样性和群落组成,促进矿区氮素的累积,已成为矿区生态恢复的研究焦点.
因此,本研究以广西柳州泗顶铅锌矿区为研究对象,运用高通量测序和荧光定量PCR技术,对泗顶矿区上游、下游和尾矿区剖面各层土壤中固氮微生物群落结构、丰度和多样性进行了研究,探讨矿区不同区域剖层土土壤固氮微生物群落结构、丰度和多样性的分布特征及其与土壤环境因子之间的关系,以期深入认识矿区不同区域剖层土壤中固氮微生物的群落结构特征,为矿区的氮素调控、生态恢复和重建提供理论依据.
1 材料与方法
1.1 研究区概况
土壤样品采自广西柳州泗顶矿区(北纬24°46′~25°34′,东经109°13′~109°47′).区域地貌为外围环形突起、中间洼地的峰林地,环形隆起高程400m以上,盆地高程为320m左右.该地区属中亚热带季风气候,常年温暖潮湿,年均气温17.8℃,年降水量189.9mm.
矿区面积约为13.64km2,已于2006年开采完毕;冶炼厂附近有一条河流,冶炼污水通过排污口排入河流.其中,上游区位于河流上游,土壤属于黏质黄土,植被类型主要有蜈蚣草、五节芒、芦苇、马唐等,植物生长茂盛;下游区位于河流下游,土壤属于砂质棕土,植被类型主要有五节芒、蜈蚣草、辣蓼等;尾矿区位于矿山尾矿库,土壤类型主要是选矿后筛出的泥土与矿石废渣混合物,属于砂质黑土,植被类型主要有五节芒、芦苇、节节草、狗牙根等.因此,本文选择上述3个区域作为代表区域进行研究.
1.2 土壤采集与理化性质分析
2020年7月上旬,在泗顶矿区的上游区(北纬25°02′53′′~25°02′58′′,东经109°41′60′′~109°41′ 63′′)、尾矿区(北纬25°06′60′′~25°06′61′′,东经109°41′66′′~109°41′67′′)、下游区(北纬25°08′73′′~25°08′75′′,东经109°41′56′′~109°41′57′′)随机均匀设置3个采样点.每个采样点自上而下垂直分为4层,每层15cm,每层随机采集3个土壤样品.其中上游区土壤简称为S,按照自上而下分别对应S-1(0~15cm), S-2(15~30cm), S-3(30~45cm)和S-4(45~60cm);同理,尾矿区土壤简称为W,下游区土壤简称为X.采集的同一类型土壤,在去除植物根系和碎石等杂物后充分混匀,采用四分法选取适当样品置于无菌袋中,冷藏保存运回实验室.每个土样分为2个部分,一部分鲜土样品通过2mm筛后置于-80℃冰箱保存以提取土壤微生物DNA;另一部分土壤自然风干后过0.149mm筛,用于分析土壤理化性质.土壤重金属含量及其他理化性质采用《土壤农业化学分析法》进行测定[21],结果见表1.
1.3 土壤DNA提取与高通量测序
称取0.5g土壤样品,采用Fast®DNA SPIN Kit(MP Biomedical, Solon, OH, USA)对土壤DNA进行提取.引物为:HF(5′-AAAGGYGGWATCG GYAARTCCACCAC-3′)和HR(5′-TTGTTSGC SGCRTACATSGCCATCAT-3′)[22].PCR扩增体系(20μL)为:引物各0.8μL(5μmol/L), 2.0μL DNA, 4.0μL 5×FastPfu缓冲液, 2.0μL dNTPs (2.5 μmol/L), 0.4μL TransStart®FastPfu DNA聚合酶, 补无菌ddH2O至20μL. PCR的扩增条件为:95℃预变性3min, 95℃变性30s, 55℃退火30s, 72℃延伸45s,循环35次,最后72℃延伸10min.使用EZNA Gel Extraction Kit (Omega, USA)回收PCR混合产物进行纯化.土壤样品完成DNA提取后,送至上海美吉生物科技有限公司运用Illumina Miseq测序平台进行高通量测序.
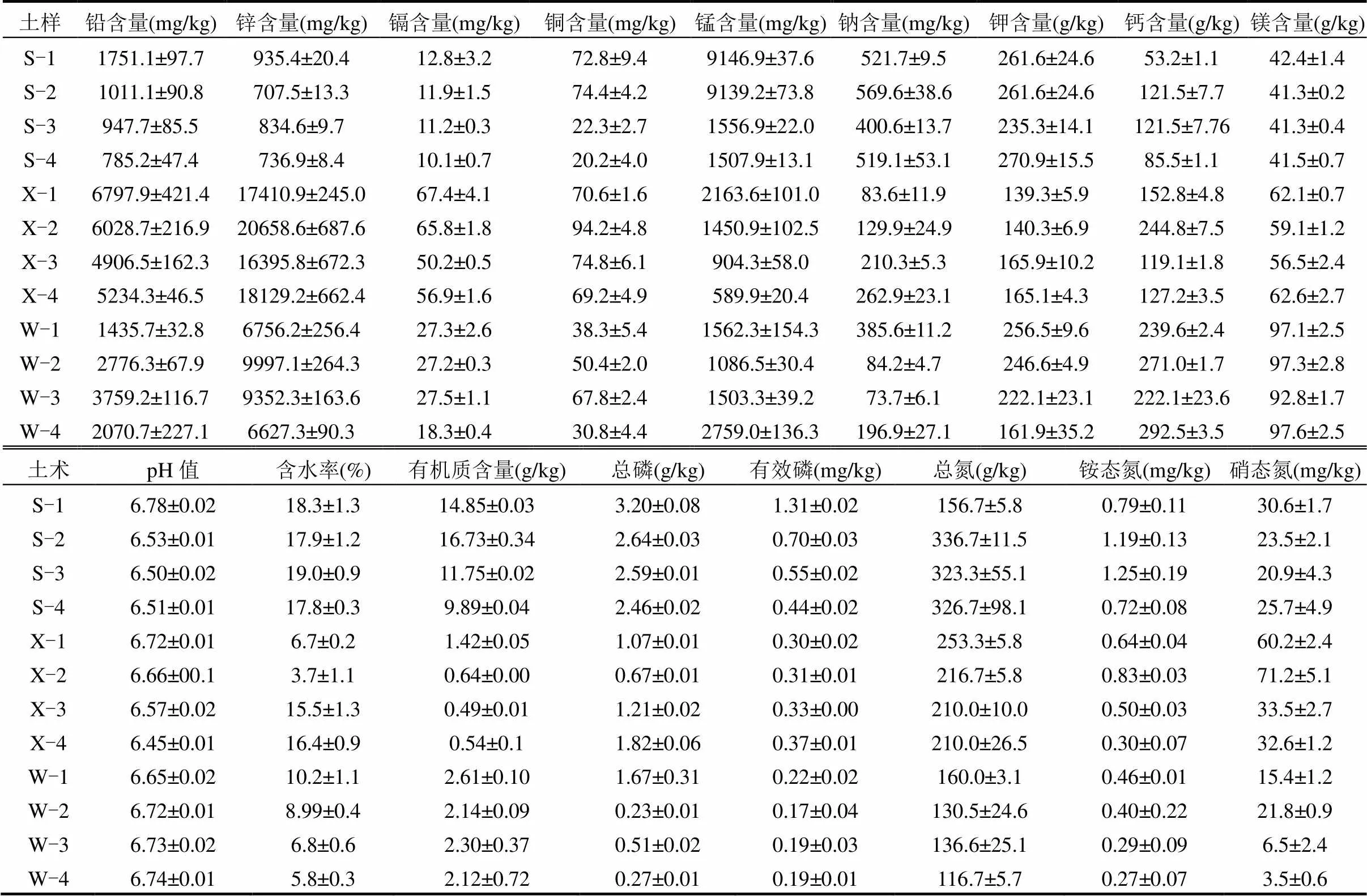
表1 泗顶矿区剖层土土壤金属含量及其理化性质
1.4 nifH基因丰度测定
利用荧光定量PCR(Real-time PCR)技术分析剖面土H基因数.反应引物同1.3所示,扩增片段长度为461bp.反应体系(20μL)为: 2X Taq Plus Master Mix 10μL,引物各0.8μL(5μmol/L), 1.0μL DNA,补无菌ddH2O至20μL.荧光定量PCR反应条件为:95℃预变性5min, 95℃变性30s, 55℃退火30s, 72℃延伸1min,循环35次.根据标准曲线计算基因丰度,H基因丰度最终被计算为每克干土的拷贝数(基因拷贝数/g(干土)).
1.5 数据处理与分析
数据处理采用Microsoft Excel 2019软件完成,绘图采用Origin 2019b软件完成.利用Uparse软件对高通量测序样本进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units)[23].采用QIIME(Version 1.9.1)软件对样本序列进行抽平,α多样性指数(Shannon、Simpson和ACE指数)和β多样性指数(NMDS1指数)的计算利用QIIME平台完成.H基因拷贝数和多样性指数的单因素方差分析(One-way ANOVA,=3)、环境因子对Shannon、Simpson、ACE和NMDS1指数影响的多元线性回归分析、环境因子对固氮微生物H基因数属水平相对丰度影响的Spearman等级相关系数分析均采用SPSS 19.0软件完成.其中,矿区不同区域间H基因数和α-多样性的差异性通过T检验(Student’s-test)进行分析,采用SPSS 19.0软件完成.环境因子对固氮微生物H基因数和属水平相对丰度影响的热图采用Origin 2019b软件完成.固氮微生物群落与环境因子关系的冗余度分析及绘图采用Canoco 5.0软件完成.
2 结果与分析
2.1 土壤固氮微生物群落丰度和多样性分析
利用Illumina Miseq测序平台对泗顶矿区上游、下游和尾矿区12个剖层土固氮微生物H基因进行测序分析,获得质控后的序列数分别为:上游区(S-1~S-4)18569、15973、13758和15566条;下游区(X-1~X-4)15485、17134、16177和13933条;尾矿区(W-1~W-4)19238、12175、14873和17003条.把相似度水平³97%的序列聚为OTUs,置信度阈值设为0.8.
由图1(a)可知,矿区不同区域剖层土固氮微生物H基因丰度差异显著(<0.05).上游区、下游区和尾矿区的剖面各层土壤H基因丰度范围分别为3.02×106~1.17×107、2.55×106~7.78×106和8.19× 105~3.14×106基因拷贝数/g(干土).各区域表层土(0~15cm)的H基因丰度相对于其他层最大;上游区和下游区的H基因丰度随着剖面深度的增加而显著减小(<0.05).
由图1(b)~图1(d)可知,矿区不同区域剖层土固氮微生物群落的α-多样性指数(Shannon、Simpson和ACE指数)差异显著(<0.05).上游区剖层土的Shannon指数和ACE指数范围分别为4.31~4.39和595.12~795.89,显著高于下游区和尾矿区(图1(b)和图1(d));表明上游区剖层土固氮微生物群落的多样性和丰富程度相对较高.同时,下游区和尾矿区表层土(0~15cm)的Shannon指数和ACE指数相对于其他层最大.另外,上游区剖层土的Simpson指数范围为0.03~0.04,显著低于下游区和尾矿区(图1(c));表明上游区剖层土固氮微生物的均匀性相对较低.

*<0.05, **<0.01, ***<0.001.其中: 右侧箱型图分别对应表示矿区不同区域间H基因数和α-多样性指数的差异性
2.2 土壤固氮微生物群落组成分析
泗顶矿区上游区、下游区和尾矿区12个剖层土的固氮微生物群落相对丰度如图2所示,相对丰度<0.03%的门种类合并为其他(Others).其中,变形菌门在矿区各区域剖层土中均为优势菌门;在上游区、下游区和尾矿区的剖层土中所占比例范围分别为82.1%~87.1%、92.8%~96.6%和71.4%-95.9%.其中,上游区和下游区剖层土的优势菌纲为α-变形菌纲(Alphaproteobacteria),所占比例范围分别为26.2%~32.8%和60.6%~87.7%.另外,上游区剖层土β-变形菌纲(Betaproteobacteria)的丰度范围为1.6%~3.1%.而在尾矿区剖层土中,除了α-变形菌纲,在W-1层中优势菌纲还有δ-变形菌纲(Deltaproteobacteria) (27.8%),在W-3层中优势菌纲还有γ-变形菌纲(Gammaproteobacteria) (30.4%).在上游区、下游区和尾矿区剖层土中,α-变形菌纲下的根瘤菌目(Rhizobiales)相对丰度较高,所占比例范围分别为8.4%~14.6%、3.7%~67.4%和8.2%~32.7%.其中,在上游区剖层土中,根瘤菌目下的慢生根瘤菌属()相对丰度较高,所占比例范围为3.6%~11.9%.
除了变形菌门固氮微生物,在矿区上游区、下游区和尾矿区的剖层土中还存在蓝藻菌门、拟杆菌门和放线菌门(Actinobacteria)固氮微生物.其中,尾矿区W-1层的蓝藻菌门的相对丰度最高,为6.9%,主要为念珠藻科(Nostocaceae).尾矿区W-3层中拟杆菌门的相对丰度最高,为4.1%,主要为沼小杆菌属().上游区各层剖层土、下游区X-4层和尾矿区W-1层中还存在放线菌门固氮微生物,主要为弗兰克氏菌属().
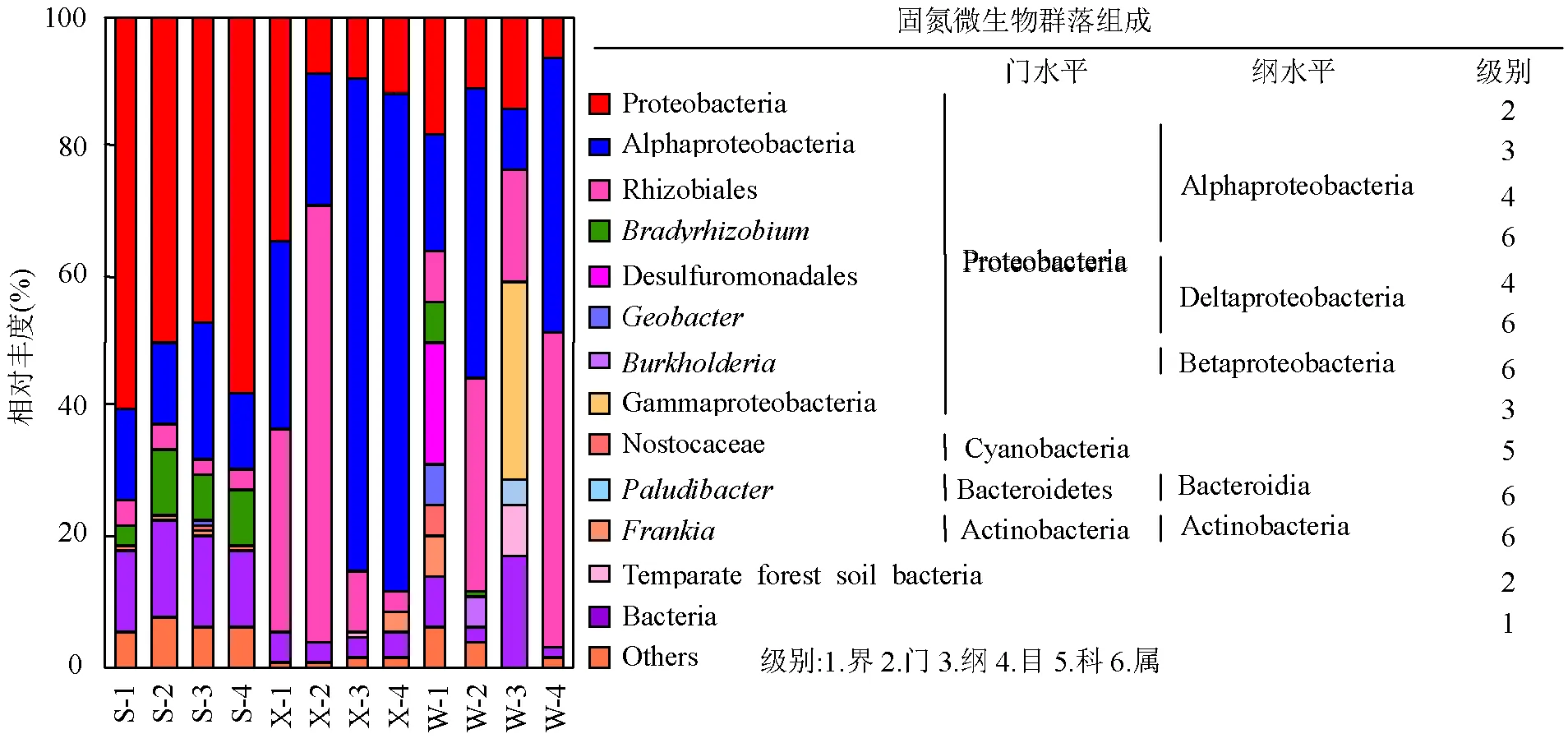
图2 泗顶矿区剖层土土壤固氮微生物属水平群落组成
2.3 土壤环境变化对固氮微生物群落结构多样性的影响

表2 多元线性回归分析环境因子多样性指数的影响
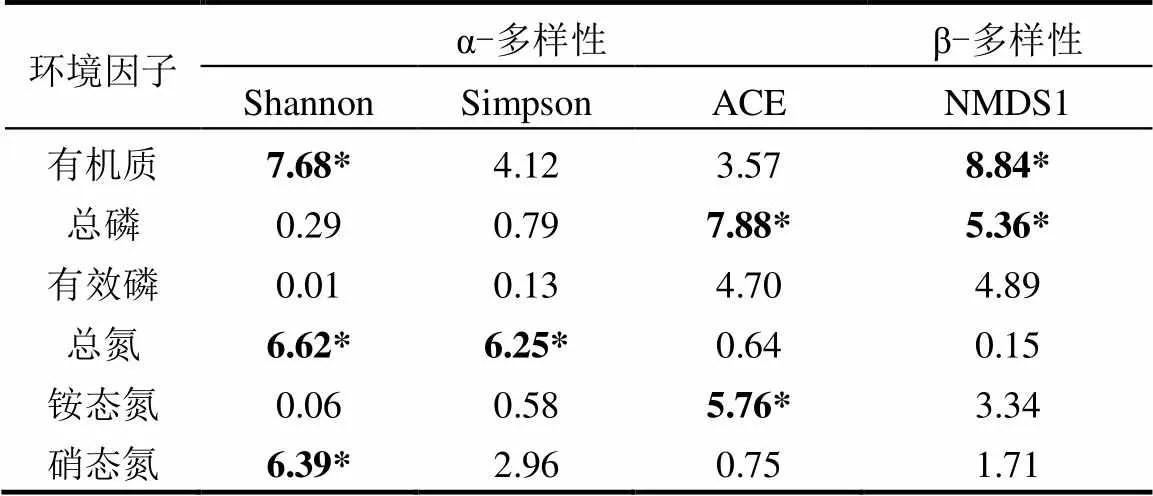
续表2
注: *<0.05, **<0.01, ***<0.001.
以土壤重金属含量(铅、锌、镉、铜和锰含量)、土壤pH值、含水率、有机质、总氮、铵态氮、硝态氮、总磷和有效磷含量以及土壤中钾、钙、钠和镁含量作为环境变量,采用多元线性回归分析环境因子变化对土壤固氮微生物群落的α-多样性指数(Shannon、Simpson和ACE指数)和β-多样性指数(NMDS1指数)的影响(表2).结果表明,土壤铅、锌和镉含量的变化显著影响了Shannon指数、ACE指数和NMDS1(<0.05),其中,锌含量变化对NMDS1指数的影响尤其显著(=33.89,<0.001).土壤钾、钙和钠含量变化显著影响了ACE指数(<0.05),其中,钠含量变化对ACE指数的影响尤其显著(=46.91,<0.001).同时,土壤钾和钠含量变化显著影响了NMDS1指数(<0.05).另外,土壤含水率、有机质、总氮和硝态氮含量变化显著影响了Shannon指数(<0.05).土壤含水率和总氮含量变化显著影响了Simpson指数(<0.05).土壤总磷和铵态氮含量变化显著影响了ACE指数(<0.05).土壤有机质和总磷含量变化显著影响了NMDS1指数(<0.05).
2.4 土壤环境变化对固氮微生物nifH基因丰度和群落组成的影响
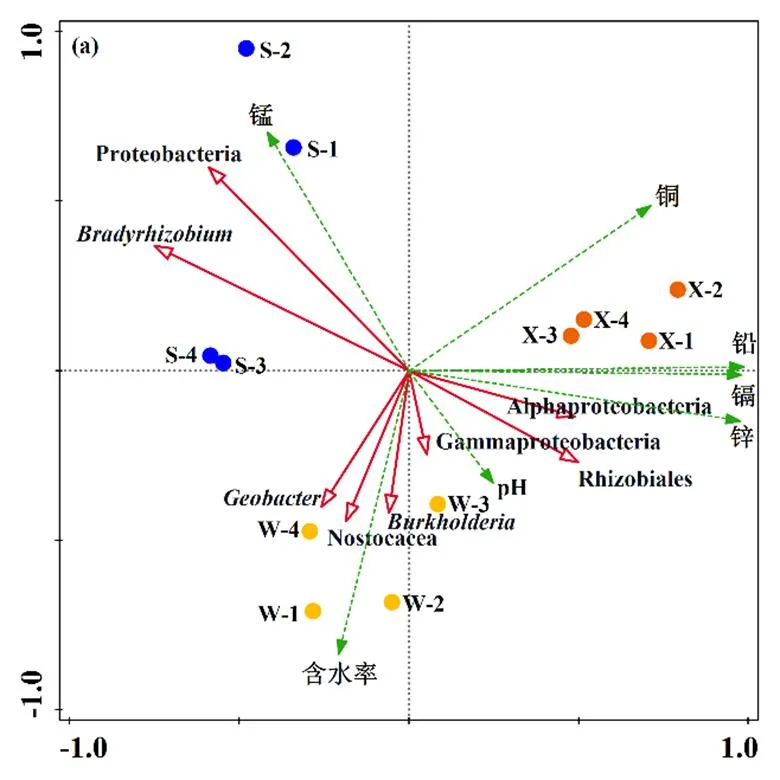
图(a) 固氮微生物与重金属、pH值和含水率的冗余分析; 图(b) 固氮微生物与有机质、总氮、铵态氮、硝态氮、总磷、有效磷和H基因数的冗余分析.其中:红色实线箭头代表属水平上的土壤固氮微生物OUT,绿色虚线箭头代表环境因子,紫色实线箭头代表H基因数
土壤环境变化对固氮微生物H基因丰度和群落组成的冗余分析如图3和表3所示.图3(a)的RDA结果表明,第一轴(Axis 1)和第二轴(Axis 2)分别解释了52.57%和47.92%的变异;同时,微生物群落数据变化的累计解释量为98.94%;微生物组分变化-土壤环境因子累计解释量为97.13%.表明土壤重金属含量、土壤pH值和含水率对固氮微生物群落组成有显著影响.图3(b)的RDA结果表明,第一轴(Axis 1)和第二轴(Axis 2)分别解释了53.11%和86.06%的变异;同时,微生物群落数据变化的累计解释量为98.26%;微生物组分变化-土壤环境因子累计解释量为98.83%.表明土壤有机质、氮(总氮、铵态氮和硝态氮)和磷(总磷和有效磷)对固氮微生物群落组成有显著影响.

表3 土壤固氮微生物群落结构差异的解释变量冗余分析
基于Spearman等级相关系数分析环境因子对固氮微生物H基因数和属水平相对丰度影响的热图如图4所示.可以看出,α-变形菌纲和根瘤菌目的丰度与铅、锌、镉和有机质含量呈正相关(<0.05或<0.01).其中,根瘤菌目的丰度还与土壤pH值呈正相关(<0.05).慢生根瘤菌属、珠藻科和弗兰克氏菌属的丰度与土壤中钾和钠含量呈正相关(<0.05或<0.01),与土壤铅和锌的丰度呈负相关(<0.05或<0.01).并且,慢生根瘤菌属的丰度还与土壤中铵态氮、总磷和有效磷含量呈正相关(<0.05).另外,慢生根瘤菌属、地杆菌属()、珠藻科、除硫单胞菌目(Desulfuromonadales)、弗兰克氏菌属的丰度与土壤中钙含量呈负相关(<0.05).同时,固氮微生物H基因丰度与土壤中铜、锰、钠、总氮、铵态氮、硝态氮、总磷、有效磷含量及含水率呈正相关(<0.05或<0.01);与土壤中钙和镁的含量呈负相关(<0.01).表明土壤环境因子变化在不同程度上影响了固氮微生物H基因丰度和群落组成.

图4 环境因子对固氮微生物nifH基因数和属水平相对丰度影响的热图
*<0.05, **<0.01
3 讨论
微生物在生态系统的功能保持和维护过程中起着至关重要的作用,尤其是在氮循环过程中,固氮微生物直接影响土壤的固氮效率,对缓解土壤生态系统的氮素极端不足和实现氮循环的正常运转至关重要[24].矿区及周边土壤重金属污染严重,各区域土壤中碳、氮和磷等含量差异较大,这会对土壤固氮微生物的丰度、多样性和群落组成产生影响[9,25].
变形菌门在矿区各区域剖层土中均为优势菌门(图2).研究表明,变形菌门在土壤养分循环中发挥着重要的作用,广泛的存在于各种环境中,并且呈现出高度的多样化[8,24].变形菌门是加拿大安大略省北部矿区(主要污染物:镍和铜)土壤中的优势菌门[26],也是斯洛伐克西南部矿区(主要污染物:镍、钴和锌)土壤中的优势菌门[27].在本研究中,变形菌门固氮微生物主要由α-变形菌纲组成.α-变形菌纲下的根瘤菌目、慢生根瘤菌科、慢生根瘤菌属和厌氧粘细菌等可以与豆科植物形成根瘤并进行共生固氮[28].其中,这些固氮微生物物种如根瘤菌目、慢生根瘤菌科和慢生根瘤菌属被认为是可以定殖于矿区的先锋微生物物种[29].矿区各区域剖层土中根瘤菌目相对丰度较高,并且在上游区剖层土中,慢生根瘤菌属相对丰度较高;这些固氮微生物的高比例存在,表明这些区域存在共生固氮的可能.另外,在矿区各区域剖层土中还存在蓝藻菌门固氮微生物.研究表明,蓝藻菌门微生物是自养型微生物,广泛存在于植物的根瘤中[11,30].这表明这些区域的剖层土壤中存在一定丰度的自养型固氮微生物.在尾矿区W-3层中还检测到拟杆菌门固氮微生物,研究表明,拟杆菌门微生物也是常见的固氮微生物[31].Li等[32]指出拟杆菌门微生物对重金属的耐受性较好,可以在重金属污染严重的环境中生存.
矿区上游剖层土固氮微生物H基因丰度较高,并且各区域表层土(0~15cm)中的H基因丰度相对于同区域的其他层最大;上游区和下游区的H基因丰度随着土壤剖层深度的增加而显著减小(<0.05)(图1(a)).Zhao等[33]的研究表明,重金属污染可能对土壤微生物产生两个明显的影响,一是不适应高浓度或重金属毒性的微生物种群数量减少;二是对高污染环境适应性较强的微生物种群数量增加.在本研究中,土壤铜和锰的含量在一定程度上影响了固氮微生物H基因丰度(图4);然而,相对于尾矿区,下游区的铅、锌和镉含量更大(表1),H基因丰度更高.因此,本文认为土壤重金属含量对泗顶矿区各区域剖层土固氮微生物H基因丰度产生了一定的影响,但主要影响剖层土固氮微生物H基因丰度的因素是土壤氮(总氮、铵态氮和硝态氮)和磷(总磷和有效磷)的含量(图4).研究表明,与氮相关的参数如总氮、铵态氮和硝态氮水平的变化是影响土壤固氮微生物丰度和群落结构的主要因素[25,34].磷作为生物生长所必须的营养元素之一,参与微生物的细胞生理过程,包括能力存储、代谢和细胞分裂[35],也会对土壤固氮微生物丰度和群落结构产生影响[36-37].并且,由于矿区各区域剖层土中存在一定丰度的根瘤菌目和慢生根瘤菌属固氮微生物,表明矿区土壤存在共生固氮的可能;Israel指出[38],土壤磷含量的增加可以有效促进共生固氮进程.因此,在氮和磷含量更为丰富的上游区和下游区,固氮微生物H基因丰度相对更高.
同时,土壤氮和磷的含量变化,对固氮微生物群落的α-多样性和β-多样性也产生了不同程度的影响(表2).在总氮含量较高的上游区,固氮微生物群落的Shannon指数较高而Simpson指数较低,表明土壤总氮含量对固氮微生物群落的多样性和均匀性产生了影响;在铵态氮含量较高的上游区,ACE指数相对较高,表明铵态氮含量对固氮微生物群落丰富程度产生了影响.说明在泗顶矿区,土壤氮含量的变化主要影响了土壤固氮微生物群落的多样性、丰富程度和均匀性.这与Li等[39]和Wang等[25]的研究一致,表明土壤氮含量变化是影响土壤固氮微生物群落结构和多样性的最主要因素之一.在总磷含量较高的上游区,ACE指数相对较高,表明总磷含量也对固氮微生物群落丰富程度产生了影响;并且总磷含量同时影响了NMDS1指数,说明在泗顶矿区,土壤总磷含量变化主要影响了土壤固氮微生物群落的均匀性和固氮微生物在各区域间的物种差异性.研究表明,铵态氮、总磷和有效磷的含量变化显著影响慢生根瘤菌属()的丰度(<0.05)(图4).这与Wang等[40]的研究一致,表明土壤磷含量和铵态氮含量是影响土壤固氮微生物群落组成和多样性的重要因素之一.
研究表明,土壤重金属含量变化对固氮微生物群落的多样性和组成均产生了不同程度的影响.其中土壤铅、锌和镉含量变化对固氮微生物群落的Shannon指数和ACE指数产生了显著的影响(< 0.05)(表2).在土壤铅、锌和镉含量较低的上游区, Shannon指数和ACE指数相对更高.表明土壤重金属含量较高,会降低群落的Shannon指数和ACE指数,影响微生物群落的多样性和均匀性,这与Chodak等[41]的研究结果相似.并且,土壤重金属含量过高,会对土壤的生物固氮过程产生抑制作用[42].同时,矿区土壤铅、锌和镉含量的变化对固氮微生物群落的NMDS1指数也产生了显著的影响(<0.01)(表2);其中锌含量变化的影响最大(=33.89,<0.001).表明矿区各区域固氮微生物群落组成的差异性主要由土壤铅、锌和镉含量的变化所引起,这也与Wang等[43]的研究结果相似.在土壤铅、锌和镉含量相对更高的下游区,α-变形菌纲和根瘤菌目的丰度更大.另外,土壤钾、钙和钠含量的变化对固氮微生物群落的ACE指数和NMDS1指数也产生了不同程度的影响(表2);其中,土壤钙(=15.63,<0.01)和钠(= 46.91,<0.001)含量的变化对ACE指数的影响最大.表明矿区各区域微生物群落组成的丰富度变化主要由土壤钙和钠含量的变化所引起.并且,土壤钠含量变化对固氮微生物群落的NMDS1指数也产生了显著的影响(<0.01).Quesada等[44]的研究表明,在稻田土壤中,钠含量与微生物固氮酶活性呈正相关关系.本研究的结果也表明钠含量与土壤固氮微生物H基因丰度呈显著的正相关关系(<0.01) (图4);然而,在重金属污染的矿区土壤中,钠含量变化如何影响固氮微生物群落结构和多样性组成还有待进一步研究.除此之外,土壤有机质含量变化对固氮微生物群落的Shannon指数和NMDS1指数产生了显著的影响(<0.05) (表2).Eo等[45]指出,土壤有机质的来源主要是植物根系碎片和渗出物,其与微生物的活性呈正相关关系,是影响土壤微生物群落结构的主要因素之一[46].本研究中,在有机质含量较高的上游区,Shannon指数相对更高;同时有机质含量变化也会引起矿区各区域微生物群落组成的差异性.
4 结论
4.1 变形菌门在上游区、下游区和尾矿区剖层土中均为优势菌门,占比超过70%;α-变形菌纲在上游区和下游区剖层土中均为优势菌纲.
4.2 上游区、下游区和尾矿区剖层土固氮微生物H基因丰度的范围分别为3.02×106~1.17×107、2.55×106~7.78×106和8.19×105~3.14×106基因拷贝数/g(干土).各区域表层土(0~15cm)的H基因丰度相对于其他层最大.主要影响H基因丰度的土壤环境因素是土壤氮和磷的含量;在氮和磷含量更为丰富的上游区和下游区,H基因丰度相对更高.
4.3 上游区剖层土的Shannon指数和ACE指数显著高于下游区和尾矿区,表明上游区剖层土固氮微生物群落的多样性和丰富程度相对较高.矿区各区域固氮微生物群落组成的差异性主要由土壤铅、锌和镉含量的变化所引起.
4.4 土壤钙和钠含量的变化对ACE指数的影响最大.表明矿区各区域微生物群落组成的丰富度变化主要由土壤钙和钠含量的变化所引起.
[1] Hernandez-Santin L, Erskine P D, Bartolo RE. A review of revegetation at mine sites in the Alligator Rivers Region, Northern Territory, and the development of a state and transition model for ecological restoration at Ranger uranium mine [J]. Journal of Cleaner Production, 2020, 246: 119079.
[2] Pietrzykowski M, Antonkiewicz J, Gruba P, et al. Content of Zn, Cd and Pb in purple moor-grass in soils heavily contaminated with heavy metals around a zinc and lead ore tailing landfill [J]. Open Chemistry, 2018,16(1):1143-1152.
[3] Ke W, Zhang X, Zhu F, et al. Appropriate human intervention stimulates the development of microbial communities and soil formation at a long-term weathered bauxite residue disposal area [J]. Journal of Hazardous Materials, 2021,405:124689.
[4] Yu FM, Lin JM, Xie DY, et al. Soil properties and heavy metal concentrations affect the composition and diversity of the diazotrophs communities associated with different land use types in a mining area [J]. Applied Soil Ecology, 2020,155:103669.
[5] Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen- cycling network [J]. Nature Reviews Microbiology, 2018,16:263.
[6] 赵 辉,周运超.不同母岩发育马尾松土壤固氮菌群落结构和丰度特征 [J]. 生态学报, 2020,40(17):6189-6201.
Zhao H, Zhou YC. Characteristics of structure and abundance of the nitrogen-fixing bacterial community insoil developed from different parent rocks [J]. Acta Ecologica Sinica, 2020,40(17):6189-6201.
[7] LeBauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed [J]. Ecology, 2008,89(2):371-379.
[8] Chen J, Shen W J, Xu H, et al. The composition of nitrogen-fixing microorganisms correlates with soil nitrogen content during reforestation: A comparison between legume and non-legume plantations [J]. Frontiers in Microbiology, 2019,10:508-518.
[9] Hsu S F, Buckley D H. Evidence for the functional significance of diazotroph community structure in soil [J]. The ISME Journal, 2009, 3(1):124-136.
[10] Steenhoudt O, Vanderleyden J. Azospirillum, a free-living nitrogen- fixing bacterium closely associated with grasses: genetic, biochemical and ecological aspects [J]. FEMS Microbiology Reviews, 2000,24(4): 487-506.
[11] Martinez-Perez C, Mohr W, Loscher CR, et al. The small unicellular diazotrophic symbiont, UCYN-A, is a key player in the marine nitrogen cycle [J]. Nature Microbiology, 2016,1(11):10.1038/ nmicrobiol.2016.163.
[12] Penton C R, Yang C Y, Wu L Y, et al. NifH-harboring bacterial community composition across an Alaskan permafrost thaw gradient [J]. Frontiers in Microbiology, 2016,7:10.3389/fmicb.2016.01894.
[13] Delmont T O, Quince C, Shaiber A, et al. Nitrogen-fixing populations of Planctomycetes and Proteobacteria are abundant in surface ocean metagenomes [J]. Nature Microbiology, 2018,3:804-813.
[14] Tischer A, Blagodatskaya E, Hamer U. Microbial community structure and resource availability drive the catalytic efficiency of soil enzymes under land-use change conditions [J]. Soil Biology and Biochemistry, 2015,89:226-237.
[15] 于方明,姚亚威,谢冬煜,等.泗顶矿区6种土地利用类型土壤微生物群落结构特征 [J]. 中国环境科学, 2020,40(5):2262-2269.
Yu F M, Yao Y W, Xie D Y, et al. Study on the soil microbial community structure associated with six land use in Siding mining area [J]. China Environemntal Science, 2020,40(5):2262-2269.
[16] Li Y, Wu Z, Dong X, et al. Variance in bacterial communities, potential bacterial carbon sequestration and nitrogen fixation between light and dark conditions under elevated CO2in mine tailings [J]. Science of the Total Environment, 2019,652:234-242.
[17] Singh J S, Gupta V K. Soil microbial biomass: A key soil driver in management of ecosystem functioning [J]. Science of the Total Environment, 2018,634:497-500.
[18] Che RX, Deng YC, Wang F, et al. Autotrophic and symbiotic diazotrophs dominate nitrogen-fixing communities in Tibetan grassland soils [J]. Science of the Total Environment, 2018,639:997- 1006.
[19] Dashti N, Ali N, Khanafer M, et al. Plant-based oil-sorbents harbor native microbial communities effective in spilled oil-bioremediation under nitrogen starvation and heavy metal-stresses [J]. Ecotoxicology and Environmental Safety, 2019,181:78-88.
[20] Han LL, Wang Q, Shen JP, et al. Multiple factors drive the abundance and diversity of the diazotrophic community in typical farmland soils of China [J]. FEMS Microbiology Ecology, 2019,95(8):10.
[21] 鲁如坤.土壤农业化学分析法 [M]. 北京:中国农业科技出版社, 1999.
Lu R K. Agrochemical analysis method of soil [M]. Beijing: China Agricultural Science and Technology Press, 1999.
[22] Chen J, Wang PF, Wang C, et al. Dam construction alters function and community composition of diazotrophs in riparian soils across an environmental gradient [J]. Soil Biology & Biochemistry, 2019,132: 14-23.
[23] Edgar RC. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013,10(10):996-998.
[24] Jing H M, Xia X M, Liu H B, et al. Anthropogenic impact on diazotrophic diversity in the mangrove rhizosphere revealed by nifH pyrosequencing [J]. Frontiers in Microbiology, 2015,6:13.
[25] Wang C, Zheng M, Song W, et al. Impact of 25 years of inorganic fertilization on diazotrophic abundance and community structure in an acidic soil in southern China [J]. Soil Biology and Biochemistry, 2017,113:240-249.
[26] Narendrula-Kotha R, Nkongolo KK. Bacterial and fungal community structure and diversity in a mining region under long-term metal exposure revealed by metagenomics sequencing [J]. Ecological Genetics and Genomics, 2017,2:13-24.
[27] Karelová E, Harichová J, Stojnev T, et al. The isolation of heavy-metal resistant culturable bacteria and resistance determinants from a heavy-metal-contaminated site [J]. Biologia, 2011,66(1): 18-26.
[28] Oldroyd G E D, Downie J A. Coordinating nodule morphogenesis with Rhizobial infection in legumes [J]. Annual Review of Plant Biology, 2008,59(1):519-546.
[29] Zhan J, Sun Q. Diversity of free-living nitrogen-fixing microorganisms in the rhizosphere and non-rhizosphere of pioneer plants growing on wastelands of copper mine tailings [J]. Microbiological Research, 2012,167(3):157-165.
[30] Schulz S, Engel M, Fischer D, et al. Diversity pattern of nitrogen fixing microbes in nodules of(L.) at different initial stages of ecosystem development [J]. Biogeosciences, 2013,10(2): 1183-1192.
[31] Inoue J, Oshima K, Suda W, et al. Distribution and Evolution of Nitrogen Fixation Genes in the Phylum Bacteroidetes [J]. Microbes and Environments, 2015,30(1):44-50.
[32] Rezaee L, Moosavi AA, Davatgar N, et al. Soil quality indices of paddy soils in Guilan province of northern Iran: Spatial variability and their influential parameters [J]. Ecological Indicators, 2020,117.
[33] Zhao X, Huang J, Lu J, et al. Study on the influence of soil microbial community on the long-term heavy metal pollution of different land use types and depth layers in mine [J]. Ecotoxicology and Environmental Safety, 2019,170:218-226.
[34] Zhong Y, Yan W, Shangguan Z. Impact of long-term N additions upon coupling between soil microbial community structure and activity, and nutrient-use efficiencies [J]. Soil Biology and Biochemistry, 2015,91: 151-159.
[35] Bent E, Németh D, Wagner-Riddle C, et al. Residue management leading to higher field-scale N2O flux is associated with different soil bacterial nitrifier and denitrifier gene community structures [J]. Applied Soil Ecology, 2016,108:288-299.
[36] Samaddar S, Chatterjee P, Truu J, et al. Long-term phosphorus limitation changes the bacterial community structure and functioning in paddy soils [J]. Applied Soil Ecology, 2019,134:111-115.
[37] Azziz G, Bajsa N, Haghjou T, et al. Abundance, diversity and prospecting of culturable phosphate solubilizing bacteria on soils under crop–pasture rotations in a no-tillage regime in Uruguay [J]. Applied Soil Ecology, 2012,61:320-326.
[38] Israel DW. Investigation of the role of phosphorus in symbiotic dinitrogen fixation [J]. Plant Physiology, 1987,84(3):835-840.
[39] Li C, Yan K, Tang L, et al. Change in deep soil microbial communities due to long-term fertilization [J]. Soil Biology and Biochemistry, 2014,75:264-272.
[40] Wang C, Zheng M M, Shen RF. Diazotrophic communities are more responsive to maize cultivation than phosphorus fertilization in an acidic soil [J]. Plant and Soil, 2020,452(1):499-512.
[41] Chodak M, Gołębiewski M, Morawska-Płoskonka J, et al. Diversity of microorganisms from forest soils differently polluted with heavy metals [J]. Applied Soil Ecology, 2013,64:7-14.
[42] Sun X, Kong T, Häggblom M M, et al. Chemolithoautotropic diazotrophy dominates the nitrogen fixation process in mine tailings [J]. Environmental Science & Technology, 2020,54(10):6082-6093.
[43] Wang C, Wu B, Jiang K, et al. Effects of different concentrations and types of Cu and Pb on soil N-fixing bacterial communities in the wheat rhizosphere [J]. Applied Soil Ecology, 2019,144:51-59.
[44] Quesada A, Leganés F, Fernández-Valiente E. Environmental Factors Controlling N2Fixation in Mediterranean Rice Fields [J]. Microbial ecology, 1997,34(1):39-48.
[45] Eo J, Park K-C. Long-term effects of imbalanced fertilization on the composition and diversity of soil bacterial community [J]. Agriculture, Ecosystems & Environment, 2016,231:176-182.
[46] Graham M H, Haynes RJ. Organic matter accumulation and fertilizer-induced acidification interact to affect soil microbial and enzyme activity on a long-term sugarcane management experiment [J]. Biology and Fertility of Soils, 2005,41(4):249-256.
Characteristics on the community structure and abundance of diazotrophsfrom the soil profile in the Siding mine area.
LI Yi1,2, ZHANG Hai-chun3, LIU Yuan2, WEI Jiao-teng2, WANG Cong2, LIANG Ying2, LIU Ke-hui1,3**, YU Fang-ming1,2*
(1.Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection, Ministry of Education, Guangxi Normal University, Guilin 541004, China;2.College of Environment and Resources, Guangxi Normal University, Guilin 541004, China;3.College of Life Science, Guangxi Normal University, Guilin 541004, China)., 2022,42(4):1819~1828
In the present study, twelve soil profile samples (4 soil layers in each area) were collected from upstream, downstream and mine tailing areas in the Siding mine located in Liuzhou, Guangxi Province. The community composition, abundance and diversity of diazotrophs from the soil profile were examined using Illumina MiSeq high-throughput sequencing technology and fluorogenic quantitative real-time PCR technology. The results indicated that the phylum Proteobacteria was the most dominant taxon, with an abundance higher than 70%. Alphaproteobacteria was the dominant class in the soil profile from the upstream and downstream areas. TheH gene abundance in the soil profile ranged from 3.02×106~1.17×107, 2.55×106~7.78×106and 8.19×105~3.14×106gene copies/g (DW) in upstream, downstream and mine tailing areas, respectively. Nitrogen-related soil properties (including total nitrogen, ammonia and nitrate) and phosphorus-related soil properties (including total phosphorus and available phosphorus) were the main factors influencingH gene abundance. Soil lead, zinc and cadmium concentrations were found to mainly influence diazotrophic community composition. The Shannon index and ACE index of the diazotrophic community in upstream area were higher than those in the downstream and mine tailing areas, which indicated that the diversity and richness of the diazotrophic community in the soil profile were relatively higher in the upstream area. In addition, the soil potassium, calcium and sodium contents contributed to the ACE index and NMDS1index of the diazotrophic community to different degrees. Hence, the results indicated that variation in soil environmental factors had an impact on the community composition, abundance and diversity of diazotrophs from the soil profile. Our research will help to provide a scientific basis for nitrogen regulation, ecological restoration and reconstruction in mining areas.
mine area;diazotrophs;soil profile;community structure;H gene abundance
X172
A
1000-6923(2022)04-1819-10
李 艺(1986-),女,辽宁盖州人,副教授,博士,主要从事环境污染生物修复研究.发表论文30余篇.
2021-09-16
国家自然科学基金资助项目(41967019,41907096)
*责任作者, 教授, fmyu1215@163.com; **教授, coffeeleave@126.com
