基于自主核酸提取方法分析单油井采出液微生物*
2022-05-09熊驷骏万云洋穆红梅李文宏费佳佳徐飞艳陈践发
熊驷骏 万云洋 穆红梅 李文宏 费佳佳 徐飞艳 陈践发
(1.中国石油大学(北京)油气资源与探测国家重点实验室,地层微生物资源与应用研究中心,油气污染防治北京市重点实验室,非常规油气科学技术研究院;2.中国石油集团长庆油田分公司勘探开发研究院)
0 引 言
由于微生物技术在油藏领域逐渐广泛的应用,使用常规培养[1-2]和免培养[3-4]方法研究其微生物变化特征的报道越来越多,一般对油田油藏样品都是从油田取样带回实验室再进行后续分析[5],样品中微生物信息往往随样品保存时间的延长而失真,由此开发了系列基于油田现场的培养[6-9]和免培养[10-11]技术用于原位快速分析指导油田生产实践,结果表明以原位直接提取采出液总DNA为主的免培养方法能较好反映油藏样品真实性。
由成千上万种烃类和非烃类化合物组成的原油[12-14]具有黏稠、浓黑、生物量低和试剂可及性差等特点,使得直接对油藏样本总DNA的提取造成困难,成为油藏微生物多样性研究的一大难题。目前对油井采出液微生物总DNA提取报道极少,在为数不多的相关报道中大多只是对原油样品使用通用的针对环境样本的商业基因组DNA试剂盒进行提取[15-17],针对性不强。本文基于自主DNA提取方法(原油核酸法)[1-11],使用γ-戊内酯等阳-阴表活剂法并对操作方法进行一定优化,再通过高通量测序分析对开发单井油水样品进行原油核酸法应用效果评价。
1 材料与方法
1.1 材 料
从长庆油田的Q2YG138140生产井井口以避免污染的方法[18]采集了采出液(地层水和原油)样品。实验试剂耗材[13]若无特别说明,均为市售分析纯,经无菌处理使用。
1.2 实验方法
1.2.1 原油密度和黏度测定
按照国家标准方法[19-20]测定原油密度和黏度,简单的说,取适量原油混合均匀并预热,待对应仪器温度稳定(密度计为28℃,黏度计为20℃)后读数并记录结果,密度的测量是将标准质量的玻璃砝码悬空缓慢浸没入装有原油的烧杯中,通过测量浮力的变化计算出原油密度;黏度的测量是将标准转子放入填充好原油的套筒中,通过检测标准转速时产生的扭矩而折算成黏度值。
1.2.2 样本预处理
实验所用试剂耗材经高压蒸汽灭菌(灭菌程序为121℃,20 min)处理。4种孔径(10.00,1.00,0.22,0.10 μm)的聚碳酸酯滤膜,由75%酒精浸泡10 min后经反渗透(RO)纯化水洗涤润湿,然后放入组装好经消毒灭菌后的砂芯过滤装置[21]。
采出液即刻在长庆油田现场进行静置油水分层(2~3 h),分层采出液(上油下水)油相和水相均分别进行基因组DNA提取。
油相样品的预处理参考原油核酸法[10-11],水相样品(500 mL)经过装有4种滤膜的设备依次逐级抽滤,将所得各级滤膜分别置于无菌离心管中,4℃保存,1 d内运到实验室分析[21]。
1.2.3 样本基因组DNA提取和验证
上一步静置分层并经预处理后的油相和水相(4种抽滤后的滤膜)基因组总DNA的提取参考原油核酸法。该方法相对于目前常规的提取方法,主要不同之处在于改良了分离和富集原油微生物的方法,原创性的缓冲液组合的配比体系使细胞裂解更彻底;并针对性地优化了纯化核酸的方法和步骤,相对于常规的商业试剂盒,该方法在保证提取质量的同时也提高了时效性和重复性[10-11]。油相基因组总DNA经4℃密封保藏7 d内运到实验室分析。
应用纳量光度仪(NanoPhotoMeter 330,P-Class,音谱堎公司(Implen GmbH Schatzbogen),德国)和1%的琼脂糖溶液电泳检测DNA的浓度和纯度。
1.2.4 高通量测序以及数据的统计分析
PCR(伯乐(BIO-RAD)快速自动编程PCR仪,C1000,美国)所用引物为覆盖16S rRNA基因V4区域的细菌、古菌通用引物515F(5′-GTGCCAGCMG-CCGCGGTA-3′)和806R(5′-GGACTACVSGGGTA- TCTAAT-3′)[22-23]。提取产物进行高通量测序分析[24]。
2 结果与讨论
2.1 结 果
2.1.1 采出液样本基因组总DNA提取结果
原油样品的密度为0.838 g/cm3(28℃),黏度为9.400 mPa·s(20℃),属于稀油样本[25-26]。
研究表明,油相样本总DNA浓度((3.07±0.11)μg/g)经密度转换后((2.57±0.09) μg/mL)远高于单位体积内水样样本各级滤膜的总DNA浓度(各级滤膜总DNA分别为(9.89±0.76),(7.51±0.47),(4.36±0.29),(2.45±0.30) ng/mL)(表1),表明油藏有丰富的嗜油微生物。电泳结果显示油相和水相对应的提取产物在经扩增后均能产生特异性条带,表明此方法提取到的油藏采出液基因组总DNA的质量(图1)可进行后续分析。
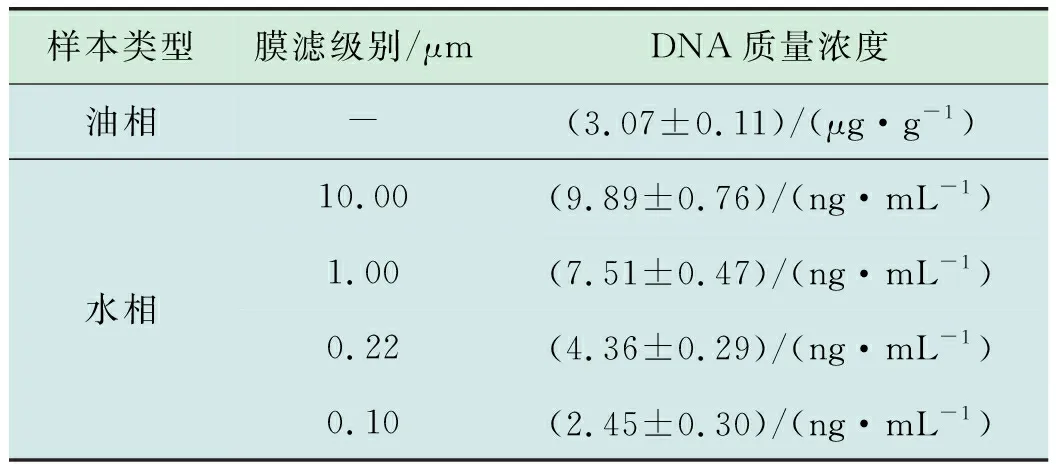
表1 Q2YG138140采出液基因组总DNA浓度
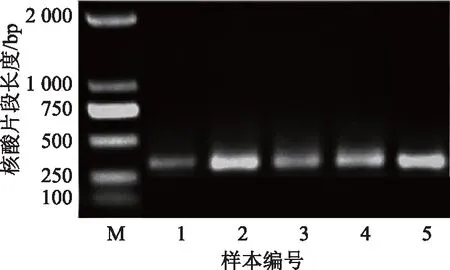
注:电泳条带M表示核酸标志物,1~4依次对应Q2YG138140采出液样品4种滤膜依次提取的微生物总DNA扩增产物,5为Q2YG138140样品油相微生物总DNA扩增产物。图1 提取Q2YG138140采出液总DNA的扩增产物琼脂糖凝胶(1%)电泳图
2.1.2 采出液群落组成
高通量测序共得到采出液菌群总DNA原始序列63 487条,有效序列63 274条,样品测序覆盖度为99.66%,测序深度达到分析要求且数据质量可靠。基于97%相似度的分类水平,共注释到105个细菌和古菌的OTU,分属于21门、43纲、73目、124科和183属。所有门及相对丰度排名前20属[27]的菌检出情况(图2)表明,采出液总菌群主要菌门依次是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、杆状菌门(Bacteroidetes)等,其中优势门为变形菌门。主要菌属依次是蛭弧菌属(Bdellovibrio)、水小杆菌属(Aquabacterium)、不运杆菌属(Acinetobacter)等,优势属为蛭弧菌属。原油核酸法对Q2YG138140采出液检出的门和属水平菌群分类情况见表2。

注:*目前未知微生物。图2 Q2YG138140采出液门水平(a)、变形菌门纲水平(b)及属水平(c)菌群相对丰度
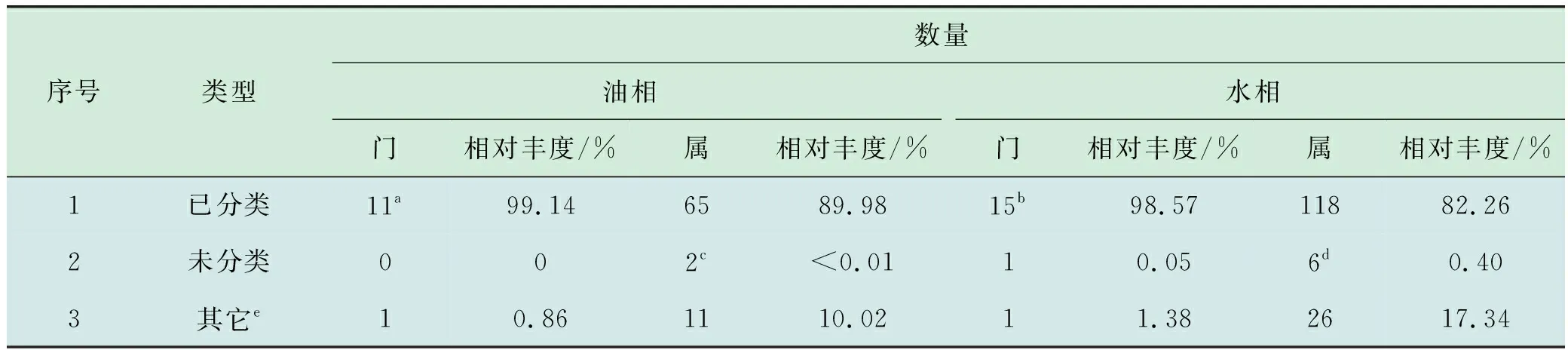
表2 原油核酸法对Q2YG138140采出液检出的门和属水平菌群分类情况
2.1.3 采出液油相和水相的群落组成
采出液中油相共检出11门,水相共检出17门,油相和水相共有6门是变形菌门、厚壁菌门、放线菌门、杆状菌门、蓝细菌门、酸杆菌门,油相独有的4门是奇果热菌门(1.06%)、芽单胞菌门(0.258%)、螺旋体门(0.079 2%)和候选醋热菌门(0.002 08%),水相独有的9门是纺锤菌门(0.290%)、衣原体门(0.232%)、协生菌门(0.102%)、热袍菌门(0.079 7%)、候选甘蔗菌门(0.075 5%)、热脱硫化小杆菌门(0.058 1%)、疣微菌门(0.050 7%)、浮霉菌门(0.006 33%)和广古菌门(0.002 11%)等(图3)。
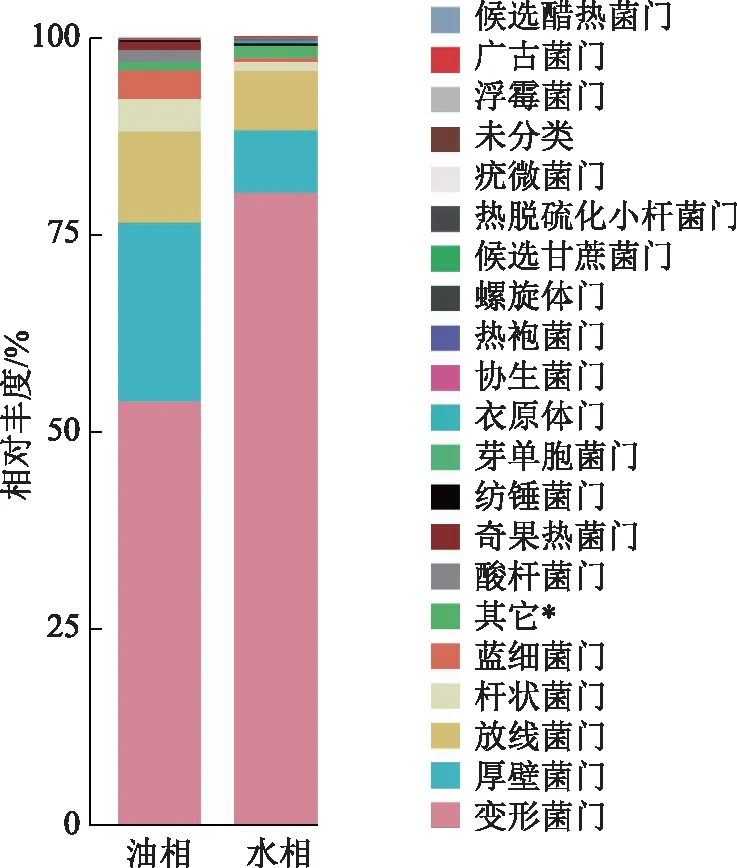
注:*细菌_门。图3 Q2YG138140采出液油相和水相门水平菌群相对丰度
采出液中油相共检出78属,水相共检出150属,油相和水相共有的9属依次是葡萄果菌属(Staphylococcus)、不运杆菌属、鞘氨醇单胞菌属(Sphingomonas)、棒小杆菌属(Corynebacterium)、蛭弧菌属、淖单胞菌属(Pelomonas)、链果菌属(Streptococcus)、海之杆菌属(Marinobacter)和甲基小杆菌属(Methylobacterium),油相独有的是冷杆菌属(Psychrobacter)(12.9%)、假单胞菌属(Pseudomonas)(5.49%)、陌柄菌属(Atopostipes)(2.39%)、窄营单胞菌属(Stenotrophomonas)(2.03%)、莫拉姓菌属(Moraxella)(1.57%)、莱茵海默氏菌属(Rheinheimera)(1.36%)、芬戈尔德氏菌属(Finegoldia)(1.31%)、乳竿菌属(Lactobacillus)(1.14%)、奇果菌属(Deinococcus)(1.06%)、玫果菌属(Rhodococcus)(0.862%)、琻姓菌属(Kingella)(0.819%)、噬甲基菌属(Methylophaga)(0.812%)、韦荣姓菌属(Veillonella)(0.712%)和紫小杆菌属(Janthinobacterium)(0.685%);水相独有的是水小杆菌属(14.8%)、分枝小杆菌属(Mycobacterium)(4.23%)、短波单胞菌属(Brevundimonas)(2.11%)、芽单胞菌属(Blastomonas)(1.34%)、涅瓦河菌属(Nevskia)(1.03%)、慢根瘤菌属(Bradyrhizobium)(1.02%)、孪果菌属(Geminicoccus)(0.937%)、嗜血菌属(Haemophilus)(0.854%)、弓杆菌属(Arcobacter)(0.755%)、奈瑟氏菌属(Neisseria)(0.619%)、卟单胞菌属(Porphyromonas)(0.475%)、竿菌属(Bacillus)(0.403%)和小粒小鏈菌属(Granulicatella)(0.342%)等(图4)。

注:1—蓝细菌门_属;2—奈瑟氏菌科_属;3—细菌_属;4—黄小杆菌科_属;5—乳杆菌目_属;6—蒂西耶姓菌科_属;7—酸杆菌纲_属;8—变形菌门_属;9—德尔塔变形杆菌纲_属;10—阿尔法变形杆菌纲_属;11—间孢囊菌科_属。图4 Q2YG138140采出液油相和水相属水平菌群相对丰度
2.1.4 采出液分级膜滤的群落组成
采出液的水相样本中,共检出17门、35纲、64目、105科和150属。4种滤膜(10.00,1.00,0.22,0.10 μm)检出的共有菌门有4门:变形菌门、厚壁菌门、放线菌门和杆状菌门,其中相对丰度最高的均为变形菌门(分别为83.0%,84.7%,72.3%和80.9%)。4种滤膜检出的共有菌属有11属:蛭弧菌属、不运杆菌属、水小杆菌属、甲基小杆菌属、鞘氨醇单胞菌属、葡萄果菌属、分枝小杆菌属、芽单胞菌属、涅瓦河菌属、淖单胞菌属和弓杆菌属,其中相对丰度最高的分别是蛭弧菌属(10.00 μm,20.7%)、蛭弧菌属(1.00 μm,17.9%)、水小杆菌属(0.22 μm,20.2%)和水小杆菌属(0.10 μm,16.9%)。
4种滤膜检出菌门分别是10门、8门、10门和13门(图5)。10.00 μm滤膜上检出的特有菌门是协生菌门,1.00 μm滤膜上检出的特有菌门是疣微菌门,0.22 μm滤膜上未检出的特有菌门,0.10 μm滤膜上检出的特有菌门是热袍菌门、热脱硫化小杆菌门和浮霉菌门。
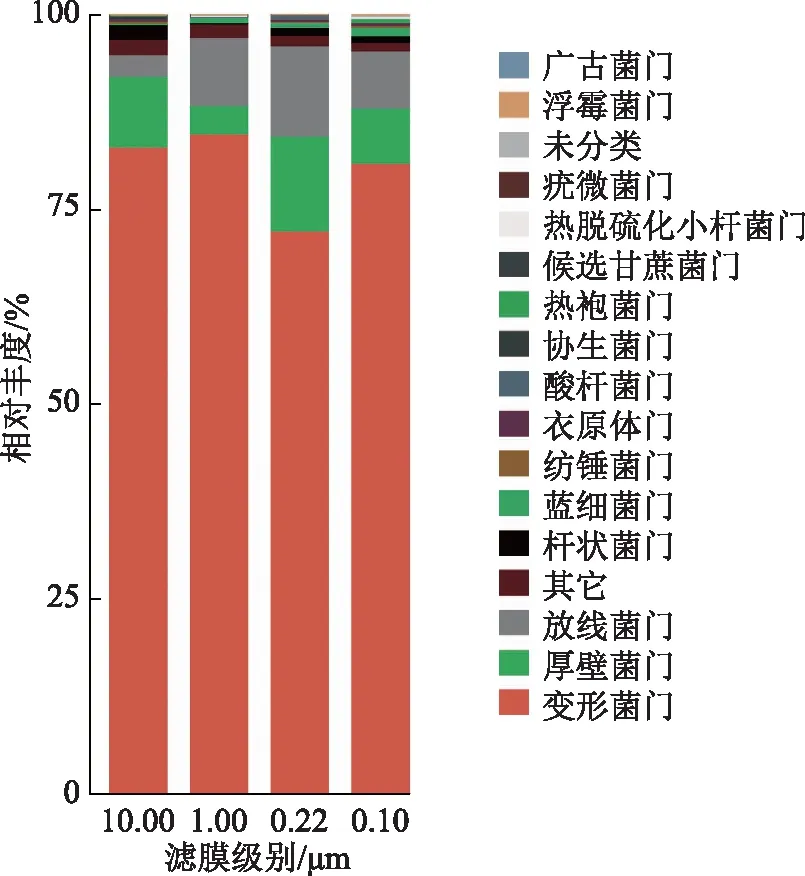
注:“其它”是指无命名地位但已分类的菌名的集合;“未分类”指未明确分类菌门的集合。图5 Q2YG138140不同膜滤级别门水平菌群相对丰度
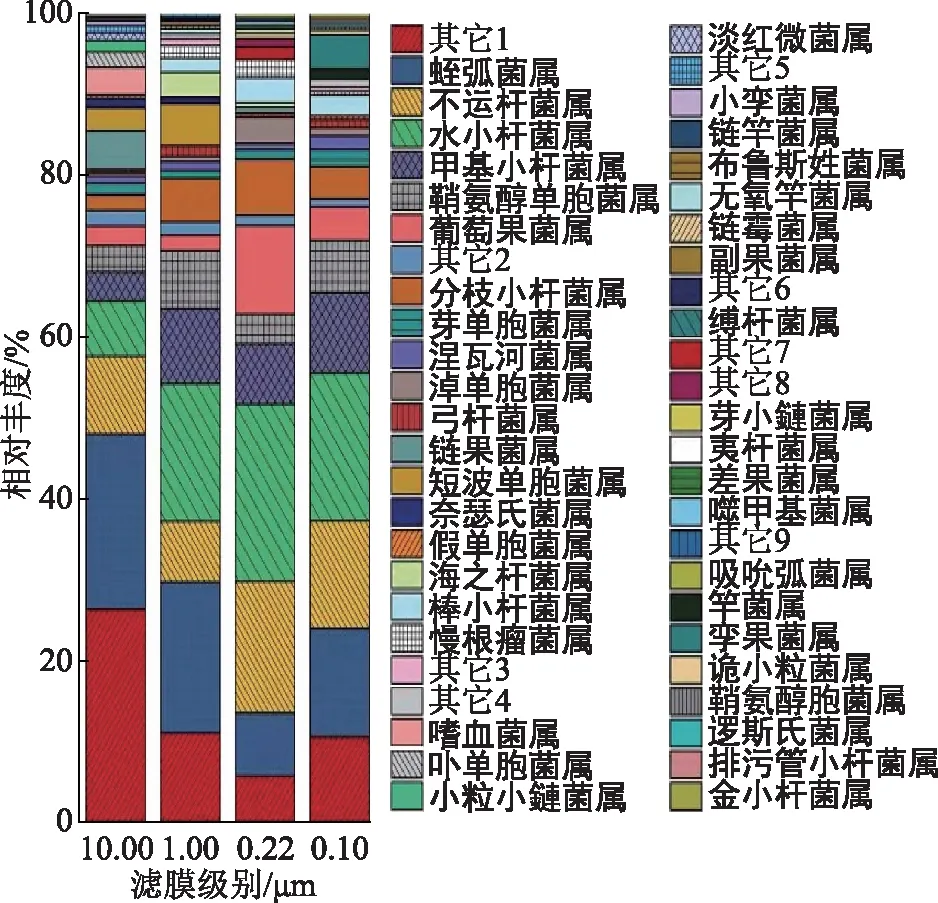
注:分类级别为1—变形菌门_属;2—细菌域_属;3—阿尔法变形杆菌纲_属;4—蓝细菌门_属;5—奈瑟氏菌科_属;6—外磂玫螺体科_属;7—德尔塔变形杆菌纲_属;8—间孢囊菌科_属;9—伽马变形杆菌纲_属。图6 Q2YG138140不同膜滤级别属水平群落相对丰度
4种滤膜菌属的检出分别是59属、65属、79属和82属(图6)。10.00 μm滤膜上检出的特有7菌属是嗜血菌属、卟单胞菌属、小粒小鏈菌属、淡红微菌属(Rubellimicrobium)、小孪菌属(Gemella)、链竿菌属(Streptobacillus)和布鲁斯姓菌属(Brucella)等;1.00 μm滤膜上检出的特有4菌属是无氧竿菌属(Anoxybacillus)、链霉菌属(Streptomyces)、副果菌属(Paracoccus)和缚杆菌属(Conexibacter)等;0.22 μm滤膜上检出的特有5菌属是芽小鏈菌属(Blastocatella)、夷杆菌属(Pontibacter)、差果菌属(Alloiococcus)、噬甲基菌属和吸吮弧菌属(Vampirovibrio)等;0.10 μm滤膜上检出的特有7菌属是竿菌属、孪果菌属、诡小粒菌属(Dolosigranulum)、鞘氨醇胞菌属(Sphingosinicella)、逻斯氏菌属(Rothia)、排污管小杆菌属(Cloacibacterium)和金小杆菌属(Chryseobacterium)。
2.2 讨 论
采出液油相的DNA浓度为(3.07±0.11) μg/g,与我们之前对各油田的研究总体一致,相对误差要远小于先前对来自不同油田不同油品性质原油的DNA提取效果(普通稠油(3.36±5.31) μg/g、中质原油(2.20±0.86) μg/g、特稠油(1.96±2.79) μg/g及超稠油(1.82±2.27) μg/g)[26],较小的质量提取偏差表明原油核酸法相较于先前的方法具有更好的重复性,对原油样本的提取本方法的提取效果更为稳定。
采出液的油相样本中,共检出11门、25纲、43目、66科和78属,而水相样本中,共检出17门、35纲、64目、105科和150属(图3和图4),采出液水相样本的微生物多样性显著大于油相样本,但从提取结果看,油相的DNA浓度高于水相,可见油相中存在非常明显的优势菌群。关于辽河油田采出液的研究中发现,在稠油油井中同一口井油相中微生物群落多样性比水相中更丰富[26],或体现微生物对不同油性的适应性差异。另外,本次提取的长庆油田白153区块Q2YG138140油井采出液样本基因组总DNA,共检出21门和183属。相比之前关于稠油的研究,每口稠油油井仅分别平均检出15门和180属。此外,奇果热菌门(仅油相检出)及3个候选菌门(候选醋热菌门(油相)、候选暗杆菌门(油相)和候选甘蔗菌门(水相))相对于先前的研究[25-26]是首次检出,这能进一步看出原油核酸法对于油藏采出液菌群总DNA的提取更具普适性,并对油相样本尤其是稠油样本的检测具有更好的实用性。
4种滤膜上检出的OTU数量依次为49 554,48 427,45 793和45 658,这与各级滤膜上提取得到的总DNA浓度大小顺序(依次为(9.89±0.76),(7.51±0.47),(4.36±0.29),(2.45±0.30) ng/mL)一致(表1),可见此提取方法在一定程度上符合一般规律,对于油藏采出液样本具较好的有适用性。门分类单元下,相对丰度大于1%的菌门(由多到少)依次为:变形菌门(75%)、厚壁菌门(11%)、放线菌门(9%)、杆状菌门(2%)、其它(1%)、蓝细菌门(Cyanobacteria)(1%)等(图2),其中变形菌门占有绝对优势;在属分类单元下,相对丰度大于1%的16属中其它占比最大(28%)(图2),进一步表明原油核酸法对油藏常见多种菌门及菌属基因组DNA的提取均具较好的适用性。
不论油相和水相均存在“其它”和“未分类”的菌属。油相中“未分类菌属”的相对丰度小于0.01%,水相中“未分类菌属”的相对丰度0.40%(表2)说明原油核酸法确能检出油藏采出液里存在的未知菌,对于环境样本里的未知微生物基因组总DNA具有一定的提取效果;提取得到的油相及水相的“其它”相对丰度分别达到10.02%和17.34%,高于文献报道[18,24],可见本方法针对生物量相对较低的极端环境微生物仍具有较好的检出能力,也进一步说明原油核酸法作为一种研究油藏微生物多样性的免培养的手段具有一定可行性。从菌门及菌属的检出情况(图5和图6)看,0.10 μm滤膜上检出的(0.10~1.00 μm尺寸范围)菌群多样性均大于其它3种滤膜的检出,这与先前的报道一致[28],说明自主DNA提取技术对于小尺寸油藏微生物的专有响应性能。
3 结 论
本研究通过自主研发的原油微生物总DNA提取方法(原油核酸法)检测到长庆油田白153区块Q2YG138140油井采出液微生物菌群。首先,较小的质量提取偏差表明本方法具有更好的重复性,对原油样本的提取效果更为稳定;其次,采出液检出菌群油相少于地层水相,符合文献报道的一般规律,表明原油核酸法对油藏常见多种菌门及菌属基因组DNA的提取均具较好的适用性和稳定性;第三,相对于先前的研究[18,25-26],该方法首次检出奇果热菌门(油相)及3个候选菌门(候选醋热菌门(油相)、候选暗杆菌门(油相)和候选甘蔗菌门(水相)),说明本方法对油藏采出液样本总DNA的提取仍具有较大的应用潜力;最后,4种滤膜共有5门和13属,0.10μm滤膜检出的菌群多样性明显多,或反映了油藏地层对微生物的胁迫。
