草海桐铜锌超氧化物歧化酶基因的克隆及序列分析
2022-04-06张静文张力文严云香李欣勇
张静文,张力文,严云香,常 义,陈 艳,李欣勇
(1.海南师范大学生命科学学院/热带岛屿生态学教育部重点实验室,海口 571158;2. 中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
【研究意义】植物受到逆境胁迫,如干旱、高盐、低温等,会诱导活性氧(ROS)的大量累积,ROS可导致生物分子损伤、凋亡或坏死、影响植物的生长发育[1]。超氧化物歧化酶(Super oxide dismutase,SOD)是一种重要的抗氧化酶,在清除自由基、维持活性氧代谢平衡、保护膜结构的功能及延迟衰老、保护组织和细胞免受氧化损伤方面起着重要作用。草海桐 (ScaevolasericeaL.) 作为一种盐生植物,因其抗逆性强而广泛分布于沿海沙滩、石砾地。研究表明伴随着盐浓度的升高,草海桐可通过增加抗氧化酶活性清除活性氧,降低盐胁迫对植物的伤害[2-3]。因此,本研究运用生物技术方法从草海桐中克隆铜锌超氧化物歧化酶基因,可为草海桐耐盐胁迫相关分子机制及超氧化物歧化酶的深入研究提供理论依据。【前人研究进展】SOD是一类金属酶,根据酶的辅因子的不同可分为4类:铜锌超氧化物歧化酶(Cu/Zn-SOD)、锰超氧化物歧化酶(Mn-SOD)、铁超氧化物歧化酶(Fe-SOD)和镍超氧化物歧化酶(Ni-SOD)[4]。该家族可催化超氧化物阴离子歧化为过氧化氢,进一步被过氧化氢酶和过氧化物酶消除,转化为无毒害作用的水和氧分子。Mn-SOD和Fe-SOD存在于线粒体、过氧化物酶体和叶绿体中。其中,Cu/Zn-SOD主要存在于叶绿体、细胞质和过氧化物酶体中,是活性氧清除酶系统中含量最丰富、最重要的酶,具有降低膜脂过氧化的作用[5]。前人研究表明,增强植物体内抗氧化酶活性有助于提高植物的抗逆性[6]。目前,研究人员已从秋茄[7]、水稻[8]、马铃薯[9]等植物中克隆得到Cu/Zn-SOD,经过逆境胁迫,发现均可诱导该基因的表达,提高植物的抗逆性。草海桐主要分布在我国华南沿海沙滩、石砾地,尤其是在我国的西沙群岛分布有大量的草海桐林。西沙群岛由于形成较晚,地貌主要是由珊瑚石灰岩和沙壤土组成,由此说明草海桐具有较强的抗逆性[10]。进一步研究表明,低盐下可促进草海桐生长;伴随着盐浓度的升高,草海桐可通过增加抗氧化酶活性和可溶性蛋白、可溶性糖、脯氨酸等渗透调节物质清除活性氧,降低盐胁迫对植物的伤害[2-3]。此外,草海桐还可响应干旱胁迫,通过对草海桐的形态解剖学特征发现:叶片及上表皮厚、气孔密度小、导管直径大,有利于适应干旱环境[11]。【本研究切入点】目前,对草海桐主要进行了在原生境下的抗逆生物学特性研究,尚未有关于抗逆功能基因的克隆与分析。【拟解决的关键问题】本研究以盐胁迫草海桐叶片为材料,运用RACE技术克隆获得草海桐Cu/Zn-SOD全长序列,并借助生物信息学技术对获得的Cu/Zn-SOD进行序列分析,并成功构建了pBinGlyRed-SsCSD重组质粒。研究结果有助于揭示草海桐对盐碱环境的适应机制,以期为草海桐的开发利用提供一定的理论与实践依据。
1 材料与方法
1.1 植物材料
草海桐(ScaevolasericeaL.)种子采自三亚铁炉港红树林自然保护区(18°15′N,109°42′E)。将浸种后的草海桐种子播种在沙床上,待种子萌发长出子叶后移植到装有黄沙、泥炭土(体积比为3∶1)的育苗袋里,随后放入人工气候箱 (10 h光照, 14 h黑暗),每天喷洒一定量的水,培养温度为25 ℃。待草海桐长出4~6片真叶时,用含有200 mmol/L NaCl的1/2 Hoagland 营养液处理24 h,处理结束后分别剪取草海桐的叶片和根,蒸馏水冲洗干净,滤纸擦拭后液氮速冻保存样品。
1.2 RNA提取及cDNA链的合成
称取0.1 g草海桐的叶片,根据EASYspinplus多糖多酚复杂植物RNA快速提取试剂盒 (艾德莱生物公司, 北京)说明书进行操作。RNA溶于30 μL RNase Free Water中,琼脂糖凝胶电泳检测RNA质量,超微量核酸蛋白测定仪(Thermo)检测所提总RNA的浓度,合格的样品用于下一步分析。以草海桐总RNA为模板,按照反转录试剂盒 (全式金,北京)说明进行反转录,合成 cDNA 第一链。使用内参基因SsActin1进行cDNA第一链检测[12]。
1.3 草海桐SsCSD基因保守片段的克隆
下载已报道的拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)、秋茄(Kandeliacandel)、苦瓜(MomordicacharantiaL.)、向日葵(Helianthusannuus)、黄花蒿(Artemisiaannua)、莴苣(Lactucasativa)、麻风树(Jatrophacurcas)、三裂叶薯(Ipomoeatriloba)、香瓜(Cucumismelo)等植物中的Cu/Zn-SOD氨基酸序列,运用ClustalW在线比对,根据同源序列设计简并引物(表1)以扩增草海桐SsCSD的保守片段。以草海桐 cDNA 为模板进行PCR扩增,PCR扩增条件为:95 ℃ 3 min; 95 ℃ 15 s,55 ℃ 15 s,72 ℃ 45 s(35个循环);72 ℃ 5 min。PCR产物检测回收后与pEASY-Blunt 载体 (全式金,北京)连接并转入到大肠杆菌感受态细胞中,随机挑取阳性菌落送到广州天一辉远基因科技有限公司测序。
1.4 草海桐SsCSD全长cDNA的克隆
对测序结果进行 Blast 在线分析,确认为CSD的同源片段后,根据获得的中间片段序列设计 3′RACE的正向引物3′RACE OP和3′RACE IP(表1),接头引物使用试剂盒提供的 UPM,参照 RACE试剂盒 (Takara,日本) 说明,进行草海桐SsCSD基因 3′末端的扩增。同样的,设计5′RACE的引物5′RACE OP和5′RACE IP,接头引物使用 UPM,进行草海桐SsCSD基因 5′末端的扩增。利用DNAMAN软件设计含有接头的引物进行ORF扩增。

表1 草海桐SsCSD基因克隆及表达分析的引物
1.5 草海桐SsCSD基因的生物信息学分析
利用Vector NTI软件对测序结果进行拼接,得到全长cDNA;运用NCBI的 ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder)识别开放阅读框并翻译成氨基酸序列。根据尹明华等[13]的方法对草海桐的SsCSD序列进行氨基酸序列分析、理化性质分析、结构预测、亚细胞定位和功能分析等。
1.6 草海桐SsCSD植物表达载体的构建及鉴定
使用无缝克隆法构建pBinGlyRed-SsCSD载体。根据NCBI的预测的ORF序列,利用DNAMAN软件设计含有接头的特异性引物,上、下游分别添加EcoRⅠ和XmaⅠ内切酶位点:SsCSDORF FP和SsCSDORF RP(表1),进行ORF扩增。PCR的扩增程序:95℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s 35个循环);72 ℃ 5 min。PCR产物经1%琼脂糖凝胶电泳进行检测回收。同时植物表达载体pBinGlyRed经过EcoRⅠ和XmaⅠ双酶切,将回收基因片段与线性化载体采用无缝克隆法进行连接,经热激法转入大肠杆菌感受态细胞。挑取单菌落进行菌落PCR验证和测序,提取质粒并采用冻融法转入农杆菌GV3101, 对菌液 PCR 鉴定为阳性的克隆即可用于遗传转化。
2 结果与分析
2.1 草海桐SsCSD全长cDNA序列的获取
使用简并引物CSD FP和CSD RP进行RT-PCR扩增获得约280 bp的保守片段(图1)。将该片段进行Blast分析,发现该序列同其他物种的铜锌超氧化物歧化酶高度同源。根据此片段序列设计特异性引物3′RACE OP,3′RACE IP,5′RACE OP和5′RACE IP,利用RACE技术获得了草海桐SsCSD基因的3′末端和5′末端cDNA片段,长度分别为650和700 bp。将上述3个核苷酸序列拼接后,获得了草海桐SsCSD基因的全长cDNA序列,其长度为1148 bp,5′端和3′端分别存在 92和370 bp 的非翻译区(图2)。
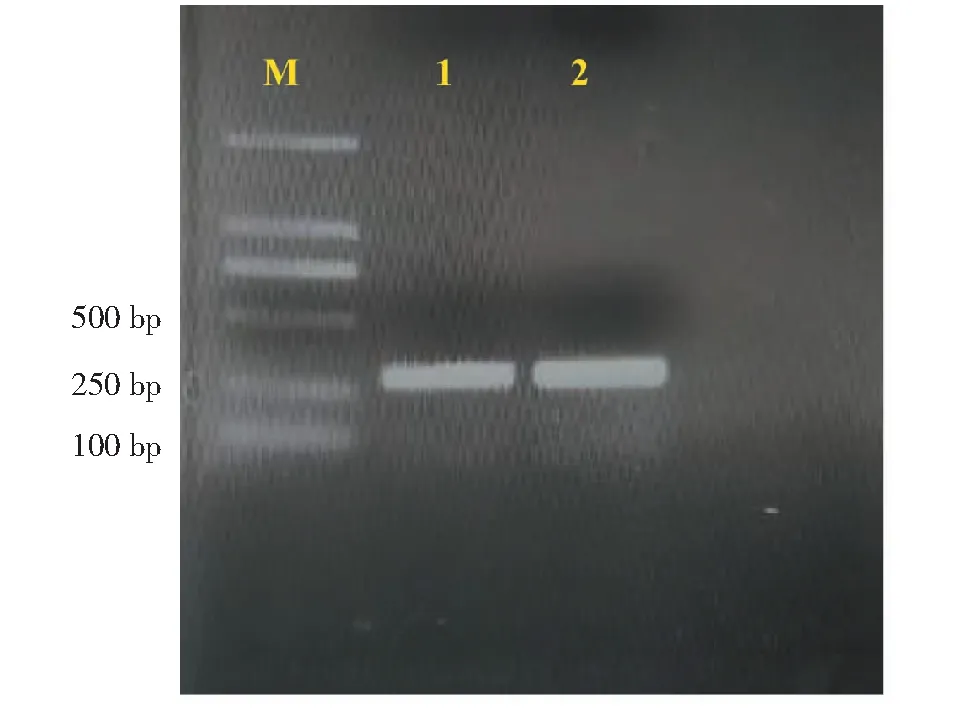
M: Trans 2K DNA marker; 1~2: CSD 保守片段M: Trans 2K DNA marker; 1-2: Conserved sequence of CSD图1 简并PCR凝胶电泳Fig.1 Degenerate PCR gel electrophoresis

图2 草海桐SsCSD的ORF框及氨基酸序列Fig.2 ORF and amino acid sequence of SsCSD in S.sericea
2.2 草海桐SsCSD基因编码蛋白的生物信息学分析
草海桐SsCSD含完整编码区,从起始子到终止子共编码228个氨基酸(图2),分子量为23.260 kDa,理论等电点为5.55,脂溶指数为85.18。利用ExPASy Proteomics Server的ProtScale程序分析该蛋白的亲水性和疏水性,总平均疏水性为-0.14,推测为亲水性脂溶蛋白(图3)。
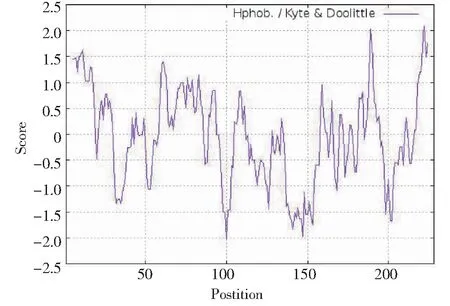
图3 SsCSD蛋白疏水性/亲水性预测和分析Fig.3 Protein hydrophobicity/hydrophilicity prediction and analysis of SsCSD
利用NCBI网站(https://www.ncbi.nlm.nih.gov/)对上述所得的蛋白序列进行保守结构域分析,由图4可知,草海桐SsCSD属于Cu/Zn-SOD家族。利用softberry网站对克隆得到的基因进行亚细胞定位分析,预测表明定位于叶绿体的可能性最大。采用Signal P 3.0 Server预测表明,SsCSD含有信号肽序列。TMHMM结果显示,该蛋白无跨膜区,为非跨膜蛋白(图5)。采用SOPMA结构预测草海桐SsCSD蛋白的二级结构显示无规则卷曲(Random coil,47.37%)和延伸链(Extended strand,28.95%)占比最高,其次是α-螺旋(Alpha helix,16.67%)和β-转角(Beta turn,7.02%)(图6)。
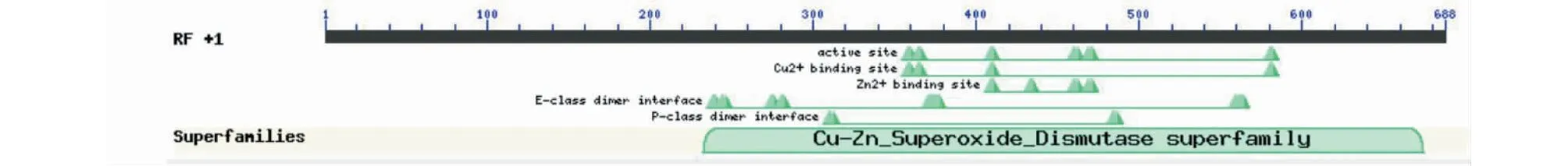
图4 草海桐SsCSD蛋白保守结构域分析Fig.4 Conserved domain analysis of SsCSD in S. sericea
2.3 草海桐SsCSD基因编码蛋白系统进化分析
为进一步了解SsCSD的生物学功能,采用MEGA7对草海桐和10个物种的CSD氨基酸序列进行系统进化树分析。经过比对分析,草海桐与双子叶植物向日葵、莴苣、黄花蒿的CSD蛋白在同一大分支下,表明草海桐的SsCSD蛋白在进化上与向日葵、莴苣、黄花蒿的亲缘关系最近(图7)。进一步聚类发现,Cu/Zn-SOD蛋白成员聚成2个大类,草海桐与拟南芥(AtCSD2)、秋茄(KcCSD)、麻风树(JcCSD)和向日葵(HaCSD)的叶绿体型CSD蛋白同处于一个分支;水稻(OsCSD1和OsCSD2)与拟南芥(AtCSD1)的细胞质型CSD蛋白同处于另一个分支。结合之前分析的SsCSD定位于叶绿体,该进化分析系统树表明草海桐SsCSD蛋白也聚类到叶绿体CSD蛋白,推测草海桐SsCSD蛋白定位于叶绿体。
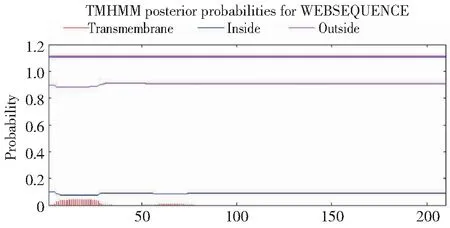
图5 草海桐SsCSD蛋白跨膜结构分析Fig.5 Protein transmembrane structure analysis of SsCSD in S. sericea
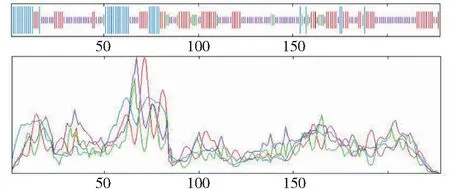
蓝色:α-螺旋;红色:延伸链; 紫色:无规则卷曲;绿色:β-转角Blue represents α-helix; Red represents extended strand; Purple represents irregular curl; Green represents β-turn图6 草海桐SsCSD蛋白二级结构预测Fig.6 Protein secondary structure prediction of SsCSD in S. sericea
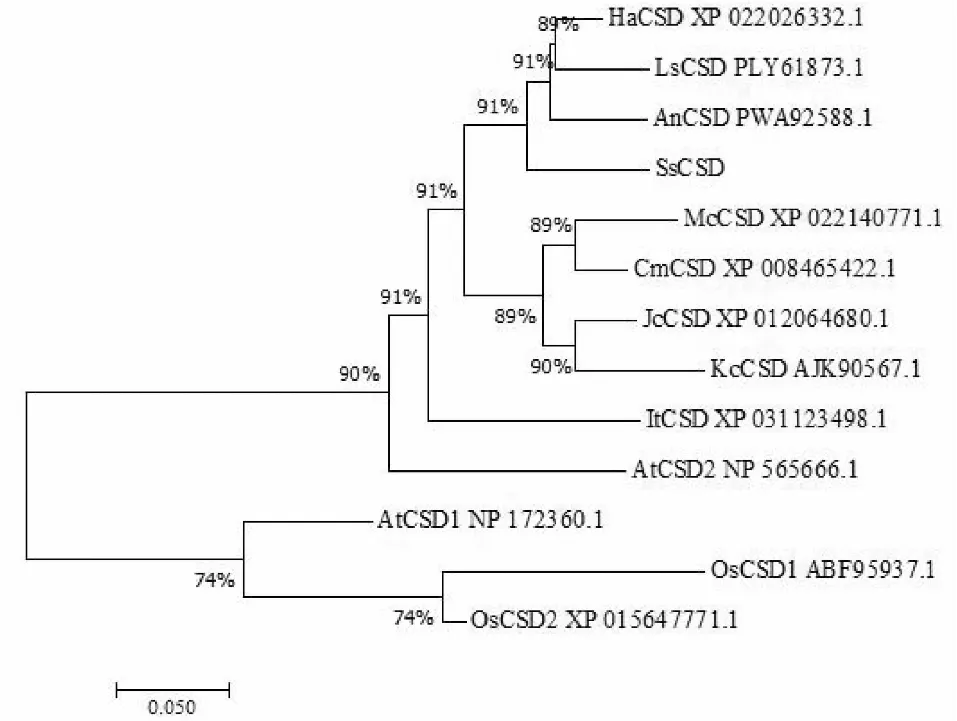
图7 草海桐与其他植物CSD氨基酸序列的系统进化分析Fig.7 Phylogenetic analysis of CSD in S. sericea and other plants
2.4 草海桐SsCSD基因的植物表达载体构建
以草海桐的cDNA为模板,用引物对CSD ORF FP和CSD ORF RP扩增SsCSD基因的ORF序列,凝胶电泳显示扩增得到一条约700 bp的条带,通过无缝克隆的方法将目的基因与线性化载体进行连接,筛选并测序正确后,重新提取质粒,转化农杆菌感受态细胞GV3101。菌落PCR鉴定显示均在750 bp左右有目的条带(图8),表明重组载体pBinGlyRed-SsCSD已成功转入农杆菌GV3101中,可用于下一步的植物遗传转化,以验证基因功能。

M: Trans 2K DNA marker; 1:阴性对照;2:阳性对照;3~9:阳性菌落M: Trans 2K DNA marker; 1: Negative control;2: Positive control;3-9: Screening for positive colonies for pBinGlyRed-SsCSD图8 草海桐SsCSD基因的表达载体阳性克隆鉴定Fig.8 The Positive clone identification for gene expression vector of SsCSD in S.sericea
3 讨 论
植物不同于动物,它以一种固着的生活方式以面对各种环境胁迫,诸如高温、低温、干旱、水涝及高盐等的影响。当植物面临非生物胁迫时,表现为叶片中叶绿素的含量减少,光合速率下降;氧离子(O2-)、过氧化氢(H2O2) 和羟基(-OH)等活性氧物质(ROS)积累,ROS的积累会引起膜系统的过氧化,从而造成细胞脂膜系统的破坏,而脂膜过氧化产物会对植物细胞造成毒害[14-15]。为了减轻ROS的毒害作用,植物配有一系列酶和非酶抗氧剂分子以清除ROS,超氧化物歧化酶作为一种抗氧化酶,具有清除活性氧的功能,保护植物体免受活性氧的危害[16]。Cu/Zn-SOD是3种歧化酶中含量最丰富的一种酶,是活性氧清除酶系统中最重要的酶,参与植物的耐盐碱、抗旱及耐高温等逆境胁迫,且易受到多种逆境因子的诱导表达[4]。草海桐是一种滨海植物,耐盐性强,且在一定范围内超氧化物歧化酶活性随着盐浓度的增大而提高,在此基础上,本研究通过RACE技术成功克隆了草海桐Cu/Zn-SOD。
近年来,对Cu/Zn-SOD研究较为广泛,如在白菜[17]、茶树[18]、丝瓜[5]、秋茄[7]中均克隆了Cu/Zn-SOD。按照其在细胞内的分布位置可分为细胞内Cu/Zn-SOD (ic Cu/Zn-SOD)和细胞外Cu/Zn-SOD(ec Cu/ZnSOD),细胞内Cu/Zn-SOD主要定位在细胞质和叶绿体中,而细胞外Cu/Zn-SOD则多见于动物细胞中[19-20]。本研究通过亚细胞定位预测SsCSD定位于叶绿体,结合系统进化分析草海桐SsCSD与其他植物叶绿体Cu/Zn-SOD聚在一个分支,推测草海桐SsCSD定位于叶绿体。研究表明,盐碱胁迫会诱导水稻的叶绿体Cu/Zn-SOD转录水平提高,SOD酶活性高于对照,过表达OsCu/Zn-SOD可显著提高水稻的耐盐性,且转基因株系的根长、株高和鲜重均高于对比水稻;随着盐胁迫加深,会加剧体内丙二醛的含量,通过生理指标检测发现过表达植株中的MDA含量显著低于对照株,表明过表达OsCu/Zn-SOD增强了植物清除活性氧的能力,降低了氧化胁迫伤害[8]。盐生植物具有更强的耐盐能力,秋茄在短期盐胁迫下,可通过根部有效排出Na+;而在长期盐胁迫下,可将Na+向上运输至叶片,导致叶片中H2O2含量提高,通过提高体内KcCSD的转录水平缓解盐胁迫,直接表现为叶片中的SOD活性增强[21]。研究人员克隆到了秋茄的CSD基因,分析显示为叶绿体型Cu/Zn-SOD,在烟草中过表达KcCu/Zn-SOD,盐胁迫情况下,转基因烟草叶绿体中的H2O2积累远低于野生型烟草,表明烟草叶绿体中光合电子传递链形成超氧阴离子,作为信号反馈调节抗氧化系统,激活逆境下的防御机制,减少叶绿体中活性氧的积累,缓解盐胁迫[7]。
4 结 论
本研究以盐胁迫草海桐为材料,运用RACE技术克隆到了草海桐Cu/Zn-SOD基因,命名为SsCSD,该基因全长共1148 bp。生物信息学分析表明SsCSD编码蛋白含有228个氨基酸,预测分子量为23.26 kDa,等电点5.55,为亲水性蛋白;其二级结构由无规则卷曲(47.37%)、延伸链(28.95%)、α-螺旋(16.67%)和β-转角(7.02%)组成;氨基酸保守结构域分析表明该序列具有铜锌超氧化物歧化酶保守结构域,属于SOD家族。草海桐Cu/Zn-SOD在进化上与向日葵、莴苣、黄花蒿叶绿体型Cu/Zn-SOD亲缘关系更近,结合生物信息学分析,推测SsCSD定位于叶绿体。在此基础上,成功构建了SsCSD植物过表达载体,有助于基因功能分析。为此,后续研究将对SsCSD的亚细胞定位,基因与草海桐耐盐能力的相关性进行分析,有助于揭示草海桐适应盐生境的分子机制。
