CCR5 siRNA对类风湿关节炎大鼠滑膜细胞增殖周期的影响
2022-03-30王友强兰由玉邹兴静
王友强,兰由玉,张 为,姚 娟,邹兴静,刘 伟
1.西南医科大学附属中医医院检验科(泸州 646000);2.西南医科大学附属医院风湿免疫科(泸州 646000)
类风湿关节炎(rheumatoid arthritis,RA)是一种全身性炎症性免疫性疾病,其患病率约为1%,可导致关节的滑膜增生和关节破坏,最终出现关节畸形,功能丧失和生活质量下降[1]。成纤维样滑膜细胞(fibro⁃blast-like synovial cells,FLS)是关节滑膜组织中的主要细胞,FLS的过度增生和滑膜血管翳形成是RA滑膜炎发展的关键因素,并且还表现出细胞增殖与凋亡失调[2-3],FLS释放多种细胞因子加速了RA关节的破坏[4-5]。细胞周期进程的失调可导致FLS的过度生长,RA中细胞周期相关基因的异常表达可影响FLS的细胞周期进程[2,6]。
CC 趋化因子受体5(CC Chemokine Receptor 5,CCR5)是一种G 蛋白偶联受体,与相应的促炎性趋化因子结合后在RA 等炎症性免疫性疾病中有着重要的作用[7-8]。CCR5 与免疫和炎症反应有关,其高效拮抗剂可减少胶原诱导的关节炎小鼠模型中的关节炎症[9]。并且有研究发现CCR5 在RA 中明显升高,并与RA 的发生发展有关[10-11]。小分子干扰RNA(small interfering RNA,siRNA)技术[12],主要是一种利用siRNA靶向沉默目标基因表达的技术。目前RA的具体发病机制仍不清楚,CCR5 在其中的作用机制报道甚少,因此本研究拟通过RNA 干扰技术抑制RA 大鼠滑膜细胞CCR5 的表达,以探讨CCR5 基因沉默对RA 大鼠滑膜细胞增殖及细胞周期的影响,以便于进一步探寻RA的发病机制及可能的治疗方法。
1 材料与方法
1.1 实验动物与材料
1.1.1 实验动物 SPF 级Wistar 雄性大鼠30 只,体重(171±8)g,购买于西南医科大学实验动物中心,实验通过了西南医科大学实验动物伦理委员会批准。
1.1.2 材料 脂质体Lipofectamine 2000(美国Invitro⁃gen 公司),弗氏完全佐剂(CFA)(美国Sigma 公司),Trizol Reagent(日本Takara公司),逆转录试剂盒(美国Promega公司),MTT(美国Solarbio公司),PI染色液(上海如吉生物科技发展有限公司),CCR5 抗体、兔抗鼠Cyclin D1、兔抗鼠Cyclin E1、兔抗鼠Cyclin B1(英国Ab⁃cam公司),二抗(兔抗羊IgG)(英国Abcam公司),GAP⁃DH(美国Invitrogen 公司),PCR 试剂盒(日本Takara 公司),CCR5 siRNA(3 条)和NC siRNA(1 条)序列由GeneChem公司设计合成。
1.2 方法
1.2.1 siRNA 载体构建 将事先设计好的大鼠CCR5 siRNA(3条)和NC siRNA(1条)序列(见表1)经处理后构建成pU6-siRNA-GFP 载体(均由GeneChem 公司完成),再通过Lipofectamine 2000将载体转入大鼠滑膜细胞,操作按照说明书进行。转染完成48 h 后检测细胞CCR5 mRNA的水平以判断各条siRNA的转染效率,我们前期的研究[13]已经明确选取了效率最佳的一条(CCR5 siRNA-2)进行后续实验。

表1 CCR5 siRNA序列Table 1 CCR5 siRNA sequences
1.2.2 RA大鼠模型构建 SPF级Wistar雄鼠30只适应性饲养1 周后随机分为2 组:Control 组10 只、RA 组20只。用胶原蛋白诱导法[14]构建RA 大鼠模型,具体方法为:将Ⅱ型胶原蛋白充分溶解于浓度为0.1 mmol/L 的醋酸溶液中,然后再将相同剂量的弗氏完全佐剂(com⁃plete freund’s adjuvant,CFA)充分与上述混合液一起混匀,最后放置在冰浴中待其完全乳化;用注射器在Wi⁃star雄鼠尾根部多处注射,同样的方法再于1周后重复操作一次;Control组的Wistar雄鼠可以在同样的时间、同样的部位仅注射Ⅱ型胶原蛋白0.2 mg。采用关节炎症指数(arthritis index,AI)评分法评估RA 大鼠模型是否构建成功,AI大于或等于4分提示造模成功,四肢评分标准见表2,每隔5 d观察一次。

表2 AI评分标准Table 2 Arthritis Index score
1.2.3 滑膜细胞的分离与培养 用6 g/L的Ⅱ型胶原酶处理滑膜组织,37 ℃、5%CO2培养箱中消化3 h;再将细胞团用2.5 g/L的胰蛋白酶消化5 min;离心弃上清,将得到的细胞重新悬浮于含1.5 mL/L 胎牛血清、1×105U/L青霉素和100 mg/L 链霉素的DMEM 培养基中,置37 ℃、5%CO2条件下培养3~5 d使用台盼蓝初步判断细胞的存活率,若存活率大于95%,可供后续实验使用。第7 d,经2.5 g/L的胰酶-EDTA消化传代细胞,取3代的细胞用于后续实验。
1.2.4 滑膜细胞的转染 在转染前24 h,将待转染的大鼠滑膜细胞以2×105个/mL 的密度铺于6 孔板内;每孔添加500 uL 不含抗生素的完全培养液,放入37℃、5%CO2培养箱内孵育24 h后,待细胞汇合达50%即可用于转染。本研究将细胞分为4 组:RA 组(RA 大鼠滑膜细胞)、RA+NC 组(加入脂质体包裹的NC siRNA)、RA+mock组(加入脂质体)、RA+siRNA组(加入脂质体包裹的CCR5 siRNA)。转染前更换细胞培养基(37 ℃预温),用250 μL 不含血清培养基OPti-MEM 稀释100 pmol mock、siRNA(终浓度50 nM)及5 μL liPofectamin 2000,轻轻混匀并室温孵育5 min后加入6孔板中轻摇,常温放置20 min;再在6 孔板中添加含10%血清的细胞培养基,于37 ℃,5%CO2放置6~8 h 后,换完全培养基,持续放置48 h后获取细胞。
1.2.5 CCR5、Cyclin D1、Cyclin E1、Cyclin B1 mRNA及蛋白水平测定 各组滑膜细胞用Trizol 法提取总RNA,并按照逆转录试剂盒说明书将RNA 逆转录为cDNA,再以GAPDH 为内参基因,将cDNA 进行PCR 扩增,引物序列,见表3。滑膜细胞以2×105个/mL的浓度平铺于6 孔板培养72 h,加入蛋白裂解液提取蛋白,再利用10%SDS分离胶与浓缩胶电泳分离、转膜,滴加稀释的一抗兔抗鼠CCR5、兔抗鼠Cyclin D1、兔抗鼠Cy⁃clin E1、兔抗鼠Cyclin B1,4 ℃孵育过夜;加入二抗37 ℃振荡孵育l h后用化学发光仪检测。
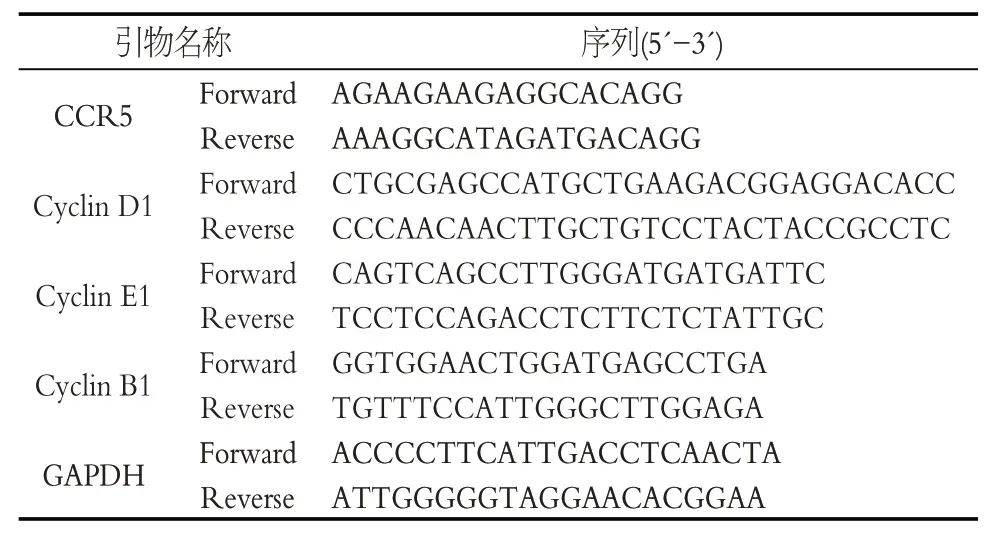
表3 引物序列Table 3 Primer sequences
1.2.6 MTT检测细胞增殖情况 选取对数生长期的滑膜细胞以2×105个/mL 的密度100 μL 平铺于96 孔板,每组各有3个相同的孔。在37 ℃、5%CO2条件下过夜,待细胞逐渐贴壁,24 h后换液,分别在相同条件下培育后的第0、24、48 和72 h 时添加5 mg/mL 的MTT 20 μL再培育4h,弃上清,每孔加入DMSO 150 μL,震荡10 min。酶标仪分别测定第0、24、48和72 h时各孔吸光值(A490)值,并作好记录,以3孔的平均值为最终结果。
1.2.7 PI 单染检测细胞周期 将快速生长期的滑膜细胞铺于6 孔板,其密度为1.2×105个/mL,每孔2 mL,培养24 h 后,每组设置3 个复孔。用不含EDTA 的胰酶消化、收集细胞,2 500 rpm/min 离心5 min。PBS 洗涤× 2次,离心收集细胞,加3mL 70%酒精处理,4 ℃静置一夜。第二天,离心,去除上清液,添加PI 染色液,4 ℃避光30min。染色结束后,用细胞滤网过滤,流式细胞仪上样,在大于575 nm下检测PI,计算细胞周期百分比。
1.2.8 统计学分析 用SPSS 21.0 分析所得数据,计量资料以()表示,两样本均数比较t 检验,多组间比较采用单因素方差分析,数据正态性检验采用Kol⁃mogorov-Smirnov 法,呈正态分布的数据多组间比较使用One way AVONA 分析。P <0.05 表示差异有统计学意义。
2 结果
2.1 RA大鼠模型鉴定
在给大鼠注射弗氏完全佐剂(CFA)8 h后,RA组大鼠在注射一侧足趾部位出现红肿等关节炎症的表现,24 h后出现足踝部肿胀。10 d后RA模型大鼠表现出多关节炎,具体为前肢或对侧肢体甚至耳、尾均有前面所述的炎症反应的表现。皮毛暗沉,有部分褪毛现象,体重下降,食欲减退,活动量减少,甚至有脱皮、溃疡和结节。10 d 时RA 组大鼠AI(1.31 ± 0.63)较5 d 时(0.98±0.54)明显升高(P <0.05);分别与10 d(1.45 ± 0.58)、15 d(5.06±1.29)时AI 比较,25 d 时AI(7.22±1.23)进一步增高(P <0.05),且AI随着时间的增加而升高,见图1。而Control 组大鼠无关节炎症等表现。由此可见RA大鼠模型构建成功。
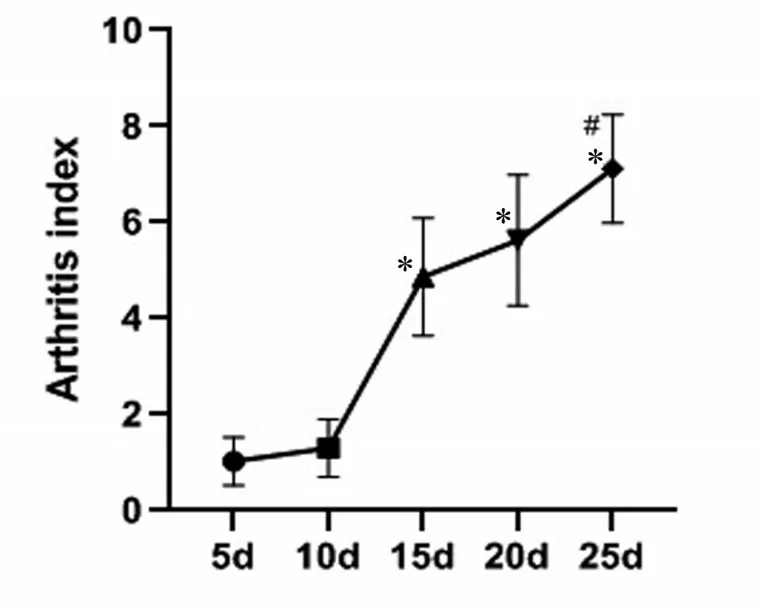
图1 RA组大鼠关节炎指数(AI)Figureure 1 The Arthritis Index of RA group
2.2 siRNA转染效率
转染大鼠滑膜细胞48 h 后,qRT-PCR 测定CCR5 mRNA表达水平,由图2可知,与CCR5 siRNA-NC组相比,3 条siRNA 序列转染后均可引起CCR5 mRNA 明显下降(P <0.05),其中CCR5 siRNA-2 序列转染效率较CCR5 siRNA-1 和CCR5 siRNA-3 更高。因此本研究选用CCR5 siRNA-2序列为最终实验所用序列,进行后续研究。
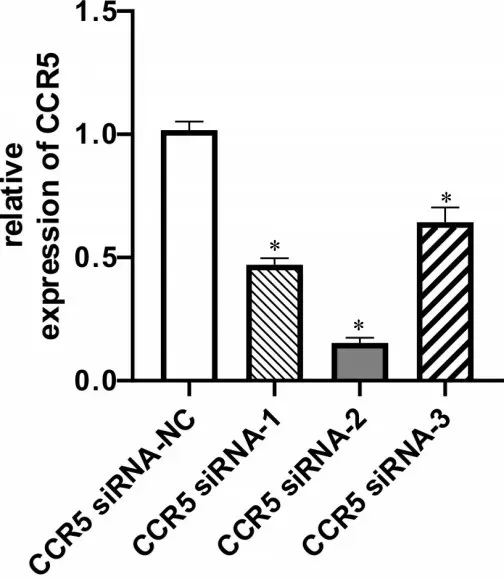
图2 CCR5 siRNA序列转染效率Figureure 2 CCR5 siRNA transfection efficiency
2.3 沉默CCR5 对CCR5、Cyclin D1、Cyclin E1、Cy⁃clin B1 mRNA水平的影响
各组RA 大鼠滑膜细胞CCR5、Cyclin D1、Cyclin E1、Cyclin B1 mRNA 表达水平如图3A、3B 所示:与RA组相比,RA+siRNA 组CCR5 mRNA 表达水平(1.16 ±0.21)较(1.85±0.61)明显下降(P <0.05),进一步验证了CCR5 siRNA 转染是有效的,见图3A;图3B 提示,RA+siRNA 组Cyclin D1、Cyclin E1、Cyclin B1 mRNA 水平(1.32±0.01)、(1.23±0.26)、(1.33±0.05)分别较RA组(1.52±0.06)、(1.68±0.08)、(1.94±0.07)显著降低,差异有统计学意义(P <0.05);而RA+NC组、RA+mock组较RA组无明显变化(P >0.05)。
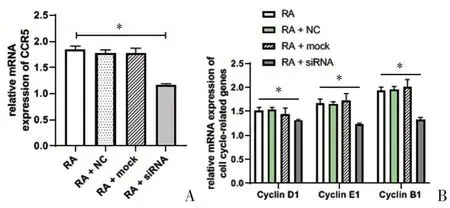
图3 CCR5、Cyclin D1、Cyclin E1、Cyclin B1 mRNA水平比较Figureure 3 ThemRNAexpressionofCCR5、CyclinD1、CyclinE1、CyclinB1
2.4 沉默CCR5 对CCR5、Cyclin D1、Cyclin E1、Cy⁃clin B1蛋白水平的影响
各组RA 大鼠滑膜细胞CCR5、Cyclin D1、Cyclin E1、Cyclin B1蛋白表达水平如图4A、4B所示:与RA组相比,RA+siRNA 组CCR5 蛋白水平(0.19 ± 0.01)较(0.44±0.05)明显下降(P <0.05),见图4A;由图4B可知,RA+siRNA 组Cyclin D1、Cyclin E1、Cyclin B1 蛋白水平(0.88±0.03)、(1.46±0.13)、(1.56±0.13)分别较RA组(1.38±0.03)、(1.98±0.12)、(2.13±0.08)显著降低,差异有统计学意义(P <0.05);而RA+NC 组、RA+mock组较RA组无明显变化(P >0.05)。
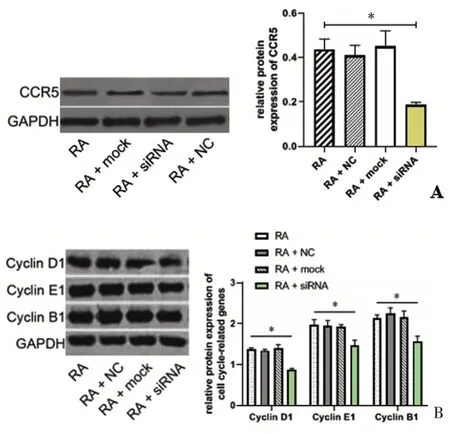
图4 CCR5、Cyclin D1、Cyclin E1、Cyclin B1蛋白水平比较Figureure 4 TheproteinexpressionofCCR5、CyclinD1、CyclinE1、CyclinB1
2.5 CCR5基因沉默对RA大鼠滑膜细胞增殖的影响
本研究采用MTT 协助判断沉默CCR5 对RA 大鼠滑膜细胞增殖情况的影响,见图5。与RA 组相比,RA+siRNA 组滑膜细胞出现明显生长抑制,且随时间增长其抑制效果逐渐增大(P <0.05),而RA+mock组、RA+NC组无特别变化(P >0.05)。
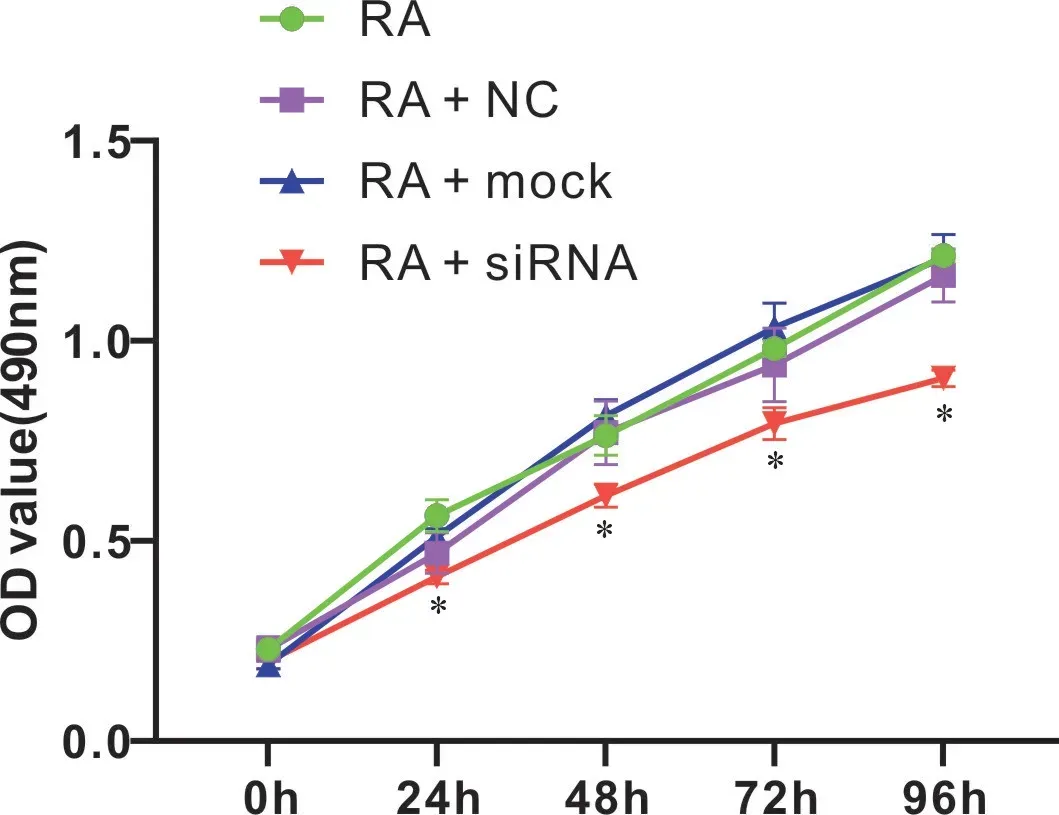
图5 各组RA大鼠滑膜细胞增殖情况比较Figureure 5 The synoviocytes proliferation of each group
2.6 沉默CCR5对RA细胞周期分布的影响
PI 单染测定细周期分布情况,见图6。与RA 组对比,RA+siRNA 组RA 大鼠滑膜细胞G0/G1 期比例(70.27 ± 1.06)%较(59.26 ± 0.59)%上升,S 期比例(14.10±0.82)%较(23.94±1.71)%降低(P <0.05),而RA+mock、RA+NC组无明显变化(P >0.05)。
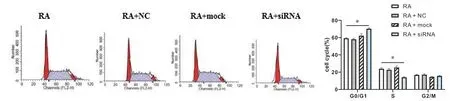
图6 各组RA大鼠滑膜细胞细胞周期分布情况比较Figureure 6 The cell cycle distribution of each group
3 讨论
RA 发病机理受多种因素的影响,包括遗传、表观遗传学和环境因素以及免疫紊乱和细胞因子等因素[15-16]。活化的RA-FLS 表现出与肿瘤细胞相似的增殖特征,其肿瘤样增殖特性可导致滑膜增生发展,逐渐出现软骨的侵蚀及关节破坏[3,17]。RA-FLS 具有激活细胞周期和抗细胞凋亡的特性,从而可导致细胞增殖[18]。同时,细胞周期又控制着细胞生长或凋亡的潜力[6,19]。
细胞周期分为DNA合成前期(G1期),DNA合成期(S期),DNA合成后期(G2期)和分裂期(M期),大多数细胞处于G0/G1期[20]。细胞周期的正确进展取决于细胞周期蛋白的表达水平以及细胞周期蛋白依赖性激酶(Cdks)的激活[21]。本研究发现,CCR5 siRNA干预后RA大鼠滑膜细胞的生存能力受到抑制,G0/G1 期滑膜细胞比例增大,S 期细胞的比例减少,提示沉默CCR5 可明显抑制滑膜细胞的生长,并影响细胞周期的分布。有还研究发现,通过调节细胞周期调节因子将细胞周期阻滞在G1 到S 相转变,即G1 停滞,即可抑制FLS 的增殖[22]。细胞周期从G1 到S 期的进展还受Cyclin D 和Cy⁃clin E及其同系激酶CDK 2,CDK 4和CDK 6的调节[22],且可通过诱导细胞周期停滞在G0/ G1 期来抑制RA-FLS的增殖[23]。
此外,CCR5沉默可抑制CCR5的表达,还可调节细胞周期相关基因的表达,相应地,CCR5、Cyclin D1、Cy⁃clin E1 和Cyclin B1 的表达均降低。细胞周期调节剂是控制RA-FLS 分裂和增殖的强制因素,可先后作用于Cyclin D、pRB和Cyclin E,进而加速RA-FLS的DNA合成和增殖[6]。其中cyclin D1 在RA 的滑膜细胞增殖和凋亡中起了重要作用[24]。细胞周期相关蛋白的异常表达与RA的疾病进展有关[19]。Cyclin D1和Cyclin E1是细胞周期的调节因子[25],主要调控G1/S 期转化,其中Cyclin D1的主要功能在于促进细胞增殖,而Cyclin E是G1晚期的重要调控因子;Cyclin B1是细胞周期中G2/M阶段的主要介质[26],主要与M期的完成有关。
4 结论
本研究结果显示,沉默CCR5可抑制滑膜细胞的生长,使G0/G1期滑膜细胞比例增加,S期细胞比例减少,还可通过调节与细胞周期相关的基因表达来影响细胞周期的分布,进而抑制滑膜细胞的增殖。本研究为CCR5基因沉默作为RA治疗的潜在靶点提供了实验依据,但还需进一步大规模的研究阐明RA 滑膜细胞中CCR5的潜在机制。
(利益冲突:无)
