萎缩芽胞杆菌(Bacillus atrophaeus)GJW2-1 可湿性粉剂研制及对党参灰霉病的防治效果
2022-03-22陈大为周天琦张培怡庹顺羽贾凌云候勤正
陈大为, 周天琦, 张培怡, 庹顺羽, 贾凌云, 候勤正, 孙 坤
(西北师范大学 生命科学学院,甘肃 兰州 730070)
党参 (Codonopsispilosula(Franch) Nannf.) 为桔梗科多年生草本植物。以根入药,用于脾肺虚弱、气血两亏、体倦无力等病症治疗[1]。甘肃省是我国党参主产区之一,其产量占全国总量的70%以上,居全国第一[2]。近年来,随着市场需求增大,党参种植面积也随之扩增。由于长期连作、农药化肥过量使用,病虫害发生日益严重,特别是灰霉病的危害已经成为制约甘肃党参种植产业发展的主要障碍之一[3]。党参灰霉病是由灰葡萄孢 (Botrytiscinerea) 引起的一类真菌性病害,其寄主范围广,传播能力强,侵染速度快,可引起1 400多种植物发生灰霉病[2,4]。目前,党参灰霉病的防治主要以化学药剂和抗病品种并结合一些粗放的农业措施为主,但是随着化学药剂长时间的大量使用,灰霉菌对很多药剂均产生了不同程度的抗药性,防治效果日益降低,同时,化学药剂长期大量使用所引起的环境污染,危害人畜健康等问题日益加重。鉴于目前防治方法的不足,促使人们寻求党参灰霉病新的防治措施。因此,具有高效、安全、无污染等特性的生物防治途径成为当下国内外党参灰霉病防治研究的新趋势[5]。芽胞杆菌(Bacillusspp.)具有抗逆能力强、繁殖速率快、无污染等特点,被广泛用于植物病害防治[6]。黄大野等[7]报道枯草芽胞杆菌 (Bacillussubtilis) NBF809对番茄叶斑病的盆栽防治效果高达73.26%;许丽婷等[8]报道枯草芽胞杆菌XC-1对马铃薯黑痣病大田防效为54.51%;王铁霖等[9]从人参根部分离筛选出一株内生解淀粉芽胞杆菌(Bacillusmyloliquefaciens) RS-3,其对灰霉菌抑菌率达到54.4%。但是,由于受环境条件的多变性和土壤系统复杂性的影响,生防菌对植物病害的田间防治效果往往低下。而生防菌经过制剂化后,避免了外界因素的影响,成为当下植物病害防治的首选方法[10]。目前,国内外已研制出了大量芽胞杆菌制剂。美国现已登记并投入实际推广应用的芽胞杆菌制剂有枯草芽胞杆菌 (Bacillussubtilis) 制剂 6 种、解淀粉芽胞杆菌 (Bacillusamyloliquefaciens) 制剂 6 种、地衣芽胞杆菌 (Bacilluslicheniformis) 制剂 2 种、短小芽胞杆菌 (Bacilluspumilus) 制剂 3 种、坚强芽胞杆菌 (Bacillusfirmus) 制剂 2 种、蜡质芽胞杆菌 (Bacilluscereus) 制剂 1 种、巨大芽胞杆菌 (Bacillusmegaterium) 制剂 1 种、蕈状芽胞杆菌 (Bacillusmycoides) 制剂 1 种[11-12]。而国内在芽胞杆菌制剂研发中,枯草芽胞杆菌制剂有72 种、多粘类芽胞杆菌 (Bacillusmarinus) 2 种、甲基营养型芽胞杆菌 (Bacillusmethylotrophicus) 4 种[12]。可见,芽胞杆菌属细菌在制剂开发方面有着巨大的潜力。可湿性粉剂是我国微生物源农药主要的剂型之一,因其具有有效成分含量高、对环境友好、生产所需成本低等特点,被广泛用于叶部病害的防治[13]。因此,可湿性粉剂是灰霉病等叶部病害防治的最佳剂型。本研究以前期从党参组织中分离的一株对灰霉病有较好抑制作用的内生萎缩芽胞杆菌 (Bacillusatrophaeus) GJW2-1为试验材料,对其进行制剂工艺优化,并对所研制的可湿性粉剂的稳定性及盆栽防治效果进行评价,为该菌株商品化开发及党参灰霉病的生物防治提供参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 萎缩芽胞杆菌 (Bacillusatrophaeus) GJW2-1 和党参种子 (渭党 1 号) 均由西北师范大学生命科学学院逆境植物进化与发育实验室提供。
1.1.2 培养基 ①营养琼脂培养基(NA);②营养液体培养基(NB);③马铃薯葡萄糖琼脂培养基 (PDA)。
1.1.3 主要试剂与仪器设备 载体:硅藻土、高岭土、碳酸钙、凹凸棒土;助剂:分散剂 (木质素磺酸钠、羧甲基纤维素钠、聚乙烯醇),湿润剂 (十二烷基硫酸钠、十二烷基苯磺酸钠、丁基萘磺酸钠),紫外保护剂 (抗坏血酸、β-环糊精、腐殖酸)。所有载体与助剂购自上海迈瑞尔化学技术有限公司。台式干燥箱 (DHG-9070A,上海东麓仪器设备有限公司);超微粉碎机 (WZJ-6B,济南天方机械有限公司);超净工作台 (SW-CJ-3F,上海沪净医疗器械有限公司);恒温培养箱 (HPX-II-80,上海新诺仪器集团有限公司);恒温培养摇床 (SLSK-2018R,上海世平实验设备有限公司)。
1.2 方法
1.2.1 载体与助剂筛选 将菌株GJW2-1划线接种于NA培养基上,28 ℃培养24 h,挑取单菌落接种于装有50 mL的NB培养基的150 mL三角瓶中,30 ℃、180 r/min培养3 d,得活菌发酵液。将载体按5%(质量分数)比例与灭菌的NA培养基混合均匀,制成平板。取1 mL菌株GJW2-1发酵液 (1.14×109cfu/mL)用无菌水稀释106倍后,取100 μL稀释液,均匀涂布于含不同载体的平板上,以不含载体的平板为空白对照,每个处理3次重复,28 ℃培养3 d后统计平板菌落数,筛选出对该菌没有影响的载体。将湿润剂以250 μg/mL[12-13],分散剂以1 500 μg/mL[14-15],保护剂以50 μg/mL[14-15]质量浓度的比例与灭菌的NA培养基混合均匀,制成平板。取1 mL菌株GJW2-1发酵液 (1.14×109cfu/mL)用无菌水稀释106倍后,取100 μL稀释液,均匀涂布于含不同助剂的平板上,以不含助剂的平板为空白对照,每个处理3次重复,28 ℃培养3 d后统计平板菌落数,筛选出对该菌没有影响的助剂。
1.2.2 载体与助剂最佳配比正交优化 利用筛选出的载体和助剂进行4因素3水平正交试验设计(L9(34)),检测不同配比对活菌数的影响[16],以确定载体和助剂的最佳配比。试验设计如表1所示。
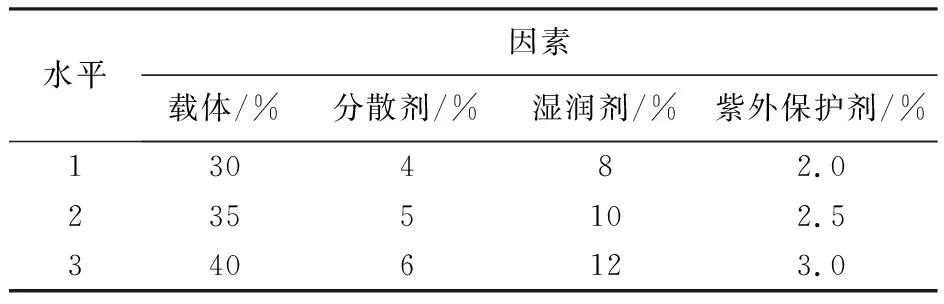
表1 载体和助剂配比优化的正交试验设计Table 1 Orthogonal experimental design table for optimization of the ratio of carrier and auxiliary agent
1.2.3 可湿性粉剂的加工及指标检测 将菌株GJW2-1发酵液 (1.14×109cfu/mL) 按正交优化试验结果与载体和助剂混合均匀,40 ℃干燥箱中烘干,经超微粉碎制成可湿性粉剂。称取1 g,无菌水稀释106倍,取100 μL涂布于NA培养基上,重复3次,28 ℃培养3 d后测其活菌数。
1.2.4 可湿性粉剂质量标准检测 ①悬浮率、湿润时间:分别参照国家标准农药可湿性粉剂悬浮率测定方法GB/T14825-2006[17]和国家标准农药可湿性粉剂湿润性测定方法GB/T5451-2001[18]检测可湿性粉剂悬浮率、湿润时间。②含水率:称取10 g样品放在已经精准测量的培养皿中,105 ℃烘干,测量样品及培养皿的总重量,根据公式计算含水率:含水率 (%)=((样品重量+培养皿重量-烘干后总重量)/(烘干后总重量-培养皿重量))×100%。细度检测参照李姝江等[14]方法进行。③热稳定性:分别称取1 g可湿性粉剂于20、30、40、50、60、70 ℃条件下水浴30 min,冷却至室温,用无菌水稀释106倍,取100 μL涂布于NA培养基上,重复3次,以未经处理的制剂为对照,28 ℃培养3 d后测定其活菌数。④酸碱稳定性:分别称取1 g可湿性粉剂用0.1 mol/L NaOH和0.1 mol/L HCl溶液调节pH值为4、5、6、7、8、9、10,用无菌水稀释106倍,取100 μL涂布于NA培养基上,重复3次,以未经处理的制剂为对照,28 ℃培养3 d后测定其活菌数。⑤紫外稳定性:分别称取1 g可湿性粉剂置于紫外灯 (28 W) 下10 cm处,分别照射20、40、60、80、100、120 min后,用无菌水稀释106倍,取100 μL涂布于NA培养基上,重复3次,以未经处理的制剂为对照,28 ℃培养3 d后测定其活菌数。⑥储藏期:将10 g可湿性粉剂在室温 (25 ℃) 下贮存,每20 d取 1 g,用无菌水稀释106倍,取100 μL涂布于NA培养基上,重复3次,28 ℃培养3 d后测定其活菌数。
1.2.5 菌株 GJW2-1可湿性粉剂对党参灰霉病的盆栽防治效果 ①党参灰霉菌孢子悬浮液的制备:向活化7 d后的党参灰霉病菌中加入5 mL无菌水,震荡30 min即得分生孢子悬浮液原液,用无菌水稀释至1×106个/mL,备用。②党参种子发芽:挑选籽粒饱满的党参种子,用2% NaClO溶液表面消毒10 min后,用无菌水漂洗 3~4 次,25 ℃浸种24 h,置于铺有无菌湿纱布的培养皿中催芽。待党参种子发芽后,播种于装有灭菌蛭石土的花盆 (规格:高150 mm×直径200 mm) 中,28 ℃,相对湿度70%,16 h光照/8 h黑暗条件下培养。待幼苗长至六到八叶期时进行后续防效试验。③预防试验:分别取1 g可湿性粉剂,无菌水稀释100、500、1 000 倍 (20 mL),喷施党参植株,以药液完全布满叶片而不滴水为度。待叶片上的液体晾干后,接种灰霉菌孢子悬浮液 (20 mL)于各处理植株,以喷施无菌水后接种灰霉菌孢子悬浮液为对照,每个处理3盆,每盆5株,25 ℃保湿48 h, 14 d后记录发病情况,并按下述公式计算病情指数和防治效果。④治疗试验:先将党参灰霉菌孢子悬浮液 (20 mL) 喷施到党参幼苗上,25 ℃保湿48 h,分别取1 g可湿性粉剂用无菌水稀释100、500、1 000倍 (20 mL) 喷施于处理的党参植株,以先接种灰霉菌孢子悬浮液后喷施无菌水为对照,每个处理3盆,每盆5株, 14 d后记录发病情况,并按下述公式计算病情指数和防治效果。按病斑面积占叶片总面积进行分级。0级:无病症;1级:10%以下;2级: 10%~20%;3 级:20%~30%;4 级:30%~60%;5 级: 60%以上[19]。病情指数=∑(各级病叶数×相对级数值) /(调查总数×最高值代表值)×100,防治效果(%)=((对照病情指数-处理病情指数) /(对照病情指数))×100%。
1.2.6 数据统计与分析 数据输入Excel 2007软件进行统计分析和作图,并用SPSS 19.0软件和Duncan氏新复极差法进行多重比较(P<0.05)。
2 结果与分析
2.1 不同载体对菌株 GJW2-1 活性影响
由图1可知,不同载体均对菌株 GJW2-1活菌数有一定的影响。其中,硅藻土对菌株GJW2-1 活菌数影响最小,与对照无显著性差异 (P>0.05)。因此选用高岭土用作可湿性粉剂载体。
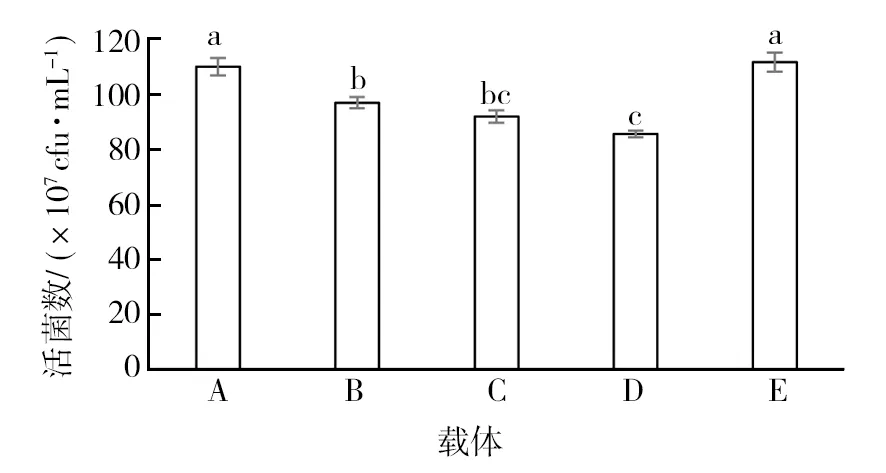
图1 不同载体对菌株 GJW2-1活性的影响Fig.1 Effect of different carriers on activity of strain GJW2-1A:硅藻土;B:高岭土;C:碳酸钙:D:凹凸棒土;E:无菌水 (对照)。不同小写字母表示在0.05水平上差异显著,下同A: Diatomite; B: Kaolin; C: Calcium carbonate; D: Palygorskite; E: Sterile water (CK).The different lowercase letters represent significant differences at 0.05 level,the same as below
2.2 不同助剂对菌株 GJW2-1 活性影响
2.2.1 不同分散剂对菌株 GJW2-1 活性影响 由图2可知,不同分散剂均对菌株 GJW2-1 活菌数有一定的影响。其中添加羧甲基纤维素钠后对菌株 GJW2-1 活菌数影响最小,为102.33×107cfu/mL,与对照无显著性差异 (P>0.05)。因此选用羧甲基纤维素钠用作可湿性粉剂分散剂。
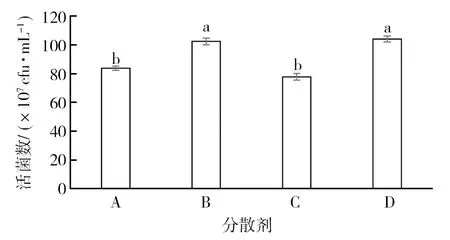
图2 不同分散剂对菌株 GJW2-1活性的影响Fig.2 Effect of different dispersant on activity of strain GJW2-1A:木质素磺酸钠;B:羟甲基纤维素钠;C:聚乙烯吡咯啉酮;D:无菌水 (对照)A: Sodium ligninsulfonate; B: Carboxymethylcellulose sodium; C: Polyvinyl pyrrolidone; D: Sterile water (CK)
2.2.2 不同紫外保护剂对菌株 GJW2-1 活性影响 由图3可知,不同紫外保护剂对菌株 GJW2-1活菌数均有一定影响。其中, β-环糊精对菌株GJW2-1 活菌数影响最小,为102.00×107cfu/mL,与对照无显著性差异 (P>0.05)。因此选用 β-环糊精用作可湿性粉剂紫外保护剂。
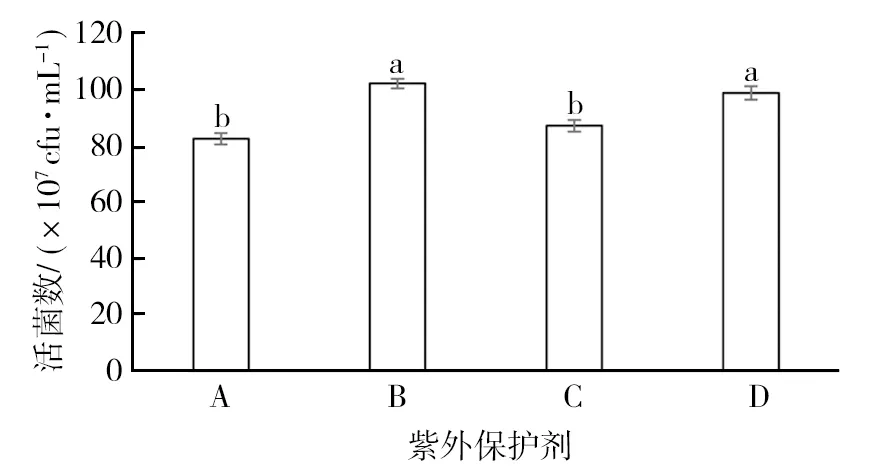
图3 不同紫外保护剂对菌株 GJW2-1活性的影响Fig.3 Effect of different UV Protective agents on activity of strain GJW2-1A:抗坏血酸;B: β-环糊精;C:腐殖酸;D:无菌水 (对照)A: Ascorbic acid; B: β-Cyclodextrin; C: Humic acid; D: Sterile water (CK)
2.2.3 不同湿润剂对菌株 GJW2-1 活性影响 由图 4 可知,不同湿润剂对菌株 GJW2-1活菌数均有一定影响。其中,十二烷基苯磺酸钠对菌株GJW2-1 活菌数影响最小,为97.33×107cfu/mL,与对照无显著性差异 (P>0.05)。因此选用十二烷基苯磺酸钠用作可湿性粉剂湿润剂。
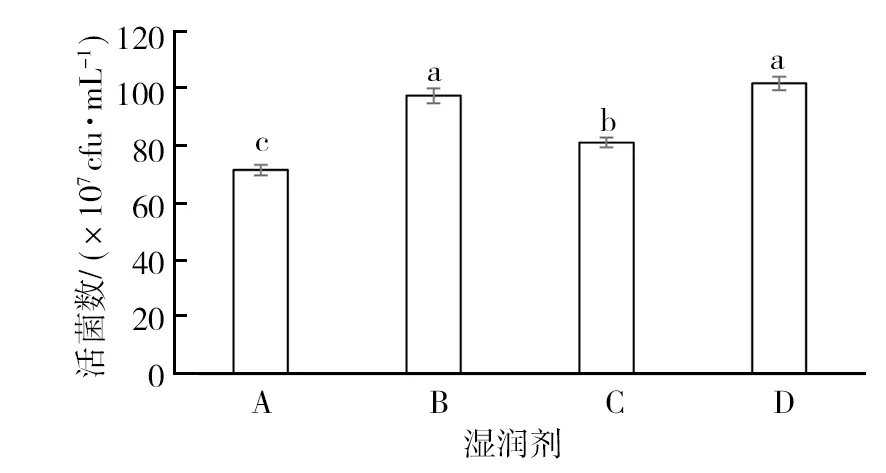
图4 不同湿润剂对菌株 GJW2-1活性的影响Fig.4 Effect of different wetting agents on activity of strain GJW2-1A:十二烷基硫酸钠;B:十二烷基苯磺酸钠;C:丁基萘磺酸钠;D:无菌水 (对照)A: Sodium dodecyl sulfate; B: Sodium dodecyl benzene sulfonate; C: Naphthalenesulfonic acid; D: Sterile water (CK)
2.3 载体与助剂配比的优化
由表2可知,载体与助剂不同配比对菌株 GJW2-1活菌数均有一定影响。其中,按第4组配比后,可湿性粉剂中活菌数最多,为105.00×107cfu/g。因此,载体和助剂最佳配比为高岭土35%、羧甲基纤维素钠4%、十二烷基苯磺酸钠10%、β-环糊精3%。
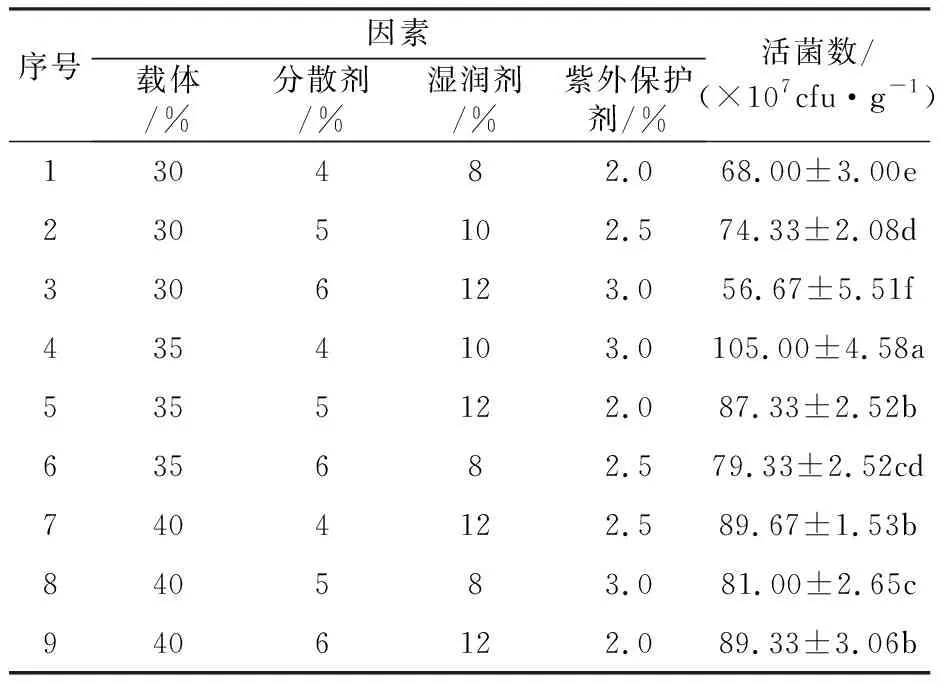
表2 载体和助剂正交试验结果Table 2 Proportioning optimization result of the carriers and additives in orthogonal test
2.4 可湿性粉剂的指标检测
参照国家标准对菌株GJW2-1 可湿性粉剂六项主要指标进行检测,结果可知,活菌数为1×109cfu/g,悬浮率为81%,湿润时间为57 s,pH值为7.1,细度为99%,含水量2.03%。六项指标在国家标准范围内,说明该可湿性粉剂合格,可以用来防治植物病害(表3)。

表3 菌株 GJW2-1 可湿性粉剂性能指标Table 3 Performance index of strain GJW2-1wettable powder
2.5 菌株GJW2-1可湿性粉剂稳定性
对菌株GJW2-1可湿性粉剂稳定性进行测定,结果表明,菌株GJW2-1可湿性粉剂经不同温度处理后,其活菌数随着温度的升高而下降,在20~40 ℃范围内,活菌数无显著性差异 (P>0.05),说明该可湿性粉剂在高温环境中能保持一定活性 (图5A)。紫外稳定性测定表明,菌株GJW2-1可湿性粉剂中活菌数随着紫外辐射时长的增加而减少,但在120 min时仍能保持一定活性,说明该可湿性粉剂具有较好的紫外耐受性 (图5B)。酸碱稳定性测定表明,随着pH值的增大,该可湿性粉剂中活菌数呈现先增加后减少的趋势,pH 6~8时,其活菌数无显著性差异 (P>0.05),说明pH过高或者过低,均会对该菌剂活性产生一定的影响 (图5C)。储藏期测定表明(图5D),该可湿性粉剂在0~60 d内活菌数无显著性差异 (P>0.05),60 d 后活菌数有一定下降,但仍能保持一定活性,说明该可湿性粉剂在120 d内能保持较好的活性。
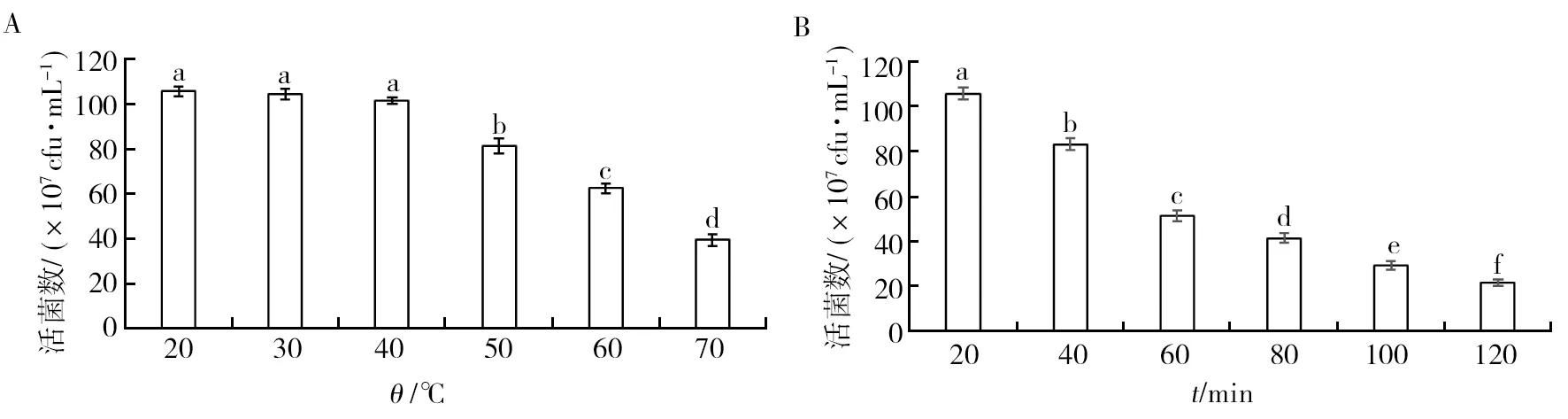
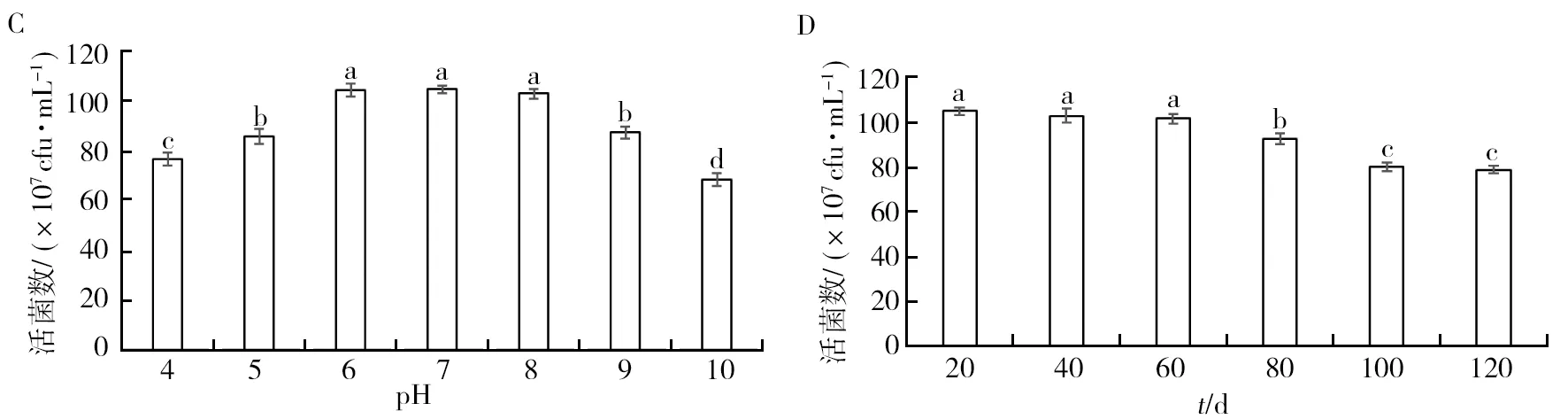
图5 菌株GJW2-1可湿性粉剂的稳定性测定Fig.5 Determination of the stability of strain GJW2-1 wettable powderA:热稳定性;B:紫外稳定性;C:酸碱稳定性;D:储藏期A: Thermal stability; B: Ultraviolet stability; C: pH stability; D: Storage period
2.6 菌株GJW2-1可湿性粉剂对党参灰霉病盆栽防治效果
盆栽试验结果表明(表4),菌株GJW2-1可湿性粉剂对党参灰霉病有较好的预防效果和防治效果,且预防效果优于治疗效果,随着稀释倍数的增大,防治效果均表现出递减的趋势。稀释100倍喷施后,菌株GJW2-1可湿性粉剂对党参灰霉病的预防效果达81.75%,治疗效果为71.56%,且各处理间差异性显著 (P<0.05)。
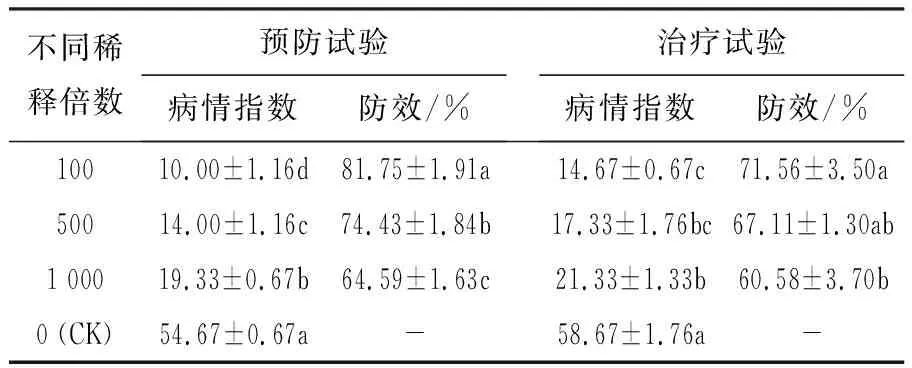
表4 菌株GJW2-1可湿性粉剂对党参霉病的盆栽防效试验Table 4 The control efficiency of strain GJW2-1wettable powder against gray mold of C. pilosula
3 讨 论
微生物源农药在植物病虫害防控中发挥着越来越大的作用。但是,由于发酵工艺和制剂工艺优化技术研究薄弱,进入市场投入使用的生物药剂仍为数不多。因此,高效生防菌的筛选和工业化生产以及实际应用等是目前需要迫切解决的问题[20]。生防菌存活力是决定其在实际应用中防效高低的重要因素之一,含有活菌的生物制剂的研发不仅能够提高农作物的品质,还能保护自然环境[21]。因此,在载体和助剂研究中,活菌数是衡量可湿性粉剂最佳配方的重要因素。本研究采用单因素和正交试验相结合的方法,以探究载体与助剂对萎缩芽胞杆菌活性的影响,以此来筛选出载体和助剂最佳的配比,最终研制的菌株GJW2-1可湿性粉剂活菌数高达1×109cfu/g,且各项指标均达到国家标准。载体在可湿性粉剂中占有较大比例,因此载体对制剂的湿润性和悬浮率具有一定的影响,虽然载体是一种惰性材料,但不同种类的载体对活体微生物的影响较大。本研究通过筛选发现,高岭土对菌株GJW2-1活性影响最小,这与李姝江等[14]报道以高岭土为载体,对解淀粉芽胞杆菌BA-1活性影响最小的结论一致。助剂不仅可以提高防效,还能降低成本[21]。本研究通过单因素筛选最终确定紫外保护剂为 β-环糊精。据报道 β-环糊精被广泛应用于医药、食品、环境等领域,且对微生物具有良好的紫外保护作用[22]。分散剂为羧甲基纤维素钠,因其具有良好的分散、悬浮、成膜、持水等性能,被广泛应用于食品、造纸、涂料等领域[23]。湿润剂为十二烷基苯磺酸钠,具有良好的表面活性,亲水性较强[24]。菌株GJW2-1可湿性粉剂稳定性测定表明,制剂优化后,菌株GJW2-1在高温、酸碱性、紫外光环境下具有较好的稳定性,贮存期较长。因此,该可湿性粉剂可在复杂多变的环境中,保持较好的活性。在盆栽防效试验中,该可湿性粉剂防效随着稀释倍数的增加而降低,但是稀释1 000倍时,防效仍高于60%,说明该可湿性粉剂效果良好,适用于下一阶段大田试验。
本研究经过制剂工艺优化所研制的萎缩芽胞杆菌可湿性粉剂,稳定性强,且在盆栽试验中对党参灰霉病表现出了良好的防治效果,具有实际应用潜力。但本研究研制的可湿性粉剂在田间试验防效及进一步制剂优化等方面还需进一步研究。