炎症因子在类风湿关节炎中的研究进展
2022-03-22李小枫温家根
罗 帅,李小枫,黄 成,温家根,李 俊
(安徽医科大学药学院,安徽 合肥 230032)
类风湿关节炎(rheumatoid arthritis,RA)影响全球约1%的人口[1],在中国发病率为0.42%,其中女性发病是男性的2~3倍[2]。任何年龄都可能发生RA,最常见于30~60岁。家族遗传、吸烟、雌激素等是患RA的危险因素。RA患者的免疫系统会攻击自身周围关节的健康结缔组织,此时患者关节会产生炎症进而肿胀、僵硬和疼痛并且感觉到温热。症状在早晨和静止后一段时间最为严重。最常见的受损关节是手的小关节,脚和脚踝,但较大的关节也可能受到影响。症状通常在身体两侧对称发生。RA的发病机制与炎症因子关系密切。炎症因子发挥重要作用,贯穿RA始终,当炎性细胞因子中促炎因子的效应高于抑炎因子时,会导致多系统免疫并发症。促炎细胞因子如肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、IL-1、IL-17等可刺激骨和软骨的炎症和降解,逐渐导致患者关节炎损伤畸形,最后致残。
1 炎症因子的来源与作用
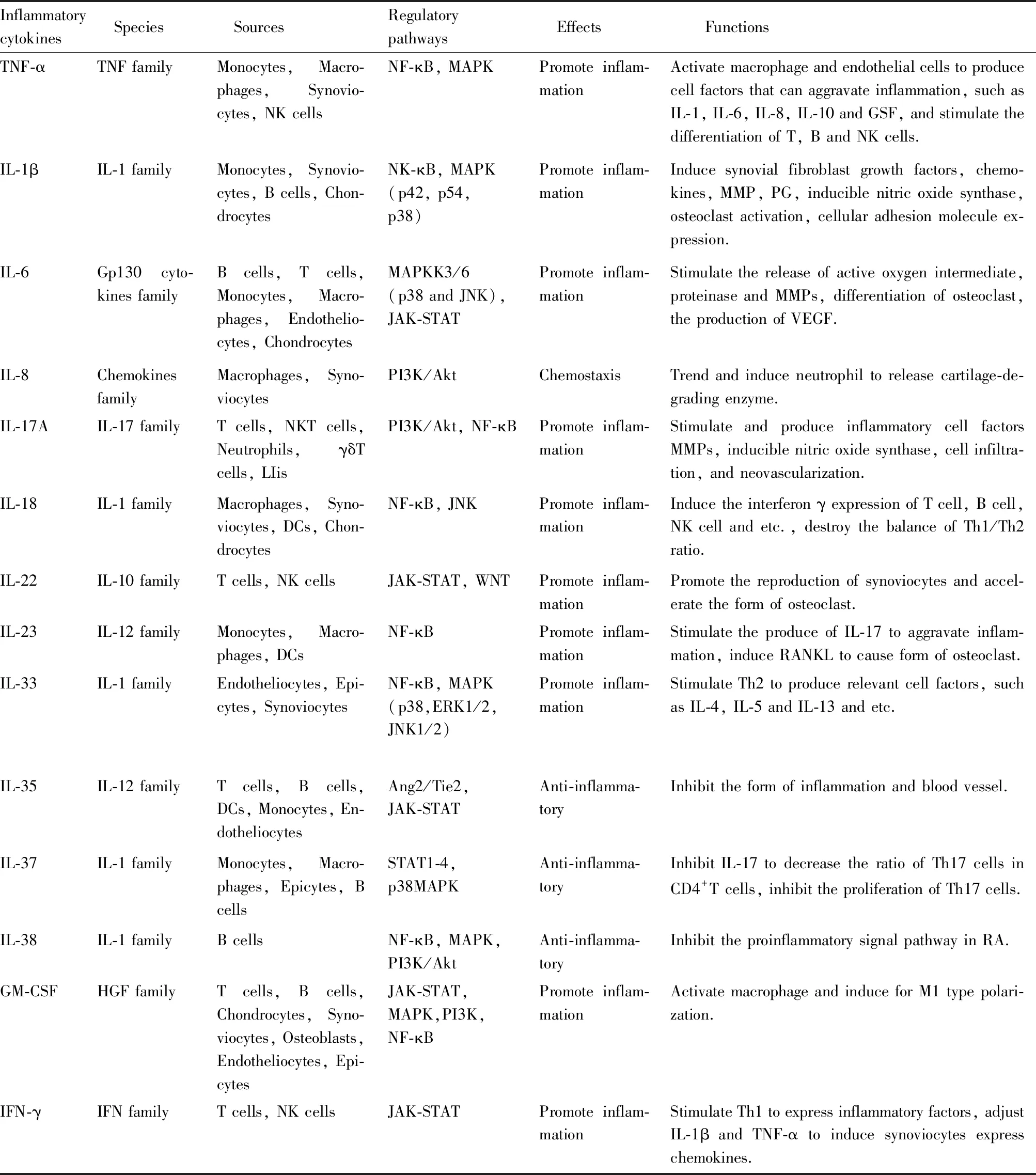
细胞因子(cytokine,CK)多为小分子多肽、蛋白质或糖蛋白,在RA这类自身免疫疾病中主要由被活化的免疫细胞产生具有高度的活性和不同的功能。细胞因子作为人体内细胞互相应答的必要物质在生理与病理反应中起重要作用,它有以下特征:①细胞因子一般在浓度为10-6~10-2nmol·L-1时即可刺激靶细胞。②细胞因子在炎症免疫反应中分泌较多。③细胞因子表达有信号细胞和靶细胞之间的旁分泌和自分泌方式。④细胞因子必须与靶细胞上的受体结合发挥作用。⑤不同细胞因子之间交叉影响相互作用。当免疫细胞(巨噬细胞、淋巴细胞、肥大细胞、T细胞、粒细胞)被激活在发挥作用(如杀菌)的同时进一步释放炎症因子引发更强的炎症反应。炎症因子作用各不相同,起发热作用的有IL-1、IL-6、TNF-α,起疼痛作用的有缓激肽、P物质,促进血管扩张的有组织胺、缓激肽、前列腺素(prostaglandin,PG)包括(PGE2、PGD2、PGF2和PGI2)和NO等,使血管通透性升高的组织胺、缓激肽、白细胞三烯(leukotrienes,LT)(包括LTC4和LTD4)等活性氧代谢产物、血小板激活因子等等。从病理学上,炎性细胞因子是RA炎性反应的主要介质,是调节炎症的始动因素。炎症因子与RA中各种细胞关联交错纵横,参与RA的炎症因子的种类与功能见Tab 1。
2 炎症因子参与RA发病
在RA中,活化的滑膜细胞会分泌趋化因子,将T细胞、B细胞、巨噬细胞、自然杀伤细胞以及中性粒细胞募集到关节腔彼此相互“应答”。其中炎症因子是细胞之间相互“应答”的关键物质。以下炎症因子在RA中的研究中较多被提及,其中经典的RA炎症因子TNF-α、IL-6、IL-1β、粒细胞巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)和干扰素-γ(interferon-γ,IFN-γ)以及近几年发现与RA有关的炎症因子IL-33、IL-35、IL-38、IL-37。炎症因子与RA中的各种细胞相互作用见Fig 1。
2.1 TNF-α与RATNF-α是肿瘤坏死因子家族中的一员。TNF最初作为一种名叫233-氨基酸跨膜的蛋白分泌在细胞表面,后被肿瘤坏死因子转化酶切割转变为157-氨基酸可溶性肿瘤坏死因子被释放到血液中。在多种自身免疫以及炎症相关疾病中频繁被提及,其中就包括RA。在RA中,细胞受到TNF-α刺激后,通过NF-κB信号通路和MAPK信号通路进行的传导,调控一系列以炎症因子为主的细胞因子以及蛋白酶。例如,促炎细胞因子TNF-α、IL-1、IL-6和IL-8等,以及起保护作用的炎症因子IL-4和IL-10,在RA患者的关节腔各个组分如滑膜细胞、滑膜组织液以及患者的血清中较正常人都呈增加趋势。在RA中,炎症因子刺激靶细胞继续表达炎症因子形成持续性的炎症循环,继而持续侵蚀骨关节。研究表明,TNF-α通过激活靶细胞NF-κB信号通路和JNK信号通路加剧炎症反应环,如TNF-α刺激滑膜细胞产生前列腺素和胶原酶,在RA的病理机制中起关键作用。TNF生物拮抗剂一直运用于RA的临床治疗,更加强调了TNF-α在RA中深厚的影响。
Tab 1 Types and functions of inflammatory cytokines involved in RA
2.2 IL-1β与RA在上个世纪末,人们在探索淋巴细胞诱导发热的分子时,在白细胞之间发现了白细胞介素(interleukin,IL),一种具有“通信”能力的蛋白质分子。随着分子学的技术的快速进步,白介素家族逐步壮大,目前已有41种被鉴定的白细胞介素。其中,对IL-1家族及其受体(IL-1R)的研究非常活跃,配体和受体之间形成了功能复杂结构重叠的调节网,具有十分重要的生物学效应。IL-1家族的异常表达及调节对RA的发生发展起着关键作用。IL-1家族细胞因子包括11个成员:IL-1α、IL-1β、IL-1RA、IL-1RN、IL-18、IL-36RN、IL-36A、IL-37、IL-36B、IL-36G、IL-38、IL-33。目前IL-1家族中的IL-1β、IL-18、IL-37、IL-38在RA中研究中较多被提及。IL-1β由IL-1β前体在含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase-1)的切割下产生。关节炎中很多细胞分泌IL-1β,其中巨噬细胞为主力。在RA中,呈提抗原细胞(antigen-presenting cell,APC)增多并携带HLA-DR抗原诱导CD4+T淋巴细胞分泌大量细胞因子,一方面活化并刺激B细胞,产生过多抗体。另一方面这些细胞因子激活滑膜巨噬细胞分泌IL-1β与TNF-α,靶作用于关节处细胞使其产生胶原和中性蛋白酶等,致滑膜增殖、关节软骨被侵蚀加重病情;另外,巨噬细胞直接接触T淋巴细胞或者在免疫复合物作用下也可刺激滑膜巨噬细胞的活化,在正常人关节滑液中,凡乎不含有lL-1β。IL-1家族成员和TNF-α一样是参与RA病理活动的重要成员。
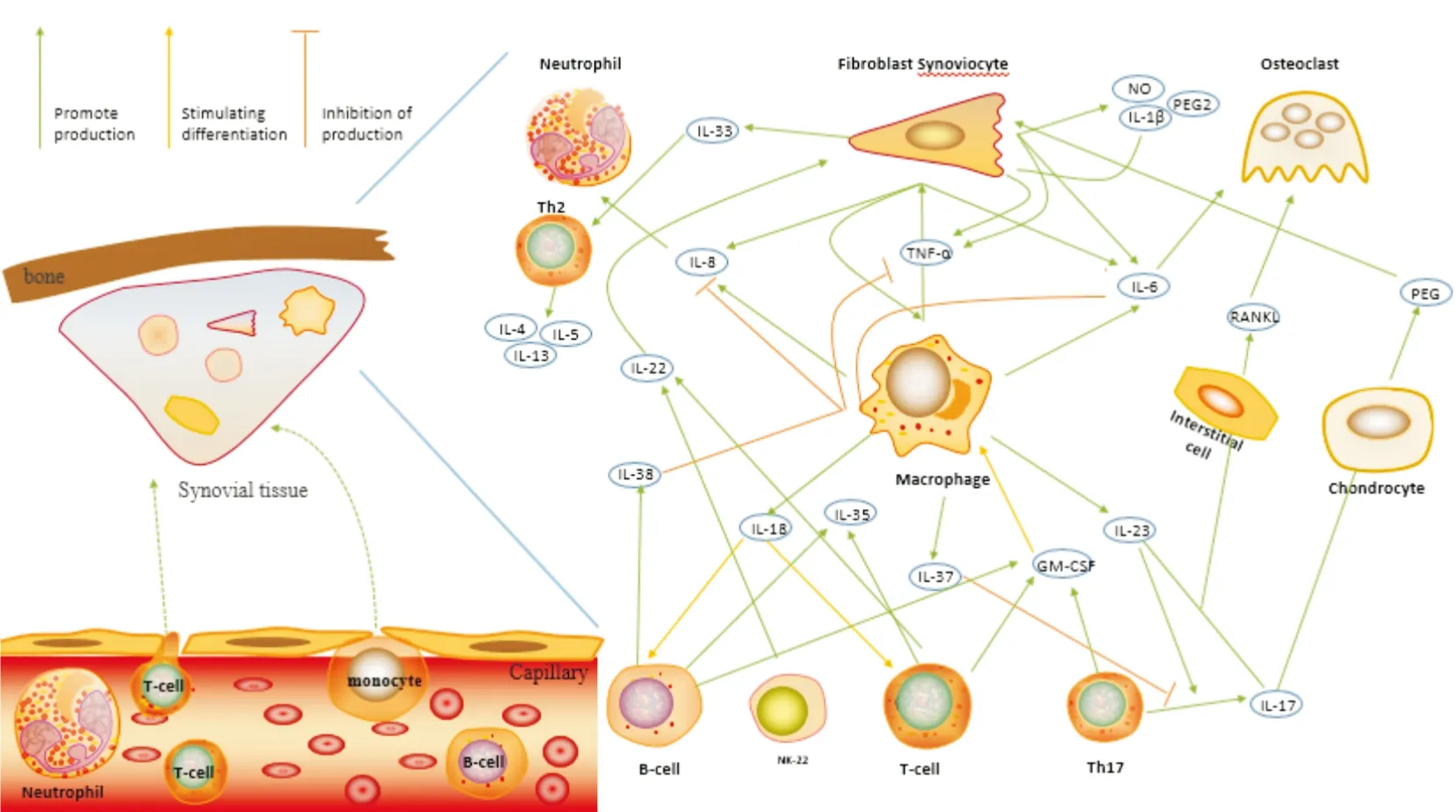
Fig 1 Inflammatory cytokines and cells in RA
2.3 IL-6与RA除了研究较多的TNF-α与IL-1家族,还有其他一些炎症因子也影响着RA的发病与进程。IL-6是一种22~29 ku糖蛋白。它由多种细胞产生,如B细胞、T细胞、成纤维细胞、内皮细胞、单核细胞、巨噬细胞、角质形成细胞、软骨细胞和一些肿瘤细胞。在RA中,由成骨细胞及基质细胞如Th1、Th2、Th17等分泌的炎症因子,调节骨吸收和破骨细胞形成。IL-6主要由上游的MAPK和NF-κB通路调控。研究表明IL-6在患者体内升高。它还表现出与IL-1β和TNF-α协同作用,产生血管内皮生长因子(vascular endothelial growth factor,VEGF),作用于血管内皮细胞,使其通透性增加,最终导致关节积液堆积,加剧肿胀[3]。有研究表明,TAK1与免疫细胞质中的对应结合蛋白激活MAPKK3/6再激活p38和JNK转导信号促IL-6升高,在激活MAPK通路的同时,还促进p65磷酸化,激活NF-κB通路,产生TNF-α和IL-6,TNF-α又能通过其他方式再促进IL-6分泌。另外,IL-6与TNF-α协同刺激B细胞和T细胞,促其分泌细胞免疫球蛋白,并对Ig M型类风湿因子产生诱导作用,刺激定向造血干细胞前体细胞的增殖和分化等多种生理过程,而在 RA 自身免疫途径中发挥关键作用。IL-6与关节炎和关节外表现有关,如贫血、心血管疾病风险增加和骨质疏松甚至抑郁症。IL-6在RA患者体内的水平可以作为提示疾病程度轻重的指标,关节炎合并抑郁症的患者中,抑郁评分与IL-6的水平呈正相关[4]。目前,IL-6在RA中研究和治疗中的地位不亚于TNF-α。
2.4 IL-8与RAIL-8是一种属于趋化因子家族的细胞因子,分子量8~10 ku。在RA中,IL-8主要由滑膜细胞和巨噬细胞分泌,可以趋化中性粒细胞。IL-8可以趋化并激活中性粒细胞,促进其脱粒,产生呼吸爆发,释放超氧化物和溶酶体酶,这与几种炎症疾病的发病机制有关有研究表明[5]。RA患者血清中IL-8的水平明显高于正常者且随着病情加重提高,并且IL-8的水平与RA中各项代表性指标呈正相关,提示IL-8的水平可以用于评判RA病情的进展。类风湿关节炎继发肺间质病变(rheumatoid arthritis-interstitial lung disease,RA-ILD)患者血清中IL-8水平升高,提示IL-8可能参与RA继发肺间质病变的过程,RA-ILD患者体内类风湿因子(rheumatoid factor,RF)水平明显高于单纯RA组患者,RF是一种IgG球蛋白片段,由浆细胞产生,它与免疫复合物的水平呈正相关,RF的升高甚至会使全身的血管炎病变,包括肺小血管炎的加重,引发ILD。IL-8的趋化作用加强了关节炎炎症的循环是不可否认的。
2.5 IL-17A与RAIL-17A是IL-17家族中被研究最广泛的炎症因子,也是在RA中被研究最多的。IL-17A和上文中的IL-6具有共通性,RA中IL-17A主要由CD4+Th17细胞产生也可由CD8+T细胞、NKT细胞、γδT细胞、中性粒细胞和淋巴组织诱导器样细胞产生。IL-17A通常联合TNF-α协同促进成骨,软骨细胞生成PEG,刺激FLS分泌IL-6、TNF-α、IL-1β、NO和PEG2等炎性因子激活PI3K/Akt和NF-κB通路引起滑膜炎症,并且对关节软骨造成损伤。另外,IL-17A刺激滑膜细胞表达诱导环氧化物聚合酶2(cyclooxygenase,COX2),COX2是一个时相性的应激反应物质,会上调PEG2的表达,从而促进关节炎症的发生。IL-17A在RA患者的关节滑液和周围的组织中分泌较高,不仅如此,IL-17A被报道在RA中还有助于心血管疾病的发生,IL-17A可以诱导内皮功能障碍、血管炎症和动脉粥样硬化[6]。也是IL-17A通常会在预后不良的RA中水平较高的原因之一。
2.6 IL-18与RAIL-18又名IFN-γ诱生因子,由巨噬细胞、成纤维细胞和树突细胞表达,是白介素1家族的一员。IFN在慢性炎症中也发挥着不小的作用。辅助T细胞Thl与Th2在RA患者关节腔液中比例失衡,促炎性Th1细胞产生的炎症因子如IFN-γ、IL-12的效应等占明显优势,而抗炎性Th2细胞产生的炎症因子如IL-4、IL-10等效应相对较弱,是RA发病的重要病理之一。而IL-18活化Th1细胞,是Thl细胞发挥其促炎功能的重要诱因,与自身免疫疾病密不可分。研究表明,RA患者外周血单核细胞中IL-18和IFN-γ的水平均高于对照组并有统计学意义,且血清IL-18与IFN-γ被证实呈正相关,在RA患者外周血单核细胞中,IL-18诱导IFN-γ的产生剂量依赖关系,因此认为IL-18与RA患者外周血中IFN-γ的产生及疾病活动性相关,提示IL-l8有可能通过促进IFN-γ的分泌而介导RA病理活动。RA症中IL-18通常与IL-12联合发挥作用,诱导刺激T细胞、B细胞、NK细胞等的IFN-γ表达,所以RA发病过程中IL-12水平上升。激活IFN-γ启动子AP-l是IL-18以非IL-12依赖性的途径促淋巴细胞增生和IFN-γ产生的另一种方式。大量研究证明着IL-l8在RA病理分子轴中的存在。
2.7 IL-22与RA除了IL-6和IL-8,由NK-22分泌的IL-22在RA中也发挥作用。IL-22属于IL-10家族,由多种淋巴细胞特异性产生的α螺旋细胞因子。NK细胞中最早发现的是NK-22型细胞,有表面标记物NKp44+CCR6+,肠炎的病灶处产生较多。RA患者关节腔液和外周血中的NK-22细胞的水平显著高于未患病对照者。用NK-22细胞中提取的高浓度IL-22体外刺激RA的成纤维样滑膜细胞,可促进其增殖功能。而IL-22促进的机制主要是通过上调RA患者成纤维滑膜细胞中的核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)的表达来加速破骨细胞形成的。WNT信号通路贯穿人体生长骨形成的重要因素,有研究表明,IL-22不仅可以上调NKL还能局部抑制WNT信号通路的转导从而抑制骨形成对RA患者的骨关节不利[7]。因此,IL-22在未来可能被作为一种新的指标来评判RA患者病情的活动性。
2.8 IL-23与RA炎症因子IL-23由p19和p40亚基组成,属于IL-12家族,是唯一的异二聚体蛋白细胞因子家族,有助于炎症自身免疫性疾病中Th17细胞的形成和维持[8]。IL-23是一种人破骨细胞因子,有研究显示,IL-23可诱导Th17细胞通过刺激间质细胞上的RANKL激活滑膜成纤维细胞、内皮细胞等产生炎症因子IL-6、IL-8和PGE2等,使关节腔形成慢性炎症环,RANKL不仅可参与慢性炎症的发生过程,也可以侵蚀骨组织形成骨损伤[9]。有研究发现,在RA中IL-23与IL-17相互协同发挥关键的病理作用。IL-23维持T17细胞,刺激IL-17的产生。由IL-23诱导的IL-17增加了炎症介质如TNF-α的产生。此外,IL-23诱导的IL-17上调了RANKL的表达,而TNF-α又和RANKL协同破骨发生。IL-17和TNF-α反过来又上调IL-23的表达[10]。IL-17还可以通过正反馈调节滑膜细胞分泌IL-23,进一步加重关节滑膜炎症。可见IL-23与IL-17在RA中的活动有着密不可分的关系。
2.9 IL-33与RA核细胞因子IL-33是IL-1家族的最新成员,由前体在caspase-1的切割下形成的一种18 ku的蛋白质,在内皮细胞、上皮细胞和成纤维细胞样滑膜细胞中大量表达。IL-33在RA中的研究很少,成纤维滑膜细胞在TNF-α与IL-1β刺激下会分泌IL-33,致使RA病人关节滑液中的IL-33水平变高。研究表明IL-33水平与滑液中IL-6、IL-1β、IL-8等经典炎症因子水平呈U型相关趋势,但在血清中却不相关,再次提示了IL-33的组织源性[11]。IL-33与生长刺激表达基因2蛋白(growth stimulation expressed gene 2,ST2)发挥作用,IL-33/ST2轴参与很多的生物活动,如免疫反应,伤口愈合和组织修复。在RA中,IL-33与ST2结合,可以募集IL-1RAcP、IRAK1、IRAK4、TNFR、TRAF6和MyD88,进而激活NF-κB和MAP激酶途径(p38、ERK1/2和JNK1/2),这可能使进Th2相关细胞因子如IL-4、IL-5和IL-13的产生的原因[12]。
2.10 IL-35与RAIL-35是IL-12家族的最新成员,由IL-12亚单位α链(IL-12A/P35)和EBI3组成,与IL-23一样是一种异二聚体蛋白,但是功能却有所不同。IL-35主要由T细胞、B细胞、树突状细胞、单核细胞、内皮细胞等分泌。IL-35与同为IL-12家族的IL-23相反,IL-35在RA中主要起抑制炎症与血管形成的作用。IL-35通过影响Ang2/Tie2信号转导下调基础和VEGF诱导的血管紧张素分泌来抑制RA血管生成和炎症[13]。IL-35与其受体的结合能激活JAK-STAT信号通路,促进STAT1的磷酸化,抑制胶原性关节炎(collagen induced arthritis,CIA)小鼠模型的FLS中血管内皮生长因子生成和TNF-α、IL-6等促炎细胞因子的表达[14]。体内体外均有研究表明,IL-35在RA中对血管生产的抑制。最新研究表明,人外周血中IL-35的水平不仅可以用于帮助诊断风湿性疾病,更能在诊断中区分RA与其他如:红斑狼疮、骨关节炎、痛风以及强直性脊柱炎等风湿病[15]。IL-35在RA中的研究及作用是存在着一定的潜力。
2.11 IL-37与RAIL-37、IL-38都是IL-1家族中的新成员,IL-37原名IL-1F7,在关节炎中研究尚不多。IL-37蛋白已在各种人体组织中得到鉴定。在RA患者滑膜细胞中检测。研究报告RA患者血浆IL-37水平明显升高,而健康对照几乎没有。此外,与活动性疾病患者相比,RA缓解患者IL-37水平明显降低。有研究表明,IL-37在RA的发病中可能存在细胞内外共2种机制:①在细胞内,IL-37先与SMAD3结合,不仅抑制STAT1~4的功能还抑制了p38MAPK的磷酸化,促进GSK-3α/β磷酸化,从而调节基因的转录,TLR诱导的促炎因子的表达和树突状细胞的活化最终被抑制。②在细胞外,IL-37可以通过影响转化生长因子-β(transforming growth factor-β,TGF-β)的水平上升,抑制树突状细胞的活性,继而降低B细胞和T细胞的免疫应答;IL-37还可以与IL-18结合蛋白结合来抑制IFN-γ,从而抑制TLR4下游一系列信号转导[16]。还有研究提出,IL-37发生基因突变是加重疾病活动的重要因素。但IL-37在RA中的研究还处于一个初步的阶段,有待更多研究。
2.12 IL-38与RA新表征的细胞因子IL-38(IL-1F10)属于细胞因子IL-1家族。IL-38在皮肤、胸腺、扁桃体、胸腺、心脏还有B细胞中表达。研究表明,IL-38或与RA疾病的进程有关,IL-38 mRNA在RA患者滑膜组织中水平升高,IL-38蛋白在血清及滑膜组织中表达升高,在骨性关节炎(osteoarthritis,OA)患者和正常人中的浓度较低,治疗后RA患者体内IL-38水平下降。IL-38抑制RA中NF-κB、PI3K/Akt、MAPK信号通路对RA中相关细胞和细胞因子的影响、抗血管生成作用、抗骨质疏松作用显示IL-38在RA中对关节起保护作用[17]。但目前IL-38在RA中的研究尚不够完善,还要不少问题有待解决,如天然存在的IL-38 的变体源头及其成熟所需的酶、IL-38的双重活性、IL-38对免疫细胞的机制功能、RA患者血清中IL-38水平是否提示疾病进程、IL-38经由哪些信号通路减少成纤维样滑膜细胞的活化、IL-38对骨质破坏的影响、IL-38能否抑制关节腔血管翳的生成、IL-38能否治疗RA。
2.13 GM-CSF与RAGM-CSF是一种小型分泌型细胞因子,负责骨髓祖细胞中骨髓细胞的增殖和分化。除髓系细胞外,T、B细胞和包括软骨细胞、成纤维细胞、成骨细胞、小胶质细胞、内皮细胞和上皮细胞在内的组织驻留细胞也能分泌GM-CSF。GM-CSF结合异二聚体粒细胞集落刺激因子受体(GM-CSFR),该受体由特异性配体结合α链(GM-CSFRα)和信号转导β链(GM-CSFRβ)组成,IL-3R和IL-5R共享。GM-CSFR激活导致JAK-STAT-SOCS以及其他通路,包括MAPK、PI3K和NF-κB[18]。GM-CSFRα的胞质尾也具有与信号通路相互作用的能力。在RA中,GM-CSF将巨噬细胞极化成产生炎症细胞因子的M1样巨噬细胞。这些细胞因子诱导炎症细胞的募集和组织驻留细胞的活化。M1巨噬细胞分泌的粒细胞集落刺激因子诱导抗原呈递细胞产生IL-6和IL-23。IL-6和IL-23再次引起T细胞的激活和向Th17细胞的分化,Th17细胞又分泌GM-CSF和IL-17维持循环。Th17细胞产生的GM-CSF也通过激活单核-巨噬细胞系统和中性粒细胞诱导炎症。有研究认为,GM-CSF是炎症淋巴样细胞和髓系细胞之间的主要通讯管道[19]。
2.14 IFN-γ与RAIFN是当细胞被感染时所产生的炎症因子,调控感染后固有免疫和获得性免疫反应。IFN家族有Ⅰ型、Ⅱ型和Ⅲ型。其中Ⅱ型IFN在自身免疫疾病中被研究较多。IFN-γ是Ⅱ型干扰素的唯一成员,在先天和适应性免疫反应中起重要作用。IFN-γ和TNF-α都是最经典的炎症因子之一。在RA中,IFN-γ主要存在于患者的滑液和滑膜组织的T细胞中。IFN-γ主要由NK细胞和T细胞产生。当IFN-γ受体被激动时会激活胞内的JAK-STAT1信号通路,从而激活效应基因的转录[20]。IFN-γ在Th1细胞反应中起着核心作用,该反应驱动细胞因子的表达并激活炎症细胞,这与RA的基本机制有关。另一方面,IFN-γ也可以作为一种重要的免疫调节剂,通过控制Th17细胞的发育和活性、中性粒细胞趋化性,以及通过增强CIA模型中Treg细胞的活性[21]。同时,IFN-γ可以调节IL-1β和TNF-α诱导的RA患者滑膜细胞CCL2和CXCL8的产生,加强免疫细胞的募集。
3 用于治疗RA的生物制剂
目前,临床用于对RA治疗的药物分4大类:非甾体抗炎药、糖皮质激素、csDMARDs(传统合成改善病情抗风湿药物)和生物制剂。非甾体抗炎药和糖皮质激素属于RA的一线药物,因为它们有效、快速、价廉。但是这类药物往往只能减轻关节炎症和疼痛,并不能对关节的损伤有效止损,所以一般配合csDMARDs一起使用,最常见的如甲氨蝶呤(methotrexate,MTX),研究表明MTX较其他同类抗风湿药物能降低心血管相关死亡率[22],csDMARDs的特性为长期有效性,平价,能对关节炎处损伤有很好的延缓效果。然而,这些疗法通常伴随着相关的不良反应,如胃肠道出血、肝肾毒性、感染和肿瘤风险。因此,仍迫切需要寻找低毒高效治疗RA的新药。以炎症因子为靶点的生物制剂很好的弥补了以上药物的不足。RA的研究中,被认定起重要作用的炎症因子以TNF-α和IL-6为主。目前认为,JAK-STAT信号通路的激活在RA促炎作用中起主要作用,所以专门针对JAK通路的靶向抑制剂在临床上也取得很好的反响。
3.1 靶向TNF-α生物制剂针对TNF-α而言,目前有5种已获批的治疗RA的TNF抑制剂,分别是戈利木(golimumab)、阿达木(adalimumab)、塞妥珠(certolizumab)、英夫利西(infliximab)、和依那西普(etanercept)。与csDMARDs相比,TNF-α拮抗剂的主要特点是起效快、抑制骨破坏的作用明显和耐受性良好。有研究比较了adalimumab、etanercept和infliximab在RA患者中的持续使用情况,实验数据表明,RA患者终止治疗率:infliximab>adalimumab>etanercept。与以adalimumab和etanercept为起始治疗相比,infliximab治疗终止率更高,1年期adalimumab的治疗终止率较etanercept增加。治疗终止率随时间逐渐增加,无效率亦逐渐增加[23]。目前,对于golimumab和certolizumab的数据较少,有Meta分析显示,这两种较新的抗TNF-α单克隆抗体并不增加结核发病风险,但是,使用不同TNF-α拮抗剂的结核发病风险需要更多研究和更长时间的随访观察加以明确。对TNF抑制剂的疗效进行整体的讨论,评价其相关临床改善和指标,发现这些药物的疗效具有相似性,和MTX的疗效相比,效果显著。TNF抑制剂与MTX联合使用对患者治疗,其疗效优于单用MTX。
3.2 靶向IL-6生物制剂目前,围绕IL-6治疗RA的生物制剂有两种类型,一种是以IL-6为靶点,一种以IL-6R为靶点。托昔单抗(tocilizumab)是第一个以IL-6R为靶点的抗RA单克隆抗体药物,也是迄今唯一一个单独使用疗效比甲氨喋呤的抗RA生物药物好的药物。Tocilizumab于2009年上市,主要面向对csDMARD和TNF-α阻断药物效应不够或由于长期使用产生耐药性的病人。目前,在日本,tocilizumab已被作为一线生物药物,广泛应用于对MTX和其他常规抗风湿药物响应不足的RA病人。欧洲风湿病防治联盟(EULAR)2013年新出版的“有关使用DMARD治疗RA的最新推荐意见”中进一步将tocilizumab推荐作为必需接受生物DMARD单药治疗患者的优先选择药物,将tocilizumab提升到了和 TNF-α阻断药物相同的地位。Tocilizumab的成功之后对于抗IL-6治疗RA提高了关注度,之后又有萨里单抗(sarilumab)的问世,sarilumab是最新的IL-6受体拮抗剂 ,2017年获得美国美国食品药品监督管理局食品和药物管理局(food and drug administration,FDA)的批准,sarilumab是治疗RA的最新生物制剂。一种针对IL-6R复合物α亚单位的人单克隆抗体,它具有独特的结构,与第一种在RA中获得批准的IL-6抑制剂妥昔单抗相比,对受体的亲和力更高,效果与副作用较第一代均匀改善。以IL-6为靶点的抗体则有奥洛组单抗(olokizumab)和萨库单抗(sirukumab),在大多数研究中,sirukumab具有良好的耐受性和药代动力学特征。一个显著的优点是它不仅对RA的症状和体征有有益的影响,而且对与该疾病相关的系统性并发症,如抑郁症也有有益的影响[24],olokizumab也是较新的IL-6单克隆抗体,目前相关研究较少。
3.3 靶向JAK生物制剂JAK通路抑制在RA的治疗中提供了极大的贡献。在最近关于RA管理的欧盟评估报告建议中,JAK抑制剂被推荐用于未能通过MTX或其他常规合成抗风湿药物治疗且预后因素不佳的患者。托法替布(tofacitinib)、巴林替尼(baricitinib)和乌帕替尼(upadacitinib)是目前治疗RA的3种已上市的Janus激酶抑制剂(JAK)。JAK抑制剂治疗RA的优势在于起效快。Tofacitinib 是第一个获批用于治疗RA的口服JAK抑制剂,tofacitinib治疗csDMARDs应答不足的中重度RA患者,其ACR20应答率在第二周就显著高于安慰剂组,并且随着治疗时间延长,差距增大[25]。Tofacitinib治疗3个月,ACR20达到59.8%。Baricitinib和tofacitinib均通过与ATP活性构象位点相互作用,从而靶向JH1酪氨酸激酶结构域,该结构在JAK激酶中高度保守。因此,tofacitinib非选择性地靶向几种JAK激酶,而baricitinib在tofacitinib后特异性靶向抑制JAK1/2,效果优于tofacitinib。Upadacitinib是第二代全新的JAK通路抑制剂,通过利用JAK1/2 活性位点以外非保守结构域的差异,选择抑制JAK1,可能会减少与JAK2和JAK3相关的副作用。因为前几代JAK药物的成功,迄今还有20多种JAK抑制剂正在进行临床实验。
3.4 靶向IL-1Ra生物制剂随着IL-1Ra的发现,人们假设是否能通过IL-1Ra选择性拮抗IL-1的分子学功能治疗RA,重组的人源非糖基化的IL-1Ra(IL-1Ra人体中天然存在的具有可以竞争性的与IL-1R结合,拮抗IL-1生物活性IL-1家族成员)阿那白滞素(anakinra)。它在IL-1Ra的氨基端增加了1个蛋氨酸,通过与IL-1R结合的方式,同时抑制IL-1α和IL-1β。因为半衰期短至5~6 h,因此它是每日注射一次的针剂,副作用包括感染、注射部位皮疹等。Anakinra对RA的改善程度明显要低于其他生物制剂治疗,故通常不推荐使用该药。
3.5 其他未获批靶向炎症因子生物制剂单针对于GM-CSF的生物制剂与IL-6生物制剂一样分为两种,一种拮抗GM-CSFR另一种直接拮抗GM-CSF。当前还没有上市的针对GM-CSF的生物制剂。玛弗利木单抗(mavrilimumab)是一种对GM-CSFR的α链具有高亲和力的。在Ⅱ期临床试验中,与安慰剂相比,在第24周的所有剂量中,接受mavrilimumab治疗的患者达到ACR20主要终点的百分比明显更高(P<0.001)。在为期24周的研究期间,mavrilimumab(特别是150 mg eow)在许多疾病活动参数上显示了快速且有临床意义的效果,具有可接受的安全性和耐受性[26]。奥提利单抗(otilimab)是另一种靶向GM-CSF的单克隆抗体,目前正在进行两个Ⅲ期临床试验,对标的是JAK通路抑制剂托法替尼对常规抗风湿药应答不足患者的疗效。GM-CSF的生物制剂大多都停滞在Ⅱ、Ⅲ期试验,只有otilimab目前正在进行临床实验。总体来说,GM-CSF抑制剂在用于RA的临床数据显示其效果并不如其他已上市的生物制剂。
除此之外,还有IL-12/IL-23靶向制剂优特克单抗(ustekinumab)和IL-23靶向抑制剂蒂尔他昔单抗(Tildrakizumab)和古塞库单抗(guselkumab),靶向针对IL-12家族的细胞因子,Ustekinumab在治疗克罗恩病(IBD)中有着不俗的表现,IBD和RA都是慢性炎症循环、进行性和致残性的疾病。Tildrakizumab和guselkumab都特异性结合IL-23的p19亚单位。Tildrakizumab现在在RA中进行Ⅱ期临床试验,Ⅰ期结果表明tildrakizumab在健康群中耐受性良好,并且在所有剂量组中都没有观察到血液学参数、血液化学、生命体征和心电图的临床显著变化,且200 mg tildrakizumab不影响细胞色素P450代谢,表明与tildrakizumab发生药物相互作用的可能性很低[26]。Guselkumab是另一种新的抗IL-23p19的人IgG1单克隆抗体,但是在随机的第二阶段研究中,guselkumab未能在RA患者中产生临床意义的改善。
针对IL-17家族而言,目前有苏金单抗(secukinumab),secukinumab是一种人源单克隆抗体,可选择性地与IL-17A结合,通过与IL-17A结合,secukinumab阻止其与其受体结合,并抑制其触发炎症反应的能力。但实际临床上Ⅲ期研究表明150 mg的secukinumab对DAS28-CRP的改善显著(P=0.049 5),而75 mg的Secukinumab则没有改善。结合Ⅱ期研究以及和IL-17A药物对比的研究结果表明,IL-17A在RA的发病机制中起着较小的作用。
4 展望
炎症因子一直以来为RA的诊断和治疗提供着方向。因为RA的无法治愈性,所以目前的治疗目标为减轻疼痛和延缓进一步的损害。目前临床用于对RA治疗的药物分四大类:非甾体抗炎药、糖皮质激素、csDMARDs(传统合成改成病情抗风湿药物)和生物类靶向抑制剂。非甾体抗炎药和糖皮质激素属于RA的一线药物,因为它们有效、快速。但是这类药物往往只能减轻关节炎症和疼痛,并不能对关节的损伤有效止损,所以一般配合csDMARDs一起使用,最常见的如MTX,研究表明,MTX较其他同类抗风湿药物能降低心血管病相关死亡率[22]。csDMARDs的特性为长期有效性,能对关节炎处损伤有很好的延缓效果。本文所综述的炎症因子为靶点的生物制剂和口服制剂在实际临床上也有较多运用(Tab 2)。其中TNF-α、IL-6和JAK拮抗剂是使用最多的药物。生物制剂在RA治疗中有作用迅速、效果好、精准抑制和不良反应少等优点。但是作为靶向生物制剂往往只能作用于某一种炎症因子或者信号通路,在极其复杂的细胞免疫学中,以上靶向抑制剂也有自身的局限性。所以,深入研究RA中不同免疫细胞炎症因子相互作用的机制对开发RA新药是非常必要的。

Tab 2 Biological agents in target of inflammatory cytokines
