中国吊钟花属植物核DNA含量(2C-值)与倍性水平研究
2022-03-17梁华蒋露朱大海周建伟范邓妹张志勇
梁华 蒋露 朱大海 周建伟 范邓妹 张志勇


摘 要: 植物核DNA含量(2C-值)與倍性水平是重要的植物学基本特征,是进行种群进化、物种分类和生态学等研究的有力证据。为确定中国吊钟花属(Enkianthus Lour.)各物种的核DNA含量与倍性水平并探究该属植物在种间、种内核DNA含量差异,该研究以6种中国吊钟花属植物共23个居群60个样品为试验材料,以水稻品种‘日本晴’(Oryza sativa spp. japonica ‘Nipponbare’)为内部参照,利用流式细胞术检测该属植物核DNA含量。进而以二倍体植物齿缘吊钟花(Enkianthus serrulatus)为倍性参照推测其他种的染色体倍性,并采用染色体压片计数法验证倍性的准确性。结果表明:(1)该属植物核DNA含量介于1.77~5.62 pg之间。(2)吊钟花组4个种——吊钟花(E. quinqueflorus)、齿缘吊钟花、晚花吊钟花(E. serotinus)、台湾吊钟花(E. perulatus)均为二倍体(2n=2x=22);总状花序组2个种——灯笼树(E. chinensis)和毛叶吊钟花(E. deflexus)均存在四倍体和六倍体。(3)该属二倍体植物核DNA含量在种间、种内存在显著性差异(P<0.05),四倍体和六倍体植物在种间和种内均无显著性差异(P>0.05)。该研究为吊钟花属系统发育、生物地理、引种驯化、遗传育种等研究奠定了基础。
关键词: 吊钟花属, 多倍体, 基因组大小, 流式细胞术, 染色体压片
中图分类号: Q943
文献标识码: A
文章编号: 1000-3142(2022)01-0058-10
收稿日期: 2021-02-24
基金项目: 国家自然科学基金(31660059, 31960049) [Supported by the National Natural Science Foundation of China(31660059, 31960049)]。
第一作者: 梁华(1996-),硕士研究生,主要从事植物系统与进化研究,(E-mail)hualiang1556@126.com。
*通信作者: 周建伟,讲师,主要从事林木花卉遗传育种研究,(E-mail)zhoujianwei@jxau.edu.cn。
Nuclear DNA content (2C-value) and ploidy level of
Enkianthus species (Ericaceae) from China
LIANG Hua 1,4, JIANG Lu1,4, ZHU Dahai2, ZHOU Jianwei3*,
FAN Dengmei4, ZHANG Zhiyong4
( 1. College of Forestry, Jiangxi Agricultural University, Nanchang 330045, China; 2. Longxi-Hongkou National Natural Reserve,
Chengdu 611830, China; 3. Science and Technology Park, Jiangxi Agricultural University, Nanchang 330045, China; 4. Laboratory
of Subtropical Biodiversity, Jiangxi Agricultural University, Nanchang 330045, China )
Abstract: Plant nuclear DNA content (2C-value) and ploidy level are important botanical characteristics which are powerful evidences for studies on population evolution, biosystematics and ecology. In order to determine the nuclear DNA content and ploidy level of Enkianthus Lour. from China, and to explore the difference of nuclear DNA contents between interspecies and intraspecies, we collected 60 samples from 23 populations, representing all six species of Enkianthus in subtropical areas of China, as experimental materials. We used Oryza sativa spp. japonica variety ‘Nipponbare’ as an internal standard to determine their nuclear DNA contents by flow cytometry, and then the ploidy level was examined by referencing the 2C-value of a diploid species of E. serrulatus. In addition, the ploidy level was further verified by using traditional chromosome tableting technology. The results were as follows: (1) The mean nuclear DNA contents of Enkianthus species in China ranged from 1.77 to 5.62 pg. (2) Four species in Enkianthus sect. Enkianthus, E. quinqueflorus, E. serrulatus, E. serotinus and E. perulatus were diploid (2n=2x=22), and two species in Enkianthus sect. Racemus, E. chinensis and E. deflexus were tetraploid or hexaploid. (3) For diploid species, the nuclear DNA contents showed significant differences between interspecies and intraspecies (P<0.05), but there were no significant differences in tetraploid and hexaploid species (P>0.05). The results of this study provides reference for the future researches on phylogenetics, biogeography, domestication and genetic breeding of Enkianthus.
Key words: Enkianthus, polyploid, genome size, flow cytometry, chromosome tableting
DNA携带着生物体的遗传信息,是生物体生存与繁衍的核心。DNA含量与生物体的细胞大小、代谢速率、叶片气孔密度等都呈一定的相关性(Beaulieu et al., 2007, 2008)。每个生物体的DNA含量通常恒定不变,为了更加形象地描述生物体的DNA含量,Swift(1950)提出“C-值”(C-value)一词,特指生物配子体(染色体数目为n)细胞核中的DNA含量。C-值变化可显示出植物基因组大小多样性,目前,植物DNA C-值数据库(https://cvalues.science.kew.org/)收集了被子植物、裸子植物、蕨类、苔藓和藻类共计12 273种植物的C-值数据。由于细胞有丝分裂间期拥有两套未复制基因组,故细胞核中具有2C DNA含量(2C-值)(Dolezel & Barto, 2005)。2C-值是描述生物多样性的一个主要特征参量,在分子生物学、生物系统学、生态学和种群生物学等领域都具有重要意义(Bennett et al., 2000; 倪丽萍和郭水良,2005; Kron et al., 2007)。
核DNA含量的测定方法主要有化学分析法(chemical analysis)(Schmidt & Thannhauser, 1945)、复性动力学法(reassociation kinetics)(Britten & Kohne, 1968)、孚尔根显微分光光度测定法(Feulgen microspectrophotometry)(Feulgen & Rossenbeck, 1924; Deeley, 1955)、DNA图像光密度法(DNA image densitometry)(Vilhar et al., 2001)和流式細胞术(flow cytometry)(Galbraith et al., 1983)。其中,流式细胞术因其操作简单、检测高效、结果精准等优势,已成为核DNA含量测定的主流方法(Bennett & Leitch, 2011)。此外,对于估算染色体小、数目多以及难以获取染色体压片植物材料的倍性,流式细胞术有着广大应用前景(Bailey et al., 2008)。
吊钟花属(Enkianthus Lour.)是杜鹃花科(Ericaceae)中的一个东亚特有小属,约12种。我国吊钟花属植物种类较为丰富,共7种(Fang & Steven, 2005),分别是单花吊钟花(E. pauciflorus)、吊钟花(E. quinqueflorus)、齿缘吊钟花(E. serrulatus)、晚花吊钟花(E. serotinus )、台湾吊钟花(E. perulatus )、灯笼树(E. chinensis)和毛叶吊钟花(E. deflexus)。吊钟花属植物小巧玲珑的钟形花朵惹人怜爱,尤其是吊钟花更是花中珍品,在广州花市上享有盛誉(徐廷志, 1982)。吊钟花属植物拥有较大的倍性变化,1960年,Sax(1960)报道了日本吊钟花属植物存在二倍体(2n=22)和八倍体(2n=88)。但因其染色体较小,细胞学观察较难,关于该属的倍性研究一直没有较大进展。另外,吊钟花属植物还具有抗炎等药用价值(Wang et al., 2020)。吊钟花属植物具有较高的研究价值,目前该属的相关研究多局限于分类与系统发育(徐廷志,1982;Anderberg, 1994; Tsutsumi & Hirayama, 2012)、栽培繁育(杨建芬等,2009; 潘文等,2010;李超等,2020)、化学成分(Ogawa et al., 1970; Sakakibara et al.,1983; Wang et al., 2014)等方面,而吊钟花属核DNA含量与倍性水平的基础性研究却严重缺失,这已经阻碍了该类群系统发育、植物资源利用和遗传育种等相关领域的研究。
针对中国吊钟花属植物总共有几种倍性,同一物种是否存在多种倍性,相同倍性的物种核DNA含量是否存在差异,同一物种在不同分布区的核DNA含量是否存在差异等问题。本研究采用流式细胞术检测国内吊钟花属6个物种的核DNA含量与倍性水平,用传统的压片观察计数染色体数量以验证倍性,并计算该属植物基因组大小,探讨植物核DNA含量在种间、种内的差异和地理环境的关系,以及不同倍性植物之间可能存在的亲缘关系。本研究可填补中国吊钟花属植物核DNA含量与倍性研究的空白,并为吊钟花属植物资源利用、多倍化、系统发育、引种驯化、遗传育种和基因组学等方面的研究奠定基础。
1 材料与方法
1.1 试验材料
野外采集来自中国10个省(自治区)27个县的吊钟花属植物的活体植株和/或种子材料,其中收集了6个种23个居群的活体植株60株,6个种8个居群的种子(表1),凭证标本保存于江西农业大学亚热带生物多样性实验室(LSTB-JXAU)。将6种吊钟花属植物种子,在恒温20 ℃人工气候箱内催芽,取其幼嫩根尖用于染色体压片试验。活体植株则移栽于江西农业大学生态园中,其幼嫩叶片用于流式细胞术检测。根据前人研究(Dolezel et al., 2007),本文选用水稻品种‘日本晴’(Oryza sativa spp.japonica ‘Nipponbare’)(Sasaki & Burr, 2000)作为2C-值的标准参照。水稻催芽后栽培于人工气候培养箱中,待其长叶后使用。使用二倍体齿缘吊钟花(E. serrulatus)作为倍性参照。
1.2 试验方法
1.2.1 染色体压片计数 待种子露出0.5~1 cm胚根时,取健壮个体5~8个,放入4 ℃预冷的2.0 mL离心管中,加入0.6 mL 4 ℃预冷的超纯水,放入冰水混合物中预处理6 h。预处理材料用超纯水冲洗数次,转移至现配卡诺I固定液(冰乙酸∶无水乙醇=1∶3),放入4 ℃冰箱中固定4 h。固定材料水洗数次,放入提前预热至60 ℃的1 mol·L-1盐酸溶液中,解离8 min左右。解离材料水洗数次,取根尖于洁净的载玻片上,取其分生区(距根冠2~5 mm之间,颜色为乳白色部分),加1滴改良苯酚品红染色液,染色10 min后制片。使用奥特光学BK 6000显微镜检,选择染色体形态清晰、分散性好的细胞,使用OPTPro 3000显微图像分析处理软件添加标尺并进行拍摄。选择30个以上分裂像较好的中期细胞,统计染色体数目。
1.2.2 流式细胞术检测法 参考Dolezel等(2007)的方法,取1 cm×1 cm 左右待测叶片组织放入60 mm培养皿中,滴加1 mL WPB解离液(200 mmol·L-1 Tris; 4 mmol·L-1 MgCl2·6H2O; 2 mmol·L-1 Na2EDTA·2H2O; 86 mmol·L-1 NaCl; 10 mmol·L-1焦亚硫酸钠; 1% PVP-10; 1% (v/v) Tritonx-100,PH 7.5),使用锋利的刀片垂直运刀,迅速切碎样品,不可沿培养皿底部刮擦刀片,以防细胞核破裂,整个过程,材料须浸没在解离液里,以便更好地游离细胞核(叶林江等, 2015)。后向培养皿中加入1 mL DAPI染料(Sysmex公司),冰上避光孵育10 min,期间轻轻摇匀2~3次,再用400目尼龙网过滤,得到染色后的细胞核悬液。使用德国Sysmex公司的CyFlow Cube 6流式细胞仪,采用UVLED光激发,每个样品以水稻为标准内参,每次检测至少收集10 000个细胞,每个样品进行3次重复试验,同一居群取所有个体的平均值。
1.3 数据分析
使用软件FlowJo 7.6进行流式细胞术试验数据采集和分析,样品平均峰值的变异系数(coefficient of variation,CV=标准差/平均值× 100%)大于5%的结果予以舍弃。样品细胞核DNA含量 (2C-值) 计算公式为样品2C-值(DNA pg或Mbp)=(样品平均峰值/标样平均峰值)×标样的2C-值(Dolezl et al., 2007),并根据1 pg DNA=978 Mb(Dolezl et al., 2003),计算该属植物基因组大小。用二倍体齿缘吊钟花做参照,推测该属其他物种的倍性水平,计算公式为样品倍性(整数)=(样品G1平均峰值/标样G1平均峰值)×标样倍性(Dolezl et al., 2007)。使用SPSS 22.0对核DNA含量(2C-值)数据进行显著性统计分析,并使用OriginPro 9.0软件绘图。
2 结果与分析
2.1 核DNA含量(2C-值)与基因组大小
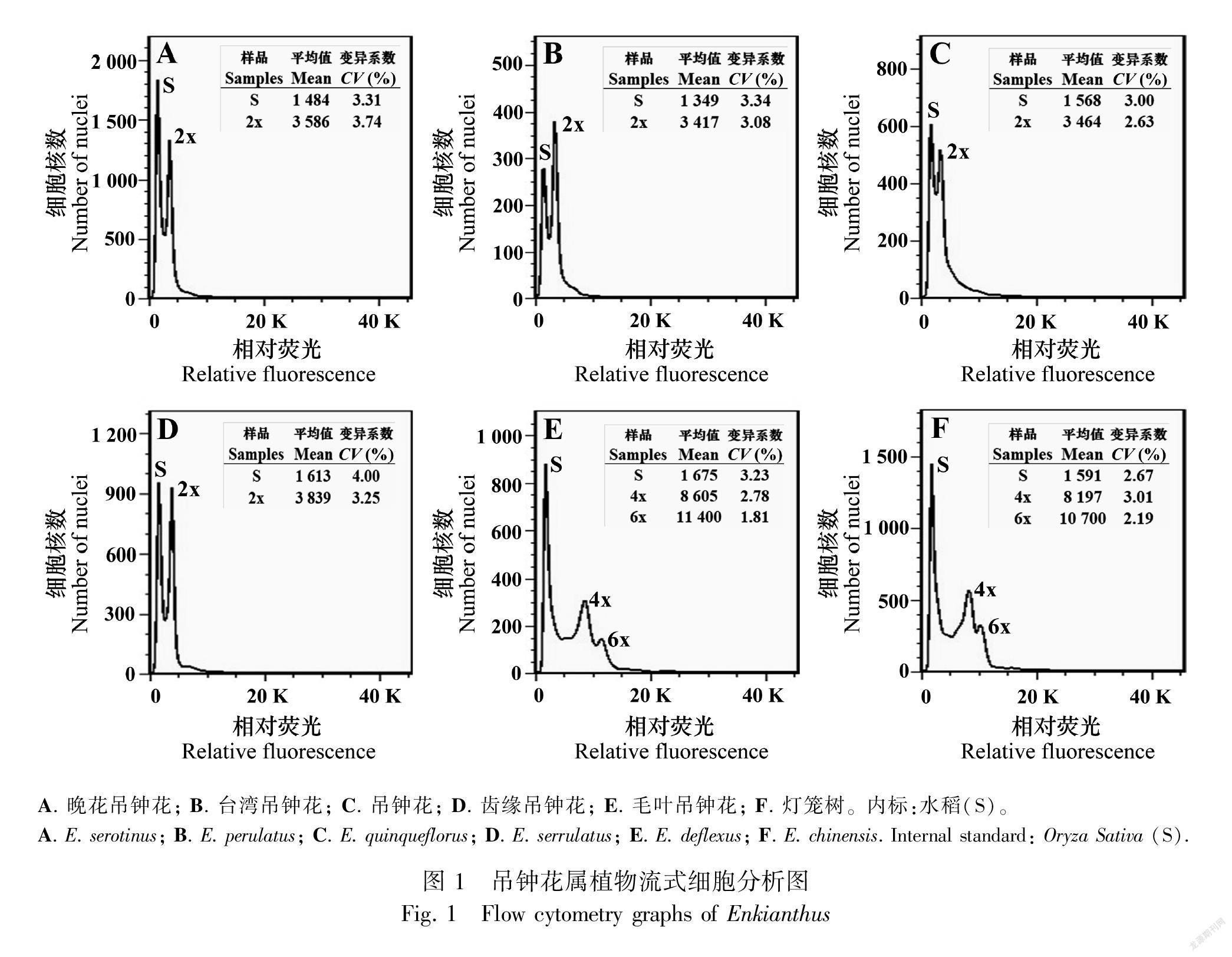
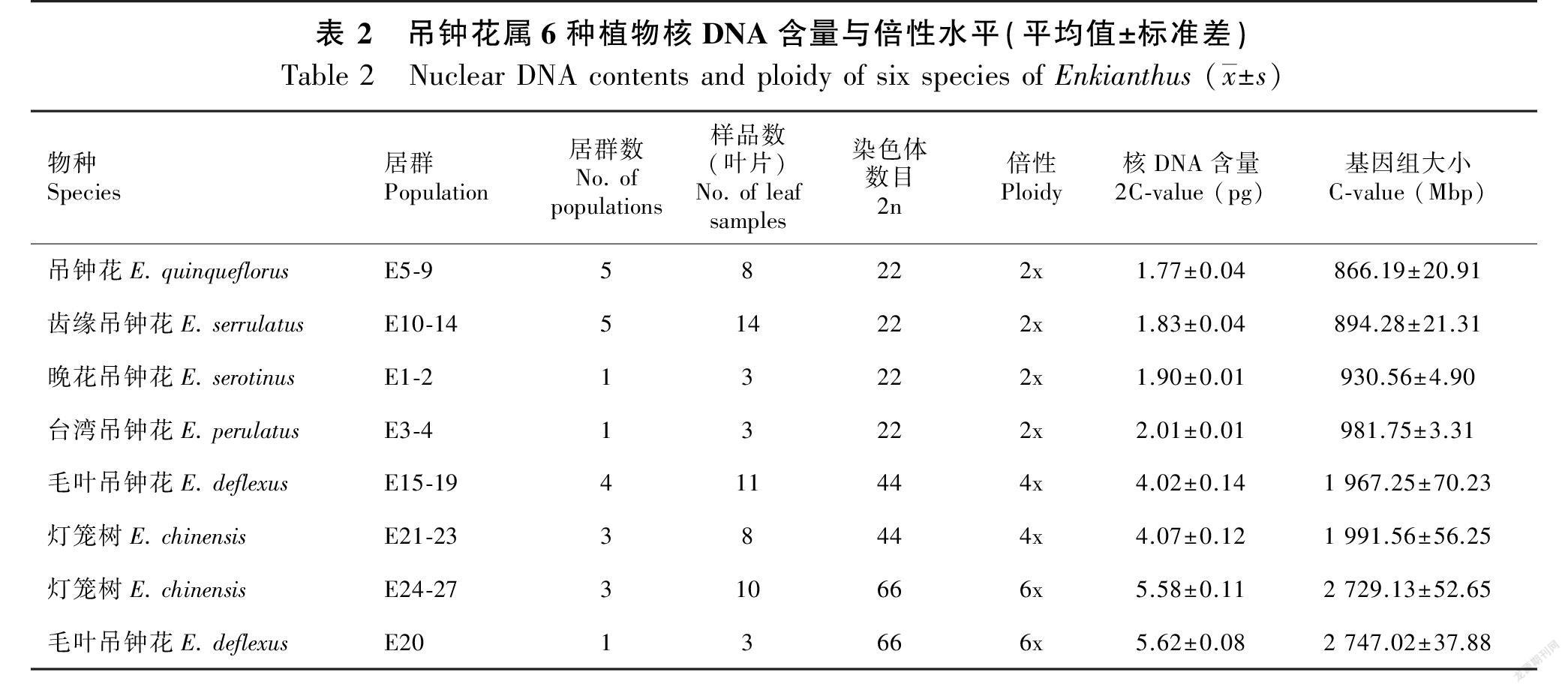
樣品平均峰值的变异系数(CV)均保持在5%以内(图1),通过进一步计算,得到6种吊钟花属植物的2C-值及基因组大小。六倍体毛叶吊钟花核DNA含量(2C-值)最大,平均值为5.62 pg;最小的是吊钟花,平均值为1.77 pg。六倍体毛叶吊钟花基因组大小最大,平均值为2 747.02 Mbp;最小的是吊钟花,平均值为866.19 Mbp(表2)。
2.2 倍性水平的确定
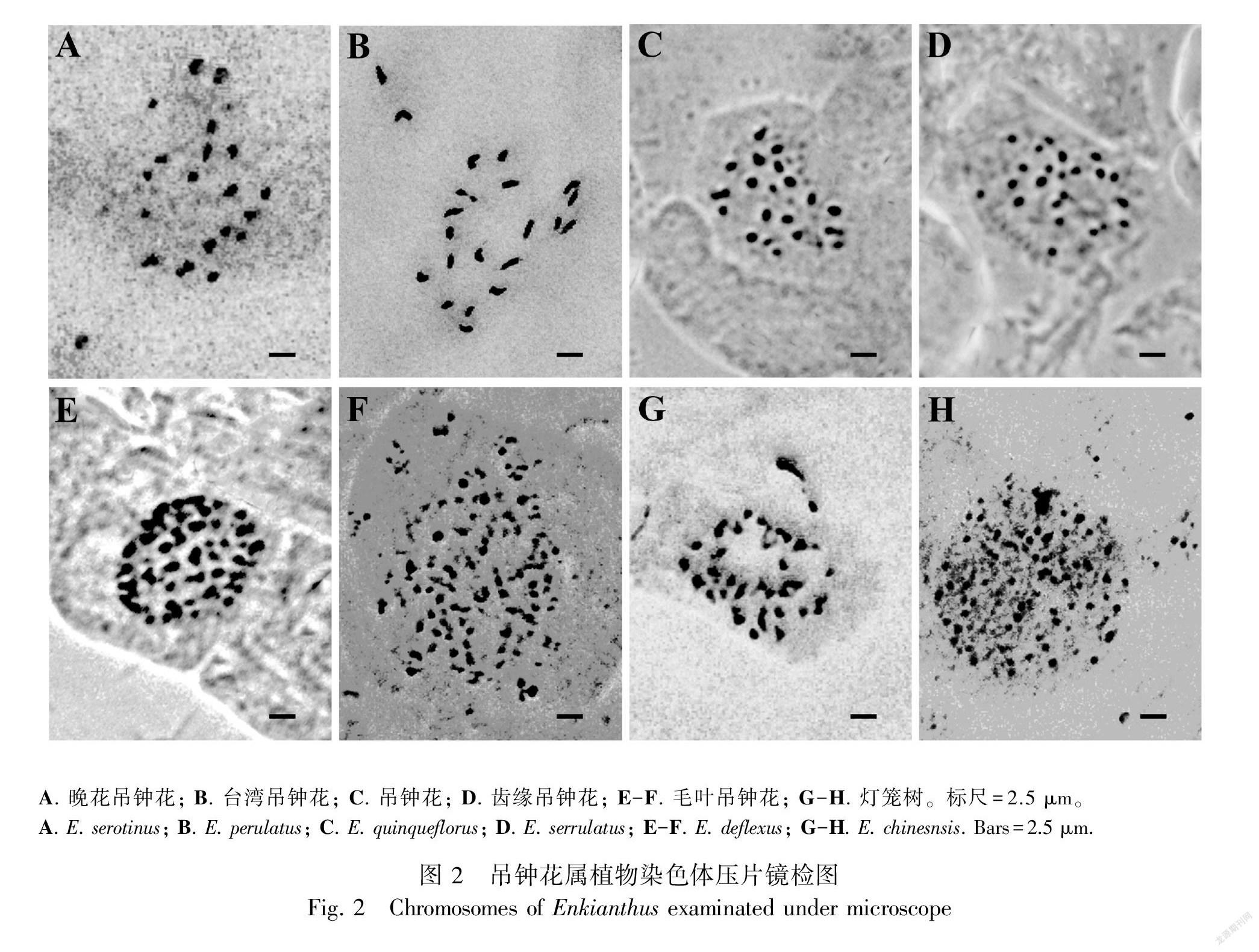
染色体压片结果显示,吊钟花组的齿缘吊钟花、晚花吊钟花、台湾吊钟花、吊钟花的染色体数目为22条,均为二倍体,总状花序组的毛叶吊钟花和灯笼树的染色体数目为44和66条,均存在四倍体与六倍体(图2),流式细胞术检测的倍性结果与之一致(表2)。
2.3 吊钟花属种间与种内核DNA含量(2C-值)差异
将吊钟花属植物核DNA含量数据进行单因素方差分析,二倍体4个种的核DNA含量之间有显著差异(P<0.05),其中,吊钟花核DNA含量显著低于其他二倍体物种,而台湾吊钟花核DNA含量显著高于其他二倍体物种。然而,相同倍性的灯笼树和毛叶吊钟花核DNA含量无显著差异(P>0.05)(表2)。选取样本量较多的齿缘吊钟花、灯笼树和毛叶吊钟花,对其种内不同居群间的核DNA含量进行了单因素方差分析,发现二倍体齿缘吊钟花不同居群之间存在显著性差异(图3)(P<0.05),而多倍体物种灯笼树和毛叶吊钟花在相同倍性的情况下,不同居群之间的核DNA含量无显著性差异(图3)(P>0.05)。
3 讨论与结论
自然界中不同类群之间植物核DNA含量差异较大(Chen et al., 2010),杜鹃花科各类群之间核DNA含量亦是如此。根据植物DNA C-值数据库的记录,目前,杜鹃花科已报道12属25种植物核DNA含量(2C-值),核DNA含量最小的是密花欧石南(Erica multiflora),为0.96 pg(Pellicer et al., 2010),最大的是水晶兰(Monotropa uniflora),为59.80 pg(Bai et al., 2012)。吊钟花属植物核DNA含量为1.77~5.62 pg,属于杜鹃花科植物内核DNA含量偏小的类群。在同属相同倍性的植物间也存在显著差异,如越桔属(Vaccinium)(Costich et al., 1993)、枣属(Ziziphus)(吴丽萍等,2013)、草莓属(Fragaria)(陈丙义等,2015)等。本研究中四个二倍体植物间存在显著性差异,且吊钟花和齿缘吊钟花核DNA含量显著低于晚花吊钟花和台湾吊钟花(P<0.05)。核DNA含量差异大,说明物种间生态位分离大,生态适应性多样化(李国旗等,1999)。在同一科(或属)内相同生活型的相关物种间,核DNA含量越低,其生长发育速率越快,所要求的世代时间变短,能适应条件恶劣的环境,所以其分布范围广(倪丽萍等,2005;郭水良等,2008)。查阅文献加上多年野外调查,我们发现吊钟花和齿缘吊钟花的确要比晚花吊钟花和台湾吊钟花的分布范围广(徐廷志,1982),说明吊钟花和齿缘吊钟花拥有更强的环境适应能力。对于分布范围较小且环境适应能力较弱的晚花吊钟花和台湾吊钟花可以考虑采用迁地保护,收集种子等策略保护这一稀缺植物资源。
一定程度上,同种植物为了保证遗传的稳定性,核DNA含量是保持恒定的,如木豆(Cajanus cajan) (Greilhuber & Obermayer, 1998)、小麦(Triticum aestivum)(Wetzel et al., 1999)、Seleria albicans(Lysák et al., 2000)等。本研究中多倍体植物灯笼树和毛叶吊钟花在相同倍性的情况下,种间和种内均无显著性差异(P>0.05),拥有较为稳定的遗传体系,并未因物种和地理环境等因素的不同而产生较大差异。但是,在自然界中依旧存在不少例外,早在1966年,Evans等(1966)发现不同环境下的亚麻(Linum usitatissimum)核DNA含量存在16%的差异。在玉米(Zea mays)(Laurie & Bennett, 1985)、黑麦草(Lolium perenne)(Sugiyama et al., 2002)、葫芦(Lagenaria siceraria)(Achigan et al., 2008)等植物中也有类似报道,这些差异可能是由不同环境的气候地理条件、生境、种群密度和生长发育阶段等因素所导致(郭水良等, 2011)。本研究二倍体齿缘吊钟花核DNA含量除了贵州赤水与湖南新宁的居群之间都没有显著差异,其他居群之间都存在显著性差异。比较这四个居群的气候地理条件可以发现,仅有贵州赤水与湖南新宁的居群分布环境属于典型的丹霞地貌,因为丹霞地貌的土壤保水能力较差,所以生长在该地域的植物都有较强的抗旱能力(张贵志, 2012)。而江西永修的居群濒临鄱阳湖,鄱阳湖由于复杂的地形和水陆地表性质不均匀性,影响湖区的中小尺度对流天气系统的发生、发展和消亡,对植物生长的气候环境影响很大(傅敏宁, 2013)。至于湖北利川的居群,处于中亚热带与北亚热带的过渡地带,山岭重叠,溪谷纵横,相对高差和气候变化较大,山地气候明显。不同的地理环境条件对植物的生长发育影响极大,这可能也是齿缘吊钟花不同居群植物核DNA含量存在差异的原因。
我们基于流式细胞术,以二倍体齿缘吊钟花为倍性参照,推测出了吊钟花属其他5个种的倍性水平。值得注意的是,灯笼树和毛叶吊钟花四倍体个体存在非整倍性问题,四倍体物种的核DNA含量约为二倍体齿缘吊钟花核DNA含量的2.2倍,台湾吊钟花的2.0倍。其原因可能是(1) 倍性参照的选择,不同二倍体物种核DNA含量存在显著性差异,以不同二倍体种为参照,所推测目标种的核DNA含量比值也有差异(Wang et al, 2009);(2)四倍体物种可能来源于核DNA含量较大的物种杂交(Yokoya et al., 2000)。所以,研究吊钟花属四倍体物种起源进化时,应该重点关注二倍体物种中核DNA含量较大的台湾吊钟花和晚花吊钟花。此外,我们还发现吊钟花属六倍体植物的核DNA含量小于四倍體核DNA含量的1.5倍,小于二倍体晚花吊钟花和台湾吊钟花核DNA含量的3倍。Bonos等(2002)发现剪股颖属(Agrostis)六倍体植物核DNA含量小于二倍体核DNA含量的3倍,Jian等(2014)也发现了在蔷薇属(Rosa)四倍体植物核DNA含量小于二倍体核DNA含量的2倍。这些差异可能是物种之间基因组本质差异,也可能是由高倍性的植物加倍形成过程中舍弃一些重复的DNA片段所导致(Bonos et al., 2002)。
另外, 吊钟花属吊钟花组除了分布在中国的四个物种为二倍体,还有分布在日本的Enkianthus perulatus也为二倍体(Sax, 1960),总状花序组的灯笼树和毛叶吊钟花均存在四倍体与六倍体,分布在日本的E. campanulatus为八倍体,该组暂未发现二倍体物种,说明该属这两个组在倍性水平上有较大区别。该属这两个组的划分不仅在宏观形态(徐廷志, 1982)、微观花粉(程子白和赖小荣, 1988)、分子标记(Tsutsumi & Hirayama, 2012)和化学成分(陈孝泉等, 1986)上得到支持,现在还在核DNA含量与物种倍性上也印证了以上划分的合理性。但是,关于吊钟花属核DNA含量与倍性水平研究还不完善,比如分布在中国的单花吊钟花(E. pauciflorus)以及分布在日本的E. sikokianus、E. cernuus、E. nudipes皆因材料获取困难而没有得到充分研究。此外,本研究中有3个物种的5个居群E7、E8、E9、E12、E18样品量较少,鉴于一个样品量较少的居群植物核DNA含量可能无法代表单个物种的核DNA含量,所以本研究采用了多个居群去衡量单个物种的核DNA含量,可以更好地反映单个物种的核DNA含量(Bai et al., 2012; Pellicer et al., 2012)。
吊钟花属植物染色体大小为1~2 μm,属于小染色体(Lima-De-Faria A, 1980),难以进行核型分析。该属植物流式细胞术倍性推测结果与染色体压片结果一致,说明流式细胞术检测结果可靠,可以用于该属植物大规模倍性测定,这将极大提高植物倍性检测的效率。本研究首次报道了吊钟花、齿缘吊钟花、晚花吊钟花、灯笼树、毛叶吊钟花共5个种的核DNA含量(2C-值)、基因组大小和倍性水平,以及台湾吊钟花的核DNA含量(2C-值)和基因组大小。吊钟花属内存在2x、4x、6x、8x,甚至同一个物种内都存在多个倍性,由此可见,该属多倍化现象非常普遍。至于该属植物不同多倍体如何形成,不同倍性物种之间的系统发育关系如何,倍性变异在吊钟花属植物生态分化、物种形成中具有何种作用。这些有意义的问题尚未解决,但本研究为这些问题的解决奠定了重要的研究基础。
参考文献:
ACHIGAN-DAKO EG, FUCHS J, AHANCHEDE A, et al., 2008. Flow cytometric analysis in Lagenaria siceraria (Cucurbitaceae) indicates correlation of genome size with usage types and growing elevation [J]. Plant Syst Evol, 276(1-2): 9-19.
ANDERBERG AA, 1994. Cladistic analysis of Enkianthus with notes on the early diversification of the Ericaceae [J]. Nord J Bot, 14(4): 385-401.
BAILEY JP, KAY QON, MCALLISTER H, et al., 2008.Chromosome numbers in Sorbus L. (Rosaceae) in the British Isles [J]. Watsonia, 27(1): 69-72.
BAI CK, ALVERSON WS, FOLLANSBEE A, et al., 2012. New reports of nuclear DNA content for 407 vascular plant taxa from the United States [J]. Ann Bot, 110(8): 1623-1629.
BEAULIEU JM, LEITCH IJ, KNIGHT CA, 2007. Genome size evolution in relation to leaf strategy and metabolic rates revisited [J]. Ann Bot, 99(3): 495-505.
BEAULIEU JM, LEITCH IJ, PATEL S, et al., 2008. Genome size is a strong predictor of cell size and stomatal density in angiosperms [J]. New Phytol, 179(4): 975-986.
BENNETT MD, BHANDOL P, LEITCH IJ, 2000. Nuclear DNA amounts in angiosperms and their modern uses: 807 new estimates [J]. Ann Bot, 86: 859-909.
BENNETT MD, LEITCH IJ, 2011. Nuclear DNA amounts in angiosperms: targets, trends and tomorrow [J]. Ann Bot, 107(3): 467-590.
BONOS SA, PLUMLEY KA, MEYER WA, 2002. Ploidy determination in Agrostis using flow cytometry and morphological traits [J]. Crop Sci, 42(1): 192-196.
BRITTEN RJ, KOHNE DE, 1968. Repeated sequences in DNA [J]. Science, 161(3841): 529-540.
CHEN BY, LI JF, HUO HZ, et al., 2015. Estimation of genome size in six wild strawberry species [J]. J Fruit Sci, 32(1): 51-56. [陳丙义, 李金凤, 霍恒志, 等, 2015. 6种野生草莓基因组大小估算 [J]. 果树学报, 32(1): 51-56.]
CHEN GQ, GUO SL, YIN LP, 2010. Applying DNA C-values to evaluate invasiveness of angiosperms: validity and limitation [J]. Biol Invasions, 12(5): 1335-1348.
CHEN XQ, SHAO H, WANG GX, et al., 1986. The chemotaxonomy of Enkianthus [J]. Acta Bot Boreal-Occident Sin, 6(3): 209-212. [陈孝泉, 邵宏, 王国祥, 等, 1986. 吊钟花属的植物化学分类 [J]. 西北植物学报, 6(3): 209-212.]
CHENG ZB, LAI XR, 1988. Studies on the pollen morphology and evolution of the genus Enkianthus [J]. J Sichuan Univ (Nat Sci Ed), 25(2): 221-229. [程子白, 赖小荣, 1988. 吊钟花属Enkianthus花粉形态及其演化关系的研究 [J]. 四川大学学报(自然科学版), 25(2): 221-229.]
COSTICH DE, ORTIZ R, MEAGHER TR, et al., 1993. Determination of ploidy level and nuclear DNA content in blueberry by flow cytometry [J]. Theor Appl Genet, 86(8): 1001-1006.
DEELEY EM, 1955.An integrating micodensitometer for biological cells [J]. J Sci Instrum, 32(7): 263-267.
DOLEEL J, BARTO J, 2005. Plant DNA flow cytometry and estimation of nuclear genome size [J]. Ann Bot, 95: 99-110.
DOLEEL J, BARTO J, VOGLMAYR H, et al., 2003. Nuclear DNA content and genome size of trout and human [J]. Cytom Part A, 51(2): 127-128.
DOLEEL J, GREILHUBER J, SUDA J, 2007. Estimation of nuclear DNA content in plants using flow cytometry [J]. Nat Protoc, 2(9): 2233-2244.
EVANS GM, DURRANT A, REES H,
1966. Associated nuclear changes in the induction of flax genotrophs [J]. Nature, 212(5063): 697-699.
FANG RZ, STEVENS PF, 2005. Enkianthus [M]// WU ZY, RAVEN PH. Flora of China. Beijing: Science Press; St. Louis: Missouri Botanical Garden Press: 243-245.
FEULGEN R, ROSSENBECK H, 1924. Mikroskopisch-chemischer nachweis einer nukleinsure von typus der thymonucleinsure und die darauf beruhende selektive frbung von zellkernen in mikroskopischen prparaten [J]. Hoppe-Seylers Z Physiol Chem, 135(5-6): 203-248.
FU MN, 2013. Research on the impacts of Poyang lake on typical weather process and the characteristics of near surface boundary layer, Jiangsu China [D]. Nanjing: Nanjing University of Information Science and Technology: 8-10. [傅敏宁, 2013. 鄱阳湖对典型天气过程的影响及近地面边界层特征研究 [D]. 南京: 南京信息工程大学: 8-10.]
GALBRAITH DW, HARKINS KR, MADDOX JM, et al., 1983. Rapid flow cytometric analysis of the cell cycle in intact plant tissues [J]. Science, 220(4601): 1049-1051.
GREILHUBER J, OBERMAYER R, 1998. Genome size variation in Cajanus cajan (Fabaceae): A reconsideration [J]. Plant Syst Evol, 212: 135-141.
GUO SL, CHEN GQ, MAO LH, 2008. Relationship between DNA C-value and invasiveness in 539 angiosperm species in China [J]. Acta Ecol Sin, 28(8): 3698-3705. [郭水良, 陈国奇, 毛俐慧, 2008. DNA C-值与被子植物入侵性关系的数据统计分析——以中国境内有分布的539种被子植物为例 [J]. 生态学报, 28(8): 3698-3705.]
GUO SL, ZHOU P, YIN LP, et al., 2011. Interspecific and intraspecific variations of plant DNA C-values and its biological significance [J]. J Shanghai Norm Univ (Nat Sci), 40(1): 102-110. [郭水良, 周平, 印丽萍, 等, 2011. 植物DNA C-值在种间和种内的变异及其生物学意义 [J]. 上海师范大学学报(自然科学版), 40(1): 102-110.]
JIAN HY, ZHANG T, WANG QG, et al., 2014. Nuclear DNA content and 1Cx-value variations in genus Rosa L. [J]. Int J Cytol Cytosyst Cytogenet, 67(4): 273-280.
KRON P, SUDA J, HUSBAND BC, 2007. Applications of flow cytometry to evolutionary and population biology [J].Ann Rev Ecol Evol Syst, 38(1): 847-876.
LAURIE DA, BENNETT MD, 1985. Nuclear DNA C-ontent in the genera Zea and Sorghum. Intergeneric, interspecific and intraspecific variation [J]. Heredity, 55: 307-313.
LI C, LU T, LIU Y, et al., 2020. Effects of different treatments on seed germination of Enkianthus chinensis Franch [J]. N Hortic, 469(22): 72-78. [李超, 盧婷, 刘阳, 等, 2020. 不同处理对灯笼树种子萌发的影响 [J]. 北方园艺, 469(22): 72-78.]
LI GQ, AN SQ, CHEN XL, et al., 1999. A primary research on relationship peteen C value paradox and its ecological adaptation of the life [J]. Explor Nat, 18(2): 1-66. [李国旗, 安树青, 陈兴龙, 等, 1999. 生物的C值矛盾与其生态适应性的关系初探 [J]. 大自然探索, 18(2): 61-66.]
LIMA-DE-FARIA A, 1980. Classification of genes, rearrangements and chromosomes according to the chromosome field [J]. Hereditas, 93(1): 1-46.
LYS K MA, ALEXANDRA R, DIXON JM, et al., 2000. Limited genome size variation in Sesleria albicans [J]. Ann Bot, 86(2): 399-403.
NI LP, GUO SL, 2005. Review on relationship between invasiveness of plants and their DNA C-value [J]. Acta Ecol Sin, 25(9): 372-2381. [倪麗萍, 郭水良, 2005. 论DNA C-值与植物入侵性的关系 [J]. 生态学报, 25(9): 2372-2381.]
OGAWA M, HISADA S, INAGAKI I, 1970. Studies on the constituents of Enkianthus nudipes. I. New flavan glucosides of the leaves and its absolute configuration [J]. Yakugaku Zasshi, 90(9): 1081-1087.
PAN W, ZHU BZ, XU B, et al., 2010. Nursery and twig-coiling techniques for raising seedlings of wild ornamental plants Enkianthus quinqueflorus Lour. [J]. Guangdong For Sci Technol, 26(6): 86-88. [潘文, 朱报著, 徐斌, 等, 2010. 野生观赏花卉吊钟花实生和圈枝育苗技术 [J]. 广东林业科技, 26(6): 86-88.]
PELLICER J, CLERMONT S, HOUSTONL, et al., 2012. Cytotype diversity in the Sorbus complex (Rosaceae) in Britain: sorting out the puzzle [J]. Ann Bot, 110(6): 1185-1193.
PELLICER J, ESTIARTE M, GARCIA S, et al., 2010. Genome size unaffected by moderate changes in climate and phosphorus availability in Mediterranean plants [J]. Afr J Biotechnol, 9(37): 6070-6077.
SAKAKIBARA J, KAIYA T, FUKUDA H, et al., 1983. 6β-Hydroxyursolic acid and other triterpenoids of Enkianthus cernuus [J]. Phytochemistry, 22(11): 2553-2555.
SASAKI T, BURR B, 2000. International rice genome sequencing project: The effort to completely sequence the rice genome [J]. Curr Opin Plant Biol, 3(2): 138-141.
SAX HJ, 1960. Polyploidy in Enkianthus (Ericaceae) [J]. J Arnold Arbor, 41(2): 191-196.
SCHMIDT G, THANNHAUSER SJ, 1945. A method for the determination of desoxyribonucleic acid, ribonucleic acid, and phosphoproteins in animal tissues [J]. J Biol Chem, 161(161): 83-89.
SUGIYAMA S, YAMAGUCHI K, YAMADA T, 2002. Intraspecific phenotypic variation associated with nuclear DNA content in Lolium perenne L. [J]. Euphytica, 128(2): 145-151.
SWIFT H, 1950. The constancy of desoxyribose nucleic acid in plant nuclei [J]. Proc Natl Acad Sci USA, 36(11): 643-654.
TSUTSUMI C, HIRAYAMA Y, 2012. The phylogeny of Japanese Enkianthus species (Ericaceae) [J]. Bull Natl Mus Nat Sci, Ser. B, 38(1) : 11-17.
VILHAR B, GREILHUBER J, KOCE JD, et al., 2001. Plant genome size measurement with DNA image cytometry [J]. Ann Bot, 87: 719-728.
WANG HQ, MA SG, LIN MB, et al., 2020. Hydroxylated ethacrylic and tiglic acid derivatives from the stems and branches of Enkianthus chinensis and their potential anti-inflammatory activities [J]. J Nat Prod, 83(10): 2867-2876.
WANG XH, JIANG R, LIU ZZ, et al., 2014. Phytochemicals and biological activities of poisonous genera of Ericaceae in China [J]. Nat Prod Comm, 9(3): 427-442.
WANG Y, BIGELOW CA, JIANG Y, 2009. Ploidy level and DNA content of perennial ryegrass germplasm as determined by flow cytometry [J]. Hortscience, 44(7): 2049-2052.
WETZEL JB, AREF S, BALIGAR VC, et al., 1999. A lack of nuclear DNA C-ontent variability among wheat near isolines differing in aluminium response [J]. Ann Bot, 83( 6): 725-728.
WU LP, TANG Y, LI YY, et al., 2013. Estimation of genome size of Ziziphus jujuba and Z. acdiojujuba [J]. J Beijing For Univ, 35( 3): 77-83. [吳丽萍, 唐岩, 李颖岳, 等, 2013. 枣和酸枣基因组大小测定 [J]. 北京林业大学学报, 35(3): 77-83.]
XU TZ, 1982. Classification, distribution and phylogeny of the genus Enkianthus [J]. Acta Bot Yunnan, 4(4): 355-362. [徐廷志, 1982. 吊钟花属的分类、地理分布和系统发育 [J]. 云南植物研究, 4(4): 355-362.]
YANG JF, LIU XY, ZHANG SZ, et al., 2009. Tissue culture of Enkianthus quinqueflorus Lour. [J]. J Trop Subtrop Bot, 17(4): 383-387. [杨建芬, 刘兴尧, 张寿洲, 等, 2009. 吊钟花的组织培养技术研究 [J]. 热带亚热带植物学报, 17(4): 383-387.]
YE LJ, ZHANG ZR, SUN ZX, et al., 2015. The determination of nuclear DNA content(2C-value) on some representative genus and species of Magnoliaceae [J]. Plant Divers Res, 37(5): 605-610. [叶林江, 张志荣, 孙志霞, 等, 2015. 木兰科主要属种核DNA含量(2C-值)的检测 [J]. 植物分类与资源学报, 37(5): 605-610.]
YOKOYA K, ROBERTS AV, MOTTLEY J, et al., 2000. Nuclear DNA amount in Roses [J]. Ann Bot, 85(4): 557-561.
ZHANG GZ, 2012. Study on plants of danxia landform in Hunan and Jiangxi, Hunan, China [D]. Changsha: Central South University of Forestry and Technology: 32-34. [张贵志, 2012. 湘赣典型丹霞地貌植物研究 [D]. 长沙: 中南林业科技大学: 32-34.]
(责任编辑 李 莉)
2997501186208
