温度对烟草叶片细胞壁物质含量及组成变化的影响
2022-03-16张玉琴周蕾王永张娟董小卫肖丽霞张日强马兴华孙延国
张玉琴 周蕾 王永 张娟 董小卫 肖丽霞 张日强 马兴华 孙延国
摘要: 为探究温度影响烟草叶片细胞壁建成的机理和烟叶品质的机制,连续2年设置不同温度(15 ℃、20 ℃、25 ℃、30 ℃)处理的盆栽试验,研究不同温度对烟草叶片细胞壁物质含量和组成及合成酶基因表达量的影响。结果表明,含碳化合物在烟草叶片生长过程中及温度处理过程中发生了重新分配,随着烟草生长时间的延长,叶片中结构性碳水化合物(纤维素、半纤维素、木质素、果胶)含量整体表现为下降趋势,而非结构性碳水化合物(总糖、淀粉)含量大致表现为上升趋势;随温度升高,烟草叶片60 d时纤维素含量明显升高,而木质素含量及其占细胞壁总物质含量的比例明显降低;温度对半纤维素含量、果胶含量影响不显著。温度对纤维素含量、木质素含量的影响与其合成酶基因表达量的变化有关,温度升高有利于纤维素合成酶基因CESA1的上调表达,温度降低有利于木质素合成酶基因PAL1、4CL2的上调表达;温度变化对半纤维素合成酶、果胶合成酶基因表达的影响较小。
关键词: 烟草;叶片;温度;细胞壁;基因
中图分类号: S572 文献标识码: A 文章编号: 1000-4440(2022)01-0039-10
Abstract: To investigate the mechanisms of temperature in affecting cytoderm formation of tobacco leaf and tobacco leaf quality, pot experiment under different temperature treatments (15 ℃, 20 ℃, 25 ℃, 30 ℃) was set for two consecutive years to study the effects of different temperatures on the substance contents and composition of cytoderm, as well as expression amount of synthase genes in tobacco leaves. The results showed that, carbon compounds redistributed during the growth process of tobacco leaves and under different temperature treatments. With the extension of growth time, contents of structural carbon compounds (cellulose, hemicellulose, lignin, pectin) in tobacco leaves decreased on the whole, while contents of non-structural carbon compounds (total sugar, starch) increased approximately. The cellulose content of tobacco leaves at 60 d increased obviously, while the contents of lignin and the ratio of lignin contents to the total substance content in the cytoderm reduced significantly with the increase of temperature. The temperature had no significant effect on hemicelluloses and pectin contents. The effect of temperature on the contents of cellulose and lignin was related to the changes in the expression of related synthase genes. Increasing temperature was beneficial to the up-regulation of cellulose synthase gene CESA1, while decreasing temperature was beneficial to the up-regulation of lignin synthase genes PAL1 and 4Cl2. Temperature changes had slight impact on the expression of hemicelluloses and pectin synthase genes.
Key words: tobacco;leaf;temperature;cytoderm;gene
細胞壁在烟草生长发育过程中为植株提供结构框架物质,这些物质对烟叶的物理特性有不同程度的影响,间接决定着烟叶的加工特性,对烟叶品质有重要影响[1-2]。研究发现烟草移栽后至现蕾期的平均温度是影响烟叶评吸质量的关键因素,但其作用机理却没有被明确[3]。烟草现蕾前的营养生长期及营养生长与生殖生长并进期是确定烟草有效叶片数和叶片长度的时期,因此研究温度对烟草叶片细胞壁建成的机制,有利于探明温度影响烟叶品质的机制。
植物细胞壁主要由纤维素、半纤维素、果胶质、木质素等构成,结构与成分具有高度的复杂性和多样性[4]。随着分子遗传学的发展,大量主导细胞壁物质合成的关键基因被克隆和鉴定, 细胞壁主要成分的生物合成过程得到解析[5]。高等植物细胞壁中的纤维素由纤维素合成酶(CesA)合成,纤维素合成酶超家族包括纤维素合成酶和纤维素合成酶类似基因家族(CSL)[6]。烟草SR1以及花烟草的烟草纤维素合成酶1(CESA1)基因已被克隆[7]。丙氨酸裂解酶(PAL)、肉桂酸-4-羟基化酶(C4H)、4-香豆酸辅酶A连接酶(4CL)等是控制木质素组成成分的关键酶[8]。在果胶合成方面,研究结果显示糖基转移酶GAUT1和 GAUT7相互作用合成同聚半乳糖醛酸聚糖,是组成果胶质的一类酸性糖基[5]。
目前对细胞壁建成响应环境温度胁迫的研究较少,主要集中于蔬菜作物。研究结果表明,豌豆幼苗经冷驯化后,细胞壁物质含量和组成都发生改变[9];越冬油菜经冷驯化后,细胞壁物质总量增加1倍,其中果胶质含量变化较大,纤维素含量变化较小,细胞壁结构发生了重组[10]。本研究通过分析不同温度对烟草叶片细胞壁物质的含量和组成、细胞壁物质合成酶编码基因的影响,初步明确温度影响烟草叶片细胞壁建成的机制,为解析温度影响烟叶品质的机制提供理论参考。
1 材料与方法
1.1 试验设计
试验于2018-2019年在中国农业科学院烟草研究所精密人工气候室开展,试验烟草品种为K326。
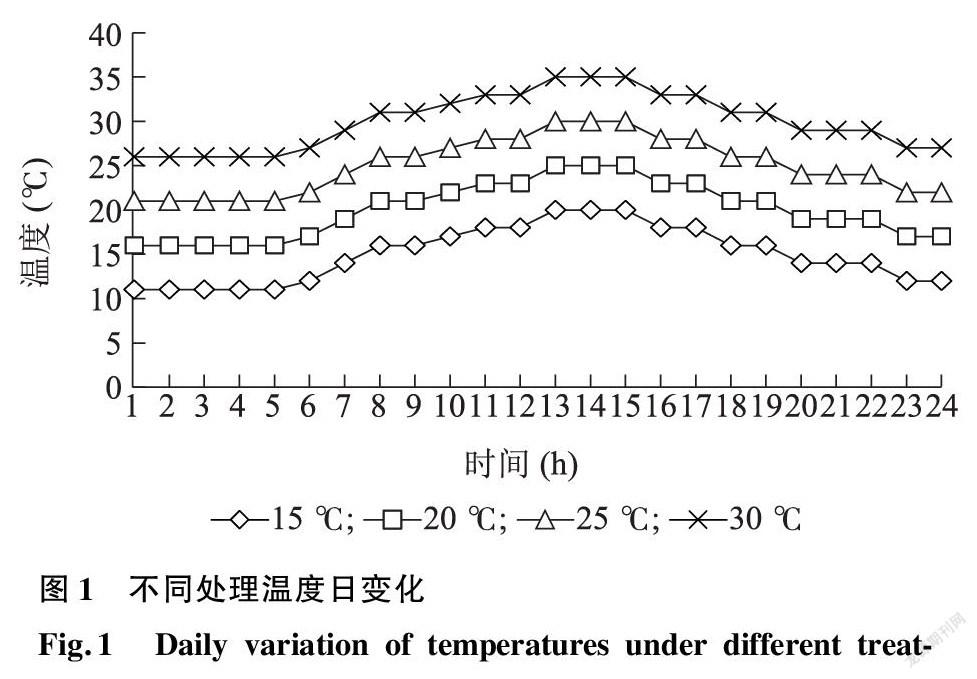
采用基质育苗方式培育烟草幼苗,于6叶1心时移栽至花盆中,在日均温25 ℃条件下培养至10叶1心时进行温度处理。试验设计4个不同日平均温度处理,分别为15 ℃(T1)、20 ℃(T2)、25 ℃(T3)、30 ℃(T4),采用分时段控制温度(图1)的方式模拟自然气候条件,其中2018年试验设置15 ℃、20 ℃、25 ℃ 3个处理,2019年试验设置15 ℃、20 ℃、25 ℃、30 ℃ 4个处理,每个处理放置24盆烟草幼苗。处理时挂牌标记最上部相同叶位(第10叶位)、相同大小的叶片,用于后续取样。各培养室光照条件一致,各项管理措施保持一致。
1.2 测定项目及方法
1.2.1 样品采集及化学成分检测 2018年,于处理后第20 d、40 d、60 d,每处理选择6株烟草,采集标记叶位以上的叶片,105 ℃杀青、80 ℃烘干;2019年,于处理后第15 d、30 d、45 d、60 d,每处理选择6株烟草,采集标记叶位以上的叶片,105 ℃杀青、80 ℃烘干。分别参照农业行业标准《农业生物质原料 纤维素、半纤维素、木质素测定(NY/T 3494-2019)》、烟草行业标准《烟草及烟草制品 果胶的测定 离子色谱法(YC/T 346-2010)》检测叶片纤维素、半纤维素、木质素、果胶等细胞壁物质含量,细胞壁总物质含量为以上4种物质之和。分别参照烟草行业标准《烟草及烟草制品 水溶性糖的测定 连续流动法(YC/T 159-2002)》、《烟草及烟草制品淀粉的测定 酶水解-离子色谱法(YC/T 283-2009)》检测叶片总糖、淀粉等非结构性碳水化合物的含量。
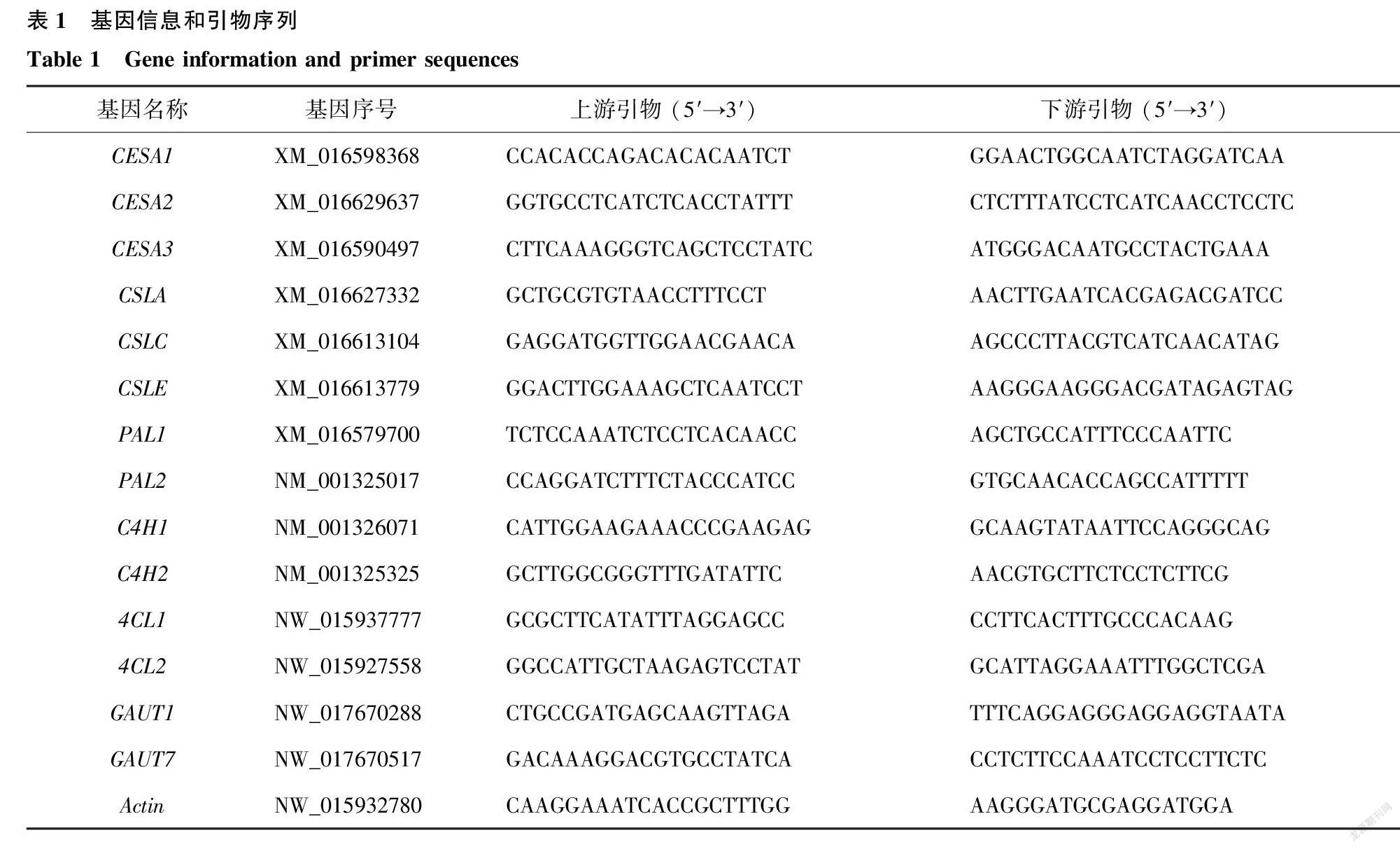
1.2.2 细胞壁合成相关基因表达量检测 参考已发表的拟南芥、番茄和马铃薯的叶片细胞壁物质合成酶基因,在美国国立生物技术中心(NCBI:https://www.ncbi.nlm.nih.gov/) 数据库中搜索,筛选得到烟草叶片细胞壁合成酶基因序列,采用Primer 5.0软件设计引物,以Actin为内参基因[11],引物由上海派森諾生物科技股份有限公司合成,基因引物序列见表1。
2019年,于处理起始阶段与处理后第5 d、10 d、15 d、30 d,每处理选择3株烟草幼苗,采集标记烟叶样品,液氮速冻,-80 ℃保存,采用RNA 提取试剂盒MiniBEST Plant RNA Extraction Kit(TaKaRa公司产品)提取RNA,琼脂糖凝胶电泳检测RNA 的浓度和完整性,利用反转录酶Primescript RT reagent Kit (TaKaRa公司产品)将RNA 反转录为cDNA,进行基因表达定量检测。反应体系为20.0 μl,其中包含DNA 1.0 μl,SYBR qPCR Master Mix 10.0 μl,上下游引物各0.4 μl,焦碳酸二乙酯(DEPC) 水8.2 μl,3次重复。采用2-△△Ct法[12]进行基因相对定量分析。
1.3 数据处理与分析
数据分析、作图采用Excel进行,方差分析采用DPS进行。
2 结果与分析
2.1 不同温度对烟草叶片细胞壁物质含量的影响
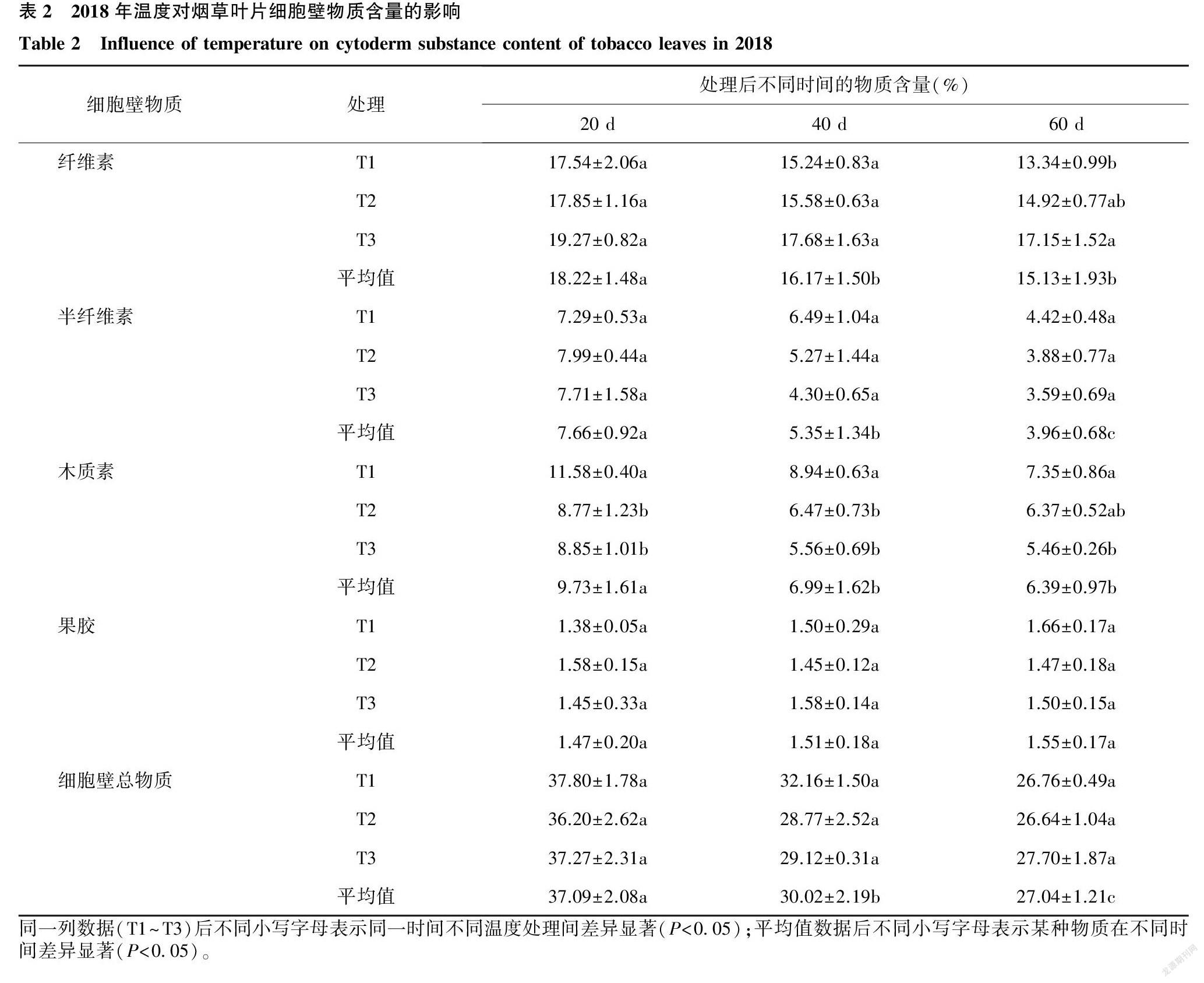
由表2可知,随叶片生长期延长,纤维素、半纤维素、木质素含量及细胞壁总物质含量均呈降低趋势,果胶含量基本保持不变。处理60 d时T3处理叶片纤维素含量显著高于T1处理;处理20 d、40 d时T1处理木质素含量均显著高于T2、T3处理,处理60 d时各处理木质素含量大小顺序为T1>T2>T3,且T3和T1差异显著。各时期不同温度处理间半纤维素、果胶含量及细胞壁总物质含量均无显著差异。
由表3可知,随叶片生长期延长,纤维素、半纤维素、木质素、果胶含量及细胞壁总物质含量整体呈降低趋势。处理60 d时T3、T4处理叶片纤维素含量显著高于T1、T2处理;处理60 d时叶片木质素含量随处理温度升高而降低。各时期不同温度处理间半纤维素、果胶含量及细胞壁总物质含量均无显著差异。
同一列数据(T1~T3)后不同小写字母表示同一时间不同温度处理间差异显著(P<0.05);平均值数据后不同小写字母表示某种物质在不同时间差异显著(P<0.05)。
2.2 温度对烟草叶片细胞壁物质组成比例的影响
由图2可知,处理40 d、60 d时,叶片纤维素含量占比随温度升高明显升高;处理40 d时,叶片半纤维素含量占比随温度升高明显降低;处理20 d、40 d、60 d时,叶片木质素含量占比随温度升高明显降低;不同处理叶片果胶含量占比在各时期均无显著差异。
由图3 可知,处理30 d、45 d、60 d时,叶片纤维素含量占比随温度升高而明显升高;处理45 d时,T4处理半纤维素含量占比显著低于T1处理,其他时间各温度处理半纤维素含量占比无显著差异;处理30 d、45 d、60 d时,叶片木质素含量占比随温度升高显著降低;处理各时期,不同温度处理烟草叶片的果胶含量占比均无显著差异。
2.3 温度对烟草叶片非结构性碳水化合物含量的影响
由表4可知,处理60 d时叶片淀粉含量及非结构性碳水化合物总含量高于处理20 d、40 d,总糖含量基本保持不变。各时期烟草叶片总糖含量均随处理温度升高而升高,且T3处理显著高于T1;处理60 d时T3处理叶片淀粉含量显著低于T1处理;各时期不同处理烟草叶片非结构性碳水化合物总含量均无显著差异。
由表5可知,随叶片生长期延长,总糖、淀粉含量及非结构性碳水化合物总含量整体呈升高趋势。处理30 d、45 d、60 d时烟草叶片总糖含量均随处理温度升高而升高,且T4处理显著高于T1处理;处理60 d时T4处理叶片淀粉含量显著低于T1处理;各时期不同处理非结构性碳水化合物总含量均无显著差异。
同一列数据(T1~T4)后不同小写字母表示同一时间不同温度处理间差异显著(P<0.05);平均值数据后不同小写字母表示某种物质在不同时间差异显著(P<0.05)。
不同小写字母表示同一时间不同温度处理同一物质含量占比差异显著(P<0.05)。
不同小写字母代表同一时间不同温度处理同一物质含量占比差异显著(P<0.05)。
同一列数据(T1~T3)后不同小写字母表示同一时间不同温度处理间差异显著(P<0.05);平均值数据后不同小写字母表示某种物质在不同时间差异显著(P<0.05)。
2.4 温度对烟草叶片细胞壁物质合成相关基因表达量的影响
由图4可知,温度对纤维素合成酶CESA1基因表达量有显著影响,各处理时间,CESA1基因表达量随温度升高明显上调表达,处理15 d时,T3、T4处理的基因表达量分别是T1处理的3.4倍、4.8倍,处理30 d时,T4处理的基因表达量达到T1处理的5.6倍。由图5可知,温度对半纤维素合成酶CSLA、CSLC、CSLE基因表达量的影响均较小。由图6可知,温度对木质素合成酶PAL1、4CL2基因表达量有显著影响,在不同温度处理下,PAL1基因表达量随温度降低而明显上调表达,处理30 d时,T1处理相对于T4处理的基因表达量上调2.8倍。4CL2基因表达量随温度降低而显著上调,处理后15 d、30 d时,T1处理相对于T4处理的基因表达量分别上调4.7倍、1.9倍。由图7可知,温度对果胶合成酶GAUT1、GAUT7基因表达量影响均较小。
同一列数据(T1~T4)后不同小写字母表示同一时间不同温度处理间差异显著(P<0.05);平均值数据后不同小写字母表示某种物质在不同时间差异显著(P<0.05)。
不同小写字母表示同一时间同一种合成酶基因不同温度处理间差异显著(P<0.05)。
不同小写字母表示同一时间同一种合成酶基因不同温度处理间差异显著(P<0.05)。
不同小写字母表示同一种合成酶基因同一处理时间不同处理温度间差异显著(P<0.05)。
不同小写字母表示同一种合成酶基因同一处理时间不同处理温度间差异显著(P<0.05)。
3 讨论
细胞壁物质含量与烟叶质量密切相关,细胞壁物质含量高,其烟气具有强烈的刺激性,呛咳、涩口且枯焦气和木质气重,影响烟叶吃味;适当降低烟叶细胞壁物质含量,转化为小分子量碳水化合物,能提高烟叶质量[2,13]。闫克玉等[14]的研究结果表明,在烤烟品种和烟叶产地相同的条件下,烤烟叶片细胞壁总物质含量、全纤维素含量、果胶质含量均随其等级的升高而减少,木质素含量随烟叶等级升高而略有升高,但变化甚微。刘春奎等[15]研究了烤烟叶片细胞壁物质的组成和含量,对烤烟叶片细胞壁物质与烟叶等级、部位、颜色、油分、物理特性、化学成分、评吸质量的关系进行了阐述。已有研究多是对烤后烟叶细胞壁物质组分的研究,但是关于叶片在生长发育过程中,细胞壁物质组分的含量和转化鲜有报道。本研究通过控制烟叶生长发育的温度这一主要限制因子[16],揭示了细胞壁物质组分响应温度的变化,研究结果表明,烟草叶片中几种细胞壁物质含量随生育进程的推进而逐渐降低,而非结构性碳水化合物(淀粉、总糖)含量变化不明显,表明随着生长发育的进行,烟叶品质趋于完善,这与烤后烟叶对细胞壁物质减少的要求是一致的。
植物生长过程中受到环境信号影响后,细胞壁特性会发生改变,从而改变其机械特性,这是植物对环境胁迫的响应[17]。Takahashi等[18]冷驯化诱导拟南芥细胞壁变化的研究结果表明,低温处理下细胞壁的组成结构发生变化,细胞壁总物质含量和果胶质、纤维素、半纤维素含量增加,但细胞壁总物质质量占莲座叶干质量的比例、各成分占细胞壁总物质含量的比例均无明显变化。在油菜叶片中,冷驯化反应与果胶含量的增加有关[10,19]。在热带植物凤梨中,与在25 ℃下生长的植物相比,在10 ℃和15 ℃下生长的植物果胶含量增加[9,20]。本研究结果表明,不同温度对烟草叶片细胞壁总物质含量无显著影响,但对不同细胞壁物质含量和占细胞壁总物质含量的比例有显著影响;叶片生长中后期,纤维素含量、纤维素含量占细胞壁总物质含量的比例整体上随温度升高而明显升高,木质素含量、木质素含量占细胞壁总物质含量的比例整体上随温度升高而明顯降低,不同温度处理下烟草叶片半纤维素含量、果胶含量和占比无显著差异。植物在低温下经过冷驯化后细胞壁物质总量增加,细胞壁孔径变小,对水的透性减小,这与细胞壁成分合成相关酶活性升高有关,其主要作用是增加细胞对冷冻脱水引起的塌陷的抗性[17]。本研究温度设置在烟草适宜生长的温度范围,可能导致细胞壁总量无明显变化。
温度变化影响糖类、淀粉等非结构性碳水化合物的积累。任雷等[21]研究发现,可溶性糖含量和果糖含量随温度的升高而增加,转化酶活性会随着温度的上升而升高,蔗糖含量、磷酸蔗糖合成酶(SPS)活性以及蔗糖合成酶(SS)活性随温度的变化趋势较为一致;张建波等[22]的研究结果表明,相比高温条件,低温条件更有利于移栽-团棵期和团棵-现蕾期淀粉的积累及腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)活性的提高。本研究结果表明,不同温度处理对非结构性碳水化合物含量有显著影响,叶片生长中后期,总糖含量随温度升高而明显升高,淀粉含量随温度升高而明显降低,与前人研究结果基本一致。
细胞壁响应环境的变化伴随着编码细胞壁修饰酶基因的表达。低温胁迫对纤维素合成酶基因的调控有显著影响,在棉花上的试验结果表明,低温(4 ℃)处理后纤维素合成酶的表达量下调了50%[23]。而在水稻耐冷基因型中,纤维素合成酶基因表达量在受冷48 h后上调了5~8倍[24]。木质素生物合成基因在低温反应中受到影响,在冷驯化过程中,通过加强木质素的合成参与细胞壁修饰,从而防止冻害[25]。CAD(肉桂醇脱氢酶)基因在甘薯和拟南芥中上调表达,以响应冷胁迫[26-27]。芒草耐霜冻基因型和甘蓝型油菜在低温冷驯化过程中PAL酶活性显著提高[28-29]。其他参与木质素生物合成的基因,包括PAL、CCR(肉桂酰辅酶A还原酶)、COMT(咖啡酸/5-羟基-阿魏酸-O-甲基转移酶),在豌豆和菜豆中也有应对寒冷胁迫上调表达的表现[30-31],这与响应低温胁迫时细胞壁的强化相伴而生。本研究发现,温度对烟草叶片细胞壁合成酶基因相对表达量有显著影响。纤维素合成酶基因CESA1随温度升高显著上调表达,木质素合成酶基因PAL1、4CL2随温度降低显著上调表达;这与其他作物對寒冷反应的基因表达试验结果基本一致,而温度对半纤维素、果胶合成酶基因的相对表达量影响较小。
植物对胁迫的反应是高度复杂的,取决于植物种类、基因型、胁迫的时间和强度等[32-33],因此很难在细胞壁结构中确定一种共同的应激反应模式[25]。烟叶在大田生长发育过程中内含物质的积累、品质的形成与细胞壁物质的具体关系还需进一步的研究。
参考文献:
[1] 于建军.卷烟工艺学[M].2版.北京:中国农业出版社,2009:13-23.
[2] 武圣江,宋朝鹏,许自成,等.烘烤过程中烤烟细胞壁生理变化研究[J].中国烟草科学,2010,31(3):73-77.
[3] 孙延国,马兴华,姜 滨,等.烟草温光特性研究与利用:Ⅱ.气象因素对山东主栽烤烟品种生长发育及产质量的影响[J].中国烟草科学,2020,41(3):44-52.
[4] BURTON R A, GIDLEY M J, FINCHER G B. Heterogeneity in the chemistry, structure and function of plant cell walls[J]. Nature Chemical Biology, 2010, 6: 724-732.
[5] 张保才,周奕华.植物细胞壁形成机制的新进展[J].中国科学:生命科学,2015,45(6): 544-556.
[6] 胡慧贞. 拟南芥纤维素合酶及纤维素合酶类似D基因家族生物学功能研究[D].武汉:华中农业大学,2017.
[7] 刘晓柱,李银凤,赵 燕,等.烟草纤维素合成酶1(CESA1)蛋白结构比较[J].作物研究,2019,33(4):284-291.
[8] 胡嘉祺. 融合基因4CL1-CCR对烟草细胞壁影响的研究[D].北京:北京林业大学,2020.
[9] WEISER R L, WALLNER S J, WADDELL J W. Cell wall and extensin mRNA changes during cold acclimation of pea seedlings[J]. Plant Physiology, 1990, 93: 1021-1026.
[10]KUBACKA-ZEBALSKA M, KACPERSKA A. Low temperature-induced modifications of cell wall content and polysaccharide composition in leaves of winter oilseed rape ( Brassica napus L. var. oleifera L.)[J]. Plant Science, 1999, 148(1): 59-67.
[11]LI R, ISLAM S U, WU Z, et al. Bensulfuron-methyl treatment of soil affects the infestation of whitefly,aphid,and tobacco mosaic virus on Nicotiana tabacum[J]. Frontiers in Plant Science, 2016, 7: 1970.
[12]LIVAK K J, THOMAS D S. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408.
[13]武圣江,李先锋,王国良,等.烟叶细胞壁和细胞超微结构研究进展[J].浙江农业科学,2010(1):15-18.
[14]闫克玉,闫洪洋,李兴波,等.烤烟烟叶细胞壁物质的对比分析[J].烟草科技,2005(10):6-11.
[15]刘春奎,蔡 佳,杨 靖,等.烤烟细胞壁物质与烟叶质量的关系研究[J].广东农业科学,2012,39(12):33-35.
[16]孙延国,马兴华,黄择祥,等. 烟草温光特性研究与利用Ⅰ:气象因素对山东烟区主栽品种生育期的影响[J]. 中国烟草科学,2020,41(1): 30-37.
[17]裴惠娟,张满效,安黎哲.非生物胁迫下植物细胞壁组分变化[J].生态学杂志,2011,30(6):1279-1286.
[18]TAKAHASHI D, GORKA M, ERBAN A, et al. Both cold and sub-zero acclimation induce cell wall modification and changes in the extracellular proteome in Arabidopsis thaliana[J]. Scientific Reports, 2019,9(1):2289.
[19]SOLECKA D, ZEBROWSKI J, KACPERSKA A. Are pectins involved in cold acclimation and de-acclimation of winter oil-seed rape plants?[J]. Annals of Botany, 2008, 101(4):521-530.
[20]CARVALHO C P, HAVASHI A H, BRAGA M R, et al. Biochemical and anatomical responses related to the in vitro survival of the tropical bromeliad Nidularium minutum to low temperatures[J]. Plant Physiology and Biochemistry, 2013, 71: 144-154.
[21]任 雷,鄒志荣,李鹏飞.不同温度对甜瓜糖分积累与蔗糖代谢酶的影响[J].北方园艺,2010(7):12-16.
[22]张建波,金云峰,王莎莎,等.生长温度对不同生育期烟草淀粉代谢的影响[J].生物技术通报,2016,32(5):200-211.
[23]ZHU Y N, SHI D Q, RUAN M B, et al. Transcriptome analysis reveals crosstalk of responsive genes to multiple abiotic stresses in cotton (Gossypium hirsutum L.)[J]. PLoS One, 2013, 8(11): e80218.
[24]ZHANG F, HUANG L Y, WANG W S, et al. Genome-wide gene expression profiling of introgressed indica rice alleles associated with seedling cold tolerance improvement in a japonica rice background[J]. BMC Genomics, 2012, 13(1): 461.
[25]GALL H, PHILIPPE F, DOMON J M, et al. Cell wall metabolism in response to abiotic stress[J]. Plants, 2015, 4: 112-166.
[26]SEKI M, NARUSAKA M, ISHIDA J, et al. Monitoring the expression profiles of 7 000 Arabidopsis genes under drought, coldand high-salinity stresses using a full-length cDNA microarray[J]. Plant Journal, 2002, 31: 279-292.
[27]KIM Y H, JEONG J C, LEE H S, et al. Comparative characterization of sweet potato antioxidant genes from expressed sequence tags of dehydration-treated fibrous roots under different abiotic stress conditions[J]. Molecular Biology Reports,2013, 40(4): 2887-2896.
[28]DOMON J M, BALDWIN L, ACKET S, et al. Cell wall compositional modifications of Miscanthuseco types in response to cold acclimation[J]. Phytochemistry, 2013, 85: 51-61.
[29]SOLECKA D, KACPERSKA A. Activity of L-phenylalanine ammonia-lyase in winter rape leaves treated with cold[J]. Acta Biochimica Polonica, 1993, 40(1): 113-118.
[30]BADOWIEC A, SWIGONSKA S, WEIDNER S. Changes in the protein patterns in pea (Pisum sativum L.) roots under the influence of long- and short-term chilling stress and post-stress recovery[J]. Plant Physiology and Biochemistry, 2013, 71: 315-324.
[31]BADOWIEC A, WEIDNER S. Proteomic changes in the roots of germinating Phaseolus vulgaris seeds in response to chilling stress and post-stress recovery[J]. Journal of Plant Physiology, 2014, 171( 6): 389.
[32]郑庆柱,谭海运,高 雪,等.干旱、盐胁迫及盐旱复合胁迫对青稞幼苗生理生化特性的影响[J].江苏农业科学,2020,48(1):97-103.
[33]杨 欢,李锦馨,姚爱彬,等. 3个茶用菊花品种应对碱胁迫的生理响应及耐碱性评价[J].南方农业学报,2020,51(12):2993-3003.
(责任编辑:陈海霞)
