氟苯尼考在北京油鸡体内残留变化规律研究
2022-03-10甘芝霖张星联杨曙明徐贞贞
米 璐, 甘芝霖, 王 雪, 张星联, 杨曙明, 邱 静, 徐贞贞,*
(1.中国农业大学 食品科学与营养工程学院/国家果蔬加工工程技术研究中心/农业农村部果蔬加工重点实验室/食品非热加工北京市重点实验室, 北京 100083;2.中国农业科学院 农业质量标准与检测技术研究所/农业农村部农产品质量安全重点实验室, 北京 100081;3.北京林业大学 生物科学与技术学院/林业食品加工与安全北京市重点实验室, 北京 100083)
北京油鸡是北京地区独有的肉蛋兼用的珍稀地方黄羽肉鸡品种,已有300余年的养殖历史,有凤头、毛腿和胡子嘴特征。公鸡头部高昂,羽毛色泽亮且鲜艳,多为黑色;母鸡体态较为敦实,头、尾略微翘,胫较短。相比于白羽肉鸡,北京油鸡在肉质性状、营养成分等方面存在得天独厚的优势[1],肌间脂肪分布好、肉质细腻且味道鲜美,深受消费者喜爱。氟苯尼考(florfenicol,FF),是一种动物专用型氯霉素类抗菌广谱药物,具有吸收好,体内分布广,抗菌效果好等特点;不同于已被欧盟[2]和我国列为禁用药的氯霉素(chloramphenicol,CAP),氟苯尼考不易产生耐药性且毒副作用低[3],被广泛用于治疗畜禽[4](猪、鸡、牛等)及水产[5](甲壳类动物、淡水鱼、海水鱼)等养殖动物的细菌性疾病。目前,有很多关于氟苯尼考的药代动力学研究,报道显示,不同的产品类型[6]、给药方式[7-8]、给药剂量[9]以及动物的健康状况[10]都会导致药物代谢差异。关于氟苯尼考在白羽肉鸡[11-12]和鸡蛋[13]中的残留消除规律已有较多报道,但是,氟苯尼考在北京油鸡体内的残留变化规律尚不明确,给食品安全问题埋下了隐患。本研究拟针对北京油鸡开展氟苯尼考残留变化规律研究,评估氟苯尼考残留标示物(以氟苯尼考和氟苯尼考胺之和计)在北京油鸡不同组织中的残留变化规律,探明其在北京油鸡中的残留消除时间,希望为北京油鸡中抗菌药氟苯尼考休药期的制定提供数据支撑。
1 材料与方法
1.1 试剂与材料
试剂:氟苯尼考粉(质量分数20%),广东大华农动物保健品股份有限公司;氟苯尼考标准品溶液(纯度99.9%)、氟苯尼考胺标准品溶液(纯度99.8%),美国A ChemTek公司;甲醇、甲酸,均为色谱纯,北京迪马科技有限公司;乙酸乙酯、正己烷,均为色谱纯,北京迈瑞达科技有限公司;乙腈,色谱纯,美国Thermo Fisher Scientific公司;氨水(质量分数25%),分析纯,北京化工厂;超纯水,Milli-Q一体化水净化系统制备。
标准溶液:氟苯尼考标准品母液(质量浓度10 μg/mL):准确量取1 mL质量浓度为100 μg/mL的氟苯尼考标准品溶液,用甲醇稀释至10 mL,-20 ℃保存。氟苯尼考胺标准品母液(质量浓度10 μg/mL):准确量取1 mL质量浓度为100 μg/mL的氟苯尼考胺标准品溶液,用甲醇稀释至10 mL,-20 ℃保存。 内标溶液(质量浓度1 μg/mL):分别准确量取100 μL氟苯尼考标准品母液、100 μL氟苯尼考胺标准品母液以及800 μL甲醇,混匀。
流动相:甲酸乙腈/水(质量分数为0.5%):准确量取2.5 mL甲酸,用乙腈/水[V(乙腈)∶V(水)=1∶4]溶液定容至500 mL。流动相A(质量分数为0.01%甲酸水):准确量取50 μL甲酸,用水定容至500 mL。
北京油鸡种鸡(110日龄)购自北京市畜牧兽医研究所,公鸡80只,平均体质量(1.92±0.32) kg;母鸡80只,平均体质量(1.73±0.45) kg。鸡体色均匀、体表无伤、活力好,进食正常,体质健康,随机抽检鸡肉及其前期食用饲料均无氟苯尼考给药残留。试验预饲2周,饲喂无抗饲料,自由饮水。在预饲期间,对照组每只公鸡平均日采食量为80 g,每只母鸡平均日采食量为76 g,给药组每只公鸡平均日采食量为72 g,每只母鸡平均日采食量为60 g。
1.2 仪器与设备
AcquityTMUltra Performance LC型超高效液相色谱仪,Waters公司;Triple QuadTM4500型三重四级杆质谱仪,美国爱博才思公司;TTL- DC Ⅱ型氮吹仪,北京同泰联科技发展有限公司;VX- Ⅲ型高速涡旋仪,北京踏锦科技有限公司;3K15型高速冷冻离心机,德国Sigma公司;分析天平,艾德姆衡器(武汉)有限公司;0.22 μm有机滤膜,安捷伦公司;1~10 μL、20~200 μL、100~1 000 μL可调微量移液器,Eppendorf公司;Milli-Q Advantage A10型纯水系统,德国Merck Millipore公司。
1.3 试验方法
1.3.1试验动物给药及样品采集
试验鸡随机分为4组,2组为给药组,2组为对照组。给药组公母各40只,对照组公鸡40只,母鸡33只(由于7只母鸡在试验过程中死亡,40只变为33只),试验前后各组饲养条件相同。试验鸡4只一笼,给药前分别称重,编号。本试验用鸡体质量较大,因此按照预饲期间的平均体质量和采食量对拌料浓度进行估算,确定氟苯尼考粉与饲料的拌料质量分数为2.5 g/kg。采用口服饲喂给药方式给北京油鸡用氟苯尼考粉,每隔24 h给药1次,连续给药5 d。参照《中国兽药典(2015年版)》,按照采食量和体质量计算给药组的氟苯尼考摄入量,公鸡21.6 mg/kg(以体质量计),母鸡21.4 mg/kg(以体质量计)。在给药前1 d停止喂料并采集组织样品为空白对照组。按采样时间点2.5 h、1、3、5、7、9、12、15、21 d时各屠宰6只公鸡(给药组4只、对照组2只)和6只母鸡(给药组4只、对照组2只),采集肌肉(鸡胸肉)、肾脏、肝脏组织后迅速降温,置于-20 ℃保存备用,同时取空白组织样品和血液为对照。
1.3.2检测分析方法
1.3.2.1 提取条件的确定
1)鸡胸肉、肝脏样品处理。样品自然解冻后,准确称取5.00 g(精确至0.01 g)已均质的鸡胸肉、肝脏样品于50 mL离心管中。向离心管中加入50 μL质量浓度为1 μg/mL内标溶液,涡旋10 s,再向其中加入15 mL乙酸乙酯和0.5 mL氨水,并加入1颗均质子,涡旋提取3 min,9 000 r/min离心5 min,转移上清液至另一个50 mL离心管中。按以上步骤重复提取一次,合并上清液。取6 mL上清液于15 mL离心管中,在50 ℃下氮吹至近干,待净化。
2)肾脏样品处理。样品自然解冻后,准确称取2.00 g(精确至0.01 g)已均质的肾脏样品于50 mL离心管中。向离心管中加入20 μL质量浓度为1 μg/mL内标溶液,涡旋10 s,再向其中加入6 mL乙酸乙酯和0.2 mL氨水,并加入1颗均质子,涡旋提取1 min,9 000 r/min离心5 min,转移上清液至另一个50 mL离心管中。按以上步骤重复提取一次,合并上清液。取6 mL上清液于15 mL离心管中,在50 ℃下氮吹至近干,待净化。
1.3.2.2 净化条件的确定
用1 mL 质量分数为0.5%甲酸乙腈/水[V(乙腈)∶V(水)=1∶4]溶液复溶,涡旋30 s,加入5 mL饱和正己烷,涡旋1 min,9 000 r/min离心2 min,弃去上层正己烷,收集下层清液。重复操作3次。取清液过0.22 μm微孔滤膜,吸取适量滤液至进样小瓶,待上机测定。
1.3.2.3 基质标准溶液的配制及测定
分别取对照组的各可食性组织(肌肉、肾脏、肝脏)作为空白样品,按1.3.2.1和1.3.2.2中步骤操作,得到的滤液用作备用液。用备用液将氟苯尼考和氟苯尼考胺标准溶液分别稀释成质量浓度为1、2、5、10、20、50、100 ng/mL的基质匹配标准溶液,上机进行超高压液相色谱串联三重四级杆质谱(ultra-performance liquid chromatography tandem mass spectrometry,UPLC- MS/MS)测定。
1.3.2.4 色谱和质谱条件的确定
1)色谱条件。色谱柱为C18(150 mm×3.0 mm,1.8 μm),流动相为质量分数0.01%甲酸水(A),乙腈(B),梯度洗脱条件为0~1 min,98%A,2%B;1~3 min,98%~2%A,2%~98%B;3~5 min,2%A,98%B,5~5.1 min,2%~98%A,98%~2%B;5.1~8 min,98%A,2%B,流速为0.4 mL/min,柱温30 ℃,进样体积为10 μL。
2)质谱条件。电喷雾(ESI+/-)离子源;扫描方式为正离子扫描(氟苯尼考胺、氟苯尼考胺- D3)和负离子扫描(氟苯尼考、氟苯尼考- D3)。质谱扫描方式为动态多反应离子监测(dMRM)。正离子扫描方式为气帘气35 psi,离子化电压5 500 V,离子源温度500 ℃,喷雾器50 ℃,辅助加热气50 ℃。负离子扫描方式为气帘气35 psi,离子化电压-4 500 V,离子源温度500 ℃,喷雾器50 ℃,辅助加热气50 ℃。氟苯尼考残留标示物(氟苯尼考和氟苯尼考胺)特征离子参考质谱条件见表1。
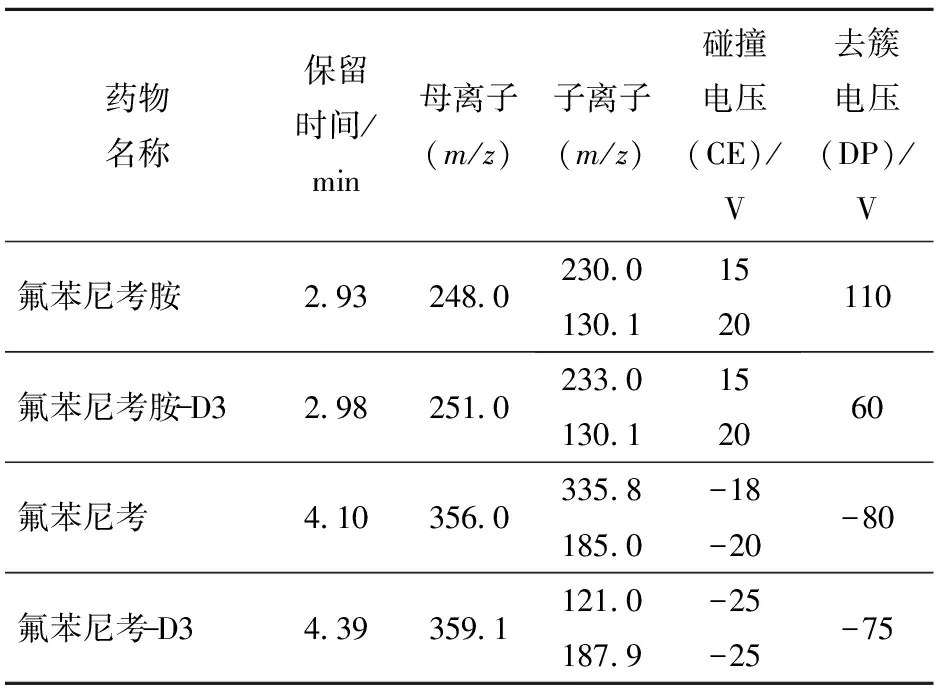
表1 特征离子参考质谱条件Tab.1 Optimized MS/MS parameters for drug
1.3.3方法的检出限和定量限的确定
添加一定质量浓度的标准溶液于空白样品(肌肉、肝脏、肾脏组织)中,按照1.3.2.1和1.3.2.2中步骤处理后进行UPLC- MS/MS测定,取信噪比为3和10时的浓度测出检出限(limit of determination,LOD)和定量限(limit of quantitation,LOQ)。
1.4 数据处理
除方法检出限和定量限的测定进行6次平行试验之外,其余试验均进行4次平行试验,数据以平均值±标准偏差表示。采用Excel 2010软件绘制基质标准曲线,采用Graphpad Prism 9软件绘制药物浓度变化曲线,采用WT 1.4软件进行休药期计算。
2 结果与分析
2.1 标准曲线、方法检出限和定量限分析
在已建立的质谱条件下,用UPLC- MS/MS法测定基质匹配标准溶液浓度,横坐标分别为氟苯尼考、氟苯尼考胺基质标准溶液的质量浓度,纵坐标为定量离子的色谱峰面积,得到的基质标准曲线回归方程见表2。由表2可知,标准曲线在样品质量浓度为2~100 ng/mL时具有良好线性关系,线性回归直线拟合优度的相关系数R2均大于0.99。氟苯尼考和氟苯尼考胺在北京油鸡各可食性组织中的LOD分别为0.5 μg/kg和1.0 μg/kg,LOQ分别为1.0 μg/kg和10.0 μg/kg;选择空白(肌肉、肝脏、肾脏组织)样品,在50 μg/kg添加水平下,按照1.3.2和1.3.3中步骤处理,计算得空白添加回收率为101.89%~109.43%,且该方法具有较高回收率[14]。结果表明,本试验采用的UPLC- MS/MS方法能满足氟苯尼考、氟苯尼考胺在北京油鸡各可食性组织(肌肉、肝脏、肾脏)的残留检测需要。

表2 方法学参数Tab.2 Methodological parameters
2.2 氟苯尼考在北京油鸡各可食性组织中的残留变化规律
氟苯尼考残留除原型药物之外,还存在氟苯尼考胺、氟苯尼考醇以及其他尚未明确的代谢物,其中,氟苯尼考胺为其主要代谢物。在动物体内,氟苯尼考的酰胺键断裂转化为无活性的代谢物氟苯尼考胺[14]。我国食品安全国家标准GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》[15]和欧洲药品管理局[16]确定的氟苯尼考在动物体内的残留标示物是氟苯尼考和氟苯尼考胺之和。
2.2.1氟苯尼考残留变化规律
停药之后,北京油鸡各可食性组织(肌肉、肝脏、肾脏)中氟苯尼考的残留变化情况如图1。由图1可见,停药后第2.5 h,北京油鸡肌肉组织中氟苯尼考残留量最高,在公鸡肌肉组织中残留可达(262.56±14.70) μg/kg,在母鸡肌肉组织中残留为(212.56±89.43) μg/kg。停药后第12 d,公鸡各组织中氟苯尼考残留均低于母鸡组织,在公鸡、母鸡肌肉组织中残留分别为(1.53±0.90) μg/kg、(2.25±0.85) μg/kg,肝脏组织中残留分别为(0.48±0.88) μg/kg、(1.51±2.09) μg/kg,肾脏组织中残留分别为(10.30±0.80) μg/kg、(1.79±2.01) μg/kg。停药后第21 d,仍能在肌肉组织中检测到氟苯尼考残留,其中公鸡肌肉组织中氟苯尼考残留量为(2.28±1.14) μg/kg,母鸡肌肉组织中氟苯尼考残留量为(1.30±0.70) μg/kg,而在肾脏和肝脏组织中氟苯尼考残留量低于LOD(图1)。氟苯尼考残留量在北京油鸡的公鸡和母鸡体内均呈下降趋势,其消除时间较为缓慢;氟苯尼考的残留量在肌肉组织大于肝脏组织,该现象与其他动物体内的变化规律一致[17],这是由于氟苯尼考药物通过脂溶性弥散进入细菌细胞内[18],作用于细菌70S核糖体的50S亚基达到杀菌目的,所以氟苯尼考在肌肉组织中残留较多。
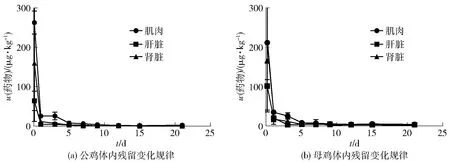
图1 氟苯尼考在北京油鸡体内各组织的残留变化规律Fig.1 Residue depletion curves of florfenicol from Beijing fatty chicken tissues
2.2.2氟苯尼考胺残留变化规律
停药之后,北京油鸡各可食性组织(肌肉、肝脏、肾脏)中氟苯尼考胺的残留变化情况如图2。停药后第2.5 h,氟苯尼考胺在北京油鸡肝脏组织中的平均残留量最高,公鸡可达(521.04±66.56)μg/kg、母鸡可达(781.46±496.00)μg/kg,之后依次是肾脏组织[公鸡(265.53±106.44)μg/kg、母鸡(177.62±76.12)μg/kg]和肌肉组织[公鸡(106.62±31.06)μg/kg、母鸡(64.28±26.25)μg/kg];停药后第12 d,在母鸡肾脏和肌肉组织以及公鸡肝脏、肾脏和肌肉组织中氟苯尼考胺的残留含量均低于LOD,仅能在母鸡肝脏组织中检测出氟苯尼考胺残留(图2)。氟苯尼考胺残留量在北京油鸡的公鸡和母鸡体内呈基本一致的趋势。研究可知,在药物代谢过程中,代谢产物氟苯尼考胺大都残留于肝脏组织中。肝脏中较高的药物残留量与前人的报道[19]相一致,该过程可能与药物的“首过效应”有关,在氟苯尼考口服吸收后,部分药物还未达到全身循环之前已经被肝脏代谢,从而导致其代谢物含量升高。
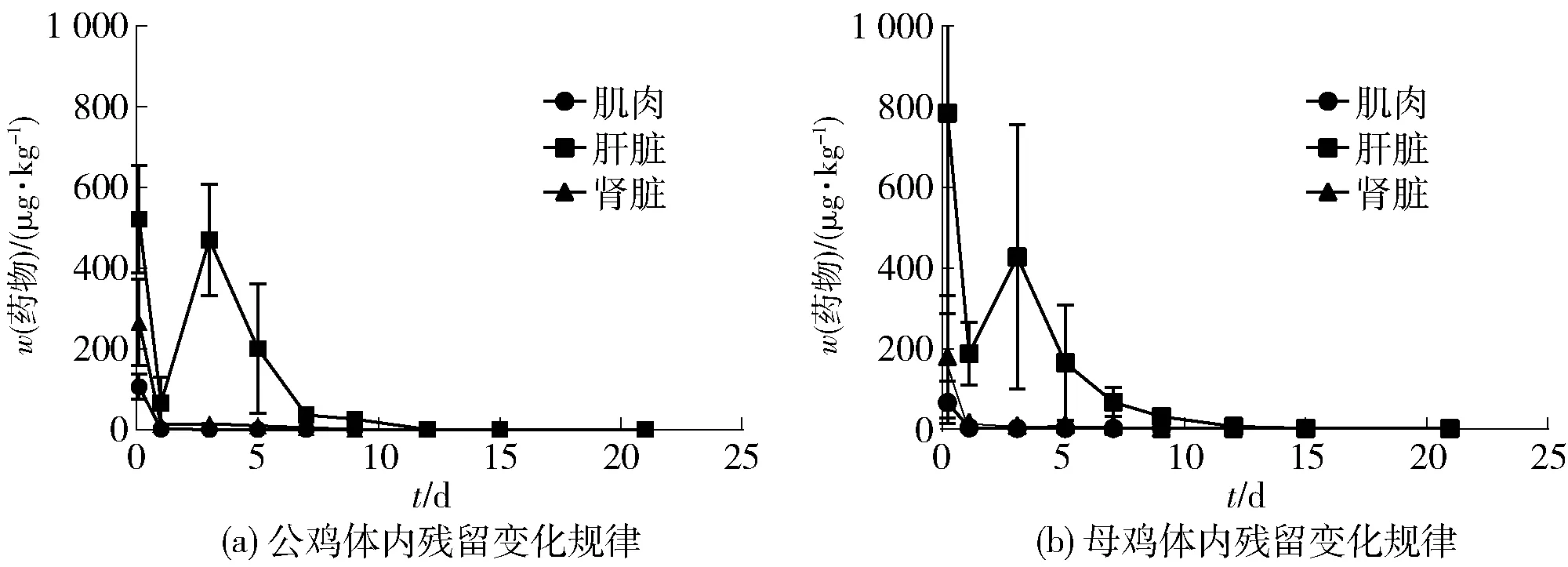
图2 氟苯尼考胺在北京油鸡体内各组织的残留变化规律Fig.2 Residue depletion curves of florfenicol-amine from Beijing fatty chicken tissues
2.2.3氟苯尼考残留标志物变化规律
停药之后,北京油鸡各可食性组织(肌肉、肝脏、肾脏)中氟苯尼考残留标志物(以氟苯尼考和氟苯尼考胺之和计)变化情况如图3。停药后第2.5 h,氟苯尼考和氟苯尼考胺在北京油鸡的肝脏组织中平均残留量最高,在母鸡的肝脏组织中残留峰值可达(881.88±278.90)μg/kg,在公鸡的肝脏组织中残留峰值也有(585.24±71.01)μg/kg,之后依次是肾脏组织[母鸡(343.13±97.97)μg/kg]、公鸡[(425.41±126.46)μg/kg]和肌肉组织[母鸡(276.83±115.65)μg/kg、公鸡(369.18±15.23)μg/kg];停药后第12 d,氟苯尼考胺残留基本不能检出,氟苯尼考残留标示物中只剩氟苯尼考存在残留(图3)。由于母鸡较高的脂肪含量且该药物的亲脂性,导致公鸡各组织中的氟苯尼考残留标志物低于母鸡各组织的现象出现。氟苯尼考残留标示物在肝脏组织中的变化程度比其在肾脏和肌肉组织中明显,此现象表明,肝脏为氟苯尼考药物在北京油鸡体内的主要代谢器官。
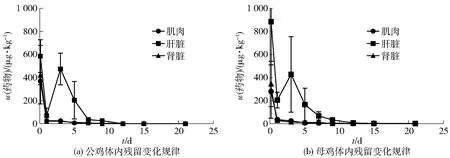
图3 氟苯尼考残留标志物在北京油鸡体内各组织的残留变化情况Fig.3 Residue depletion curves of florfenicol and florfenicol-amine from Beijing fatty chicken tissues
由于口服用药之后,氟苯尼考药物吸收迅速,在组织内分布广泛,在体内发生代谢转化为氟苯尼考胺等其他代谢物,氟苯尼考胺的残留上升。相比氟苯尼考,其代谢物氟苯尼考胺在北京油鸡的可食性组织中消除较快。同时,在北京油鸡体内出现类似于氟苯尼考在水产品[20]等中的“双峰现象”,该药物的代谢曲线也在停药后第2.5天和第3天出现了两个峰值,且最高峰值均出现在肝脏组织。“双峰现象”可能与肝肠循环、胃肠循环等动物体内循环以及该药物多部位吸收的特点有关。原药经过吸收、分散、代谢等原因被稀释[21-22],从而浓度降低,因此其在达峰值降低后会发生再次回升,该现象受动物类型、给药方式及实验条件等因素的影响。
2.3 氟苯尼考在北京油鸡体内休药期的计算
休药期是指动物停止给药到许可屠宰或它们的产品许可上市的间隔时间[23]。动物在此期间,药物在体内不断地代谢、消除和排出,直至低于最大残留量(maximum residue limit,MRL)。我国食品安全国家标准GB 31650—2019《食品安全国家标准食品中兽药最大残留限量》和欧洲药品管理局规定,氟苯尼考残留标示物在肌肉(鸡胸)、肝脏、肾脏中的MRLs分别为100、2 500、700 μg/kg。
采用WT 1.4软件,用北京油鸡鸡胸、肾脏、肝脏组织中氟苯尼考残留标示物的实测残留量计算休药期。结果显示,北京油鸡肝脏和肾脏组织中的氟苯尼考残留标示物总量均低于MRL值,因此采用北京油鸡肌肉(鸡胸)组织的氟苯尼考残留标示物总量计算休药期。在置信区间为95%时,推算氟苯尼考在北京油鸡的肌肉(鸡胸)中休药期为8.3 d;在置信区间为99%时,推算氟苯尼考在北京油鸡的肌肉(鸡胸)中休药期为11.4 d。结合休药期计算结果,建议氟苯尼考在北京油鸡体内的休药期不应低于12 d。
目前,我国的国家规定以及白羽肉鸡的研究报道的休药期均在一周之内。国家规定氟苯尼考可溶性粉在鸡体内休药期应不低于5 d[24]。Afifi等[11]在研究白羽肉鸡体内氟苯尼考残留消除规律时,尽管使用了多于本研究剂量[30 mg/kg(以体质量计)]的氟苯尼考药物,但是在停药后第3 d时,除了仅能在胆汁检测到氟苯尼考残留之外,其余组织和血浆样本中均未检出,该研究建议氟苯尼考在白羽肉鸡中的休药期不低于4 d。Anadn等[12]对白羽肉鸡连续3 d口服给药剂量为40 mg/kg(以体质量计)的氟苯尼考,分别以肾脏和肝脏为靶细胞,分析氟苯尼考残留消除情况,参照欧盟标准[16],建议休药期不少于6 d。北京油鸡与白羽肉鸡在生长周期[25]、胃肠道消化功能[26]、脂肪含量、营养成分等方面均存在较大差异。北京油鸡具有较慢的生长速度,并且不同肠道的结构和适应能力可能会影响药物吸收和滞留时间,使其药物代谢存在差异,导致氟苯尼考在北京油鸡体内的休药期明显长于白羽肉鸡,明显长于我国国家目前规定的休药期,这无疑会给该农产品的兽药残留抽检以及消费者安全带来影响。建议在之后的研究中对北京油鸡其他的给药方式加以验证,确保不同剂型、不同剂量的氟苯尼考药物有其对应的休药期;并且氟苯尼考在其他黄羽肉鸡体内的残留变化规律也需要深入研究,应根据品种差异选择合适的休药期,在生产过程中更加规范用药,从而确保食品安全。
3 结 论
本研究用口服饲喂方式给北京油鸡用氟苯尼考粉,使用UPLC- MS/MS法检测氟苯尼考残留标示物含量,发现该药物在北京油鸡体内组织分布广泛,且消除较慢,肝脏为氟苯尼考药物在北京油鸡体内的主要代谢器官。为满足我国食品安全国家标准GB 31650—2019《食品安全国家标准食品中兽药最大残留限量》的相关要求,建议氟苯尼考在北京油鸡养殖中执行的休药期应不低于12 d。希望本研究结果可为北京油鸡中抗菌药氟苯尼考休药期的制定提供数据支撑;同时为响应我国农业农村部开展的兽用抗菌药综合治理活动,规范用药,保障包括北京油鸡在内的黄羽肉鸡产业发展提供技术参考。
