富硒红曲米对高脂饮食小鼠脂代谢和肠道菌群的改善作用
2022-03-07张亚萍袁亚宏岳田利
张亚萍,袁亚宏,岳田利,2*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)(2.西北大学食品科学与工程学院,陕西 西安 710069)
近年来,以高血脂为代表的“三高”症状已成为一种日益年轻化的疾病,据卫生部门统计结果显示,自2012年以来,我国成年人的血脂异常总体患病率超过四成,6~17岁的儿童青少年群体中血脂异常总检出率高达 28.5%[1]。不合理的饮食结构是诱导血脂异常的主要因素之一,长期血脂水平过高会引发高脂血症、动脉粥样硬化等心脑血管疾病[2]。研究表明,肠道菌群可促进机体对营养物质的消化吸收,在宿主的能量代谢和免疫调节中发挥着重要作用[3],肠道菌群结构改变、功能失调与肥胖、心脑血管疾病之间也具有关联性[4,5]。相比于药物治疗,通过饮食改善肠道菌群的结构组成以恢复能量供需平衡,具有副作用产生率低、安全可控性强等优势。
硒作为人体必需的微量元素,具有抗氧化、增强免疫、保护心脑血管等有益生理功能[6]。但自然界中分布较广的为无机形态的硒,毒理活性强、体内吸收利用率低[7,8],使其开发利用受阻。红曲霉是一种优良的微生物富硒载体,通过微生物富集作用将亚硒酸钠等无机硒转化为硒蛋白或硒代氨基酸等有机硒[9,10],有效降低无机硒的毒副作用,提高硒的生物利用率。同时,红曲霉在固态发酵过程中,也会产生抑制胆固醇合成的洛伐他汀[11],相比于化学合成的他汀类降脂药物,生物合成途径获取的洛伐他汀具有更显著的降脂效果和较低的副作用产生率[12],因此被广泛应用于高血脂人群的膳食干预研究中。研究证实,红曲米的降血脂功效与肠道菌群组成的改变有关。Dong等[13]发现高脂饮食小鼠经红曲米干预后,血脂水平降低,肠道菌群结构改变,其中与血清TC和LDL-C呈正相关的Alistipes和Flavonifractor的相对丰度显著降低。Zhou等[14]发现由红曲米分离提取的红曲色素具有改善高脂血症的功效,模型组小鼠肠道中与脂质代谢和炎症参数呈负相关的菌属的相对丰度显著增加。
此外,硒与血脂水平、肠道健康之间也存在关联性。研究证实,适量补充有机硒可恢复脂代谢和肠道内环境稳态[15-17]。Sharma等[18]研究发现,膳食中摄入足量的硒可以优化宿主的肠道菌群,保护肠道免受外界不良刺激诱导的炎症损害和有害细菌侵染。Reid等[19]发现膳食中补充硒会影响宿主肠道菌群的组成,而肠道菌群也会影响硒的生物利用度。富硒红曲米是将红曲霉(Monascus)接种于添加亚硒酸钠的大米上经固态发酵制备的一种发酵食品。然而,人们对富硒红曲米在体内的降脂和肠道健康调节功效尚不明确。因此,本研究以高脂饮食小鼠为研究对象,探究富硒红曲米对其脂代谢和肠道菌群的影响作用,旨在为一种降血脂功能性富硒食品的开发应用提供理论依据。
1 材料与方法
1.1 实验材料
基础对照饲料、高脂饲料(饲料成分表见表1),江苏南通特洛菲饲料科技有限公司;食品级羧甲基纤维素钠(CMC-Na),上海源叶生物科技有限公司;总甘油三酯(TG)试剂盒、总胆固醇(TC)试剂盒、高密度脂蛋白胆固醇(HDL-C)试剂盒、低密度脂蛋白胆固醇(LDL-C)试剂盒,武汉塞维尔生物科技有限公司;红曲米、富硒红曲米均由本实验室制备所得(采用高效液相色谱法[20]测定洛伐他汀含量;采用紫外可见分光光度法[21]测定红曲色素含量;采用氢化物-原子荧光光谱法[22]测定总硒含量;采用柱前衍生化-高效液相色谱法[23,24]测定有机硒含量)。红曲米和富硒红曲米的主要成分及含量见表2。
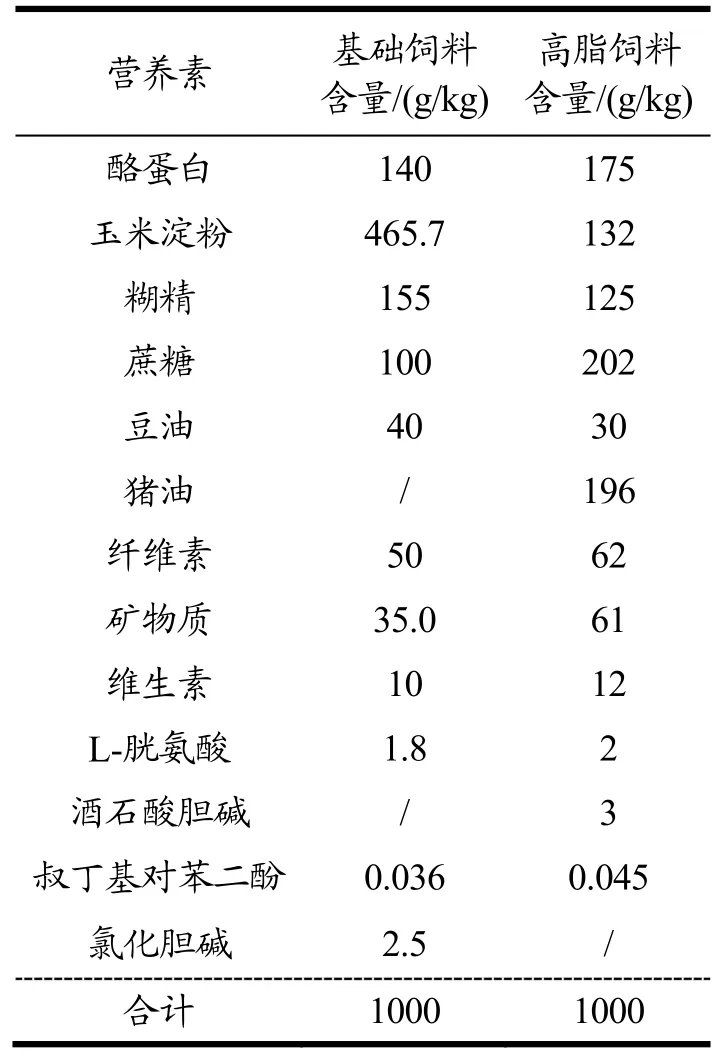
表1 饲料成分表Table 1 Feed composition table

表2 不同物质中主要成分含量Table 2 Content of main components in different products
1.2 实验仪器
ABI-9700 PCR仪,赛默飞世尔科技(中国)有限公司;KZ-II高速组织研磨仪,武汉塞维尔生物科技有限公司;D3024R台式高速冷冻离心机,大龙兴创仪器(北京)股份公司;Epoch-67酶标检测仪,美国伯腾仪器有限公司;Chemray-240全自动生化分析仪,深圳雷杜生命科学股份有限公司;BX-43电子显微镜,美国奥林巴斯公司。
1.3 红曲米及富硒红曲米混悬液的制备
(1)红曲米混悬液的制备流程:将红曲霉菌株CICC41601接种于PDA斜面培养基上,28 ℃恒温培养5 d。无菌条件下,将生理盐水注入菌种的斜面培养基上,用竹签将菌丝轻轻刮下,将洗脱液转移至装有玻璃珠的锥形瓶中,于28 ℃、120 r/min震荡30 min,使孢子均匀分布(孢子悬液浓度为106~107CFU/mL)。移取1 mL孢子悬液接种于100 mL PDB培养基中,于28 ℃、120 r/min培养48 h,获得种子扩大培养液。称取30 g籼米于250 mL锥形瓶中,加入蒸馏水将基质的初始含水量调节至 30%左右,自然 pH,浸泡过夜后,于121 ℃、高压灭菌15 min。取3 mL种子扩大培养液,接种于灭菌后的籼米上,用竹筷充分搅拌后,用透气封口膜将瓶口扎紧,于28 ℃恒温培养15 d。发酵结束后,将产物置于 50 ℃烘箱中烘干至恒重。将红曲米粉碎过筛(40目)后,以0.5%的CMC-Na制成质量浓度为9.4%的红曲混悬液,置于4 ℃低温、避光条件下密封储存。
(2)富硒红曲米混悬液的制备流程:将富硒驯化后的红曲霉菌株 CICC41601作为发酵菌株,用 20 μg/mL的亚硒酸钠溶液替代蒸馏水以调节基质的初始含水量,其他步骤与红曲米制备过程相同。将富硒红曲米粉末与0.5%的CMC-Na充分混合,分别制成质量浓度为 2.4%、4.7%、9.4%的富硒红曲混悬液,置于4 ℃低温、避光条件下密封储存。
1.4 动物分组及处理方法
48只6周龄雄性C57BL/6J小鼠(体重18~20 g),购于西安交通大学实验动物中心(实验动物生产许可证号:SCXK(陕)2020-001;实验动物使用许可证号:SCXK(陕)2020-005)。所有实验流程均按照《实验动物护理与使用指南:第八版》(ISBN-10:0-309-15396-4)执行,该实验规程已获取西北农林科技大学批准。适应性培养1周后,按体重水平随机分为 6组(n=8),根据不同物质中洛伐他汀含量确定各组小鼠的每日灌胃剂量:HFD-LSRYR和HFD-MSRYR 组分别为0.24 g/kg·BW、0.47 g/kg·BW(相当于洛伐他汀的人体推荐剂量的5倍、10倍),HFD-HSRYR组、HFD-RYR组均为0.94 g/kg·BW(相当于洛伐他汀的人体推荐剂量的20倍)。具体分组及处理方法见表3。
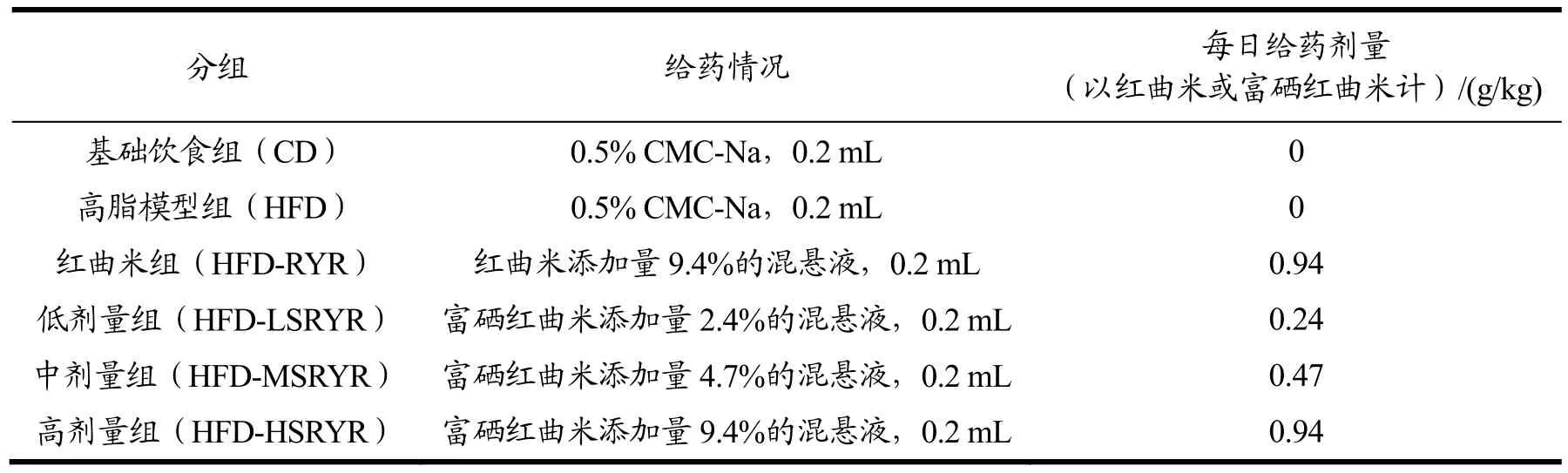
表3 动物分组及处理方法Table 3 Animal grouping and treatment methods
试验过程中,除CD组动物喂以基础对照饲料外,其余各组均喂以高脂饲料。试验期间,每天对试验动物灌胃一次,各组动物自由饮水,正常摄食。经过 8周的饮食干预后,对小鼠禁食12 h(不禁水)后麻醉、解剖。
1.5 血脂水平测定
对动物进行麻醉后,通过眼球取血法获取新鲜血液,在4 ℃下,以5000 r/min离心15 min以分离出上层血清,并将其转移至洁净的离心管中。置于液氮罐中冻存待测。采用试剂盒法通过全自动生化分析仪对小鼠血清中血脂生化指标(甘油三酯 TG、总胆固醇TC、高密度脂蛋白胆固醇HDL-C和低密度脂蛋白胆固醇LDL-C)含量进行测定。
1.6 肝脏组织的病理学观察
取出部分已去除表面血渍的新鲜肝脏组织,将其浸没于 4%的多聚甲醛溶液中,进行固定处理。然后通过石蜡包埋、切片、经苏木素伊红(HE)工作液染色处理后,封片。于电子显微镜下对不同组织进行病理学形态观察,并拍照记录。
1.7 肝脏组织的脂肪状态观察
取出部分已去除表面血渍的新鲜肝脏组织置于液氮罐中快速冷冻,用 OCT包埋胶(聚乙二醇和聚乙烯醇水溶性混合物)在冷冻好的组织表面进行包埋、切片。切片先经水洗、异丙醇浸洗,进行油红O染液染色处理,再经异丙醇分色、水洗,进行HE复染。最后,流水清洗以进行蓝化,蒸馏水洗后,弃去多余水分,封片。在电子显微镜下观察肝脏组织中脂肪堆积状态。
1.8 粪便的采集及送样
最后一天灌胃结束后,在无菌操作条件下,利用无菌离心管收集每组小鼠(n=8)的新鲜粪便,并立即放入液氮罐中冻存。将新鲜粪便样品送至上海美吉生物医药科技有限公司进行肠道菌群基因组提取及高通量测序处理。
1.9 动物肠道菌群分析
通过高通量测序技术[25]分析富硒红曲米对高脂饮食小鼠肠道菌群的影响:采用试剂盒法对小鼠粪便基因组DNA进行提取,紫外-可见分光光度法对DNA纯度及浓度进行测定,通过粪便菌群的16S rRNA的V3和V4区构建Miseq测序文库,使用的引物对序列为 : 338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。PCR 扩增体系:4 μL 5×FastPfu Buffer,2 μL dNTPs(2.5 mmol/L),0.8 μL 引物(5 μmol/L),0.4 μL FastPfu DNA聚合酶,0.2 μL BSA,10 ng样本基因组DNA模板,加入无菌的去离子水至20 μL。PCR反应条件:95 ℃反应 3 min;95 ℃反应 30 s,58 ℃反应 30 s,72 ℃反应45 s,循环数为29;72 ℃反应10 min。取PCR扩增后的产物3 μL通过2%琼脂糖凝胶电泳检测。采用Illumina测序平台进行测序,原始数据已存入 NCBI序列读档案(SRA)数据库中,将原始的 16S rRNA基因测序读数经过多路分解、质量过滤和合并,对具有97%相似性截止值的操作分类单位(ASV)进行了聚类、鉴定并去除嵌合序列,在 Majorbio I-Sanger Cloud在线平台上对数据进行分析。
1.10 数据处理及统计学分析
所有实验至少进行 3次,数据以均数±标准差(SD)表示。所有统计分析均采用GraphPad Prism 6.0软件进行,采用Duncan's检验计算统计学差异的显著性,p<0.05为显著,p<0.01为极显著。
2 结果与讨论
2.1 富硒红曲米对高脂饮食小鼠血脂水平的影响
各组小鼠的血脂水平变化如表4所示。与CD组相比,HFD组小鼠血清中的TG和TC分别显著上升了71.15%、66.82%(p<0.05),LDL-C水平显著增加了5.65倍(p<0.05),HDL-C水平显著降低了58.33%(p<0.05)。经口灌胃富硒红曲米混悬液可不同程度地改善高脂饮食小鼠的血脂异常症状。与HFD组相比,HFD-LSRYR组的血清 TC浓度显著下降了 13.92%(p<0.05);HFD-MSRYR组的血清TC和LDL-C浓度分别显著降低了20.17%、44.66%(p<0.05),HDL-C浓度显著提升了 71.43%(p<0.05);HFD-HSRYR 组的血清 TG、TC和 LDL-C浓度分别显著减少了26.97%、24.43%、49.03%(p<0.05),HDL-C 浓度显著增加了95.71%(p<0.05)。

表4 各处理组小鼠血脂水平(mmol/L)Table 4 Blood lipid levels of mice in each treatment group
随着富硒红曲米剂量的增加,小鼠血清TG、TC和LDL-C浓度下降,HDL-C浓度上升;与低剂量组相比,中剂量组的TG水平变化不显著(p>0.05);不同剂量组的TC水平变化无显著性差异(p>0.05);与中剂量组相比,高剂量组的HDL-C增加、LDL-C下降,但均不显著(p>0.05),可能是由于干预周期过短,不能充分凸显其降血脂活性。此外,与HFD-RYR组相比,HFD-HSRYR组小鼠血清中LDL-C含量显著降低(p<0.05),HDL-C水平上升,但不具有显著性差异(p>0.05)。结果表明,高脂饮食诱导小鼠血脂水平升高,导致脂代谢紊乱。富硒红曲米可改善高脂饮食小鼠的血脂异常症状,主要表现为降低血清TC水平,干预效果与剂量呈正相关。与红曲米相比,富硒红曲米通过显著降低 LDL-C水平调节高脂饮食小鼠的脂代谢。
研究表明,红曲米含有天然的降脂活性成分-洛伐他汀,其在体内与胆固醇合成反应过程的关键限速酶(HMG-CoA还原酶)形成竞争性抑制,从而抑制LDL-C的合成[26]。程慧敏[27]利用红曲对高脂饮食诱导的动脉粥样硬化模型小鼠进行膳食干预,12周后发现血清TC和LDL-C水平显著降低。除洛伐他汀外,红曲色素也是一类潜在的降脂活性物质。红曲色素中的红、黄、橙色素不仅能显著降低高脂饮食大鼠的血脂水平,而且对肝脏脂肪堆积症状也具有明显的缓解作用[14]。硒以硒代半胱氨酸的形式参与谷胱甘肽过氧化物酶的构成,能及时清除沉积于血管内壁上的自由基和脂质过氧化产物,避免血管阻塞。然而,缺硒会诱导血液中的胆固醇和甘油三酯水平上升,增加动脉粥样硬化的风险[28]。研究表明,饮食中增加有机硒蛋白的摄入可显著降低血清总胆固醇含量[29]。Zhou等[30]发现膳食生物硒可通过抑制 HMG-CoA还原酶的mRNA表达降低高脂饮食小鼠血清和肝脏中脂质水平。以上文献报道与本研究结果具有相似性,表明富硒红曲米的降血脂活性可能是由于有机硒和红曲中的洛伐他汀、色素的协同作用,而微生物富硒提高了富硒红曲米的有机硒含量,使其对高脂饮食诱导的胆固醇水平上升具有显著的抑制效果。
2.2 富硒红曲米对高脂饮食小鼠肝脏组织病理形态学的影响
各处理组小鼠肝脏组织切片的HE染色结果如图1所示。CD组的肝脏细胞形态完整,细胞核明显且居于中央,胞间排列紧密,轮廓清晰。HFD组的肝脏细胞明显肿胀,空泡化现象严重,细胞核偏移,胞间排列松散,轮廓模糊。与 HFD组相比,富硒红曲米高剂量组的改善效果较显著,表现为空泡化细胞数量明显减少,细胞肿胀化程度下降,细胞核回归到细胞中央位置。然而,红曲米组和富硒红曲米低、中剂量组相较于 HFD组,肝脏组织中空泡化细胞明显增多且空泡变大,可能是由于试验周期过短,红曲米和低、中剂量富硒红曲米对高脂饮食小鼠肝脏组织细胞结构的改善效果尚未显现。
各处理组小鼠肝脏组织切片的油红O染色如图2所示。HFD组小鼠肝脏组织中有大量的红色脂滴聚集,出现明显的脂肪肝症状。与 HFD组相比,红曲米组和富硒红曲米组小鼠的肝脏组织中红色脂滴面积明显变小,脂肪堆积现象显著改善。其中,富硒红曲米中、高剂量组抑制肝脏脂肪蓄积的作用明显优于低剂量组。然而,红曲米和富硒红曲米对肝脏脂肪分布的影响无显著差异,可能是由于灌胃周期过短,红曲米和富硒红曲米抑制肝脂质蓄积的作用还未完全凸显。
本研究结果表明,高脂饮食会诱导小鼠肝脏脂肪堆积,破坏肝脏细胞结构。富硒红曲米对高脂饮食小鼠的脂肪肝和组织损伤具有明显的改善作用。Zhou等[14]从古田红曲米中提取分离出红曲色素(MPs),对高脂饮食大鼠灌胃8周,观察到高脂饮食大鼠的肝脂质蓄积和脂肪变性症状有明显改善。李艳[31]探究了硒的浓度对高脂饮食大鼠脂代谢的影响,16周后观察肝脏病理切片,相比于对照组,中剂量硒组的脂滴空泡化和脂肪变性程度显著减轻。结合上述相似性文献报道及本实验结果得出,富硒红曲米对高脂饮食诱导的肝脏脂肪堆积具有显著的改善效果。
2.3 富硒红曲米对高脂饮食小鼠肠道微生物多样性的影响
Ace指数、Sobs指数、Chao指数均代表样本的物种丰富度,Shannon指数代表样本物种多样性。各处理组小鼠的肠道菌群物种多样性如图3所示。同CD组相比,HFD组的Ace指数、Chao指数和Sobs指数呈极显著下降(p<0.001),Shannon指数也显著降低(p<0.05)。与HFD组相比,随着富硒红曲剂量的增加,样本的Ace指数、Chao指数和Sobs指数呈显著上升趋势(p<0.05),其中HFD-HSRYR组的Ace指数、Chao指数和Sobs指数显著高于HFD组(p<0.05)。结果表明,高脂饮食会降低肠道菌群的物种多样性和物种丰富度,富硒红曲米对高脂饮食诱导的小鼠肠道菌群的物种多样性下降具有显著的改善作用。
Gao等[32]以红曲合生元、酵母硒及其复配组合对高脂饮食动物进行30 d膳食干预,与高脂对照组和单一物质组相比,红曲合生元和酵母硒复配组的肠道菌群多样性均显著增加,Ace指数和Shannon指数显著上升,由此推测红曲和硒可能对肠道菌群物种多样性的提升起到了协同作用。联系本研究得到的相似结果,表明富硒红曲米同样具有改善高脂饮食小鼠肠道菌群多样性的效果。
在 Venn图中,重叠区域代表各组样本的共有物种数目,未重叠区域表示该组样本的独有物种数目。由图4可知,七组共有物种数量为62,各组样本肠道菌群群落的独有物种数目不同。与CD组相比,HFD组独有物种数量由256减少至40。与HFD组相比,HFD-LSRYR组和HFD-MSRYR组的独有物种数目无明显变化,可能是由于灌胃干预周期过短,富硒红曲米对高脂饮食小鼠肠道菌群物种丰富度的改善效果还未凸显。HFD-HSRYR组的独有物种数目为 105,相较于HFD组,增加了1.63倍。与HFD-RYR组相比,HFD-HSRYR组的独有物种数目由57上升至105,增加了84.21%。由此可见,高脂饮食通过减少肠道菌群群落中的独有物种数目以降低小鼠肠道菌群的物种丰富度。与红曲米相比,富硒红曲米通过增加高脂饮食小鼠肠道菌群的独有物种数目以提高肠道菌群的物种丰富度。
2.4 富硒红曲米对小鼠肠道菌群组成的影响
基于门水平上,各组小鼠肠道菌群组成基本相同,如图5所示,按相对丰度大小排在前四位的优势菌门为厚壁菌门(Firmicutes)、疣微菌门(Verrumcomicrobiota)、变形菌门(Proteobicteria)、拟杆菌门(Bacteroidota)。在CD组小鼠肠道菌群中,Firmicutes和Bacteroidota作为主要的优势菌门,两者的相对丰度之和达到70%以上。与CD组相比,HFD组小鼠肠道中Firmicutes和Bacteroidota丰度明显改变,其中Firmicutes由30.84%增至80.09%,Bacteroidota由40.21%下降至3.91%,Firmicutes/Bacteroidota的比值显著上升。与 HFD组相比,各膳食干预组的Bacteroidota丰度无明显变化。Dong等[13]基于IlluminaHiSeq 16S rRNA基因测序技术研究了红曲米对高脂饮食小鼠肠道微生物群组成的影响,结果表明,在门水平上,红曲米干预后,小鼠肠道中 Firmicutes丰度显著降低,而 Bacteroidota丰度的变化无显著差异,这与本研究结果一致。以上研究结果表明,长期高脂饮食会对小鼠肠道菌群结构组成产生显著影响。
与高脂饮食组相比,富硒红曲米各剂量组和红曲米组的Firmicutes丰度均降低,Verrumcomicrobiota丰度均增加。对各处理组 Firmicutes和Verrumcomicrobiota丰度变化进行显著性差异分析,如图6所示。与HFD组相比,HFD-RYR和HFD-HSRYR组的Firmicutes丰度分别显著减少了24.84%、39.26%(p<0.05),而Verrumcomicrobiota丰度分别显著增加了 22.56%、36.09%(p<0.05)。HFD-LSRYR 和HFD-MSRYR组无显著差异(p>0.05),可能是由于干预周期过短,富硒红曲米对高脂饮食小鼠肠道Firmicutes和 Verrumcomicrobiota的调节作用尚未凸显。与HFD-RYR组相比,HFD-HSRYR组的Firmicutes显著减少了26.10%(p<0.05),Verrumcomicrobiota显著增加了46.59%(p<0.05)。Firmicutes相对丰度的增加会促进机体吸收热量、储存脂肪[33,34],这可能是诱导小鼠肥胖和血脂升高的原因之一。Verrucomicrobia相对丰度的减少会抑制机体的新陈代谢,诱导脂肪积累和血脂水平升高[34]。
结果表明,红曲米和富硒红曲米均有助于高脂饮食小鼠肠道中的 Verrumcomicrobiota增加,而对Firmicutes具有抑制作用。值得注意的是,与红曲米相比,富硒红曲米在改善高脂饮食小鼠肠道菌群结构组成方面具有更显著的效果。
在属水平上,各组小鼠肠道菌群的组成分布如图7所示。CD组小鼠肠道中相对丰度较高的菌属包括Akkermansia、Bifidobacterium、Lactobacillus等,HFD组小鼠肠道中优势菌属为Akkermansia、Romboutsia、Escherichia-Shigella等。已有研究证实,Bifidobacterium和Lactobacillus等肠道有益菌属通过增强肠道屏障预防病原菌的感染,维持肠道微环境稳态[35]。Escherichia-Shigella常见于能量代谢紊乱的动物或人群的肠道环境中,与细菌性痢疾具有一定的关联[36]。结果表明,高脂饮食会降低Bifidobacterium、Lactobacillus等有益菌属丰度,增加Escherichia-Shigella有害微生物,从而诱导小鼠肠道菌群结构紊乱。
与高脂饮食组相比,富硒红曲米各剂量组和红曲米组的Akkermansia丰度均上升。对各处理组Akkermansia丰度变化进行显著性差异分析,如图8所示。较HFD组相比,HFD-RYR、HFD-MSRYR和HFD-HSRYR组的Akkermansia丰度分别显著增加了23.92%、31.57%、36.93%(p<0.05),HFD-LSRYR组无显著差异(p>0.05),可能是由于剂量过小,富硒红曲米促进高脂饮食小鼠肠道Akkermansia的生长作用尚未凸显。与HFD-RYR组相比,HFD-HSRYR组的Akkermansia显著增加了44.01%(p<0.05)。Cicero等[37]发现膳食中补充红曲米后,高脂大鼠的肠道Akkermansia菌属显著上升,这与本研究结果一致。综合上述研究结果,表明富硒红曲米可通过提高Akkermansia菌属的相对丰度以改善高脂饮食小鼠肠道菌群的组成。
2.5 血脂指标与肠道菌群关联分析
采用相关性系数 Spearman评估小鼠的肠道微生物与血脂水平之间的关联性(蓝色代表负相关,红色代表正相关)。基于门水平上的关联性分析结果如图9所示,Firmicutes与TG呈极显著性负相关(p<0.01),与 LDL-C 呈 极 显 著 性 正 相 关 (p<0.01);Verrumcomicrobiota与 HDL-C呈显著性正相关(p<0.05),与LDL-C 呈极显著性负相关(p<0.01);Proteobicteria与 TC 呈显著性正相关(p<0.05),与HDL-C呈极显著性负相关(p<0.01);Bacteroidota与TG、TC和LDL-C呈负相关,但无显著差异(p>0.05)。
基于属水平上的关联性分析结果如图10所示,Escherichia-Shigella与 HDL-C呈极显著性负相关(p<0.01);Bifidobacterium与 HDL-C呈显著性正相关(p<0.05),与LDL-C呈极显著性负相关(p<0.01);Akkermansia与HDL-C呈显著性正相关(p<0.05),与LDL-C呈极显著性负相关(p<0.001)。基于高通量测序和代谢组学技术,Cicero等[27]发现膳食中补充红曲米后,高脂大鼠的肠道中所增加的Akkermansia菌属与血脂和肝脂质指标呈显著性负相关,这与本研究结果一致。
联系各组小鼠基于门水平和属水平上的肠道菌群丰度变化可知,高脂饮食可通过增加Firmicutes诱导小鼠血脂水平上升,富硒红曲米通过减少 Firmicutes并增加Verrumcomicrobiota和Akkermansia改善高脂饮食小鼠的脂代谢。
3 结论
本研究结果表明,富硒红曲米对高脂饮食诱导的血脂水平上升具有显著的抑制作用,其效果优于红曲米,具体表现为降低血清LDL-C含量。此外,富硒红曲米可显著增加高脂饮食小鼠肠道菌群的物种多样性,并通过显著降低Firmicutes(与血脂水平呈正相关)含量、增加Verrumcomicrobiota和Akkermansia(与血脂水平呈负相关)含量抑制高脂饮食诱导的血脂水平上升,改善脂代谢紊乱症状。综上,富硒红曲米具备红曲米和有机硒的双重功能,发挥的作用大于两者,具有较好的体内降血脂作用,该结论为富硒红曲米作为降脂功能性保健食品的开发和临床应用提供了一定的理论依据。然而,富硒红曲米中硒的释放路径以及硒增强降血脂活性的分子机制还有待后续深入探究。
