牛脂肪间充质干细胞对金黄色葡萄球菌生长的影响
2022-03-04杜珍珍司琳清李旭阳徐郑美袁思琦金吉东原冬伟付世新周玉龙鲁文赓
杜珍珍,司琳清,李旭阳,徐郑美,袁思琦,金吉东,原冬伟,付世新,周玉龙,鲁文赓
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江省牛病防制重点实验室;3.科菲特饲料(长春)有限公司)
间充质干细胞(MSCs)来源于发育早期的中胚层,其在上世纪70年代被Friedenstein教授首次发现并分离培养[1],它在1991年才被美国克利夫兰西地大学Caplan教授正式命名为间充质干细胞。而脂肪间充质干细胞是Zuk PA等[2]首次从脂肪血管周围分离培养出来。
间充质干细胞是成体干细胞,是一类具有自我增殖能力、多谱系分化潜能、免疫调节和修复组织损伤的多能干细胞。MSCs可以从脂肪组织和骨髓等组织器官中分离出来。它在特定条件下可以转变成为一种或多种机体组织或器官的细胞,如心肌细胞,胰腺细胞等[3],其已在多种种属动物中成功分离并进行研究,如小鼠、猪、犬、奶牛等。由于间充质干细胞特殊的生物学特性,使得其成为研究热点。脂肪间充质干细胞具有获取容易、免疫原性低、无医学伦理争议等优点,使其成为了MSCs的重要来源。多种来源的MSCs都具有免疫调节能力,如骨髓来源MSCs、以及脂肪来源MSCs等,可以调节多个免疫系统的功能。为了发挥这种作用,MSCs必须被激活。MSCs可以抑制DC的成熟,从而抑制T淋巴细胞的过度活化,并可以降低NK细胞的增殖和细胞毒性。由于这些特性,MSCs疗法成为了在免疫相关疾病中具有潜力的替代疗法。MSCs已用于临床前和临床研究以治疗疾病,例如阿尔茨海默症(Alzheimer’s disease,AD)[4]、脓毒血症(Sepsis)[5]、多发性硬化(Multiple Sclerosis,MS)[6]和乳腺癌(breast cancer,BC)[7]的研究。目前,间充质干细胞已在各领域取得重大的研究成果,包括其在血液恶性疾病[8]、乳腺癌[9]、肺损伤[10]、心肌损伤[11]、肝癌[12]等的研究。间充质干细胞不但拥有自我更新、多向分化、免疫调节功能,其还具有抗炎、抗氧化、促进损伤修复的作用[13],其中旁分泌作用在近年来受到大量研究者广泛关注及研究。
乳腺炎是一种炎症反应,其威胁着乳制品的安全与卫生,更是严重威胁动物福利。奶牛乳房感染是奶牛疾病中损失最大的疾病[14],其特征是损伤了乳腺组织。这通常是由细菌感染引起的,全年均可发生,有明显的季节性,不同的国家和地区奶牛乳腺炎的发病率也存在一定的差异。在国外,经过多方面调查,人们(奶农及兽医)认为奶牛乳腺炎是奶牛最疼痛的疾病,并将其按照疼痛等级进行划分(10分制),其中轻度乳腺炎为3,中度乳腺炎为5.7,重度乳腺炎为7.6[15]。当动物患乳腺炎时,动物行为异常,采食及运动次数减少,躺卧时间延长,乳房红肿等[16]。引起奶牛乳腺炎的病因较多,如病原菌的感染,环境因素,饲养管理不当,牛体自身因素,遗传因素,其他疾病影响。其中病原微生物的感染是奶牛乳腺炎主要的发病因素。多种不同的细菌和真菌都可引起乳腺炎,革兰氏阴性大肠杆菌常常引起急性炎症,最终导致严重的乳腺炎[17],革兰氏阳性菌如金黄色葡萄球菌、乳房链球菌、无乳链球菌[18]则可能引起持续的、慢性的感染,引起轻度炎症[19]。在很大程度上,针对这些病原体及物种的不同其宿主防御反应的潜在机制也尚不清楚,持续的感染会导致严重的经济损失,由于这些细菌病原体在农场之间分布不同,并且根据病原体的特征,奶牛进行有效免疫反应的能力也有所不同。因此,了解哪些病原体可以引起奶牛发生乳腺炎,其对研究奶牛机体的有效免疫防护机制是非常重要的。
乳腺炎的历史发展要从1947年,Murphy等[20]证实乳腺炎是由病原体入侵生物体导致的结果,随后即是IMI的建立和炎症的发展。在此之间,几乎所有的奶牛乳腺炎都是由无乳链球菌和金黄色葡萄球菌引起的,根除病原菌是治疗奶牛乳房炎重要的靶点,所以大多数治疗方案最初都是针对这些病原体而研发的。这些治疗推动了应用抗生素治疗奶牛乳腺炎的发展,使得常规使用抗生素治疗乳腺炎的方法得到了认同[21]。由于无乳链球菌和金黄色葡萄球菌在1980年受到控制,但奶牛乳腺炎的患病率仍然很高,研究人员经研究调查发现大肠杆菌及金黄色葡萄球菌引起的乳腺炎开始变得越来越普遍。并且随着抗生素的滥用,使得金黄色葡萄球菌性乳腺炎在治疗中发生了抗生素耐药性,因此严格控制抗生素治疗对奶牛乳腺炎是非常重要的。
在奶牛乳腺炎中最常见的病原体是大肠杆菌与金黄色葡萄球菌。革兰氏阴性细菌释放的脂多糖(LPS)被认为是奶牛乳腺上皮细胞炎症的重要刺激因素[22],可引起奶牛乳腺发生免疫反应和炎症。乳腺上皮细胞是乳腺中的主要细胞类型,它可以通过激活各种模式识别受体(PRR),Toll-like受体(TLR)和核苷酸寡聚域等,将LPS与病原体相关的分子模式分子结合[23]。通常,LPS与TLR或NLR的结合可导致顺序的转录调节级联反应,从而导致炎症。核因子-κB(NF-κB)是与奶牛乳腺炎发展相关的炎症关键调节因子,它还是TLRs和其他免疫受体的下游信号分子。LPS诱导的经典TLR4/NF-κB通路的激活会导致促炎细胞因子如IL-1β,肿瘤坏死因子-α(TNF-α)和IL-6的上调,这些炎性介质参与细胞稳态,并具有全身作用[24]。
当病原体侵入奶牛乳房时,可引起局部针对病原微生物的先天免疫防御系统。乳腺上皮除了具有生产牛奶的功能外,乳腺上皮还配备了一系列感受器,可检测病原体的分子成分,乳腺上皮细胞已被证实能够启动对病原菌的体外先天免疫应答[24]。在这些模式识别受体(PPR)中,哺乳动物中已经详细的描述了13种不同的TLR[25]。如TLR2与金黄色葡萄球菌的相互作用可导致各种细胞内信号传导途径如NFκB和MAPK迅速而协调地激活[26]。NF-κB和MAPK信号通路负责调节细胞因子,趋化因子的表达,是炎症过程中必不可少的免疫介质[27]。在先前的硒对脂多糖诱导的乳腺上皮细胞研究中,表明在用LPS处理细胞后,硒对乳腺上皮细胞产生有益作用,是因为硒可以通过抑制NF-κB和MAPK活化来抑制LPS诱导的乳腺上皮细胞的炎症反应[28]。而在另一项研究中,将TNF-α刺激MAC-T细胞作为炎症模型,TNFα对MAC-T细胞中的炎症作用也是通过促分裂原激活蛋白激酶(MAPK)信号传导途径介导的,该信号通路涉及c-Jun N-末端激酶(JNK),细胞外信号调节激酶(ERK)和p38[29]。研究表明所有这三种MAPK的蛋白磷酸化均会刺激趋化蛋白的释放,从而触发免疫细胞从血液向乳腺的迁移[29]。
在奶牛乳腺炎的治疗中常常可见患病牛表现出牛奶或奶牛自身可见的异常,病牛的牛奶必须弃去。在农场中,大多数的乳腺炎病例仅表现为轻度(牛奶异常)或中度症状,治疗人员对这些不严重症状通常不及时进行治疗[30]。在国内目前常使用中药、抗生素、皮质类激素、细菌素、有益菌、物理疗法等方法进行治疗。且国内农场在临床中治疗乳腺炎时,轻微的乳房发红症状,会常被忽略,当症状进一步加重时,会采取以上的方式进行治疗。乳腺炎是常见病,但治疗的效果却大不相同,抗生素的广泛使用,使得多数乳腺炎病例耐药性明显增加,多数乳腺炎在治愈后常常导致奶牛泌乳能力极度下降,乳腺受损严重,且易复发,针对此后遗症,目前国内还没有效果显著的治疗方案。在北美,大多数非严重乳腺炎的治疗均由农场工人进行,兽医监督。对此病的治疗也是使用抗生素治疗,旨在控制乳腺的细菌感染。然而,这种方法并不总是有效的,抗生素使用不当可能导致细菌耐药性。青霉素抗性可能是金黄色葡萄球菌最广为人知的抗生素耐药性,各国之间的水平差别很大,从20%到30%甚至超过85%不等[31]。此外,抗生素治疗不会促进奶牛乳腺组织的再生,因此,奶牛乳腺炎的治疗变愈加困难。
MSCs在人类疾病的治疗中,在损伤修复、肿瘤、炎症方面已进行了大量的研究。但是MSCs对于奶牛产业上的研究报道却比较少。据报道Berly等[31]在2019年发表了关于牛胎儿间充质干细胞条件培养基对引起乳腺炎的病原体金黄色葡萄球菌抗增殖作用,他们利用胎牛骨髓来源的MSCs的条件培养基对金黄色葡萄球菌的体外抗菌潜力进行了评估,得出了来自胎牛骨髓间充质干细胞条件培养基在体外条件下具有平均降低约30%金黄色葡萄球菌相对生长的能力。这些都表明了MSCs抑菌应用的潜力。而成年奶牛脂肪间充质干细胞对于金黄色葡萄球菌的作用尚不明确,因此,对成年奶牛脂肪来源的间充质干细胞对奶牛乳腺炎病原体金黄色葡萄球菌的作用进行了研究,为寻找安全可开发的制剂去替代抗生素的治疗方法提供更多的参考。
1 材料与方法
1.1 主要试剂
金黄色葡萄球菌菌株来自临床奶牛乳腺炎病例的乳样品;TSB培养基(美国BD公司);营养琼脂(北京奥博星生物技术有限公司);胎牛血清(四季青);P/S(碧云天);DMEM/F12(Thermo Fisher Scientific,Grand Island,NY);0.25%胰酶(中国,北京索莱宝);奶牛脂肪间充质干细胞(实验室原代提取[11])
1.2 金黄色葡萄球菌的纯化与鉴定
取乳腺炎病例奶牛的乳样,在4℃离心机中离心15 000 xg,1 min,弃除上层乳脂乳蛋白,将沉淀接种于营养琼脂中培养24 h。挑选出金黄色葡萄球菌菌落,在37℃恒温摇床中摇菌18 h,进行1010倍比稀释,取100 mL涂于固体营养琼脂板中培养24 h。根据金黄色葡萄球菌生长状态及特征,挑取单个菌落,进行革兰氏染色镜检,镜下观察细菌形态,判断其纯化情况。
1.3 奶牛脂肪间充质干细胞与金黄色葡萄球菌的复苏
将液氮中第3代的奶牛脂肪间充质干细胞在37℃水浴锅中快速复苏。取含1%P/S、10%FBS胎牛血清的DMEM/F12培养基对冻存管内的细胞进行复苏。1 000 xg,离心3 min,调整细胞密度至1×105/个·mL-1复苏于10 cm培养皿内。每24 h更换一次培养液,当细胞融合率达到80%~90%时,进行传代。
金黄色葡萄球菌从-80℃超低温冰箱中取出,在37℃水浴锅中快速复苏。4℃离心机中15 000 xg,离心1 min,弃除金黄色葡萄球菌离心后上清液,取金黄色葡萄球菌接种于营养琼脂中,培养18~24 h,挑取单个菌落在37℃恒温摇床中摇菌18 h,制成一级菌液,继续取1%金黄色葡萄球菌菌液接种于新的液体TSB培养基中,于37℃恒温摇床中摇晃18 h,制成二级菌液备用。
1.4 金黄色葡萄球菌群落数的确定
取震荡培养18 h的二级菌液1 mL,经PBS洗两次,4℃离心机中15 000 xg,离心1 min,弃上清,用1 mL PBS重悬金黄色葡萄球菌。并加入到比色皿中,分光光度计测OD600nm值。进行倍比稀释,取100 mL金黄色葡萄倍比稀释菌液进行涂板培养18~24 h后,对金黄色葡萄球菌进行菌落计数。
1.5 金黄葡萄球菌生长曲线的测定
根据最终金黄色葡萄球菌菌落数的确定,在含10%FBS的DMEM/F12培养基中加入300 CFU金黄色葡萄球菌,分别培养2、4、6、8、10、12、14、16、18 h后,在不同时间段测量金黄色葡萄球菌的OD600nm值,根据金黄色葡萄球菌培养时间点为横坐标,OD600nm值为纵坐标绘制生长曲线。
1.6 奶牛脂肪间充质干细胞与金黄色葡萄球菌共培养
将融合度达80%~90%的奶牛脂肪间充质干细胞以2×105个·mL-1的细胞数接种于24孔中的一个孔内,取培养24 h上清液后,更换为新的DMEM/F12(10%FBS,无双抗)培养基。将奶牛脂肪间充质干细胞培养24 h上清液进行离心15 000 xg,1 min,取上清备用。将实验分为三组,无细胞DMEM/F12培养基组(10%FBS,无双抗),奶牛脂肪间充质干细胞组,无奶牛脂肪间充质干细胞的细胞培养后上清液组。在24孔中的每个孔中各加入1 mL培养体系,每个孔内加入300 CFU的金黄色葡萄球菌共培养12 h后,取100μL培养物涂于固体营养琼脂板中,培养18~24 h后计数金黄色葡萄球菌菌落数。
1.7 统计与分析
所有实验进行3次重复,将金黄色葡萄球菌体外增殖情况数据用GraphPad Prism 5.0(加利福尼 亚州圣地亚哥的GraphPad InStat软件)进行分析,进行正态性测试。并通过单向ANOVA比较每个重复的平均值。使用Tukey多重比较检验分析实验组和对照之间金黄色葡萄球菌的相对生长,然后进行方差齐性校正。结果用平均值±SEM来表示。P<0.05认为具有统计学意义。
2 结果与分析
2.1 金黄色葡萄球菌鉴定
眼观:培养24 h的金黄色葡萄球菌菌落呈现圆形或椭圆形扁平状菌落,菌落颜色呈现金黄色(图1B)。镜检:对金黄色葡萄球菌菌落进行革兰氏染色油镜镜检,革兰氏染色结果呈现蓝紫色,为阳性,细菌呈现球状均匀分布(图1A)。
2.2 金黄色葡萄球菌的菌落数确定
实验结果显示金黄色葡萄球菌在TSB培养基中摇菌18 h,OD600nm=0.5进行1010倍比稀释时,金黄色葡萄球菌为2.42×1011CFU·mL-1(图2)。

图2 金黄色葡萄球菌OD600 nm值与其菌落数Fig.2 Staphylococcus aureus OD600nm value and its colony number
2.3 金黄色葡萄球菌生长曲线测定
当金黄色葡萄球菌在DMEM/F12(10%FBS,无双抗)中培养2~10 h时,细菌测得的OD600nm的OD值无较大变化,当培养12 h时细菌达到对数生长期,金黄色葡萄球菌快速增殖,而18 h时仍处于对数生长期(图3)。
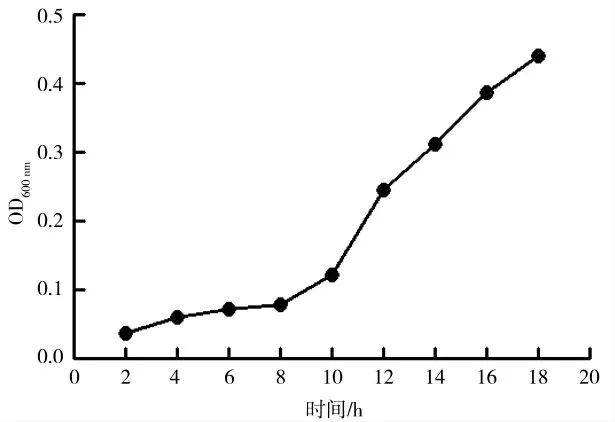
图3 金黄色葡萄球菌在细胞用培养基DMEM/F12中的生长曲线Fig.3 Growth curve of Staphylococcus aureus in cell culture medium DMEM/F12
2.4 奶牛脂肪间充质干细胞与金黄色葡萄球菌共培养结果
金黄色葡萄球菌与奶牛脂肪间充质干细胞共培养12 h,从培养体系中取出100 mL进行涂板,结果显示与DMEM/F12对照组相比,奶牛脂肪间充质干细胞显著抑制金黄色葡萄球菌体外增殖(*P<0.05)(图4A、B),而奶牛脂肪间充质干细胞培养上清液对金黄色葡萄球菌的生长抑制作用极显著(***P<0.001)(图4C)。而与奶牛脂肪间充质干细胞相比,奶牛脂肪间充质干细胞培养24 h上清液对金黄色葡萄球菌体外增殖较为显著抑制(**P<0.01)(图4B、C)。成体奶牛脂肪间充质干细胞有显著的抑制金黄色葡萄球菌体外增殖的作用(图4D)。
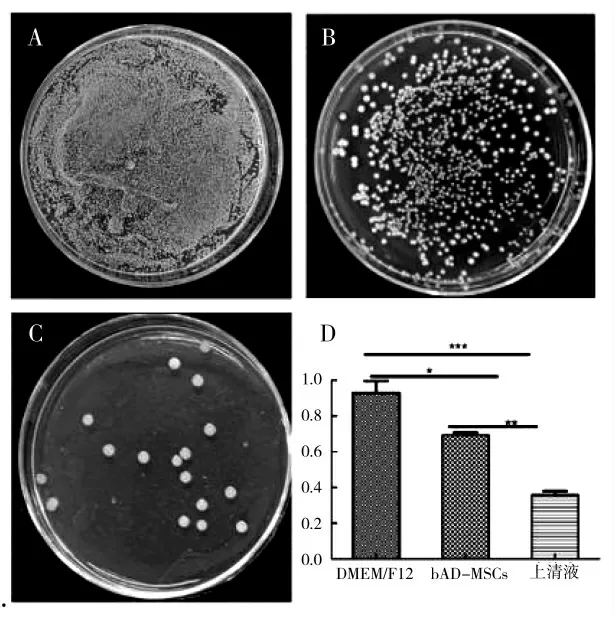
图4 成体奶牛脂肪间充质干细胞与金黄色葡萄球菌共培养后金黄色葡萄球菌体外增殖情况Fig.4 In vitro proliferation of Staphylococcus aureus after co-culture of adult dairy cow adipose-derived mesenchymal stem cells and Staphylococcus aureus
3 讨论
实验中应用的成体奶牛脂肪间充质干细胞来自实验室先前进行原代提取的细胞[32]。在以前的研究中报道了胎牛脂肪间充质干细胞与骨髓来源的间充质干细胞浓缩上清培养液具有抑制金黄色葡萄球菌的作用[31],而在研究中未浓缩的成体奶牛脂肪间充质干细胞也表现出与胎牛脂肪间充质干细胞相似的抑制细菌体外增殖的能力,这可能与细胞的状态,细胞的数量及细胞的分泌能力有关,而实验中应用的奶牛脂肪间充质干细胞活性较好,旁分泌能力强,对金黄色葡萄球菌的抑制能力也较强。除此之外,为证明奶牛脂肪间充质干细胞对金黄色葡萄球菌的生长影响,实验应用从临床奶牛乳腺炎病例乳样本中分离出来的金黄色葡萄球菌进行研究,并根据金黄色葡萄球菌的生长特征及革兰氏染色进行了鉴定,确定了分离出细菌的为金黄色葡萄球菌,并进行了下一步研究。为了进一步的实验研究,首先确定金黄色葡萄球菌在TSB培养基中的菌落数与OD600nm值,得出金黄色葡萄球菌在培养18 h时菌落数为2.42×1011CFU,根据OD600nm值与菌落数,计算出300 CFU的金黄色葡萄球菌。其次将金黄色葡萄球菌加入到DMEM/F12培养基中,测定金黄色葡萄球菌在DMEM/F12中的生长曲线,结果发现金黄色葡萄球菌在DMEM/F12培养基中培养12 h时达到对数生长期。当金黄色葡萄球菌在DMEM/F12培养中培养至对数生长期时,细菌活性及增殖能力较强。当将金黄色葡萄球菌加入到奶牛脂肪间充质干细胞共培养体系中时,金黄色葡萄球菌进入到了新的培养体系,继续进行新的生长增殖过程。因此,选用培养12 h时达到对数生长期时的金黄色葡萄球菌来研究奶牛脂肪间充质干细胞对它的体外增殖影响。结果显示成体奶牛脂肪间充质干细胞表现出了抑制金黄色葡萄球菌体外增殖的能力,这可能是奶牛脂肪间充质干细胞在培养12 h时已经分泌了抑制金黄色葡萄球菌的抗菌肽。在以前的研究中,报道了人间充质干细胞对于大肠杆菌、化脓性链球菌等增殖的影响,得出当间充质干细胞在遇到细菌时,其激活了间充质干细胞分泌抗菌肽的能力[17]。而在实验中,奶牛脂肪间充质干细胞培养24 h上清液组表现出比奶牛脂肪间充质干细胞组更为显著的抑制细菌体外增殖的能力,推测可能是奶牛脂肪间充质干细胞在培养24 h时已经分泌了足够的某种抗菌肽,这种抗菌肽在奶牛脂肪间充质干细胞培养12 h时的表达没有比奶牛脂肪间充质干细胞培养24 h时分泌的多,这可能是脂肪间充质干细胞培养上清液组抑制细菌体外增殖的主要原因。目前为止,得知间充质干细胞具有分泌β-防御素,bBD4A,NK-1等抗菌肽[33],而在研究中并未对其进行检测。但实验中奶牛脂肪间充质干细胞的这种抑制细菌体外增殖的能力,推测也是因其分泌了某种抗菌肽而产生的,具体是何种抗菌肽发挥的这种抑制细菌增殖的作用,将在未来的研究中对奶牛脂肪间充质干细胞的这种抑制细菌增殖的能力进行深入的探讨与研究。
4 结论
实验中分离培养的金黄色葡萄球菌处于对数生长期且体外生长状态较好,当将金黄色葡萄球菌与成体奶牛脂肪间充质干细胞共培养12 h后,成体奶牛脂肪间充质干细胞表现出可以显著降低金黄色葡萄球菌体外增殖的作用,并且奶牛脂肪间充质干细胞培养24 h上清液表现出更为显著有效的抑制临床奶牛乳腺炎来源的病原体金黄色葡萄球菌的体外增殖。
