中国胰腺癌高危人群早期筛查和监测共识意见(2021,南京)
2022-02-28中华医学会消化内镜学分会胰腺疾病协作组
中华医学会消化内镜学分会胰腺疾病协作组
【提要】 胰腺癌恶性程度高,5年生存率低,主要原因在于早期诊断困难。目前国内尚无胰腺癌早期筛查的规范化流程,本共识结合国内外研究进展,针对胰腺癌早期筛查的目标、高危人群、起始筛查年龄、随访间隔、筛查项目及手术时机等问题,共提出26条推荐意见,最终形成国内胰腺癌高危人群早期筛查和监测共识意见。
胰腺癌是一种恶性程度极高的消化系统肿瘤,5年生存率约为10%[1]。据全国肿瘤登记中心统计,胰腺癌占我国肿瘤发生率的第9位,死亡率占第6位[2],主要原因在于早期诊断困难。研究报道从胰腺发生病变开始到发展为转移性胰腺癌需要近21年的时间[3],这为胰腺癌的早期筛查提供了足够的时间窗。然而,我国胰腺癌的早期诊断率和国际先进水平仍有差距,胰腺癌高危人群早期筛查尚未普及,因此有必要制定中国高危人群胰腺癌筛查和监测的专家共识。为此,中华医学会消化内镜学分会胰腺疾病协作组牵头,组织国内胰腺疾病领域专家,结合国内外研究进展,采用改良Delphi法,通过多轮投票与集体讨论的方式,针对胰腺癌早期筛查的目标、目标人群、起始筛查年龄、随访间隔、筛查项目及手术时机等问题,共提出了26条推荐意见。由南京大学医学院附属鼓楼医院消化科成立共识起草小组对共识意见进行起草和修订,最终制定本共识意见。本共识基于推荐意见分级的评估、制定及评价(grading of recommendation assessment,development and evaluation, GRADE)方法,将证据质量分为高(A)、中(B)、低(C)、极低(D)4个等级,将推荐意见分为强、弱2个级别。
一、胰腺癌早期筛查的目标
推荐意见1:发现Ⅰ期胰腺癌和高级别胰腺上皮内瘤变(pancreatic intraepithelial neoplasia, PanIN)是胰腺癌早期筛查的目标。
证据质量:A 推荐强度:强
Ⅰ期胰腺癌(T1N0M0/T2N0M0)局限于胰腺原位,肿瘤最大径≤4 cm,无淋巴结或远处转移,属可切除性胰腺癌,行根治性切除术结合辅助性化疗可显著延长患者的总体生存期[4]。研究报道,接受胰腺癌早期筛查的高危人群,大多数被诊断为可切除性胰腺癌[5-7]。PanIN为胰腺癌癌前病变[8],其及时检出,跟踪监测,必要时及时手术,将有助于防止胰腺癌的发生。大部分胰腺癌被认为由PanIN发展而来,包括散发性胰腺癌患者以及具有家族性或遗传性胰腺癌易感性的患者[9];现有的二分类法根据疾病的进展将PanIN分为低级别PanIN和高级别PanIN[8]。低级别PanIN发展为胰腺癌的概率很低[10],而高级别PanIN为不可逆癌前病变,且通常伴随胰腺癌出现[11],因此将高级别PanIN列为胰腺癌早期筛查的目标之一。为切实提高我国胰腺癌早诊早治率,延长胰腺癌患者生存期,改善患者预后,本指南基于国内外胰腺癌筛查和诊疗规范,将发现I期胰腺癌和高级别PanIN作为筛查目标。
二、胰腺癌早期筛查的目标人群
推荐意见2:不推荐对无症状非高危人群进行胰腺癌筛查。
证据质量:D 推荐强度:弱
推荐意见3:遗传性胰腺癌高危个体、新发糖尿病、慢性胰腺炎、胰腺囊性肿瘤这4类人群为胰腺癌高危人群,推荐进行胰腺癌早期筛查。
证据质量:B 推荐强度:强
胰腺癌的发病率不高,年发病率约为12.9/10万人[12]。目前没有在一般人群中筛查胰腺癌而获益的相关报道,且早期胰腺癌筛查可能会增加被筛查人群的心理负担[12]。因此,结合成本效益的考虑,不推荐对无症状的非高危人群进行胰腺癌筛查。
胰腺癌高危人群主要包括以下四大类:遗传性胰腺癌高危个体[13]、新发糖尿病[14-15]、慢性胰腺炎[16-17]及胰腺囊性肿瘤[18-20],这4类人群发生胰腺癌的风险较一般人群高,在他们中进行早期胰腺癌筛查有助于提高检出率[21],同时降低筛查成本,提高社会效益。另外本共识建议,在随访中剔除高龄、基础状态差、不能耐受外科手术的患者。
1.遗传性胰腺癌高危个体
推荐意见4:推荐对具有胰腺癌家族史的个体进行胰腺癌早期筛查。
证据质量:B 推荐强度:强
推荐意见5:无论患者是否有胰腺癌家族史,推荐对Peutz-Jeghers综合征的患者[种系丝氨酸-苏氨酸蛋白激酶11(serine-threonine kinase 11,STK11)基因突变携带者]以及种系细胞周期蛋白依赖激酶抑制剂2A(cyclin dependent kinase inhibitor 2A,CDKN2A)基因突变携带者进行胰腺癌早期筛查。
证据质量:A 推荐强度:强
推荐意见6:乳腺癌易感基因1(breast-cancer susceptibility gene 1,BRCA1)、BRCA2、BRCA2定位协作基因(partner and localizer of breast-cancer susceptibility gene 2,PALB2)、共济失调症突变蛋白(ataxia telangiectasia mutated,ATM)、mutL同源物1(mutL homolog 1,MLH1)、mutS同源物2(mutS homolog 2,MSH2)、MSH6或腺瘤性结肠息肉病基因(adenomatous polyposis coli,APC)突变携带者,且至少有1个受累的一级亲属,推荐对其进行胰腺癌早期筛查。
证据质量:B 推荐强度:强
遗传性胰腺癌高危个体指具有胰腺癌家族史或已证实携带胰腺癌易感基因(以下简称突变携带者)的个体[5]。如果1个家庭中至少有2个互为一级亲属的成员被诊断为胰腺癌,则认为其具有胰腺癌家族史[22]。胰腺癌家族史家系中的个体患胰腺癌的风险与具有患胰腺癌的一级亲属的数量直接相关,有1个患胰腺癌一级亲属的个体患癌风险为一般人群的4~6倍,当一级亲属患癌数量达到3人时,该个体患癌风险增加至一般人群的17~32倍[23-24]。随着家族中胰腺癌发病年龄的降低,风险可能进一步增加[24]。具有家族性胰腺癌的高危群体终生具有患胰腺癌风险。因此,建议对有胰腺癌家族史的个体进行胰腺癌筛查。
Peutz-Jeghers综合征患者(STK11基因突变携带者)患胰腺癌风险为一般人群的132倍[25],且诊断为胰腺癌的年龄较年轻(平均发病年龄为40.8岁);而CDKN2A基因突变携带者患胰腺癌风险为一般人群的13~39倍[26-27]。对胰腺癌高危个体长期随访结果表明,在已确定的高危基因突变携带者中胰腺癌诊断率较高,其中Peutz-Jeghers综合征患者(2/9)和CDKN2A突变携带者(7/96,7%)的发病率最高[5]。因此本共识建议,无论患者是否有胰腺癌家族史,应对Peutz-Jeghers综合征患者(STK11基因突变携带者)和CDKN2A基因突变携带者进行胰腺癌早期筛查。
临床研究对BRCA1、BRCA2、PALB2、ATM、MLH1、MSH2、MSH6和APC等基因突变进行了胰腺癌发生风险的评估[28-30],发现不同易感基因突变导致患胰腺癌增加的风险有显著差别。其中,BRCA1、BRCA2和PALB2基因突变携带者患胰腺癌的风险为一般人群的2~9倍[31-33],ATM基因突变携带者患胰腺癌的风险为一般人群6.5倍[34],而DNA错配修复基因包括MLH1、MSH2和MSH6基因突变携带者患胰腺癌的风险为一般人群8.6~11倍[22]。此外,APC基因突变携带者患胰腺癌的风险为一般人群的5倍以上[35]。是否具有家族史也是上述易感基因突变携带者患胰腺癌风险高低的一个重要因素,尽管目前尚缺乏强有力的数据去佐证,本共识仍推荐将上述易感基因突变携带者家族史纳入考虑的范畴。综上所述,本共识推荐BRCA1、BRCA2、PALB2、ATM、MLH1、MSH2、MSH6或APC基因突变携带者,且至少有一个受累的一级亲属者,应接受胰腺癌早期筛查。
2.新发糖尿病
推荐意见7:50岁以上且体重指数低和(或)不明原因体重减轻以及短期内血糖波动较大的新发糖尿病患者,推荐进行胰腺癌早期筛查。
证据质量:B 推荐强度:强
推荐意见8:无论年龄大小,遗传性胰腺癌高危个体中的新发糖尿病患者应接受胰腺癌早期筛查。
证据质量:B 推荐强度:强
目前尚无对新发糖尿病的权威定义,结合已发表的高质量文献,本共识将新发糖尿病定义为既往无糖尿病病史、24个月内诊断的糖尿病[36-37]。越来越多的研究表明,新发糖尿病是无症状胰腺癌患者的临床表现。研究发现≥50岁新发糖尿病患者被认为是散发型胰腺癌的高风险人群[38],0.85%的50岁以上新发糖尿病患者会在3年内被诊断为胰腺癌[14]。2020年意大利一项针对新发糖尿病患者胰腺癌早期预测的多学科共识指南指出,诊断糖尿病时年龄>50岁、体重指数低和(或)不明原因突然体重减轻、空腹血糖水平高或血糖难以控制的人群患胰腺癌风险较高[15]。基于诊断新发糖尿病时的年龄、体重变化、血糖变化等组成的评分系统而构建的胰腺癌新发糖尿病富集模型(enriching new-onset diabetes for pancreatic cancer, END-PAC)有助于确定新发糖尿病患者中胰腺癌高危人群[39-40]。但目前尚无统一完善的END-PAC模型, 对新发糖尿病相关胰腺癌的早期监测方案也无定论。结合目前国内外最新研究进展,本共识推荐50岁以上且体重指数低和(或)出现不明原因体重减轻以及短期内血糖波动较大的新发糖尿病患者行胰腺癌早期筛查。
一项前瞻性研究随访了接受胰腺癌筛查的遗传性胰腺癌高危人群,发现20%的个体存在空腹血糖异常,其中1例患者被诊断出新发糖尿病[41]。如果同时具有胰腺癌家族史、糖尿病史以及吸烟史,则该人群患胰腺癌的风险将增加至正常人群的10倍以上[42]。因此,本共识推荐遗传性胰腺癌高风险个体中的新发糖尿病患者应进行胰腺癌早期筛查。
3.慢性胰腺炎
推荐意见9:推荐对慢性胰腺炎患者进行胰腺癌早期筛查。
证据质量:B 推荐强度:强
推荐意见10:阳离子胰蛋白酶原基因 1(cationic trypsinogen gene 1,PRSS1)突变携带的慢性胰腺炎患者的癌变风险较其他慢性胰腺炎患者明显升高。对病因不明的慢性胰腺炎患者,推荐进行基因突变检测,尤其是PRSS1突变检测。
证据质量:C 推荐强度:弱
慢性胰腺炎是胰腺实质逐渐被纤维组织取代并造成胰腺形态和功能发生不可逆改变的炎症过程[43]。我国慢性胰腺炎研究组发起的一项多中心回顾性研究发现,从1996年到2003年慢性胰腺炎患病率逐年增加,从3.08/10万人增加至13.52/10万人[44],与西方国家慢性胰腺炎患病率相当[43]。我国慢性胰腺炎患者以特发性为主(76.6%),其次为酒精性(18.8%)、胰管解剖异常(2.9%)和遗传性(1.2%)[45]。由于胰腺炎引起的炎症和损伤可导致腺泡导管组织转化,并逐渐发展为胰腺癌[16],因此慢性胰腺炎同样也是胰腺癌的危险因素。1993年包括6个国家共计1 552例慢性胰腺炎患者的大型多中心队列研究结果发现,慢性胰腺炎患者在10年和20年的累积胰腺癌发生风险分别为1.8%和4%[46]。研究报道,我国人群中慢性胰腺炎患者3、5、10年胰腺癌累计患病率为0.6%、1.0%和1.3%[47-48],因此慢性胰腺炎作为胰腺癌发生的高危因素,应纳入筛查。
遗传性胰腺炎是一种罕见的慢性胰腺炎类型,仅占非酒精性慢性胰腺炎的8.7%[49],患病率约(0.13~0.57)/10万人[50-51],在我国仅占慢性胰腺炎发病原因的1.2%[45]。与其他原因引起的胰腺炎相比,遗传性胰腺炎的特点包括发病早和患胰腺癌的风险显著增加。遗传性胰腺炎是一种常染色体显性遗传疾病,65%~100%的遗传性胰腺炎是由PRSS1的功能突变引起,其中p.R122H和p.N29I是最常见的突变位点[52]。PRSS1突变携带者症状发生后70年的癌症累计发生风险高达44%[17]。当慢性胰腺炎患者具有胰腺炎家族史或临床上经相关辅助检查不能明确原因(排除酒精性、胆源性、高脂血症性、药物性和先天性等)时,需高度怀疑遗传性胰腺炎,推荐对患者行外周血基因突变检测,尤其应明确是否携带PRSS1基因突变[53]。
据报道,约51.4%的慢性胰腺炎患者存在慢性胰腺炎的易感基因突变[54],除PRSS1以外,还包括糜蛋白酶C(chymotrypsin C,CTRC)[55]、囊性纤维化跨膜传导调节蛋白(cystic fibrosis transmembrane conductance regulator,CFTR)[56]、丝氨酸蛋白酶抑制剂Kazal I型(serine protease inhibitor Kazal type 1,SPINK1)[57],这些基因突变被认为与慢性胰腺炎的早期发生显著相关。此外,羧基酯脂肪酶(carboxyl ester lipase,CEL)-HYB杂合基因最近被鉴定为慢性胰腺炎的危险因素[58],但在亚洲人群中CEL-HYB和羧肽酶A1(carboxypeptidase A1,CAP1)基因与慢性胰腺炎发生无关[59-60]。一项基于我国人群的前瞻性研究显示,相对于未携带基因突变的慢性胰腺炎患者,携带SPINK1基因突变的慢性胰腺炎患者胰腺癌发生风险并不升高[48]。基于目前的研究,除PRSS1基因以外,其他易感基因包括SPINK1、CFTR、CTRC、CPA1、CEL-HYB与胰腺癌发生的关联性证据不足[61-62]。
4.胰腺囊性肿瘤
推荐意见11:推荐对较高癌变风险的胰腺囊性肿瘤患者,包括黏液性囊性肿瘤(mucinous cystic neoplasm, MCN)、实性假乳头状肿瘤(solid pseudopapillary neoplasm, SPN)、囊性神经内分泌肿瘤(cystic neuroendocrine tumours,cNET)、胰腺导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm,IPMN)进行胰腺癌早期筛查。建议对MCN、SPN、cNET、主胰管型IPMN(MD-IPMN)和混合型IPMN(MT-IPMN)患者进行多学科讨论和择期外科切除术,将分支胰管型IPMN(BD-IPMN)患者纳入筛查程序。
证据质量:B 推荐强度:强
随着影像学检查的普及,无症状胰腺囊性肿瘤的发现率逐年升高[63]。与一般人群相比,胰腺囊性肿瘤患者患胰腺癌风险更高,相对危险度可能高达22.5(95%CI11.0~45.3)[19-20]。胰腺囊性肿瘤涵盖范围很广,不同类型的囊性肿瘤恶性风险差异很大[64],其中黏液性胰腺囊性肿瘤被认为具有较高的癌变风险。高达15%的胰腺癌被认为是由黏液性胰腺囊性肿瘤引起的,包括IPMN和MCN[18],其中前者占大多数。IPMN指源于主胰管和(或)分支胰管有大量黏液分泌的乳头状肿瘤,根据胰腺内受累的位置和程度可将IPMN分为MD-IPMN、BD-IPMN和MT-IPMN[64]。据报道,MD-IPMN和MT-IPMN的恶性风险较高,为38%~68%,而BD-IPMN的恶变风险相对较低,文献报道在11%~30%不等[43,65]。除此之外,一些少见的胰腺囊性肿瘤包括SPN和cNET也被认为具有潜在恶性倾向[66]。
目前胰腺囊性肿瘤的管理仍然存在一定的争议,本共识结合国内外相关指南[67-70],推荐对较高癌变风险的MCN、SPN、cNET、IPMN患者进行胰腺癌早期筛查,其中对MCN、SPN、cNET、MD-IPMN和MT-IPMN患者建议多学科讨论和择期外科切除,将BD-IPMN患者纳入筛查程序。鉴于临床上难以明确胰腺囊性肿瘤具体类型,部分病变随访策略争议较大,建议一旦确诊为胰腺囊性肿瘤即至高级胰腺中心进行胰腺癌早期筛查,必要时经多学科讨论制定随访监测方案。
三、胰腺癌早期筛查的起始年龄
推荐意见12:有胰腺癌家族史的个体推荐胰腺癌起始筛查年龄为50岁,或比最年轻的受累血亲年轻10岁;Peutz-Jeghers综合征患者或CDKN2A突变携带者推荐胰腺癌起始筛查年龄为40岁;BRCA1、BRCA2、PALB2、ATM、MLH1、MSH2、MSH6或APC基因突变携带者起始筛查年龄为50岁,或比最年轻的受累血亲年轻10岁。
证据质量:B 推荐强度:强
推荐意见13:50岁以上新发糖尿病患者,若出现不明原因的体重减轻和(或)短期内血糖波动范围较大或新发糖尿病患者中有遗传性胰腺癌高危风险的个体,一经诊断,应开始接受胰腺癌早期筛查。
证据质量:B 推荐强度:强
推荐意见14:慢性胰腺炎患者推荐胰腺癌起始筛查年龄为40岁。
证据质量:B 推荐强度:弱
推荐意见15:BD-IPMN患者诊断明确后,推荐开始接受胰腺癌早期筛查。
证据质量:B 推荐强度:强
胰腺癌高危个体若仅具有家族史(无已知的易感基因突变),大部分于55岁以后被诊断出胰腺癌,诊断平均年龄低于无家族史的个体[7,30,71]。对于具有胰腺癌家族史(无明确基因突变)的个体,胰腺癌早期筛查应始于50岁,也有部分专家认为这部分人群可从55岁开始进行胰腺癌早期筛查[13]。本共识建议有胰腺癌家族史的个体胰腺癌起始筛查年龄为50岁,或者比家族中最年轻的患者年轻10岁。患有Peutz-Jeghers综合征的患者或CDKN2A突变携带者发生胰腺癌的平均年龄更早,Peutz-Jeghers综合征患者通常在30~40岁被诊断为胰腺癌,而16%的CDKN2A突变携带者在45岁前被诊断为胰腺癌[22]。因此,本共识建议Peutz-Jeghers综合征患者和CDKN2A突变携带者的胰腺癌筛查起始年龄为40岁。对胰腺癌高危人群长期随访结果显示,突变携带者确诊为胰腺癌的平均年龄为52岁[5]。本共识建议,对于BRCA1、BRCA2、PALB2、ATM、MLH1、MSH2、MSH6、APC基因突变携带者,推荐初筛年龄为50岁,或比最年轻的受累血亲年轻10岁。
目前国际上尚无对新发糖尿病患者的胰腺癌早期筛查起始年龄的相关共识。基于前期国内外研究,本共识推荐50岁以上新发糖尿病患者,若出现体重不明原因减轻和(或)短期内血糖波动范围较大的情况,应开始行胰腺癌早期筛查。而新发糖尿病患者中有遗传性胰腺癌高危风险的个体,建议无论年龄大小,一经诊断,应开始接受胰腺癌早期筛查[13]。
对于慢性胰腺炎患者,目前国际共识推荐具有PRSS1突变的慢性胰腺炎患者在40岁开始进行胰腺癌筛查[68]。一项研究发现402例慢性胰腺炎患者中5例发生胰腺癌,诊断年龄为(50.9±10.1)岁[73]。另外一项纳入581例慢性胰腺炎患者的研究中,6例诊断为胰腺癌,从诊断为慢性胰腺炎到发生胰腺癌的平均时间约为5.0年[74]。根据欧洲遗传性胰腺炎和胰腺癌登记处(European Registry of Hereditary Pancreatitis and Pancreatic Cancer,EUROPAC)研究结果,418 例仅纳入遗传性胰腺炎患者的队列中26例(6%)被诊断为胰腺癌,风险从40岁开始增加[17]。一项研究对497例遗传性胰腺炎患者进行随访,发现19例患者进展为胰腺癌,其中仅3例在40岁前发生胰腺癌,且这3例均为吸烟者[75]。这些研究结果表明,在40岁之前对慢性胰腺炎患者进行胰腺癌筛查的收益不大,因此不推荐对<40岁的慢性胰腺炎患者进行胰腺癌监测。
IPMN患者的发病年龄通常在50~70岁,对于BD-IPMN患者,推荐一经诊断即开始进行胰腺癌早期筛查。
四、胰腺癌高危人群的随访间隔时间
推荐意见16:在没有胰腺异常,或无报警征象的情况下,对满足筛查条件的遗传性胰腺癌高危个体、新发糖尿病患者、慢性胰腺炎患者的监测间隔时间为12个月。若存在实性病变直径<10 mm或可疑实性病变;主胰管直径5~9.9 mm;无明显病变情况下主胰管局限性狭窄或扩张≥6 mm等报警征象,则监测间隔时间为3~6个月。
证据质量:B 推荐强度:强
推荐意见17:对于BD-IPMN患者,在没有报警征象的情况下随访间隔取决于肿瘤大小,肿瘤长径<2 cm者随访间隔时间为12个月,直径2~3 cm者随访间隔时间为6个月。若出现新发糖尿病,IPMN所致的复发性胰腺炎,囊性肿瘤≥3 cm,增强的壁结节直径<5 mm,囊壁增厚强化,主胰管直径为5~9.9 mm,主胰管直径改变伴远端胰腺萎缩,血清糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)升高,囊性肿瘤增长速率>5 mm/2年和淋巴结肿大,则筛查间隔应缩短为3~6个月,同时报警征象为相对手术指征,可以经多学科讨论后,结合患者意愿,必要时择期手术切除。
证据质量:B 推荐强度:强
推荐意见18:对于手术切除后患者,随访策略为(1)如果无残余病变,推荐术后每年复查CA19-9及MRI、EUS或CT检查;(2)对于切缘低级别上皮内瘤变的患者,推荐每年至少进行2次CA19-9检测及MRI、EUS或CT检查。
证据质量:B 推荐强度:强
在没有胰腺异常的情况下,推荐对遗传性胰腺癌高风险个体和新发糖尿病患者的监测间隔时间为12个月。对于慢性胰腺炎患者的胰腺癌筛查间隔时间,目前缺乏高质量的随机对照研究、Meta分析和指南共识,且由于筛查成本较高,对于首次随访未发现可疑胰腺病变的遗传性胰腺炎患者建议每1~2年进行一次随访[76]。随访中若存在实性病变直径<10 mm或可疑实性病变;主胰管直径5~9.9 mm;无明显病变情况下主胰管直径狭窄或扩张≥6 mm,则应进行每3~6个月的密切随访。
BD-IPMN患者的随访策略尚存在争议。现有指南对BD-IPMN的报警征象和高危征象进行了定义[67-70],报警征象包括出现新发糖尿病,IPMN所致的复发性胰腺炎,囊性肿瘤直径≥3 cm,增强的壁结节直径<5 mm,囊壁增厚强化,主胰管直径为5~9.9 mm,主胰管直径改变伴远端胰腺萎缩,CA19-9升高,囊性肿瘤增长速率>5 mm/2年和淋巴结肿大;高危征象包括出现肿瘤相关的黄疸,增强的壁结节直径≥5 mm,主胰管直径≥10 mm,EUS-FNA病理恶性或可疑恶性。BD-IPMN患者若存在报警征象,应进行密切的随访(每3~6个月1次),同时这些征象也是相对手术指征,可以经多学科讨论后,结合患者意愿择期手术切除;若存在高危征象,为绝对手术指征,推荐进行多学科讨论后外科手术。对于囊性肿瘤长径<3 cm且不伴有上述报警征象和高危征象的患者,随访策略应根据肿瘤长径进行分层,若囊性肿瘤长径<2 cm,监测间隔时间为12个月;若囊性肿瘤长径为2~3 cm,监测间隔应缩短至6个月[77]。
对于术后患者,后续的监测应按照手术方式和术后病理结果制定残胰评估方案。如果切缘为阴性,建议每年进行MRI检查,并对残余胰腺进行评估[67]。对于切缘低级别PanIN患者,推荐每年至少进行2次CA19-9和MRI、EUS或CT监测[78]。因此本指南推荐对于手术切除后患者,如果无残余病变,推荐术后每年复查CA19-9及MRI、EUS或CT检查;如果为切缘低级别PanIN患者,推荐每年至少进行2次CA19-9检测及MRI(MRCP)、EUS或CT检查。
五、胰腺癌高危人群筛查项目
推荐意见19:初次检测使用空腹血糖和(或)糖化血红蛋白A1c(hemoglobin, A1c, HbA1c)+血清CA19-9联合MRI、EUS或CT检测。
证据质量:A 推荐强度:强
推荐意见20:随访中定期检测空腹血糖和(或)HbA1c+血清CA19-9,并交替使用MRI、EUS或CT检测。
证据质量:B 推荐强度:强
推荐意见21:在随访监测中若发现胰腺实性病变或有报警征象的胰腺囊性肿瘤,建议采用内镜超声引导下细针穿刺抽吸术(endoscopic ultrasound-guided fine needle aspiration, EUS-FNA)。
证据质量:B 推荐强度:强
初次接受早期胰腺癌筛查的高危人群应行空腹血糖和(或)HbA1c检测,并定期监测血糖和体重变化。研究发现HbA1c升高与胰腺癌发生风险增加呈正相关[79-81],对胰腺癌发生具有预测意义[82]。Meta分析显示,空腹血糖浓度和胰腺癌发生率之间存在很强的线性剂量-反应关系。空腹血糖每升高0.56 mmol/L,胰腺癌发病率增加14%[83]。血清CA19-9检测是目前胰腺癌筛查中唯一被使用的生物学标志物[84],虽然其特异性有限,单独应用价值不高,但CA19-9联合其他检测手段可增加灵敏度和特异度[85]。
胰腺癌早期筛查的影像学手段包括CT、MRI和EUS,3种方法各有优劣。CT易于操作,成本低,增强CT对胰腺可疑病变的识别具有一定价值,可以有效区分胰腺占位与周围结构,并显示病灶的血供特点。但CT有电离辐射的风险,且CT在检测小的胰腺病变和区分良恶性胰腺病变的灵敏度低于MRI和EUS[86-91]。研究比较CT、MRI和EUS在胰腺癌高危人群中检测到胰腺异常的比例,分别为11.0%、33.3%和42.6%[92-93]。EUS检查有助于评估与恶性肿瘤相关的特征,例如局灶性低回声、壁结节、实性肿块、主胰管扩张、主胰管充盈缺损和血管浸润[69,95]。对比EUS和MRI,EUS在检测实性病变的灵敏度高于MRI[96-97]。然而因为EUS诊断率高度依赖于操作者,使得这一方法的开展具有局限性[98]。对于首次筛查,3种影像学手段均可以使用,但在随访中发现可疑征象,优先推荐使用MRI和EUS。
若发现实性病变、有报警征象的胰腺囊性肿瘤,EUS-FNA具有较高的灵敏度和特异度[99-101]。对于胰腺囊性肿瘤患者,EUS-FNA还可以进行囊液成分如癌胚抗原(carcinoma embryonic antigen, CEA)和淀粉酶分析,对鉴别囊性肿瘤性质具有参考意义[102-103]。此外通过囊液进行Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten ratsarcoma viral oncogene homolog,KRAS)和GNAS复合体基因座(GNAS complex locus,GNAS)突变的基因分析有助于区分IPMN和MCN[104]。
许多符合胰腺癌筛查标准的高危个体(特别是突变携带者)患其他癌症的风险也会增加,这类患者应接受针对其生殖系突变状态和癌症家族史的其他癌症的监测。此外,推荐对临床证据显示胰腺炎相关疾病或病因不明的慢性胰腺炎患者,尤其是年轻患者,应行基因检测[52]。对影像学无可疑病变的患者进行胰腺癌检测非常困难,经内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreato-graphy, ERCP)联合进一步胰液细胞学检查为这类患者提供了可行的方法[105]。研究发现经内镜鼻胰管引流(endoscopic naso-pancreatic drainage, ENPD)进行重复胰液细胞学检查对胰腺癌诊断的灵敏度达80%~100%[106-107]。对于多次EUS随访仍未发现明显占位性病变,但有胰管狭窄伴近侧胰管扩张疑诊为早期肿瘤的患者,ERCP及胰液连续抽吸细胞学活检(serial pancreatic-juice aspiration cytologic exam-ination,SPACE)有助于早期诊断胰腺癌[108]。虽然目前还没有相关的前瞻性研究,但对影像学未发现实性占位,仅有胰管局限性的狭窄或扩张的高危个体,此类检查可以获取细胞学证据,对治疗决策的制定仍具有一定的参考价值,可作为EUS的补充手段,同时,对于这类患者也可在胰管狭窄周围进行EUS-FNA或超声内镜下细针活检术(endoscopic ultrasound-guided fine needle biopsy,EUS-FNB)。此外,胰管镜检查(spyglass)也有助于对IPMN等累及胰管的病变进行评估,且可以在直视的情况下对胰管可疑病变进行活检[109],对发现恶性胰管病变具有一定的帮助[110]。
六、胰腺癌高危人群的手术指征
推荐意见22:EUS-FNA病理结果为恶性或可疑恶性,推荐进行多学科讨论后择期手术切除。
证据质量:A 推荐强度:强
推荐意见23:当实性病灶>10 mm,MPD狭窄或扩张≥10 mm,但EUS-FNA不能明确病变性质,推荐进行多学科讨论及手术探查进一步明确病变性质,必要时对病灶进行切除。
证据质量:A 推荐强度:强
推荐意见24:对具有高危征象(出现实性病变、肿瘤相关的黄疸、增强的壁结节≥5 mm、MPD≥10 mm)的BD-IPMN患者推荐进行多学科讨论后择期手术切除。
证据质量:A 推荐强度:强
在决定被筛查人群是否应进行手术切除时,需要考虑多种因素,包括患者的手术风险、合并症和预期寿命等,手术决策应该由经验丰富的多学科专家团队讨论后决定。首先,无论实性病变或囊性肿瘤,FNA病理结果为恶性或可疑恶性的患者[111],都应接受外科手术。此外,对有实性病变患者,如果相关的检测如EUS-FNA不能得出明确的术前病理学诊断,但实性病变>10 mm,或有主胰管狭窄和(或)扩张≥10 mm,推荐进行多学科讨论及手术探查进一步明确病变性质,必要时对病灶进行切除。
对于胰腺囊性肿瘤手术适应证,目前不同的共识指南略有不同。虽有建议对具有潜在恶性风险的SPN、cNET、MCN、MD-IPMN和MT-IPMN患者行手术切除[70],但也有研究发现,当MD-IPMN和MT-IPMN患者MPD<10 mm,无增强的壁结节时,进展为恶性的风险降低,可以选择随访而不是立刻接受手术[112]。而对于BD-IPMN患者,当出现高危征象时推荐行手术切除[67,92,113]。
七、针对胰腺癌高危人群的生活习惯
推荐意见25:建议患者戒烟戒酒,均衡健康饮食,并适度进行体育锻炼,避免肥胖。
证据质量:B 推荐强度:强
环境因素也会增加高危人群患胰腺癌的风险。多项前瞻性研究表明,吸烟和饮酒患胰腺癌的额外风险增加[75,114-115]。研究发现吸烟会使患胰腺癌的风险增加2~6倍[116],避免吸烟和饮酒可能有助于减缓慢性胰腺炎进展,也可能直接和间接降低患胰腺癌的风险 。此外,肥胖也是胰腺癌发生的危险因素之一,体重指数升高与胰腺癌的发生具有显著的正相关性[117]。在部分多中心的病例对照研究中,发现适当进食水果蔬菜是减少胰腺癌发生的保护因素[72,118]。
八、早期胰腺癌的筛查机构
推荐意见26:满足筛查条件4 类高危人群(遗传性 胰腺癌高危个体、新发糖尿病、慢性胰腺炎和胰腺囊性肿瘤)的胰腺癌监测应在胰腺专科中心进行。
证据质量:B 推荐强度:强推荐
胰腺癌筛查应选择在高水平的胰腺专科中心进行,这些中心通常在筛查和检测过程中更有经验,并且有利于为指南的进一步制定提供高质量的证据[118]。高水平的专科中心如1994年约翰霍普金斯医院成立的国家家族性胰腺肿瘤登记处(the National Familial Pancreas Tumor Registry,NFPTR)和1996年在利物浦成立的EUROPAC更利于国家直接参与并促进胰腺癌检测的顺利进行。
九、早期胰腺癌筛查未来发展方向
本共识制定的高危人群胰腺癌筛查处理决策流程见图1。但胰腺癌总体发病率较低,筛查成本高,因此如何更有效地富集高危人群进而使他们在后续的监测中获益是胰腺癌筛查的关键。未来的胰腺癌筛查应考虑建立风险评估模型[120]和大规模数据库[121],应用液体活检和影像组学[122]等。同时胰腺癌筛查也应兼顾成本与效益,优化胰腺筛查程序,降低医疗成本[123]。
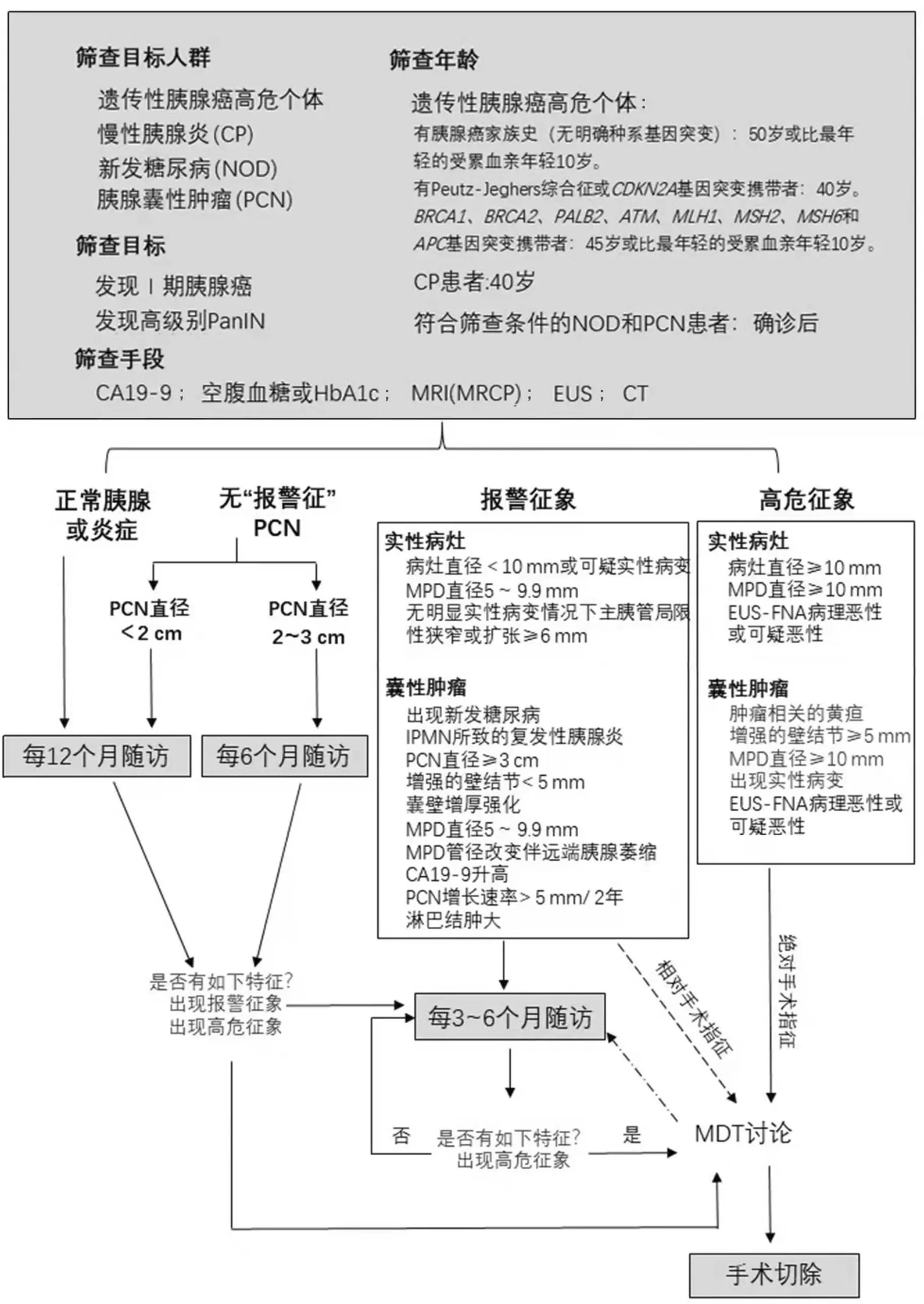
CP:慢性胰腺炎;NOD:新发糖尿病;PCN:胰腺囊性肿瘤;PanIN:胰腺上皮内瘤变;MRI:核磁共振成像;MRCP:磁共振胰胆管成像;EUS:超声内镜;CT:计算机断层成像;HbA1c:糖化血红蛋白;EUS-FNA:超声内镜引导下细针穿刺活检;MPD:主胰管图1 高危人群胰腺癌筛查的处理决策流程图
利益冲突所有作者声明无利益冲突
参与指南修订讨论和定稿专家(按姓名汉语拼音排序):
柴宁莉(中国人民解放军总医院第一医学中心),陈幼祥(南昌大学第一附属医院),丁震(华中科技大学同济医学院附属协和医院),杜奕奇(海军军医大学第一附属医院),戈之铮(上海交通大学医学院附属仁济医院),郝建宇(首都医科大学附属北京朝阳医院),何健(南京大学医学院附属鼓楼医院),侯森林(河北医科大学第二医院),胡兵(四川大学华西医院),胡冰(海军军医大学第三附属医院),黄永辉(北京大学第三医院),冀明(首都医科大学附属北京友谊医院),姜慧卿(河北医科大学第二医院),姜军梅(山东第一医科大学附属省立医院),蒋奎荣(南京医科大学第一附属医院),蒋青伟(中国医学科学院北京协和医院),江月萍(青岛大学附属医院),金钢(海军军医大学第一附属医院),金震东(海军军医大学第一附属医院),孔波(南京大学医学院附属鼓楼医院),李惠凯(中国人民解放军总医院第一医学中心),李连勇(中国人民解放军战略支援部队特色医学中心),李文(天津市人民医院),李汛(兰州大学第一医院),李延青(山东大学齐鲁医院),令狐恩强(中国人民解放军总医院第一医学中心),刘改芳(河北省人民医院),刘俊(华中科技大学同济医学院附属协和医院),吕瑛(南京大学医学院附属鼓楼医院),毛谅(南京大学医学院附属鼓楼医院),潘阳林(空军军医大学西京医院),彭贵勇(第三军医大学第一附属医院),覃山羽(广西医科大学第一附属医院),仇毓东(南京大学医学院附属鼓楼医院),沈珊珊(南京大学医学院附属鼓楼医院),孙思予(中国医科大学附属盛京医院),王邦茂(天津医科大学总医院),王贵齐(中国医学科学院肿瘤医院),王雷(南京大学医学院附属鼓楼医院),王轶(南京大学医学院附属鼓楼医院),夏明星(海军军医大学第三附属医院),许国强(浙江大学医学院附属第一医院),徐红(吉林大学白求恩第一医院),闫超(南京大学生命科学院),杨爱明(中国医学科学院北京协和医院),于红刚(武汉大学人民医院),张舒(南京大学医学院附属鼓楼医院),郑汝桦(南京大学医学院附属鼓楼医院),智发朝(南方医科大学南方医院),钟良(复旦大学附属华山医院),周平红(复旦大学附属中山医院),祝荫(南昌大学第一附属医院),邹晓平(南京大学医学院附属鼓楼医院)
执笔者:沈珊珊(南京大学医学院附属鼓楼医院消化内科),李洪祯(南京大学医学院附属鼓楼医院消化内科),余媛媛(南京大学医学院附属鼓楼医院消化内科)
审校:邹晓平(南京大学医学院附属鼓楼医院消化内科)
