体外法研究竹叶黄酮对奶牛乳腺上皮细胞抗氧化及哺乳动物雷帕霉素靶蛋白信号通路中关键基因表达的影响
2022-02-20王宇彤沈义媛霍相羽韩思雨童津津熊本海蒋林树
王宇彤 沈义媛* 霍相羽 牛 慧 韩思雨 童津津** 熊本海 蒋林树**
(1.北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
牛乳是由乳腺产生的一种具有胶体特性的生物学液体,成分包括脂肪、蛋白质、乳糖、矿物质、维生素和水[1]。其中乳蛋白是牛乳的重要营养成分,因此在奶牛乳产业中,提高牛乳中乳蛋白含量被越来越多的研究者所关注。目前,奶牛养殖场可以通过改善饲粮营养水平、加强管理、提高遗传育种技术等方面提高牛乳中乳蛋白的含量[2]。植物提取物来源于天然植物,因其具有低毒性、低残留、绿色环保、不易产生耐药性等特征,逐渐成为畜禽饲料行业的研究热点并取得了一定的研究进展[3-4]。竹叶中提取的竹叶黄酮(bamboo leaf flavonoids,BLF),因其天然活性成分在机体内残留少、不产生耐药性,并且具有抗炎、抗氧化、提高机体免疫力等多种生物学功能,在畜禽生产中具有广阔的应用潜能[5]。
现有研究表明,竹叶中含有的化学成分包括黄酮、苷类、活性多糖类、特种氨基酸、肽类、芳香成分以及锰、锌、硒等多种对人体有益的微量元素[6-8]。其中,BLF是从竹叶中提取出的一种活性物质,可作为一种健康无毒害的饲料添加剂,并被国家卫生部批准认定为天然食品添加剂。据报道,BLF具有清除氧自由基和增强免疫力的功能,并具有抗癌、抗菌、抗病毒、抗炎、抗氧化等多种生物活性[5,9-16]。本团队前期研究[17]结果表明,饲粮中添加0、30.0、60.0和90.0 g/d的竹叶提取物(BLF含量为40%)饲喂奶牛可显著提高乳汁中乳糖和乳蛋白的含量,其中30.0 g/d组奶牛血清中免疫球蛋白M(IgM)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)含量显著增加,以及竹叶提取物可显著提高奶牛血浆中过氧化氢酶(CAT)活性,显著降低血浆中丙二醛(MDA)含量。侯昆等[18]研究发现,在奶牛全混合日粮(TMR)中添加BLF(黄酮含量为40%)与青蒿提取物(青蒿素含量为39%),可以在一定程度上提高奶牛的产奶量,显著提高乳蛋白率并且降低奶牛乳中体细胞数。上述研究表明,BLF可以提高奶牛乳蛋白的含量,改善奶牛泌乳性能。然而,BLF如何调节奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)乳蛋白的合成及其作用机制尚未明确。因此,本研究旨在通过添加BLF与BMECs共培养,以期阐明BLF对奶牛乳腺抗氧化及乳蛋白合成的影响及其作用机制,为BLF在奶牛生产方面的应用提供一定的理论依据。
1 材料与方法
1.1 试验材料
BMECs由东北农业大学动物生物化学与分子生物学实验室惠赠;竹叶选购自陕西某天然制品有限公司,BLF参照张英[19]的方法由本实验室采用热回流法自行提取,提取效率1%~3%,总黄酮含量为20%~26%;DMEM/F12培养基(11995065,11765054)、澳洲胎牛血清(FBS,10099141)、青霉素/链霉素溶液(Pen Strep,15140-122)、Hank’s平衡盐溶液(HBSS,14175095)、0.25%胰蛋白酶-乙二胺四乙酸(EDTA)(25200056)购自美国Gibco公司;磷酸盐缓冲液(PBS)购自北京沃比森科技有限公司;Cell Counting Kit-8(CCK-8)活力检测试剂盒(Lot.GB707)购自日本同仁化学研究所;活性氧(ROS)检测试剂盒(S0033S)购自上海碧云天生物技术有限公司;乳酸脱氢酶(LDH)活性定量测定试剂盒(E1020)购自北京普利莱基因技术有限公司;Annexin V-FITC/PI凋亡检测试剂盒(ZP327-1)购自北京友谊中联生物科技有限公司;总超氧化物歧化酶(T-SOD)试剂盒(A001-1-2)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(A005-1-2)、MDA试剂盒(A003-1-2)购自南京建成生物工程研究所;线粒体膜电位(MMP)水平测定采用Thermo公司的MitoProbeTMJC-1 Assay Kit(M34652)试剂盒;总RNA提取试剂盒(12183018A)购自赛默飞公司;cDNA反转录试剂盒和SYBR GreenTMPremix Ex Taq Ⅱ购自日本TaKaRa公司。
1.2 试验设计
本试验采用单因素试验设计,将BMECs置于37 ℃、5% CO2细胞培养箱中培养,待细胞密度达到80%~90%,进行细胞传代,传至3~5代,然后分别更换为添加了不同浓度(0、0.5、1.0、5.0、10.0、20.0、60.0、100.0 μg/mL)BLF的DMEM/F-12(含有10% FBS)培养液继续培养,3、6、12、24和48 h后收集细胞,每次试验平行复孔6个,重复试验3次。通过CCK-8检测细胞活性,LDH法检测BMECs的毒性;采用对应试剂盒分析BMECs细胞凋亡、ROS含量、MMP水平、T-SOD与GSH-Px活性和MDA含量;并采用实时荧光定量 PCR(qRT-PCR)法检测凋亡相关基因和哺乳动物雷帕霉素靶蛋白(mTOR)信号通路中相关基因表达量的变化。
1.3 试验方法
1.3.1 BMECs的传代培养
用适量0.25%胰蛋白酶-EDTA消化BMECs,待细胞消化完全时,用含有血清的培养基进行终止消化,离心(500×g,10 min)、去上清后,将收集的细胞用DMEM/F-12(含有10% FBS)重悬,并于37 ℃、5% CO2细胞培养箱中培养BMECs,传至3~5代后用于后续试验。
1.3.2 不同浓度BLF溶液的配制
称取10 mg BLF用二甲基亚砜(DMSO)溶解,然后将溶解的BLF溶液(初始储存浓度为100.0 μg/mL)加入到细胞完全培养液中,通过倍比稀释调整BLF浓度分别为0.5、1.0、5.0、10.0、20.0、60.0和100.0 μg/mL,4 ℃保存备用。
1.3.3 BLF对BMECs活性影响
将BMECs以每孔100 μL接种于96孔板中,37 ℃、5% CO2细胞培养箱中培养,待细胞密度达到80%时,分别更换为含有不同浓度(0、0.5、1.0、5.0、10.0、20.0、60.0、100.0 μg/mL)BLF的150 μL DMEM/F-12(含有10% FBS,1%青-链霉素)培养液,于37 ℃、5% CO2细胞培养箱中培养3、6、12、24和48 h。每次试验平行复孔6个,重复试验3次。然后按照CCK-8活力检测试剂盒说明书每孔加入15 μL的CCK-8检测液,在细胞培养中继续孵育2 h,用酶标仪在450 nm处测定吸光度值(OD450 nm)。
细胞相对增殖率(%)=100×试验组OD450 nm/对照组OD450 nm。
1.3.4 BLF对BMECs毒性的影响
将BMECs接种于6孔板中,37 ℃、5% CO2细胞培养箱中培养,待细胞密度达到80%时,用PBS进行清洗并每孔加入2 mL含有不同浓度(0、1.0、5.0、10.0 μg/mL)BLF的细胞培养液,于37 ℃、5% CO2细胞培养箱中培养12 h。然后按照LDH试剂盒说明使用酶标仪在440 nm处测定吸光度值(OD440 nm),计算酶活力单位。细胞LDH释放率计算公式如下:
细胞LDH释放率(%)=细胞培养基中测定的酶活力单位/(细胞裂解液测定的酶活力单位+细胞培养基测定的酶活力单位)×100。
1.3.5 BLF对BMECs凋亡的影响
将BMECs接种于6孔板中,37 ℃、5% CO2细胞培养箱中培养,待细胞密度达到80%时,用PBS进行清洗并添加2 mL含有不同浓度(0、1.0、5.0、10.0 μg/mL)BLF的DMEM/F-12(含有10% FBS,1%青-链霉素)培养液,于37 ℃、5% CO2细胞培养箱中培养12 h。按照Annexin V-FITC凋亡检测试剂盒说明书,在200 μL含有5 μL Annexin V-FITC的结合缓冲液中室温和黑暗条件下染色20 min,在4 ℃的黑暗中再染色15 min,然后加入10 μL PI,用流式细胞仪进行检测。
1.3.6 BLF对BMECs ROS含量的影响
按照1.3.5的步骤将BMECs进行培养和处理。随后,加入二氯二氢荧光素-乙酰乙酸酯(DCFH-DA),在37 ℃孵育30 min后,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。然后用流式细胞仪检测20 000个细胞的2′,7′-二氯荧光素(DCF)荧光分布,激发波长为488 nm,发射波长为525 nm。
1.3.7 BLF对BMECs MMP水平的影响
按照1.3.5的步骤将BMECs进行培养和处理。随后,加入JC-1染料工作液,37 ℃孵育30 min,之后在37 ℃下用10 μmol/L的细胞凋亡诱导剂(CCCP)处理细胞30 min,再用JC-1染料工作液于37 ℃孵育30 min后,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的JC-1染料,使用流式细胞仪在530 nm处测量MMP水平。
1.3.8 BLF对BMECs抗氧化酶活性的影响
按照1.3.5的步骤将BMECs进行培养和处理。随后,按照试剂盒说明使用酶标仪分别在532、550和412 nm的吸收波长下测定MDA、T-SOD和GSH-Px的吸光度,并计算MDA含量及T-SOD和GSH-Px活性。
1.3.9 BLF对BMECs凋亡及mTOR通路相关基因相对表达量的影响
按照1.3.5的步骤将BMECs进行培养和处理。然后,按照总RNA提取试剂盒提取细胞总RNA,之后采用cDNA合成试剂盒反转录为cDNA,反应条件为:37 ℃,15 min;85 ℃,5 s。然后,以三磷酸-甘油醛脱氢酶(GAPDH)作为内参,采用实时荧光定量PCR方法检测凋亡及mTOR通路相关基因相对表达量。实时荧光定量PCR采用两步法进行,反应条件:95 ℃预变性30 s,1个循环;60 ℃退火30 s,60 ℃延伸5 s,40个循环。引物序列及参数见表1。采用2-ΔΔCt法计算目的基因的相对表达量。

表1 引物序列及参数Table 1 Primer sequences and parameters
1.4 数据处理与分析
试验结果用平均值±标准误表示。首先,采用Excel 2019进行试验数据的初步整理,并应用统计软件GraphPad Prism 7.0进行单因素方差分析(one-way ANOVA),P<0.05代表差异显著,P<0.01代表差异极显著。
2 结果与分析
2.1 BLF对BMECs活性的影响
如图1所示,与对照组相比,只有添加100.0 μg/mL的BLF组细胞存活率逐渐降低且低于对照组,添加0.5、1.0、5.0、10.0、20.0、60.0 μg/mL的BLF均可提高细胞存活率,且不同浓度BLF与BMECs共培养12 h后,细胞存活率最高。因此,12 h是BLF作用的最适时间;其中,添加1.0、5.0、10.0 μg/mL的BLF与BMECs共培养12 h后,细胞存活率为128.60%~141.51%,效果较好。因此选择添加BLF的浓度为1.0、5.0和10.0 μg/mL进行后续的试验。
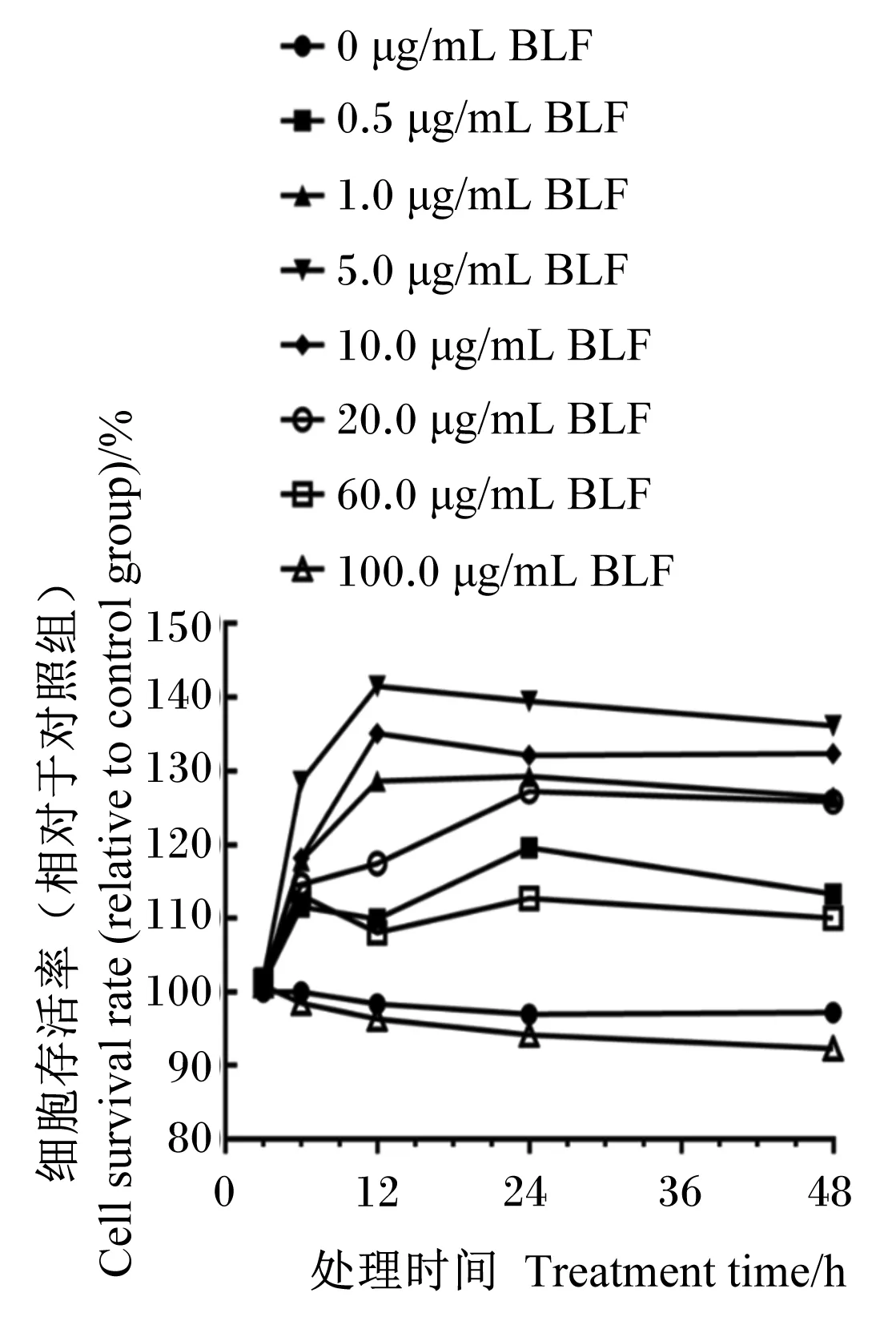
图1 BLF对BMECs活性的影响Fig.1 Effects of BLF on BMECs viability
2.2 BLF对BMECs毒性的影响
如图2所示,BLF对BMECs无毒性作用。在37 ℃条件下添加5.0和10.0 μg/mL的BLF均可显著降低LDH的释放率(P<0.05),其中5.0 μg/mL BLF效果最好。
2.3 BLF对BMECs凋亡的影响
Annexin V和PI双重染色将细胞分为3类:Annexin V和PI均为阴性的活细胞;Annexin V为阳性,PI为阴性的早期凋亡细胞;Annexin V和PI均为阳性的晚期凋亡/坏死细胞(图3-A)。如图3-B所示,与对照组相比,在37 ℃条件下添加5.0、10.0 μg/mL BLF与BMECs共培养,极显著降低细胞早期凋亡率和晩期凋亡/坏死率(P<0.01)。添加1.0、5.0和10.0 μg/mL的BLF极显著降低总凋亡率(P<0.01)。
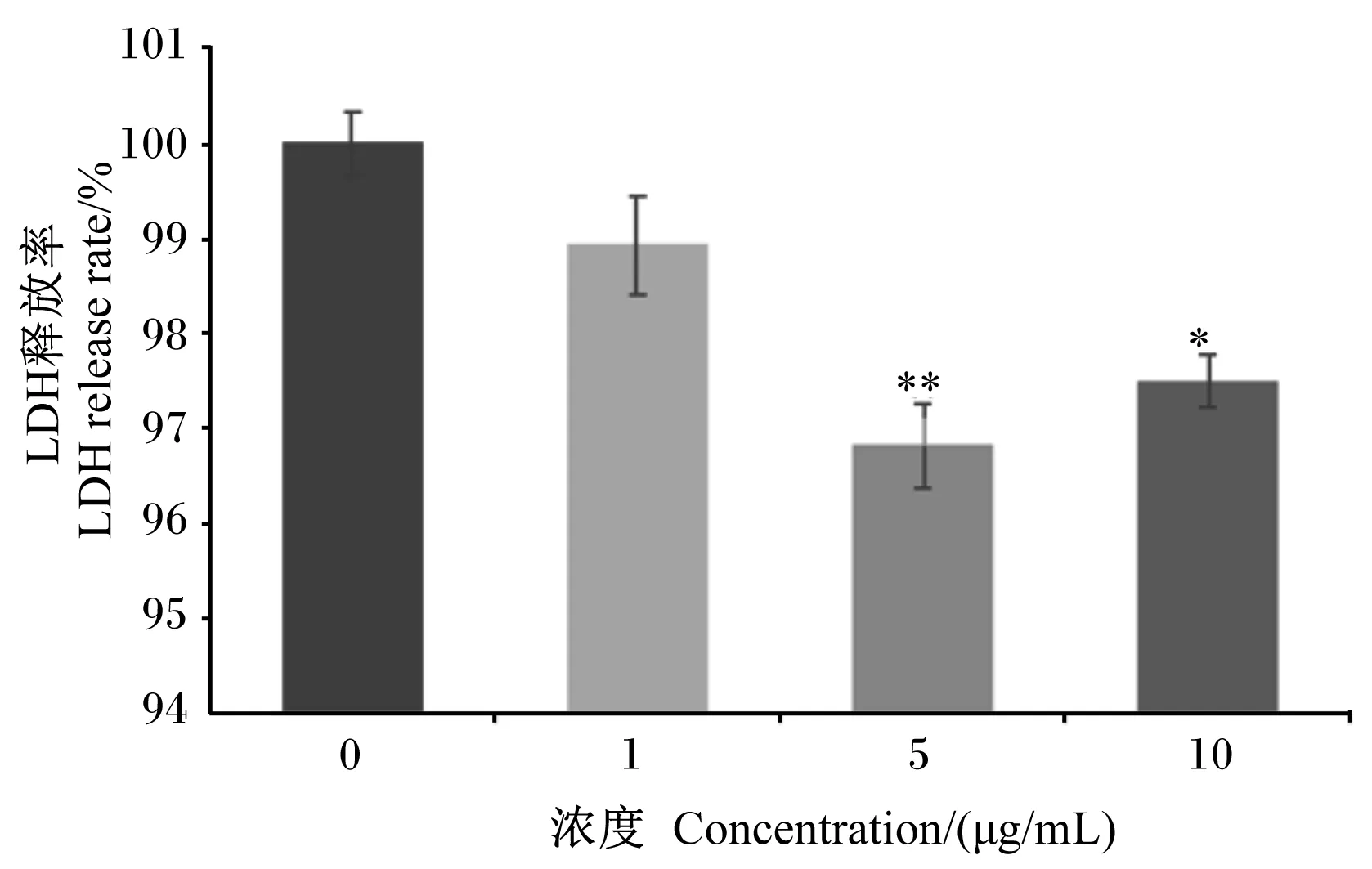
与对照组比较,“*”为差异显著(P<0.05),“**”为差异极显著(P<0.01)。下图同。Compared with control group, “*” mean significant difference (P<0.05), and with “**” mean extremely significant difference (P<0.01). The same as below.图2 BLF对BMECs毒性的影响Fig.2 Effects of BLF on BMECs cytotoxicity
2.4 BLF对BMECs ROS含量的影响
如图4所示,与对照组相比,添加5.0 μg/mL BLF与BMECs共培养,可以极显著减少细胞内ROS的产生(P<0.01)。
2.5 BLF对BMECs MMP水平的影响
如图5所示,与对照组相比,添加5.0 μg/mL BLF与BMECs共培养,可以极显著降低细胞内MMP水平(P<0.01)。
2.6 BLF对BMECs抗氧化指标的影响
如图6所示,与对照组相比,添加1.0、5.0、10.0 μg/mL BLF与BMECs共培养,可以极显著升高T-SOD、GSH-Px的活性(P<0.01),极显著降低MDA含量(P<0.01)。
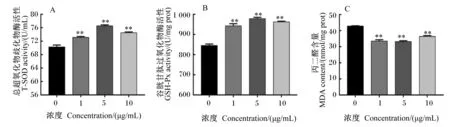
图6 BLF对BMECs中T-SOD、GSH-Px活性和MDA含量的影响Fig.6 Effects of BLF on T-SOD and GSH-Px activities and MDA content in BMECs
2.7 BLF对BMECs凋亡相关基因相对表达量的影响
如图7所示,添加5.0 μg/mL的BLF可显著降低B细胞淋巴瘤/白血病-2相关X蛋白(Bax)基因相对表达量(P<0.05);1.0、5.0和10.0 μg/mL的BLF均可极显著提高B淋巴细胞瘤/白血病-2(Bcl-2)基因的相对表达量(P<0.01),极显著降低Bax/Bcl-2的比值(P<0.01);添加5.0和10.0 μg/mL的BLF显著降低环氧合酶-2(COX-2)的基因相对表达量(P<0.05),极显著降低半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)的基因相对表达量(P<0.01)。由此说明,添加BLF可降低奶牛BMECs凋亡相关基因相对表达量。
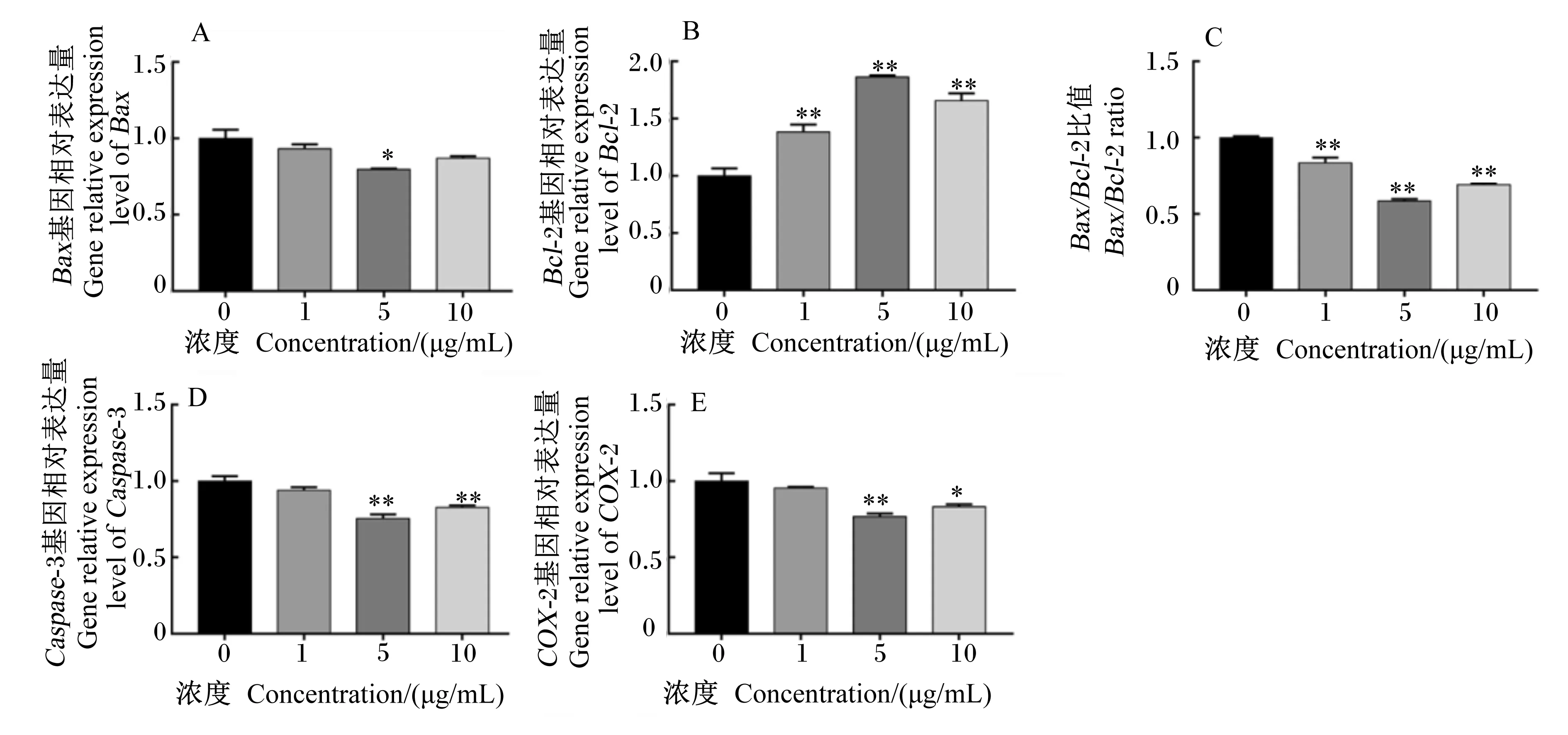
图7 BLF对BMECs凋亡相关基因相对表达量的影响Fig.7 Effects of BLF on relative expression levels of apoptosis related genes in BMECs
2.8 BLF对BMECs中mTOR信号通路中相关基因相对表达量的影响
如图8所示,添加1.0、5.0和10.0 μg/mL的BLF能极显著上调mTOR、细胞周期蛋白D1(CyclinD1)、核糖体蛋白S6激酶1(S6K1)和β-酪蛋白(β-casein)的基因相对表达量(P<0.01);添加5.0和10.0 μg/mL的BLF极显著升高真核翻译起始因子4E结合蛋白1(EIF-4EBP1)的基因相对表达量(P<0.01)。由此说明,添加BLF可通过mTOR信号通路调控关键基因的表达,从而影响BMECs中乳蛋白合成。
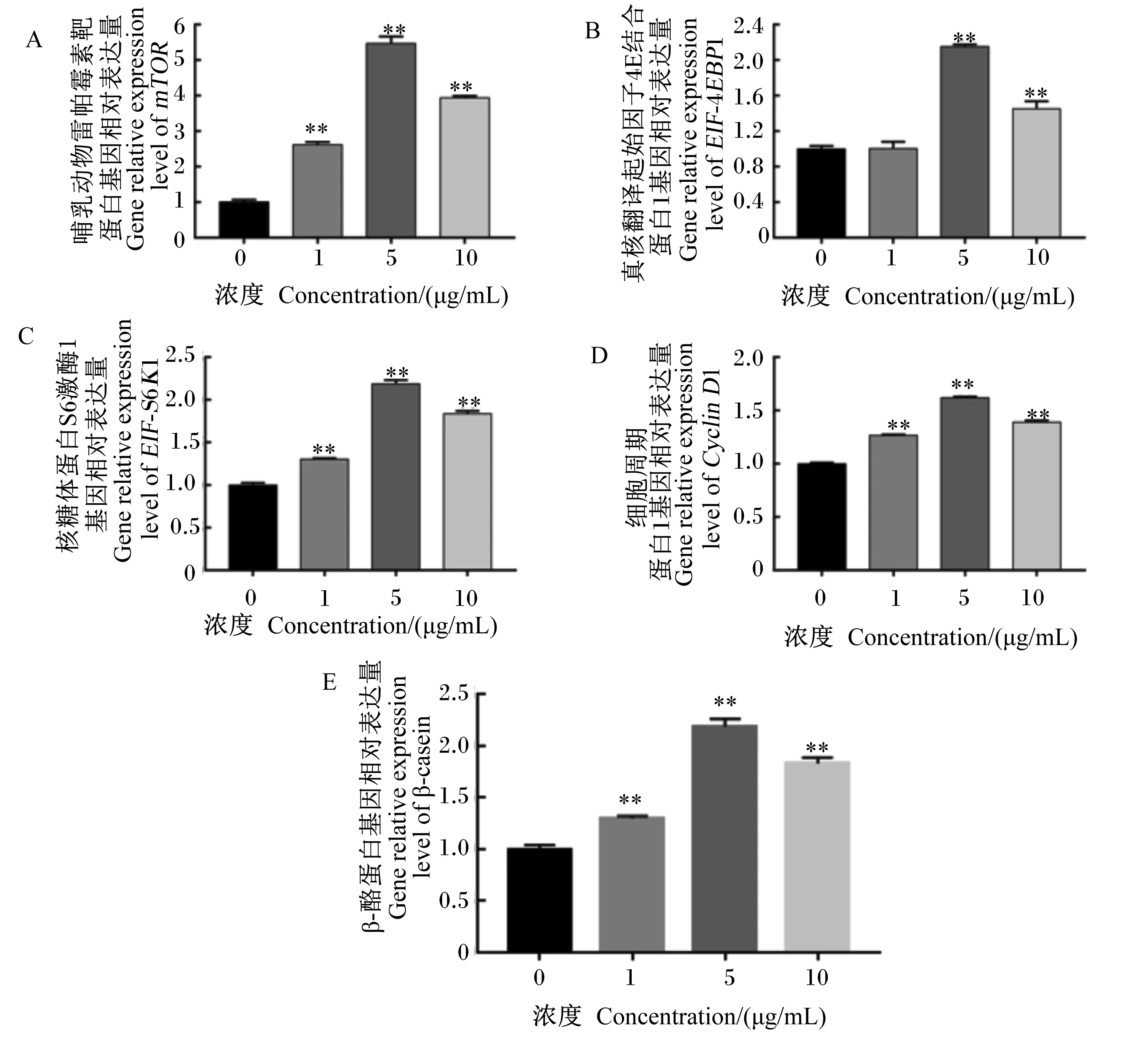
图8 BLF对BMECs中mTOR信号通路关键调控基因相对表达量的影响Fig.8 Effects of BLF on relative expression levels of key regulatory genes in mTOR signaling pathway
3 讨 论
BLF作为一种天然植物提取物,已被证实具有清除氧自由基、提高机体免疫力以及抗氧化等生物学功能[20-21],但对其对BMECs抗氧化及乳蛋白的合成及其作用机制尚未明确。为进一步揭示BLF对BMECs的抗氧化及乳蛋白合成的影响,本研究展开了对细胞活性和毒性、细胞凋亡、ROS含量、MMP水平以及抗氧化能力的检测,并通过实时荧光定量PCR的方法检测了凋亡相关基因和mTOR信号通路相关基因相对表达量的变化。本研究结果发现,添加1.0、5.0、10.0 μg/mL的BLF与BMECs共培养12 h后,可显著提高细胞增殖能力及其活性,无毒性作用,且5.0 μg/mL效果最好。这与张师[22]研究结果相一致,BLF可以显著提高四氯化碳(CCl4)所致小鼠肝损伤的细胞存活率。此外,于冯[23]的研究结果表明,0.1~10.0 μg/mL的BLF能够促进小鼠胚胎成纤维细胞增殖。因此,BLF可提高细胞存活率,对细胞增殖具有促进作用。

A图为流式细胞仪检测Annexin V/PI双染结果;B图为BLF对细胞凋亡率的影响。Figure A showed the results of Annexin V/PI double staining by flow cytometry; figure B showed the effects of BLF on apoptosis rate of cells.图3 BLF对BMECs凋亡的影响Fig.3 Effects of BLF on BMECs apoptosis
泌乳期奶牛BMECs对能量的需求增加,细胞代谢速度提高,导致ROS生成量增多[24]。当机体生成和清除ROS的动态平衡被打破时,将引起氧化应激的发生,过量的ROS会使BMECs损伤,甚至导致细胞凋亡[25]。同时,过量的ROS会攻击细胞膜上多不饱和脂肪酸,引起脂质过氧化,从而产生MDA[26]。此外,动物体内存在抗氧化酶系统,包括SOD、CAT以及GSH-Px[27],清除过量的ROS,使细胞免受氧化损伤[28]。因此,有效降低氧化应激的损伤,提高BMECs的抗氧化能力,对提高奶牛的泌乳性能具有重要的作用。本研究结果显示,BLF可以极显著降低BMECs内ROS的生成,并极显著升高T-SOD、GSH-Px活性及降低MDA的含量,从而减轻BMECs细胞凋亡和线粒体损伤,提高抗氧化能力。张守丽等[29]研究表明,BLF可以显著降低人肝癌HepG2细胞的MDA和ROS含量,从而缓解油酸诱导的氧化应激。王丹丹[11]发现一定浓度的BLF可以提高被过氧化氢(H2O2)氧化损伤的细胞SOD、CAT和GSH-Px活性,降低细胞MDA含量。张硕[30]研究表明,BLF可以显著提高仙居鸡血清SOD、CAT和GSH-Px活性,降低MDA含量,与本研究结果一致。MMP是指线粒体内膜两侧质子分布不对称而形成的电化学梯度,细胞凋亡早期MMP水平就会发生改变,出现下降现象[31]。王丹丹[11]研究表明,200.0 μg/mL的BLF可以提高被H2O2氧化损伤的大鼠嗜铬瘤细胞系PC12细胞的MMP水平。Yu等[32]发现,BLF可以显著降低HepG2细胞的MMP水平。与本研究结果BLF可以极显著降低BMECs内MMP水平相一致。因此,BLF可减少BMECs内ROS积累和MMP水平,提高抗氧化能力,从而减轻BMECs凋亡和线粒体损伤。
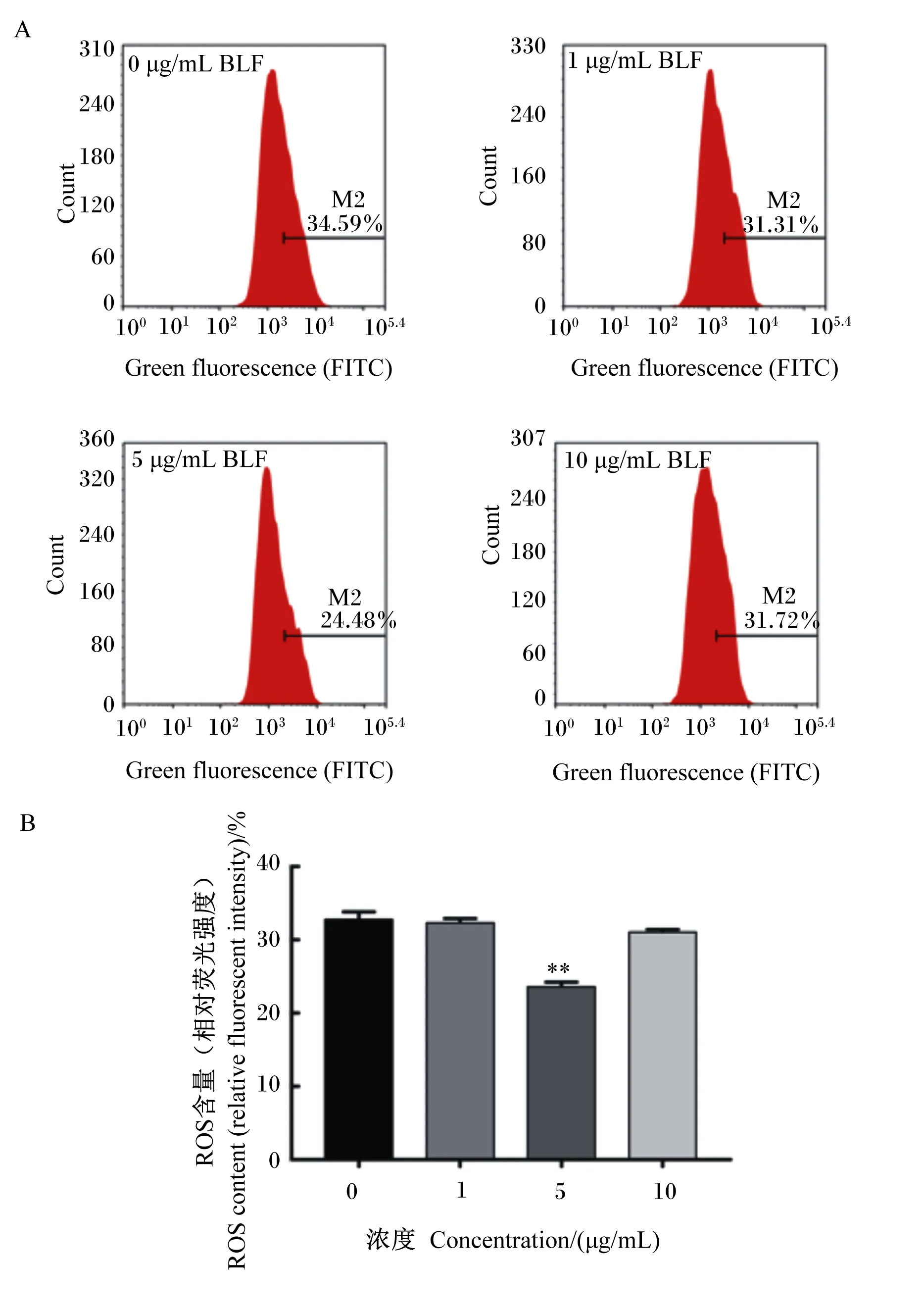
A图为流式细胞仪检测ROS结果;B图为BLF对ROS含量的影响。Figure A showed the results of ROS detected by flow cytometry; Figure B showed the effects of BLF on ROS content.图4 BLF对BMECs ROS含量的影响Fig.4 Effects of BLF on ROS content in BMECs
在细胞生长发育过程中正常的细胞凋亡发挥了维持细胞数量稳定的作用[33]。BMECs的数量和活力,决定了奶牛的泌乳性能。因此,抑制细胞凋亡,促进细胞的增殖对提高BMECs的泌乳能力具有重要的意义。现有研究表明,细胞凋亡的信号调控有3个关键的调控节点:Bcl-2家族、Caspase家族和线粒体途径。
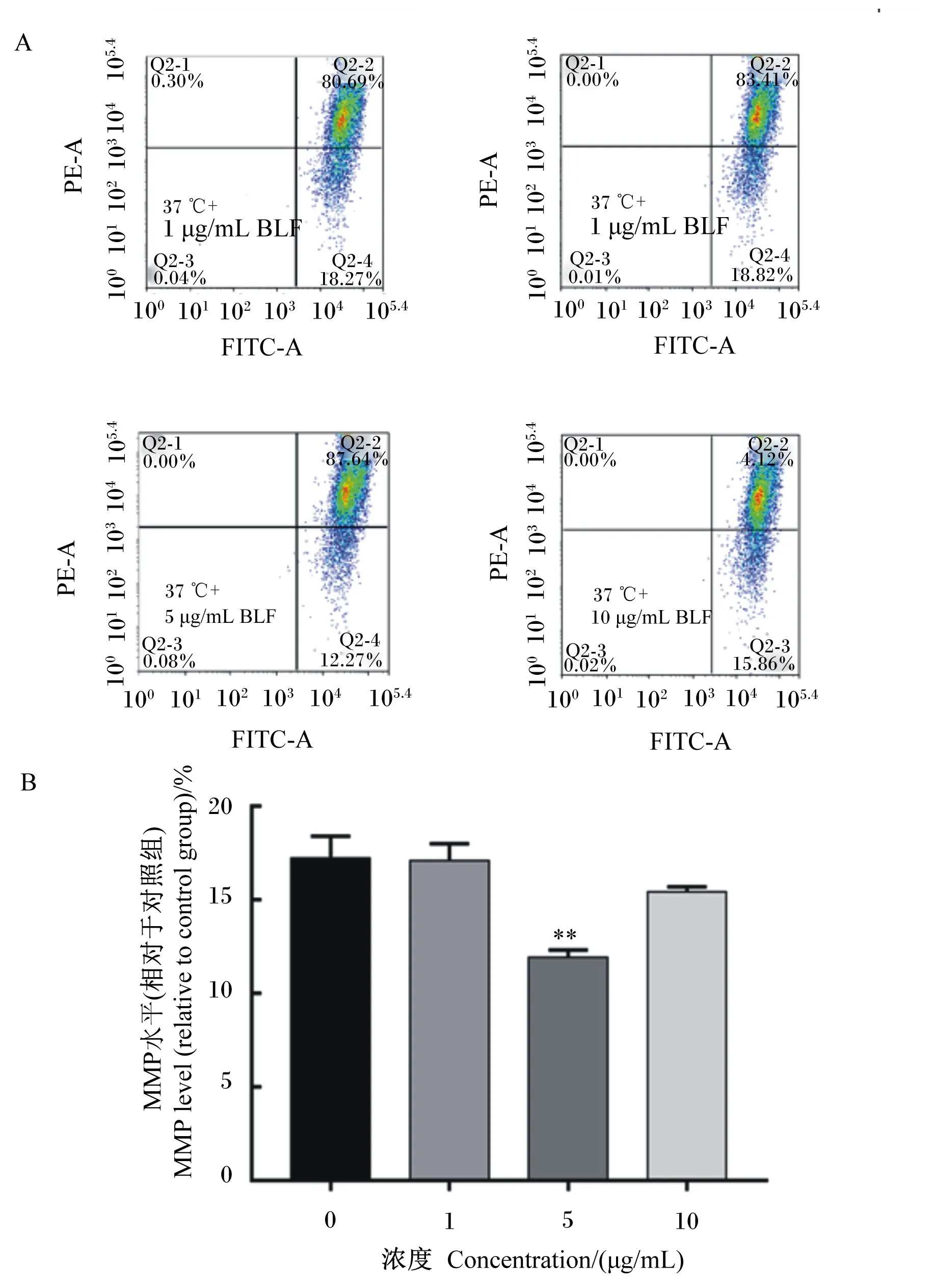
A图为流式细胞仪检测MMP 的结果(FITC-A,绿色荧光;PE-A,红色荧光);B图为BLF对细胞内MMP水平的影响。Figure A showed the results of MMP by flow cytometry (FITC-A, green fluorescence; PE-A, red fluorescence); Figure B showed the effects of BLF on intracellular MMP level.图5 BLF对BMECs MMP水平的影响Fig.5 Effects of BLF on MMP level in BMECs
Bax是Bcl-2家族中的促凋亡成员[34-36],Bcl-2可阻断Bax的促凋亡作用以及阻止细胞色素c的释放,从而抑制细胞凋亡[37]。通过抑制促凋亡因子的释放,Bcl-2蛋白家族可抑制Caspase蛋白的活性,发挥抗凋亡的作用[35]。本研究结果发现,添加BLF可显著降低Bax和Caspase-3基因相对表达量,并且可极显著提高Bcl-2的基因相对表达量,证明BLF对细胞凋亡具有显著的抑制作用。而且研究表明,Bax/Bcl-2的比值较高可能会诱导Caspase-3的水平升高[38]。本试验结果也表明,BLF显著降低了Bax/Bcl-2的比值,抑制了Caspase-3基因相对表达量。此外,COX-2是前列腺素合成途径中的一种关键酶,在正常细胞内活性较低[39]。但在细胞受到炎性反应等刺激时,会诱导COX-2表达量提高[40]。庞磊[41]研究发现,缺氧/复氧后COX-2表达量上升,引发细胞凋亡,而使用COX-2活性抑制剂后,可降低缺氧/复氧介导的H9C2心肌纤维细胞凋亡。本研究中添加BLF可显著降低COX-2基因相对表达量,从而提高了细胞的存活率。因此,BLF可显著抑制凋亡相关基因的表达,对细胞的凋亡具有抑制作用。
据报道,mTOR信号通路与BMECs的细胞增殖和乳蛋白合成密切相关[42]。乳蛋白主要包括酪蛋白和乳清蛋白,其中β-酪蛋白含量一般较高。乳蛋白合成通路主要有3条[43],分别是Janus激酶/信号转导与转录激活因子(JAK-STAT)信号通路、mTOR信号通路以及阻遏蛋白激酶2/真核翻译起始因子2α(GCN2-eIF2a)信号通路。值得注意的是,mTOR信号通路主要在调控蛋白质翻译中起作用[43-44],mTOR广泛存在于机体细胞中,可参与基因的转录、翻译、核糖体合成、凋亡等多种生命活动[44]。目前研究发现,mTOR包括2种复合物,分别是mTORC1和mTORC2[45],其中mTORC1主要调控蛋白质合成和细胞增殖。现有研究表明,mTOR上游信号通路是磷脂酰肌醇-3激酶/蛋白激酶B(PI3K-AKT),PI3K被激活后,进一步作用于蛋白激酶B(AKT),而活化的AKT基因可以直接作用于mTOR,使下游的EIF-4EBP1及S6K1磷酸化,从而促进乳蛋白的合成[43,46]。本研究结果表明,在体外培养条件下,添加1.0、5.0、10.0 μg/mL的BLF可极显著提高BMECs中mTOR信号通路关键调控基因mTOR和S6K1的基因相对表达量,添加5.0、10.0 μg/mL的BLF可极显著提高BMECs中mTOR信号通路关键调控基因EIF-4EBP1基因相对表达量,添加1.0、5.0、10.0 μg/mL的BLF可极显著提高β-酪蛋白基因相对表达量,由此可见,BLF可通过mTOR信号通路中关键基因的调节,从而影响BMECs合成乳蛋白的能力。
贾若愚[47]研究发现,在奶牛饲粮中添加30.0和60.0 g/d的BLF可以分别提高0.03和0.06 kg/d的乳蛋白产量。然而,BLF如何通过mTOR信号通路的关键因子影响乳蛋白的合成有待进一步的验证。特别是,随着质谱技术的飞速发展,高通量蛋白组学鉴定和蛋白质翻译后修饰蛋白质组学,为更好地揭示生命现象的本质与规律,提供了全新的研究思路和技术手段。因此,本研究为进一步应用组学方法研究BLF影响BMECs合成乳蛋白的相关研究奠定了基础。综上所述,添加BLF可显著上调BMECs中mTOR信号通路转导,提高该信号通路关键基因相对表达量,但具体的作用机制还有待进一步的深入研究。
4 结 论
在体外培养的条件下,添加BLF可显著提高BMECs的活性;同时,BLF可以通过降低BMECs内ROS的生成、MMP水平,降低凋亡相关基因的表达,达到减少细胞凋亡和线粒体损伤的作用;此外,BLF可以通过mTOR信号通路,影响乳的合成,其中添加5.0 μg/mL的BLF效果最为显著。
