乳腺导管内良恶性肿瘤超声图像特征的对比分析
2022-02-16高文婧肖晓君
高文婧 张 旭 李 剑 肖晓君 施 杨 张 慧 罗 慧
乳腺导管内癌是来源于导管上皮及终末导管上皮的恶性肿瘤性病变,异常增生的上皮细胞局限于导管内,未侵犯基底膜和周围间质细胞[1]。乳腺导管内乳头状瘤是一种起源于近乳头端大导管(一级及二级乳管)上皮的良性肿瘤[2],因其瘤体较小,位置较隐蔽,临床诊断较困难[3]。随着超声技术的不断发展和人们健康意识的提高,越来越多的乳腺肿块被早期发现,乳腺导管内肿瘤的检出率也逐年上升。由于早期乳腺导管内肿瘤的超声表现复杂,特异性低,良恶性肿块的超声图像特征存在交叉、重叠,加之乳腺导管内癌与乳腺导管内乳头状瘤临床表现也较相似,故对二者的鉴别诊断存在困难。本研究通过对比分析68例经手术病理证实的乳腺导管内肿瘤的超声图像特征和临床资料,旨在提高早期乳腺导管内良恶性肿瘤的诊断准确率。
资料与方法
一、研究对象
选取2019年1月至2020年1月于我院经手术及病理证实的乳腺导管内肿瘤患者68例,根据病理结果分为:乳腺导管内乳头状瘤组45例,均为女性,年龄25~64岁,平均(43.7±10.4)岁;乳腺导管内癌组23例,男1例,女22例,年龄29~70岁,平均(46.6±10.0)岁。纳入标准:均经病理确诊,有完整的超声及临床资料。排除标准:①导管内癌伴浸润性癌;②病理结果有疑问未经免疫组化检查者;③临床或超声检查资料不全者。本研究经我院医学伦理委员会批准,入选者及其家属均知情同意。
二、仪器与方法
1.临床资料收集:记录患者年龄、性别、乳头溢血等一般临床资料和乳腺钼靶、MRI等相关影像资料,以及病理及免疫组化结果。
2.超声检查:使用GELogiq E 9、Philips iU 22彩色多普勒超声诊断仪,L12-5线阵探头,频率7.5~10.0 MHz。嘱受检者取平卧位,充分暴露乳腺组织,按顺时针、放射状仔细扫查乳腺组织,观察病变位置、形态、大小、边缘、边界、内部回声(低回声、极低回声及囊实混合型回声)、内部血流、后方回声、内部微钙化及导管扩张情况。本研究发现入选样本中乳腺导管内癌病灶多集中于近乳头处的乳晕区,且分布于乳晕区2 cm内,故本研究定义以乳头为中心直径2 cm区域内为相对乳晕区,直径2 cm区域外为相对外周区。以上操作均由两名主治以上专业乳腺超声医师共同完成,若有争议,则经上级医师会诊后确定。
三、统计学处理
结 果
一、两组临床资料和超声表现比较
两组在年龄、乳头溢血比例方面比较,差异均无统计学意义。
两组在病变长径、前后径、位置、内部回声、微小钙化灶、后方回声、边界方面比较,差异均有统计学意义(均P<0.05);两组在病变内部血流、形态、边缘、侧边声影、导管扩张方面比较,差异均无统计学意义。见表1和图1~4。
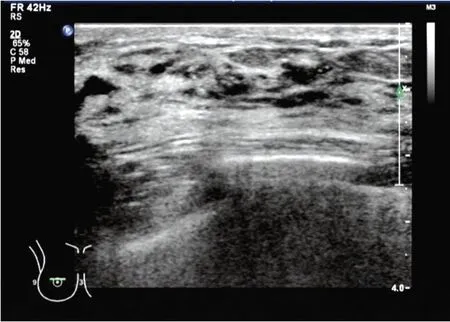
图1 超声示乳腺导管内癌患者(女,51岁)右侧乳腺内象限见多个弥漫性分布点状强回声,不伴声影,边界不清,未见明显局限性肿块

表1 两组临床资料和超声表现比较
二、乳腺导管内癌的独立相关因素分析
进一步将上述单因素分析中差异有统计学意义的超声指标(病变长径、前后径、位置、微小钙化灶、内部回声、后方回声、边界)纳入多因素Logistic回归分析,模型筛选采用逐步回归向前法,结果显示病变长径和位置是乳腺导管内癌的独立相关因素。见表2。
三、ROC曲线分析
ROC曲线分析结果显示,以病变长径14.65 mm为截断值,其鉴别诊断乳腺导管内良恶性肿瘤的敏感性为60.9%,特异性为71.1%,曲线下面积为0.694(95%可信区间0.558~0.829,P=0.009)。绘制病变位置是否位于乳腺相对外周区的二变量ROC曲线,其诊断乳腺导管内癌的敏感性为73.9%,特异性为62.2%,曲线下面积为0.681(95%可信区间0.547~0.815,P=0.015)。见表2和图5。
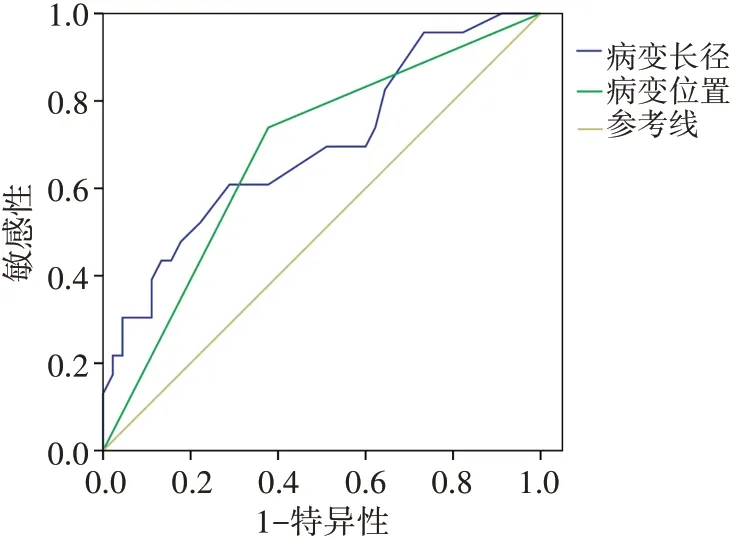
图5 病变长径和位置诊断乳腺导管内癌的ROC曲线图
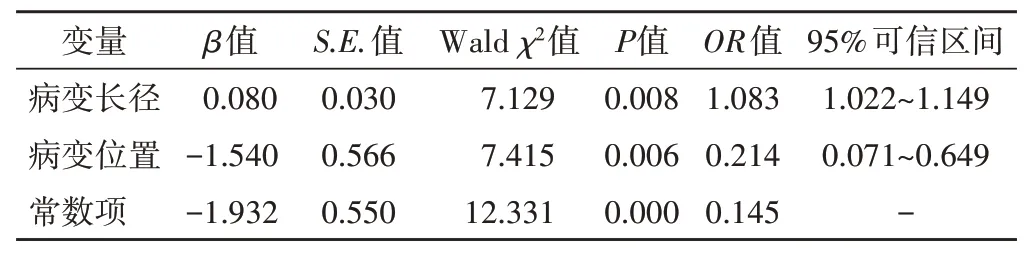
表2 多因素Logistic回归分析结果
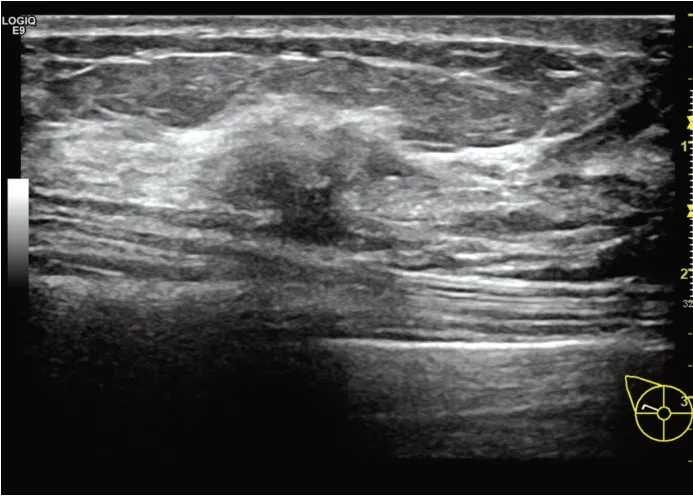
图2 超声示乳腺导管内癌患者(女,45岁)右侧乳腺外上象限距乳头24 mm处见一大小为16 mm×8 mm肿块,形态不规则,边界不清,内部呈低回声,中心区呈低回声,内见多个点状强回声,后方回声衰减

图3 超声示乳腺导管内乳头状瘤患者(女,49岁)右侧乳腺乳晕后方导管扩张,内径2.5 mm,内见一大小为12 mm×3 mm低回声肿块,边界清,形态欠规则,后方回声无变化;CDFI于其内探及较丰富血流信号

图4 超声示乳腺导管内乳头状瘤患者(女,49岁)右侧乳腺下象限乳晕后方导管扩张,内径2.4 mm,内见一大小为15 mm×6 mm肿块,边界清,形态规则,内部以低回声为主,后方回声无变化
讨 论
乳腺导管内癌近年来发病率逐渐上升,占乳腺癌总数的20%~30%[4]。本病起源于乳腺末梢导管小叶单位,多由不典型增生的导管上皮细胞发展而来,未侵犯基底膜和周围间质,未侵袭周边组织,因此并无典型的乳腺癌“高回声晕”超声表现,预后效果较其他类型乳腺癌相对较好。乳腺导管内癌对周围组织牵拉成角亦不明显,也不具有典型的乳腺癌“边缘毛刺或蟹足样”超声表现;加之多沿导管侵袭生长,纵横比多<1。由于缺乏乳腺癌特异性超声表现,临床对乳腺导管内癌和乳腺导管内乳头状瘤的鉴别诊断存在一定困难,超声定性诊断符合率较低,误诊率高[5]。
本研究通过分析68例乳腺导管内肿瘤患者的超声图像特征及临床资料发现,病变位置和长径是乳腺导管内癌的独立相关因素。本研究中乳腺导管内癌组的病变长径大于乳腺导管内乳头状瘤组,差异有统计学意义(P<0.05)。究其原因,病变较大时,或当累及分支导管的肿瘤沿导管长轴广泛生长时,病灶侵袭性更高,更可能为不典型增生或恶性。本研究ROC曲线分析显示,将病变长径14.65 mm作为鉴别乳腺导管内良恶性肿瘤的截断值,其敏感性、特异性分别为60.9%、71.1%。同时,本研究发现乳腺导管内癌组病变多位于乳腺相对外周区,乳腺导管内乳头状瘤组病变多位于乳头后方及相对乳晕区,两组病变位置比较差异有统计学意义(P<0.05)。二变量ROC曲线分析结果显示,病变位置位于乳腺相对外周区诊断乳腺导管内癌的曲线下面积为0.681,敏感性为73.9%,特异性为62.2%。分析原因,乳腺导管内癌多起源于末梢导管小叶单位,而乳腺导管内乳头状瘤多发生于中央区大导管[6],多为孤立性病变,良性多见。即便少数起源于末梢腺叶单位的外周导管系统内,但多为多发性乳头样病变,故易发生癌变,由此可见,乳腺相对外周区的病变恶性风险更高。
本研究发现乳腺导管内癌组病变内部微小钙化灶比例高于乳腺导管内乳头状瘤组,差异有统计学意义(P<0.05)。分析其原因,恶性病变生长较快,内部易出现坏死,因钙盐沉积形成钙化[7]。本研究中2例患者超声未探及明显肿块,仅可见弥漫性分布微小钙化灶,声影不明显,边界不清,占位感不明显。分析其原因,此类病变所在的导管未扩张或虽有扩张但病变体积太小,导致超声无法分辨病变位置,仅以成簇、微小、针尖样或短棒状钙化影为首发超声表现[8]。虽然超声在探查乳腺软组织肿块方面的敏感性高,但当仅探及弥漫性分布成簇微小钙化,却未见明显肿块声像时,应高度警惕乳腺导管内癌的可能[9],联合钼靶X线检查可提高乳腺导管内癌的诊断准确率。本研究乳腺导管内癌组病变后方回声多异常(包括后方回声增强及衰减),乳腺导管内乳头状瘤组病灶后方回声多无变化,两组后方回声比较差异有统计学意义(P<0.05)。与杨培胜等[10]认为乳腺导管内恶性病灶后方回声增强或衰减的发生率高于良性病灶的结果相符。而姜秀清和高涛[11]则认为后方回声无异常是乳腺导管内癌的一个典型声像图表现,有待加大样本量进一步研究。此外,本研究乳腺导管内癌组超声表现为边界不清、内部极低回声比例明显多于乳腺导管内乳头状瘤组,与研究[12]结果一致。笔者在临床实践中发现,乳腺导管内病变多位置表浅,超声扫查过程应尽可能轻置探头于肿瘤表面,以免肿瘤内部组织受压致其血流信号显示稀疏甚至无明显血流信号显示,影响最终CDFI检查结果。本研究中两组血流方面比较差异无统计学意义,与郭航[13]研究结果不一致,分析原因可能是未将超声检查者主观因素考虑入内,有待今后扩大样本量并规范超声扫查手法后进一步统计分析。
综上所述,超声对乳腺导管内良恶性肿瘤的鉴别有一定的诊断价值,其中病变长径和位置是诊断乳腺导管内癌的独立相关因素,结合乳腺导管内癌病变内部多伴微小钙化、后方回声多异常、边界多不清等超声特征,可提高诊断准确率,对患者早期手术治疗,提高生存率有重要意义。
