剪切波弹性成像各向异性与乳腺癌预后因素关系的研究
2022-02-16任志翔刘晓芳陈耀东尹郭林贺红霞郝如意
任志翔 刘晓芳 陈耀东 尹郭林 贺红霞 郝如意 陈 武
剪切波弹性成像(shear wave elastography,SWE)通过测量剪切波在不同组织内的传播速度来评估组织硬度。有学者[1-2]发现临床应用中大多数软组织对施加的机械力表现出一定程度的粘弹性、各向异性和非线性响应,其中各向异性是影响横波在介质中传播速度的解剖学因素之一。由于乳腺导管和乳房悬韧带的组织学结构特征,使得乳腺腺体组织表现出不同程度的弹性各向异性[3]。研究[4-6]表明评估乳腺占位性病变的弹性各向异性有助于鉴别其良恶性,且恶性病变的各向异性与其侵袭程度呈正相关。关于乳腺癌预后因素的研究[7-8]也表明,病灶大小、腋窝淋巴结转移情况、组织学分级和免疫组化标志物等因素是评估乳腺癌预后组织学特征的重要指标。基于此,本研究拟探讨SWE各向异性与乳腺癌病灶大小、组织学分级、淋巴结受累情况和免疫组化标志物表达等预后因素间的关系。
资料与方法
一、研究对象
选取2019年9月至2020年9月于山西医科大学第一医院腺体外科经手术及病理检查确诊的乳腺癌患者69例,均为女性,年龄29~82岁,平均(56.1±12.0)岁。共纳入73个病灶,均经病理确诊,包括浸润性导管癌(IDC)65个,导管内原位癌5个,髓样癌2个,黏液癌1个。纳入标准:术前均行常规超声、SWE检查且检查前未行任何治疗,有完整的术后病理及免疫组化结果。排除标准:妊娠期或哺乳期;有假体植入史;SWE颜色模式无法完整覆盖的大病灶(最大径>4 cm)。本研究经医院医学伦理委员会批准,受检者均知情同意。
二、仪器与方法
1.SWE检查及图像分析:使用法国声科Aixplorer彩色多普勒超声诊断仪,SL15-4探头,频率4~15 MHz;配备SWE功能。患者取仰卧位,双臂上举,充分暴露乳房,以乳头为中心放射状扫查双侧乳腺,行常规超声观察病灶二维及彩色多普勒图像特征,记录病灶最大径。然后行SWE检查,将探头轻置于病灶上方,嘱患者屏息,分别取病灶的最大直径切面和正交直径切面,调节取样框大小使其覆盖整个病灶,探头静置3~5 s,待弹性彩色模式稳定后存储图像。采用仪器内置的“Q-Box”定量分析软件,手动描绘Q-Box方式人工勾画选定感兴趣区,使其包括整个病变及其周边弹性较硬的区域,测量病灶的弹性模量最大值(Emax)、平均值(Emean)、标准差(Esd),计算病灶最硬处与正常脂肪组织比值(Eratio)。本研究采用各向异性因子(AF)来量化乳腺癌病灶弹性参数的各向异性,AF定义为最大直径切面与正交直径切面弹性参数差值的平方[6],本研究计算Emax、Emean、Esd、Eratio的AF,即AFmax、AFmean、AFsd、AFratio。
2.免疫组化标志物检查:术后进行病理及免疫组化检查,检测ER、PR、Ki-67、Her-2表达情况。对检测结果进行判读,ER、PR结果判定:细胞核染色≥10%为阳性,<10%为阴性;Ki-67结果判定:细胞核棕黄色染色≥14%为阳性,<14%为阴性;HER-2结果判定:“-”或“+”为阴性,“+++”为阳性,其中“++”的结果有HER-2基因扩增为阳性,反之为阴性。
3.记录患者腋窝淋巴结病灶转移状态,统计IDC的组织学分级情况。
三、统计学处理
应用SPSS 22.0统计软件,计数资料以例或百分比表示,行χ2检验;计量资料以±s表示,两两比较采用t检验或非参数检验,多组间比较采用方差分析。P<0.05为差异有统计学意义。
结 果
一、不同大小乳腺癌病灶弹性参数的AF比较
本研究中肿块最大径的平均值为18.2 mm,中位数为17.1 mm,为便于分组,选取介于中位数和平均值间的整数18 mm作为界值,将肿块分为最大径≥18 mm病灶39个和最大径<18 mm病灶34个。最大径≥18 mm病灶与最大径<18 mm病灶的AFmax、AFmean、AFsd、AFratio比较,差异均有统计学意义(均P<0.05)。见表1。
表1 不同大小乳腺癌病灶弹性参数的AF比较(±s) kPa2
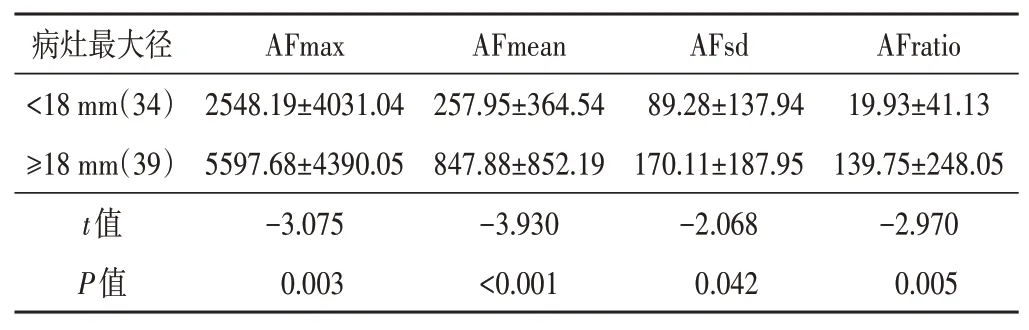
表1 不同大小乳腺癌病灶弹性参数的AF比较(±s) kPa2
AFmax、AFmean、AFsd、AFratio:弹性模量最大值、平均值、标准差及病灶最硬处与正常脂肪组织比值的各向异性因子
?
二、不同组织学分级IDC病灶弹性参数的AF比较
本研究65个IDC病灶中,组织学分级Ⅰ级14个、Ⅱ级38个、Ⅲ级13个,Ⅲ级IDC的AFmax、AFratio均高于Ⅰ、Ⅱ级,Ⅱ、Ⅲ级IDC的AFmean高于Ⅰ级,差异均有统计学意义(均P<0.05)。见表2和图1。
图1 二维超声心动图示右房内弱回声占位(箭头示)
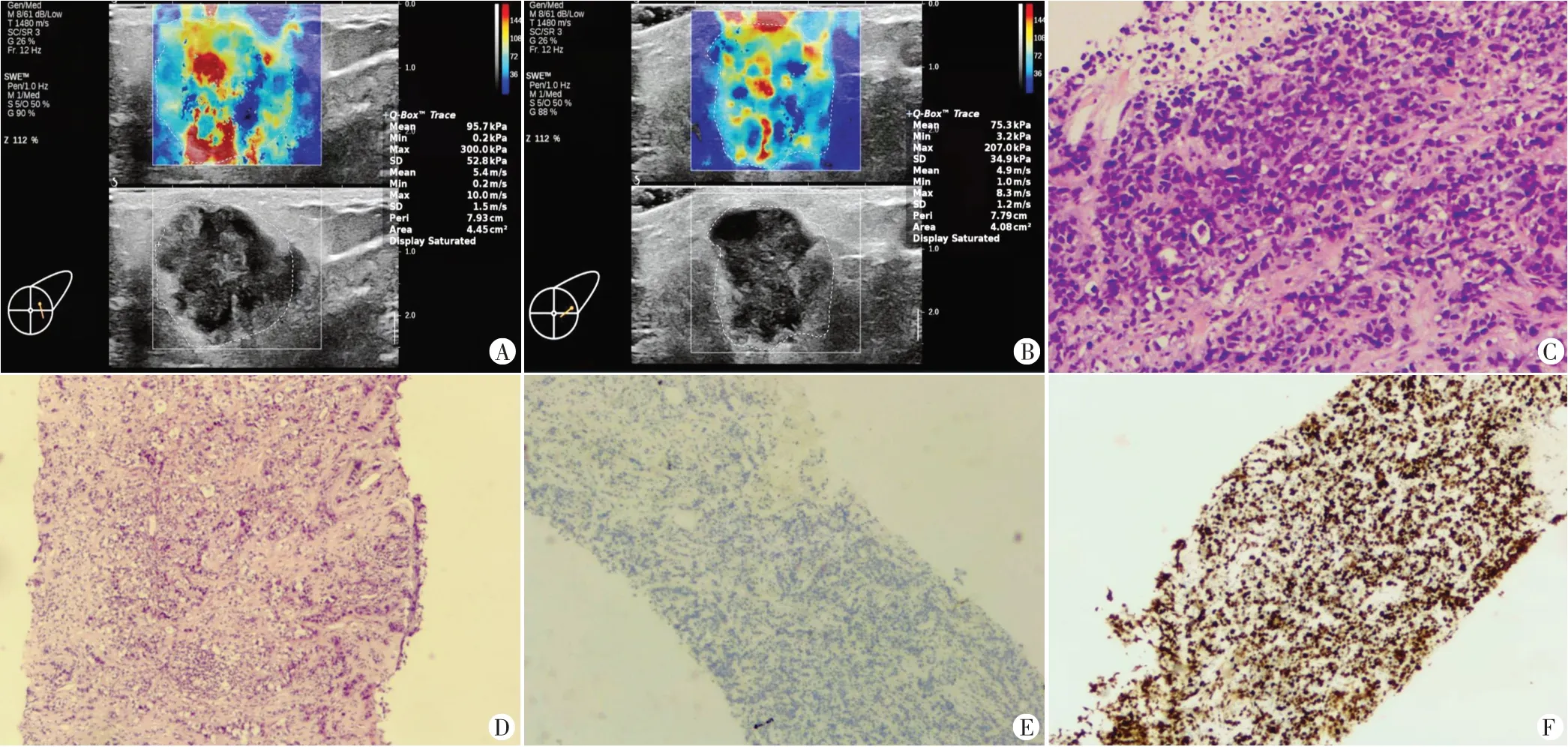
图1 IDC病灶(52岁,左乳2点钟方向,大小约3.08 cm×2.15 cm)的SWE图和病理、免疫组化图(HE染色,×40)
表2 不同组织学分级IDC病灶弹性参数的AF比较(±s) kPa2
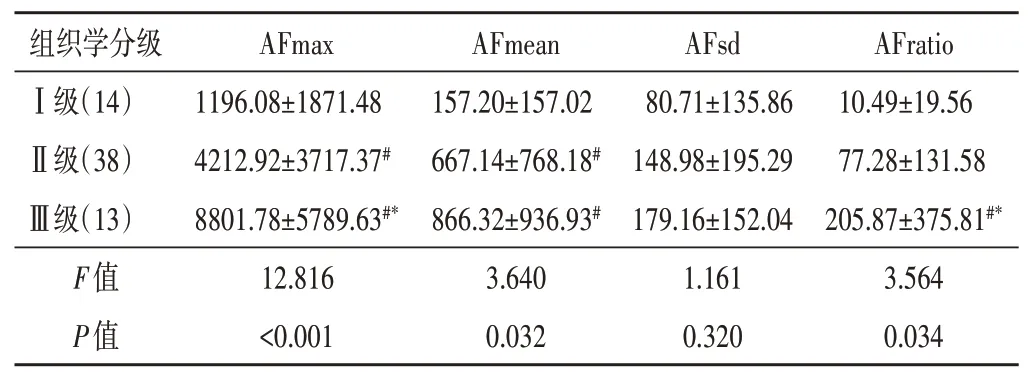
表2 不同组织学分级IDC病灶弹性参数的AF比较(±s) kPa2
与Ⅰ级比较,#P<0.05;与Ⅱ级比较,*P<0.05。AFmax、AFmean、AFsd、AFratio:弹性模量最大值、平均值、标准差及病灶最硬处与正常脂肪组织比值的各向异性因子
?
三、不同免疫组化标志物表达乳腺癌病灶弹性参数的AF比较
本研究73个病灶中,ER阳性表达52个,阴性表达21个;PR阳性表达42个,阴性表达31个;Ki-67阳性表达43个,阴性表达30个;HER-2阳性表达52个,阴性表达21个。ER阴性表达病灶的AFmax高于ER阳性表达病灶,Ki-67阳性表达病灶的AFmax、AFmean均高于Ki-67阴性表达病灶,差异均有统计学意义(均P<0.05)。HER-2、PR阳性表达与阴性表达病灶的AFmax、AFmean、AFsd、AFratio比较,差异均无统计学意义。见表3。
表3 不同免疫组化标志物表达乳腺癌病灶弹性参数的AF比较(±s) kPa2
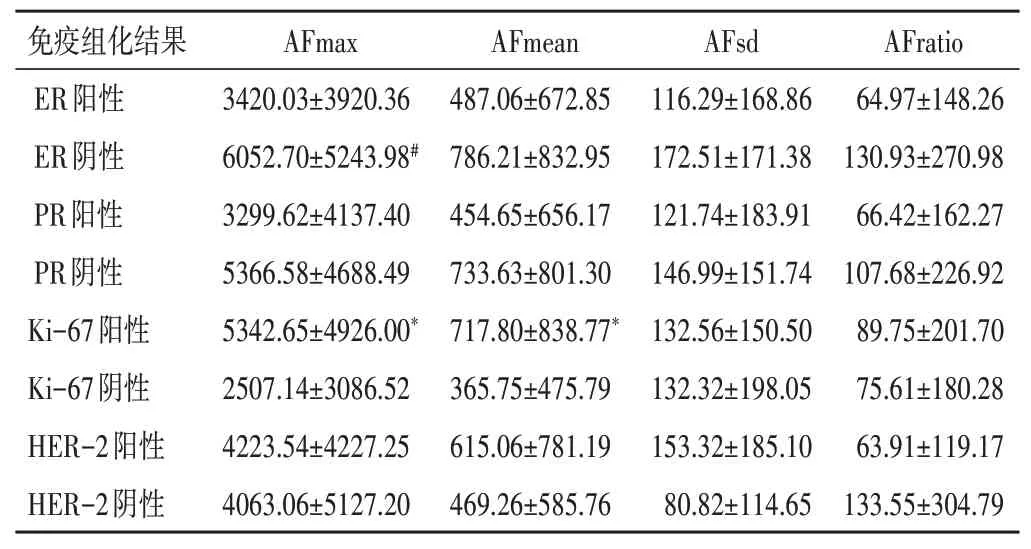
表3 不同免疫组化标志物表达乳腺癌病灶弹性参数的AF比较(±s) kPa2
与ER阳性比较,#P<0.05;与Ki-67阴性比较,*P<0.05;AFmax、AFmean、AFsd、AFratio:弹性模量最大值、平均值、标准差及病灶最硬处与正常脂肪组织比值的各向异性因子
?
四、不同淋巴结状态乳腺癌病灶弹性参数的AF比较
69例乳腺癌患者中,共32个病灶发生淋巴结转移,淋巴结转移病灶的AFmax、AFmean、AFsd均高于淋巴结未转移病灶,差异均有统计学意义(均P<0.05)。见表4。
表4 不同淋巴结状态乳腺癌病灶弹性参数的AF比较(±s) kPa2

表4 不同淋巴结状态乳腺癌病灶弹性参数的AF比较(±s) kPa2
与淋巴结转移比较,#P<0.05;AFmax、AFmean、AFsd、AFratio:弹性模量最大值、平均值、标准差及病灶最硬处与正常脂肪组织比值的各向异性因子
?
讨 论
各向异性是存在于富含纤维组织中的一种与方向相关的属性[5],是组织纤维取向的结果。在SWE检测中表现为因换能器方向不同引起所测量的弹性模量值不同。细胞外基质重塑是乳腺癌进展过程中的关键环节,胶原纤维由正常稳态下“卷曲和各向同性”的纤维重塑为“拉直和各向异性”的纤维,有条理的、拉直和(或)各向异性排列的胶原纤维是病理微环境的标志[9]。肿瘤细胞优先沿着这种垂直于肿瘤边界排列的胶原纤维侵袭,同时使基质变得僵硬,促进肿瘤细胞的增殖。乳腺癌进展过程中因细胞外基质重塑而表现出的高各向异性,可被用以评估其侵袭程度。而病灶大小、组织学分级、淋巴结受累情况和免疫组化标志物表达等临床病理特征与乳腺癌侵袭程度及预后密切相关。本研究旨在探讨乳腺癌弹性参数各向异性与其预后因素间的关系,为临床乳腺癌的治疗、预后评估提供有效参考。
本研究结果显示,最大径≥18 mm乳腺癌病灶的AFmax、AFmean、AFsd、AFratio较最大径<18 mm病灶更高,差异均有统计学意义(均P<0.05),与Skerl等[4]研究结果相一致。表明随着肿瘤的增大,平行分布于肿瘤边缘的“卷曲和各向同性”的胶原纤维伸直,随后胶原纤维成束并垂直于肿瘤边界排列[10],因此可以认为随肿瘤增大而增多的拉直和(或)垂直排列各向异性的胶原纤维促进肿瘤表现出更高的各向异性。
本研究发现不同组织学分级的IDC中,Ⅲ级IDC的AFmax、AFratio均高于Ⅰ、Ⅱ级,Ⅱ、Ⅲ级IDC的AFmean高于Ⅰ级,差异均有统计学意义(均P<0.05),表明高组织级别病灶较低组织级别病灶表现出更明显的各向异性。这与裴蓓等[6]研究结果部分一致,该研究发现Ⅰ级IDC的AFsd明显低于Ⅲ级IDC,差异有统计学意义(P<0.05);而本研究中高组织级别病灶的AFsd虽较低组织级别病灶高,但差异无统计学意义。分析原因可能是上述研究测量弹性参数时采用扩大圆形QBox法,该方法覆盖整个病变及其周围弹性较硬区域,不可避免地纳入了病变周围脂肪组织等较软区域;而本研究采用手动描绘Q-Box法人工勾画选定目标病变感兴趣区,依据病灶弹性图像色彩“适形”取样,一定程度上降低了AFsd。本研究IDC组织学分级越高,其AFmax越高,表明AFmax可以作为推断乳腺癌组织学分级的有效指标。
本研究结果显示,AFmean与ER、PR、HER-2表达状态无关,与Skerl等[4]研究结果一致。进一步研究各弹性参数的各向异性与Ki-67表达状态间的关系,结果表明Ki-67阳性表达病灶的AFmax、AFmean均高于Ki-67阴性表达病灶(均P<0.05)。Ki-67的表达能够反映恶性肿瘤潜在增殖率及肿瘤血管分布密度,其阳性表达与病理组织学分级呈正相关[11]。ER、PR阳性表达提示乳腺癌的预后良好,即分化程度高,恶性程度较低,但ER、PR阳性表达率随着组织学分级的升高而降低[12]。本研究发现ER阴性表达病灶的AFmax高于ER阳性表达病灶(P<0.05)。且Ki-67阳性、ER阴性表达的肿瘤组织学分级较高,分化较差,同时表现出更高的各向异性趋势,进一步证实了高组织级别病灶的各向异性更加显著的结果,提示弹性参数的各向异性可以作为评估肿瘤分化程度的有效指标。
此外,腋窝淋巴结受累情况也是评估乳腺癌预后的重要指标之一。本研究发现腋窝淋巴结转移病灶各弹性参数的各向异性较淋巴结未转移病灶更高。Riching等[13]和Gilkes等[14]研究表明,细胞外基质重塑和胶原纤维排列可以促进肿瘤弹性参数细胞的进展和迁移,而各向异性是细胞外基质重塑、胶原纤维重排的结果,提示腋窝淋巴结转移与乳腺癌弹性参数各向异性之间有一定关系。应用SWE技术探讨乳腺癌力学特征各向异性与免疫组化标志物和淋巴结状态间的关系,为患者手术治疗方案的选择及预后评估提供有效的参考信息。
本研究的局限性:①纳入对象的病理类型较单一,大部分为IDC,其他病理类型纳入较少,结果可能有所偏倚;②未将肿块深度、距乳头距离、乳房厚度等影响因素纳入研究;③排除了最大径>4 cm及SWE颜色不能覆盖的较大病灶,存在一定选择偏差。有待后续增加样本量进一步研究。
综上所述,乳腺癌病灶较大、组织学分级较高、ER阴性和Ki-67阳性表达、淋巴结转移的病灶中各弹性参数的各向异性更加显著,可为乳腺癌早期临床诊断及预后评估提供一定的参考依据。
