胸腔镜心脏手术后复张性肺水肿发生危险因素分析
2022-02-15丁晓燕陈远翔吴丽敏林风辉
丁晓燕 陈远翔 吴丽敏 林风辉
[摘要] 目的 探討分析胸腔镜心脏手术患者术后复张性肺水肿发生的危险因素。 方法 回顾分析2017年7月至2020年12月福建省立医院采用胸腔镜治疗心脏外科疾病的70例患者临床资料;依据术后肺部渗出情况及24 h内的氧合指数评估患者术后是否发生复张性肺水肿。将70例患者分为复张性肺水肿(REPE)组(n=20)与非复张性肺水肿(NREPE)组(n=50)。比较REPE组和NREPE组患者的基线资料和围术期指标,并用logistic回归分析胸腔镜心脏手术术后患者发生复张性肺水肿的危险因素。 结果 胸腔镜术后复张性肺水肿发生率28.57%。回归分析结果显示,BMI(OR=1.684,95%CI:1.118~2.536,P=0.013)、合并糖尿病(OR=0.021,95%CI:0.001~0.828,P=0.039)、二次接受心脏手术(OR=0.039,95%CI:0.005~0.323,P=0.003)、体外循环时间(OR=1.016,95%CI:1.000~1.031,P=0.044)是胸腔镜心脏术后复张性肺水肿发生的危险因素(P<0.05)。NREPE组再次插管率、有创呼吸机使用时间、死亡率均低于REPE组(P<0.05)。 结论 胸腔镜心脏手术复张性肺水肿在围术期发生率较高,呼吸机使用时间明显延长,复张性肺水肿组较非复张性肺水肿组死亡率增高,BMI、糖尿病、体外循环时间等是胸腔镜术后复张性肺水肿的危险因素。
[关键词] 胸腔镜;心脏手术;低氧血症;复张性肺水肿
[中图分类号] R614.2;R655 [文献标识码] B [文章编号] 1673-9701(2022)01-0103-04
Risk factors of reexpansion pulmonary edema after thoracoscopic cardiac surgery
DING Xiaoyan1,2 CHEN Yuanxiang2,3 WU Limin1,2 LIN Fenghui1,2
1.The Fourth Department of Critical Care Medicine, Fujian Provincial Hospital, Fuzhou 350001, China; 2.Provincial Clinical Medical College of Fujian Medical University, Fuzhou 350001,China; 3.The Second Department of Extracardiac Surgery, Fujian Provincial Hospital, Fuzhou 350001, China
[Abstract] Objective To explore and analyze the risk factors of reexpansion pulmonary edema (REPE) after thoracoscopic cardiac surgery. Methods The clinical data of 70 patients with cardiac diseases treated by thoracoscopy in Fujian Provincial Hospital from July 2017 to December 2020 were analyzed retrospectively. The postoperative pulmonary exudation and oxygenation index within 24 hours were used to assess whether patients develop REPE after surgery. Seventy patients were divided into two groups: REPE group (n=20) and non-reexpansion pulmonary edema (NREPE) group (n=50). The baseline data and perioperative indicators of patients in REPE group were compared with those in NREPE group, and the risk factors of REPE after thoracoscopic cardiac surgery were analyzed by logistic regression. Results The incidence of REPE after thoracoscopic surgery was 28.57%. Regression analysis showed that body mass index (BMI) (OR=1.684, 95%CI: 1.118-2.536, P=0.013), diabetes mellitus (OR=0.021, 95%CI: 0.001-0.828, P=0.039), the second cardiac surgery (OR=0.039, 95%CI: 0.005-0.323, P=0.003) and cardiopulmonary bypass time (CBPT) (OR=1.016, 95%CI: 1.000-1.031, P=0.044) were the risk factors of REPE after thoracoscopic cardiac surgery (P<0.05). The rate of re-intubation, duration of ventilator use and mortality in NREPE group were lower than those in REPE group (P<0.05). Conclusion The incidence of REPE after thoracoscopic cardiac surgery is higher during the perioperative period, and the use time of ventilator is obviously prolonged. The mortality of REPE group is higher than that of NREPE group. BMI, diabetes and CBPT are the risk factors of NREPE after thoracoscopic cardiac surgery.
[Key words] Thoracoscopy; Cardiac surgery; Hypoxemia; Reexpansion pulmonary edema
胸腔镜心脏手术发展至今已有近三十年历史,目前经右房或左房路径可完成各种心脏外科手术,如:房室间隔缺损修补、瓣膜置换等[1-2]。研究[3-4]显示,电视胸腔镜下心脏停搏二尖瓣置换术具有显著的临床疗效,可以降低炎症因子水平,减少心肌损伤,保护心脏及肾脏功能,且全胸腔镜心脏手术的手术瘢痕可以获得理想的美容效果,减少瘢痕疙瘩和增生性瘢痕的高风险[5]。然而Risto等[6]发现,心脏微创手术后复张性肺水肿(re-expansion pulmonary edema,REPE)的发生。在微创二尖瓣手术中,通过右肋间间隙的切口进行手术,要求右肺塌陷,以获得对心脏的手术通路[3],微创和机器人心脏手术后塌陷肺单侧肺水肿,术后出现低氧血症、肺功能紊乱、通气时间延长、病死率高[7-9]。复张性肺水肿属非心源性肺水肿中的一种,继发于各种原因所致的肺萎陷之后,是在肺迅速复张时或复张后发生的急性肺水肿。在临床症状上复张性肺水肿并无特异性,患者常出现呼吸急促,剧烈咳嗽,胸部不适,如诉胸闷、烦躁不安及咳痰,其痰多为白色泡沫痰,也可为红色泡沫痰,血氧下降。如果水肿严重,则出现血流动力学紊乱、休克甚至死亡[9]。本研究拟通过回顾性分析寻找胸腔镜术后复张性肺水肿发生的相关因素,以期为今后临床工作开展提供有力防治措施。因此,对70例胸腔镜心脏手术患者临床资料进行一项回顾性研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年7月至2020年12月福建省立医院行胸腔镜心脏手术成年患者70例,其中男40例,女30例。所有患者术前均经超声心动图(TEE)明确诊断心脏疾病。纳入标准:①年龄≥18岁;②需经胸腔镜心脏手术治疗;③需入住ICU监护治疗;④术前无肺部病变,且氧合指数:PaO2(动脉血氧分压)/FiO2(吸氧浓度)>300 mmHg。排除标准:①年龄<18岁;②术后因手术创面大出血失血性休克导致24 h内死亡;③术前合并低氧血症,氧合指数≤300 mmHg;④术前曾使用糖皮质激素或诊断为免疫缺陷疾病者[1]。70例患者接受手术类别如下:其中房间隔缺损修补9例,二尖瓣成形13例,三尖瓣成形5例;主动脉瓣膜置换术10例;二尖瓣瓣膜置换术12例,主动脉瓣及二尖瓣置换术5例,二尖瓣成形术13例,左房肿物切除术3例。其中再次接受心脏手术患者20例。所有患者对本研究的治疗方法均知情,并已签署知情同意书。
1.2 方法
1.2.1 资料收集及相关定义 收集胸腔镜心脏手术患者的基线资料。收集患者的性别、年龄、身高、体重、术前基础疾病(心功能不全、糖尿病、高血压)、术中体外循环时间、主动脉阻断时间、术中糖皮质激素的使用情况、术中尿量、术中平衡情况,是否为二次心脏手术、术后24 h内实验室指标(血气分析)、呼吸机使用时间、再插管使用呼吸机时间、ICU住院天数等信息。
1.2.2复张性肺水肿定义 复张性肺水肿目前缺乏诊断金标准,将手术过程经历肺萎陷环节,在术后出现单肺或双肺渗出同时24 h内出现的低氧血症,排除肺部感染、气胸及胸腔积液所致低氧血症的患者归为复张性肺水肿组[10-11],低氧血症诊断标准参照2012 ARDS柏林定义:PaO2/FiO2(氧合指数)≤300 mmHg。
1.2.3 入组情况 根据纳入标准及排除标准,本研究共70例胸腔镜心脏手术患者纳入研究,术后发生复张性肺水肿(REPE组)20例,非复张性肺水肿(NREPE组)50例。
1.3 观察指标
①术前资料:BMI、年龄、性别、术前心功能、糖尿病等;②术中情况:体外循环时间、主动脉阻断时间、术中尿量、术中液体平衡情况、糖皮质激素应用情况;③术后情况:有创呼吸机使用时间、ICU住院时间、术后心律失常发生率、再次插管发生率等临床相关指标。
1.4 统计学方法
采用SPSS 23.0统计学软件进行处理,符合正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数间距)[M(IQR)]表示,组间比较采用秩和检验;计数资料以[n(%)]表示,采用χ2检验。将单因素分析差异有统计学意义的变量,引入多因素logistic回归分析分析术后低氧血症发生的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 术前资料
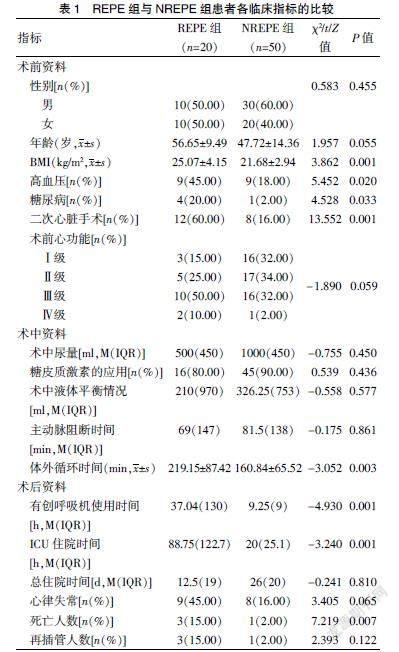
两组的BMI、高血压、糖尿病、是否再次心脏手术比较,差异均有统计学意义(P<0.05);两组的性别、年龄、术前心功能比较,差异均无统计学意义(P>0.05)。见表1。
2.2 术中资料
兩组患者术中糖皮质激素的应用、术中尿量、术中液体平衡情况、主动脉阻断时间比较,差异均无统计学意义(P>0.05),组间体外循环时间比较,差异有统计学意义(P<0.05)。见表1。
2.3 术后资料
术后REPE组有创呼吸机使用时间、ICU住院时间明显长于NREPE组,死亡率高于NREPE组,差异有统计学意义(P<0.05)。两组患者术后总住院时间、心律失常发生率、再插管率比较,差异无统计学意义(P>0.05)。见表1。
2.4术后复张性肺水肿的相关因素分析
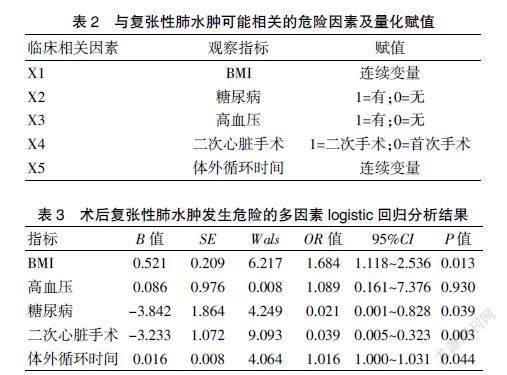
将以上单因素分析差异有统计学意义的变量纳入logistic回归分析,结果显示,BMI(OR=1.684,95%CI:1.118~2.536,P=0.013)、合并糖尿病(OR=0.021, 95%CI:0.001~0.828,P=0.039)、再次接受心脏手术(OR=0.039, 95%CI:0.005~0.323,P=0.003)、体外循环时间(OR=1.016,95%CI:1.000~1.031,P=0.044)是胸腔镜心脏术后复张性肺水肿发生的危险因素(P<0.05)。见表2~3。
3 讨论
胸腔镜心脏手术公认为微创且疗效佳的心外科手术选择之一,本组70例患者共3例在围术期1周内发现瓣膜失功再次接受手术,余患者无瓣膜功能异常。本研究纳入近3年胸腔镜手术患者,观察到术后复张性肺水肿发生率28.57%。REPE组与NREPE组死亡率比较具有显著差异,REPE组中3例患者于术后12 h内死亡,其共同特点表现为术后大量黄脓痰并夹带淡血性痰液,顽固性低氧血症,重度呼吸衰竭(PO2/FIO2≤100 mmHg),并引起循环溃败,且术后食道超声均已排除心脏收缩功能异常及肺静脉狭窄。
本研究结果显示,BMI是术后发生复张性肺水肿的危险因素,分析其原因肥胖患者胸壁肥厚,胸壁及腹部脂肪堆积、肺动脉血容量增多导致胸廓顺应性差、肺顺应性降低、呼吸运动所需克服阻力大,需氧量增加,从而更易发生低氧血症。还有研究发现,体重增加还可能是急性呼吸窘迫综合征(ARDS)的独立危险因素。产生这一现象的机制目前尚不清楚,推测与肥胖所引起的全身性炎症因子分泌失衡有关[12]。
本研究结果显示,糖尿病与复张性肺水肿发生相关,糖尿病患者更容易发生组织的缺血再灌注损伤[13],增加炎症反应[14],抗氧化应激能力的下降导致血管内皮功能障碍,最终使患者更容易出现肺血管通透性增加和肺水肿。
本研究发现,体外循环时间是复张性肺水肿发生的危险因素,胸腔镜下心脏手术为了提供足够的手术视野行左侧单肺通气处理,体外循环时间与单肺通气时间同步。Kasmani等[15]研究发现,低氧血症的发生考虑与术中体外循环单肺通气肺萎陷,肺泡毛细血管承受较长时间的机械压力,而复张时肺泡毛细血管过度伸展造成血管内皮机械性损伤,尤其在快速膨肺时出现。有动物实验发现,肺停循环前后的缺血导致血管内皮细胞损伤,引起肺泡毛细血管通透性增加,产生肺水肿。所以术中塌陷侧肺维持一定的肺泡张力及缩短体外循环时间似乎显得尤为重要。有研究显示,采取持续气道正压通气和间歇性再通气可减少单肺通气低血氧患者的分流[16]。今后拟可尝试在不影响手术操作视野下适当维持肺泡张力、缩短体外循环时间减少肺损伤的发生。
研究表明,糖皮质激素具有抗炎作用,甲强龙在多种病理生理条件下抑制炎症级联反应。因此,其广泛用于治疗包括急性肺炎症、哮喘、类风湿性关节炎等多种急慢性炎症疾病[17]。关于甲强龙的抗炎特性已有较多研究报道[18-19]。Gibbison等[20]研究发现,皮质类固醇可能不会改变心脏手术患儿的死亡风险,但可能会减少术后通气时间,减少肺损伤。然而本研究发现术中应用糖皮质激素不减少复张性肺水肿的发生,本研究使用的糖皮质激素种类为地塞米松,是否因种类不同、疗效不同有待进一步实验证实。
本研究存在一定不足,復张性肺水肿缺乏诊断金标准,目前大多数研究对于复张性肺水肿的诊断以肺部影像学渗出性改变、低氧血症等为标准,Risto等[6]研究将肺部渗出性病变>25%作为复张性肺水肿诊断标准,本研究未将肺部渗出进行定量,以低氧血症为主要客观指标进行研究,无法完全排除其他因素对氧合指数的影响,故研究结果复张性肺水肿发生率较高。
综上所述,胸腔镜心脏手术术后复张性肺水肿发生率较高,且发生复张性肺水肿患者死亡率明显上升,重视围术期对体重的控制,针对肥胖患者术中加强管理、个体化呼吸治疗、减少体外循环时间等以降低胸腔镜心脏手术后复张性肺水肿的发生率。糖皮质激素的应用与患者术后复张性肺水肿的发生是否有相关性,有待进一步前瞻性、大样本量研究考证。
[参考文献]
[1] Tamura T,Ito T,Yokota S,et al.Incidence of reexpansion pulmonary edema in minimally invasive cardiac surgery[J].Nagoya J Med Sci,2019,81(4):647-654.
[2] Kemmochi M,Senzaki H,Miyaji K,et al. Optimal timing of video-assisted thoracoscopic surgery for patent ductus arteriosus in preterm infants born at ≤28 weeks of gestation[J]. Pediatr Int,2019,61(8):792-796.
[3] Suwalski P,Smoczynski R,Kowalewski M,et al.A propensity score-adjusted comparison of thoracoscopic periareolar and video-assisted approaches for minimally invasive mitral valve surgery[J]. Kardiol Pol,2020,78(10):1029-1031.
[4] 卫婷,陈亚.电视胸腔镜下二尖瓣置换术对风湿性心脏病患者心脏及肾脏功能的保护作用[J].中国临床医生杂志,2020,48(6):704-708.
[5] Huang LC,Chen DZ,Chen LW,et al.The use of the scar cosmesis assessment and rating scale to evaluate the cosmetic outcomes of totally thoracoscopic cardiac surgery[J].Cardiothorac Surg,2020,15(1):250.
[6] Risto I Kesavuori,Antti E Vento. Unilateral pulmonary oedema after minimally invasive and robotically assisted mitral valve surgery[J].Eur J Cardiothorac Surg Actions,2020,57(3):504-511.
[7] Chronopoulos A,Trudeau K,Roy S,et al. High glucose-induced altered basement membrane composition and structure increases trans-endothelial permeability:Implications for diabetic retinopathy[J]. Curr Eye Res,2011, 36(8):747-753.
[8] Inoue K,Hiraoka A,Chikazawa G,et al.Preventive strategy for reexpansion pulmonary edema after minimally invasive cardiac surgery[J].Ann Thorac Surg,2020,109(5):e375-e377.
[9] Khalil NH,Anders R,Forner AF,et al. Radiological incidence of unilateral pulmonary edema after minimally invasive cardiac surgery[J].Cardiothorac Vasc Anesth,2020,34(1):151-156.
[10] Toyama M,Nakayama M,Fujita Y,et al.Unilateral pulmonary edema during aortic valve replacement through median sternotomy[J].Kyobu Geka,2020,73(6):417-422.
[11] Keyl C,Staier K,Pingpoh C,et al.Unilateral pulmonary oedema after minimally invasive cardiac surgery via right anterolateral mini thoracotomy[J].Eur J Cardiothorac Surg, 2015,47:1097-1102.
[12] Liu T,Fu Y,Liu J,et al.Body mass index is an independent predictor of acute kidney injury after urgent aortic arch surgery for acute DeBakey Type I aortic dissection[J].Cardiothorac Surg,2021,16(1):145.
[13] Berbudi A,Rahmadika N,Tjahjadi AI,et al.Type 2 diabetes and its impact on the immune system[J].Curr Diabetes Rev,2020,16(5):442-449.
[14] Ansley DM,Wang B.Oxidative stress and myocardial injury in the diabetic heart[J].Pathol,2013,229(2):232-241.
[15] Kasmani J,Irani F,Okoli K,et al.Re-expansion pulmonary edma following thoracentesis[J].CMAJ,2010,182(18):2000-2002.
[16] Karzai W,Schwarzkopf K.Hypoxemia during one-lung ventilation:Prediction,prevention,and treatment[J].Anesthesiology,2009,110(6):1402-1411.
[17] Ehrchen JM,Roth J,Barczyk-Kahlert K. More than suppression:Glucocorticoid action on monocytes and macrophages[J].Front Immunol,2019,10:2028.
[18] Aoyagi T,Sato Y,Toyama M,et al.Etoposide and corticosteroid combination therapy improves acute respiratory distress syndrome in mice[J].Shock,2019,52(1):83-91.
[19] Royse CF,Saager L,Whitlock R,et al.Impact of methylprednisolone on postoperative quality of recovery and delirium in the steroids in cardiac surgery trial:A randomized,double-blind,placebo-controlled substudy[J].Anesthesiology,2017,126(2):223-233.
[20] Gibbison B,Villalobos Lizardi JC,Avilés Martínez KI,et al.Prophylactic corticosteroids for paediatric heart surgery with cardiopulmonary bypass[J]. Cochrane Database Syst Rev,2020,10(10):CD013 101.
(收稿日期:2021-07-23)
