隐丹参酮对脑卒中大鼠PI3K/AKT-eNOS信号通路的影响研究
2022-02-15陈和禾朱伟新张夏军陈巧鸽许美飞祝飞虹
陈和禾 朱伟新 张夏军 陈巧鸽 许美飞 祝飞虹

[摘要] 目的 探討隐丹参酮对脑卒中大鼠的保护作用及对PI3K/AKT-eNOS信号通路的影响。 方法 将40只SD大鼠随机分为对照组、脑卒中模型组、低剂量隐丹参酮组(5 mg/kg)、中剂量隐丹参酮组(15 mg/kg)与高剂量隐丹参酮组(45 mg/kg),每组均8只,采用线栓法建立大鼠脑卒中模型。采用酶联免疫吸附法测定大鼠大脑皮质和外周血中SOD、MDA及NO水平,Western blot法检测大鼠脑组织PI3K及AKT的表达,qRT-PCR分析评估Bcl-2,Bax和VEGF的表达水平。 结果 与对照组相比,脑卒中模型组PI3K磷酸化、VEGF、eNOS、MDA水平增加(P<0.05);隐丹参酮组PI3K膜易位、AKT磷酸化、VEGF、eNOS、MDA水平减弱(P<0.05);且与剂量呈负相关(P<0.05)。与对照组相比,脑卒中组NO、SOD、Bcl-2、Bax水平显著下降(P<0.05),隐丹参酮组NO、SOD、Bcl-2、Bax水平升高(P<0.05),且与剂量呈正相关(P<0.05)。 结论 隐丹参酮对脑卒中大鼠脑组织具有保护作用,其作用机制可能与其抑制PI3K/AKT-eNOS信号通路有关。
[关键词] 脑卒中;隐丹参酮;PI3K/AKT-eNOS信号通路;蛋白质印迹法
[中图分类号] R542.2 [文献标识码] A [文章编号] 1673-9701(2022)01-0042-05
The effect of cryptotanshinone on PI3K/AKT-eNOS signaling pathway in stroke rats
CHEN Hehe ZHU Weixin ZHANG Xiajun CHEN Qiaoge XU Meifei ZHU Feihong
Department of Rehabilitation, Jinhua Central Hospital in Zhejiang Province, Jinhua 321000, China
[Abstract] Objective To explore the protective effect of cryptotanshinone on stroke rats and its influence on PI3K/AKT-eNOS signaling pathway. Methods Forty SD rats were randomly divided into the control group, the stroke model group, the low-dose cryptotanshinone group (5 mg/kg), the medium-dose cryptotanshinone group (15 mg/kg), and the high-dose cryptotanshinone group (45 mg/kg), with eight rats in each group. The rat stroke model was established by the suture method. Enzyme-linked immunosorbent assay was used to determine the levels of SOD, MDA, and NO in rat cerebral cortex and peripheral blood. Western blot method was used to detect the expression of PI3K and AKT in rat brain tissue. The expression of Bcl-2, Bax, and VEGF was evaluated by qRT-PCR analysis. Results Compared with the control group, the levels of PI3K phosphorylation, VEGF, eNOS, and MDA in the stroke model group increased (P<0.05); the levels of PI3K membrane translocation, AKT phosphorylation, VEGF, eNOS, and MDA in the cryptotanshinone group decreased(P<0.05),and was negatively correlated with dose(P<0.05). Compared with the control group,the levels of NO, SOD, Bcl-2, and Bax in the stroke group significantly decreased(P<0.05), and the levels of NO, SOD, Bcl-2, and Bax in the cryptotanshinone group increased(P<0.05), and were positively correlated with the dose(P<0.05). Conclusion Cryptotanshinone has a protective effect on the brain tissue of stroke rats, and its mechanism may be related to its inhibition of PI3K/AKT-eNOS signaling pathway.
[Key words] Stroke; Cryptotanshinone; PI3K/AKT-eNOS signaling pathway; Western blot
脑卒中是一种急性脑血管疾病,分为缺血性脑卒中和出血性脑卒中[1]。脑卒中具有高发病、高致残、高死亡的特点,缺血性脑卒中占脑卒中总数的60%~70%,而由内颈动脉或椎动脉闭塞、狭窄引起的出血性脑卒中在40岁以上的患者中有着更高死亡率[2]。丹参用于治疗心血管疾病、糖尿病、肝炎、缺血性脑卒中、慢性肾功能衰竭及月经紊乱等[3]。隐丹参酮是一种从丹参中提取出的具有多种药理活性的单体,具有抗癌、抗炎、抗氧化、抗糖尿病及抗肥胖等多种作用[4]。此外,临床研究[5]表明,隐丹参酮治疗急性缺血性脑卒中患者的疗效确切、安全、使用方便、耐受性好。细胞试验表明,隐丹参酮可通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)介导的细胞周期蛋白D1(cyclin D1)表达机制靶点来抑制脑血管内皮细胞(endothelial cell,EC)的增殖,这表明隐丹参酮可能对治疗脑卒中有一定的作用,但其机制研究甚少[6]。磷脂酰肌醇-3激酶(PI-3K)/丝氨酸-苏氨酸蛋白激酶(Akt)通路可保护缺血性脑损伤,内皮型NOS(eNOS)是该通路重要靶点,其生成的一氧化氮(NO)具有重要保护作用。鉴于此,本研究建立大鼠脑卒中模型,旨在探讨隐丹参酮作为抗脑卒中剂的可行性,并探讨其可能的作用机制,现报道如下。
1 材料与方法
1.1 动物与分组
本研究共40只SPF级雄性Sprague-Dawley大鼠,体重140~160 g,购自上海实验动物中心。本动物实验在浙江省金华市食品药品检验所实验动物中心进行。实验动物许可证号:SYXK(浙)2019-0045。饲养环境条件为温度20~26℃,湿度40%~70%,光照12 h、黑暗12 h光暗循环,大鼠自由饮水、进食,适应性喂养1周,然后将其随机分为对照组(正常大鼠)、脑卒中模型组、低剂量隐丹参酮组(5 mg/kg)、中剂量隐丹参酮组(15 mg/kg)、高剂量隐丹参酮组(45 mg/kg)及阳性对照组(LY294002),不同剂量隐丹参酮组灌胃给予不同浓度的隐丹参酮。本研究所有动物研究方案均通过动物保护和使用委员会(IACUC-20130315-01)批准。
1.2 动物模型的建立
在灌胃隐丹参酮24 h后采用线栓法建立大鼠脑卒中模型,建立模型前12 h内给予大鼠自由饮水、禁食。于大鼠腹膜内注射10%水合氯醛(0.35 ml/100 g),成功麻醉后将大鼠以仰卧位固定在平板上,并用碘消毒,在大鼠颈部正中作一切口分离皮下组织与右側腺体,并于颈总动脉近端部分及外颈动脉远端部分结扎,用血管钳将颈内动脉近端部分闭塞,随后将闭塞线沿着颈总动脉插入颈内动脉约18 mm处,直至感觉到阻力即可,结扎颈总动脉、颈外动脉及颈内动脉的分叉部位,固定闭塞线,缝合颈切口。
1.3 生化分析
采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测大鼠大脑皮质和外周血中超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde ,MDA)及一氧化氮(nitric Oxide,NO)水平。100 mmol/L Tris-HCl缓冲液处理匀浆组织样品,4℃以下10 000×g 离心20 min,分离上清液,测定和计算SOD、MDA及NO的含量。试剂盒均购自南京建成生物科技有限公司,严格按照试剂盒上说明操作。
1.4 Western blot检测
将20 mg大脑皮质样品切成小片,并与250 μl含有0.01%蛋白酶抑制剂混合物的组织细胞裂解缓冲液混合,完全裂解后,4℃下2000×g离心15 min,分离上清液,使用BCA蛋白定量试剂盒检测蛋白质含量。使用10%聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分离15 μg组织样品,并电泳转移至硝酸纤维素滤膜上,室温下用5%脱脂乳封闭1 h,随后与抗磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)(Abcam),磷酸化磷脂酰肌醇-3激酶(p-PI3K)(Abcam),蛋白激酶B (protein kinase B,AKT)(CST),磷酸化蛋白激酶B p-AKT(CST),一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)(CST),磷酸化一氧化氮合成酶(p-eNOS)(Abcam),B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2),(Santa),Bcl-2-Associated X蛋白质(Bcl-2-Associated X,Bax)(Santa),血管内皮生长因子(vascular endothelial growth factor,VEGF)(Abcam)及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)(CST)等抗体一起孵育,然后室温下与山羊抗鼠二抗或山羊抗兔二抗孵育1 h,使用增强的化学发光仪器拍照检测蛋白印迹。
1.5 实时荧光定量PCR分析
取适量组织样品,使用Trizol试剂盒定量提取总RNA,并按试剂盒说明书进行逆转录、PCR扩增,以GAPDH作为内参照。PCR反应条件为:95℃下预变性10 min,95℃下变性15 s,60℃退火/延伸45 s,进行40个循环。扩增引物见表1。
1.6 统计学方法
采用SPSS 22.0统计学软件分析数据,计量资料以均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
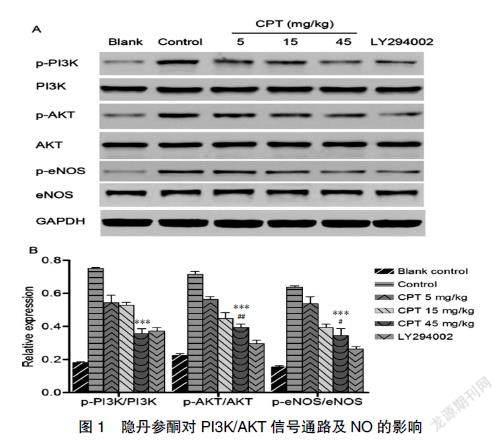
2.1 隐丹参酮对PI3K/AKT信号通路的影响
与对照组相比,脑卒中模型组PI3K磷酸化水平显著增加,脑卒中可诱导PI3K下游效应蛋白明显磷酸化(P<0.001),且隐丹参酮组PI3K膜易位与AKT磷酸化水平显著减弱。高剂量隐丹参酮组PI3K膜易位与LY294002组结果类似,但AKT磷酸化存在显著差异(P<0.001),且隐丹参酮与剂量呈负相关。见图1。
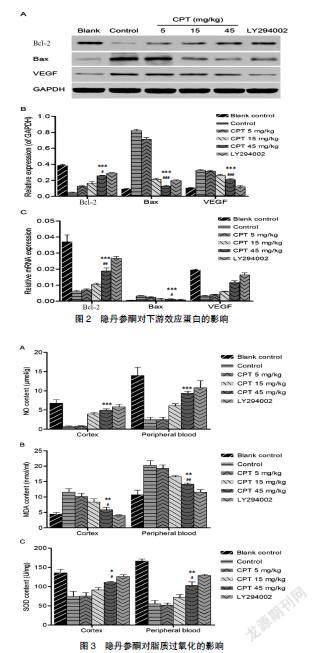
2.2 隐丹参酮对下游效应蛋白的影响
如图2所示,与对照组相比,脑卒中模型组VEGF表达水平显著增加,隐丹参酮组VEGF表达显著降低,且与剂量呈负相关(图2A、B);与对照组相比,脑卒中模型组Bcl-2表达水平显著降低(P<0.001),隐丹参酮组Bcl-2表达水平明显升高,且与剂量呈正相关;与对照组相比,脑卒中模型组Bax表达水平显著增加(P<0.001),隐丹参酮组Bax表达水平明显降低,且与剂量呈负相关。高剂量隐丹参酮组Bcl-2、Bax表达水平与LY294002组结果比较,差异有统计学意义(P<0.05)。
2.3 隐丹参酮对NO调节的影响
如图3A所示,与对照组相比,脑卒中模型组大脑皮层与外周血中NO水平均显著下降,隐丹参酮组NO水平明显升高,且与剂量呈正相关,与LY294002组相比无明显差异;与对照组相比,脑卒中模型组eNOS表达增强,隐丹参酮组eNOS表达减弱。见图1。
2.4 隐丹参酮对脂质过氧化的影响
如图3B、C所示,与对照组相比,脑卒中模型组大脑皮层与外周血中SOD水平均显著下降,隐丹参酮组SOD水平明显升高,且与剂量呈正相关;与对照组相比,脑卒中模型组大脑皮层与外周血中MDA水平均显著升高,隐丹参酮组MDA水平明显降低,且与剂量呈负相关。对照组与LY294002组SOD、MDA水平表达结果类似。
3 讨论
脑卒中是临床上常见的多发脑血管疾病,其中以缺血性脑卒中最为常见,约为全部脑卒中的60%~70%,其致残率、致死率非常高[7]。现代医学研究证实,脑卒中的发病机制主要包括血管闭塞造成缺血中心区与半暗区细胞功能衰竭、兴奋性氨基酸毒性、脑组织能量代谢、自由基损伤及神经细胞凋亡等多个环节[8]。因此,明确其发病机制及病理生理过程,对脑卒中的治疗有着积极的作用。
隐丹参酮是从丹参中提取出来的主要活性成分之一,具有抗肿瘤、抗氧化、抗炎及抗菌等多种生理活性[9]。研究证实,隐丹参酮可通过调节线粒体凋亡及抗凋亡细胞信号途径起到保护神经的作用,可降低心肌缺血再灌注损伤,还能够通过抑制或清除谷氨酸诱导的细胞内活性氧生成对皮层神經元凋亡有显著的保护作用[10]。这些均证明隐丹参酮对脑组织具有一定的保护作用,但其在脑卒中的研究较少,为此本研究建立了大鼠脑卒中模型,试图从作用机制方面解释其脑卒中脑组织的保护作用。
磷脂酰肌醇-3激酶(PI3K)是一种由趋化因子受体激活的信号传导酶。先前的一项研究显示,激动剂与C5a受体结合可以激活包括PI3K在内的多种信号传导蛋白,PI3K的激活在很大程度上与细胞内的底物有关,如纤维细胞生长因子(FGF)、血管内皮生长因子(VEGF)、人生长因子(HGF)及血管生成素I(AngI)等均可通过激活受体酪氨酸激酶导致PI3K磷酸化[11]。PI3K激活的结果在质膜上产生第二信使PIP3,其与细胞内的信号蛋白AKT及磷酸肌醇依赖性激酶-1(PDK1)结合,促使PDK1中诱导AKT的Ser308磷酸化,从而导致AKT活化。AKT,也称之为蛋白激酶B(PKB),是PI3K下游的主要效应物,活化的AKT可通过磷酸化多种酶、激酶及转录因子等下游因子调节细胞功能,如AKT可通过激活NF-κB抑制剂IκB激酶降解,导致NF-κB活化,进而提高细胞的存活率[12]。此外,AKT还能抑制Caspase-9,从而阻止凋亡级联反应的启动[13]。本研究显示,隐丹参酮组PI3K膜易位与AKT磷酸化水平显著减弱。高剂量隐丹参酮组PI3K膜易位与LY294002组结果类似,这与上述讨论一致,提示PI3K/AKT信号通路被抑制。本次研究结果表明隐丹参酮可能通过抑制PI3K的激活导致AKT磷酸化下降。
研究证明,PI3K在白细胞趋化和超氧化物生成等功能的调控中起着至关重要的作用[14]。氧自由基通过攻击多不饱和脂肪酸(PUFA)引起脂质过氧化,进而造成细胞代谢及功能紊乱。MDA是氧活性氧簇(ROS)介导脂质过氧化的敏感指标,能够反映自由基对组织和细胞损伤程度,SOD是一种内源性抗氧化酶,可抑制ROS的生成,能够反映除去氧自由基的能力,临床上常见二者结合检测[15]。研究表明ROS的发展在脑卒中引起的组织损伤中起重要作用,在缺血再灌注的过程中,其可趋化前列腺素及白三烯,进而控制血管内皮细胞功能[16]。本研究显示,隐丹参酮组SOD水平明显升高,MDA水平明显降低,说明隐丹参酮可显著降低脑卒中大鼠脑组织MDA水平及升高SOD水平,表明隐丹参酮对脑组织的脂质过氧化损伤有一定的保护作用。
NO是由一氧化氮合酶(NOS)通过L-精氨酸(L-Arg)及氧催化的产物,其与心血管、神经、胃、肾、肝脏等疾病的发生发展有着密切的关系,其是一种新的免疫分子及炎症介质,可介导多种细胞因子病理活性,如内毒素,肿瘤坏死因子(TNF-α)及白细胞介素-6(IL-6)等[17]。eNOS在血管功能调节中起着关键作用,一方面其通过产生NO来扩张血管,另一方面可通过产生超氧化物造成血管收缩[18]。有研究显示,蛋白质谷胱甘肽化参与eNOS的氧化还原开关,其水平的增加与受损的、依赖于内皮的血管扩张相关,因此能够复位这一氧化还原开关对恢复正常NO合成酶功能尤为重要[19-20]。本研究显示,脑卒中大鼠经过不同浓度的隐丹参酮治疗后,NO水平显著升高,提示隐丹参酮可通过调节NO水平来扩张血管达到脑保护的作用。
综上所述,隐丹参酮通过抑制脂质过氧化、抗凋亡及保护血管等作用来抑制脑卒中大鼠PI3K/AKT-eNOS信号通路,从而起到脑保护作用,研究结果表明隐丹参酮是治疗脑卒中潜在的药物。
[参考文献]
[1] 周红霞,王兴元,范利娟,等.阿托伐他汀在急性缺血性脑卒中患者中的临床研究[J].中国临床药理学杂志,2016,32(1):72-74.
[2] Wang W,Jiang B,Sun H,et al. Prevalence,incidence,and mortality of stroke in China:Results from a nationwide population-based survey of 480 687 adults[J]. Circulation,2017,135(8):759-771.
[3] 趙杨,陆茵,郑仕中,等.隐丹参酮的药理作用研究进展[J].中华中医药杂志,2010,37(11):1839-1841.
[4] 钱倩宇,应娜,杨贞.丹参酮ⅡA通过激活PPARα减轻4-HNE诱导的肝细胞损伤的机制研究[J].中国中药杂志,2019(9):1862-1868.
[5] Chen A,Zhao W,Lu Q,et al.Cryptotanshinone,a novel tumor angiogenesis inhibitor,destabilizes tumor necrosis factor-α mRNA via decreasing nuclear-cytoplasmic translocation of RNA-binding protein HuR[J]. Mol Carcinogen,2016,55(10):1399-1410.
[6] Chen Z,Zhu R,Zheng J,et al. Cryptotanshinone inhibits proliferation yet induces apoptosis by suppressing STAT3 signals in renal cell carcinoma[J].Oncotarget,2017,8(30):50 023-50 033.
[7] 江滨.现阶段我国脑卒中流行特征及防治现状对全科医疗服务的启示和建议[J].中国全科医学,2019(30):3653-3661.
[8] Morovatdar N,Thrift AG,Kapral MK,et al. Long-term outcomes of ischemic stroke of undetermined mechanism:A population-based prospective cohort[J]. Neuroepidemiology,2017,49(3-4):160-164.
[9] 曾金,张志荣,缪萍,等.隐丹参酮的药理作用研究进展[J].中成药,2015,37(6):1309-1313.
[10] 邹伟,钱程,张婷婷,等.隐丹参酮对小鼠下肢缺血的保护作用研究[J].中药药理与临床,2019,9(2):40-45.
[11] 彭金丽,喻娟,段晓鹏,等.隐丹参酮PEG-PE纳米胶束的制备、细胞摄取及诱导乳腺癌MDA-MB-231细胞凋亡的研究[J].中南药学,2019,8(6):47-49.
[12] 崔丽,宁忠平,刘颖.隐丹参酮抑制JNK/p38 MAPK信号通路对大鼠心肌细胞氧糖剥夺/复氧糖损伤的保护作用[J]. 医学分子生物学杂志,2019,16(2):164-169,174.
[13] Haicui Wu,Jianwei Zhang,Zhengao Sun,et al. Effects of electroacupuncture on expression of PI3K/Akt/Foxo3a in granulosa cells from women with shen (kidney)deficiency syndrome undergoing in vitro fertilization-embryo transfer[J]. Chinese Journal of Integrative Medicine,2019, 25(4):252-258.
[14] 张艳玲,谭娟,王颜刚,等.四味姜黄汤散对糖尿病肾病大鼠PI3K/Akt信号通路的调节作用[J].国际中医中药杂志,2019,41(4):387-389.
[15] Dajun L,Huiping S,Ying L.Stanniocalcin-1 protects a mouse model from renal ischemia-reperfusion injury by affecting ROS-mediated multiple signaling pathways[J]. Int J Mol Sci,2016,17(7):1051-1069.
[16] 魏薇,赖世超,谢勇,等.目标温度控制联合PGE_1对心肺复苏后大鼠脑微血管内皮缺血再灌注损伤的保护[J].四川大学学报(医学版),2016,47(3):310-315.
[17] 汤银娟,王建钧,关莹露.阿托伐他汀对高胆固醇血症大鼠侧支血管中LOX-1和eNOS表达的影响[J].南方医科大学学报,2019(11):1265-1272.
[18] 施思,雷少青,刘慧敏,等.酪醇对糖尿病大鼠心肌缺血再灌注损伤的影响及SIRT1/AMPK/eNOS信号通路在其中的作用[J].中华麻醉学杂志,2019,39(5):552-555.
[19] 房裕钞,王黎洲,黄学卿,等.微小RNA-155通过Notch信号通路对脑缺血-再灌注损伤的影响[J].介入放射学杂志,2019,8(7):661-668.
[20] 梁小娜.复方丹参片及其成方对血管性痴呆模型大鼠学习记忆能力的改善作用和机制探讨[J].中草药,2019, 50(12):2884-2890.
(收稿日期:2021-01-29)
