耐酸Bacillus velezensisP7 木聚糖酶基因在枯草芽孢杆菌中的表达及优化
2022-01-05黄雪芹左勇张强徐佳杨建飞易媛
黄雪芹,左勇,2*,张强*,徐佳,杨建飞,易媛
(1.四川轻化工大学生物工程学院,四川宜宾 644000)(2.四川师范大学生命科学学院,四川成都 610101)
白酒糟是以高粱、小麦、玉米、谷物等为原料经过发酵、蒸馏提取酒精后所产生的副产物,富含粗蛋白、酸性洗涤纤维、粗淀粉和无氮浸出物等营养成分[1]。利用白酒糟为原料制作有机肥料,既能解决环保问题,又可为绿色食品的生产提供有机环境,实现资源再利用。但由于酒糟中含有大量的木质纤维素,影响堆肥腐熟度,且木质纤维素组成多样、结构复杂,并有少量果胶包裹在纤维素周围,阻碍了纤维素酶与纤维素的接触抑制其水解。加入木聚糖酶补充纤维素酶,使二者产生协同作用[2],可以改善具有较高木聚糖含量底物的降解。木聚糖酶的种类很多,对木聚糖的降解发挥不同的作用,其中β-1,4-内切-D-木聚糖酶(endo-β-1,4-D-xylanase)[EC3.2.1.8][3]能将木聚糖的主链结构降解。目前,木聚糖酶主要被运用于包括工业[4]、农业[5]以及饲料加工等多种领域[6]。但木聚糖酶的生产主要利用细菌、真菌的发酵和构建产木聚糖酶工程菌的生产手段提高木聚糖酶产量使其在工业生产中有更广泛的应用。在构建木聚糖酶工程菌的研究中,大多以大肠杆菌和毕赤酵母为宿主菌[7],由于枯草芽孢杆菌有完善的分泌系统,可以分泌胞外酶,且具有生长速度较快、营养要求较低、对环境友好等优点[8]。近年来,很多研究将其作为模式生物运用到生物研究中,以过表达具有不同功能的异源蛋白[9]。通过基因工程使相关基因过表达是提高酶生产率的关键技术,再与优化发酵工艺相结合,摇瓶和发酵罐中蛋白酶的产量将大大提高[10]。
本研究从酒糟中分离鉴定出的优势微生物为模板克隆木聚糖酶,为获得胞外具有高酶活且生长周期短的工程菌,故用被敲除八个细胞外蛋白酶的枯草芽孢杆菌WB800 作为宿主菌表达目的基因,利用枯草芽孢杆菌的分泌型表达载体pHT43-HIS 构建重组表达质粒,它带有IPTG 诱导分泌信号序列,能够诱导物存在下引导表达外源蛋白分泌到细胞外,这样把菌体生长和诱导目的蛋白分开,有利于后期高浓度发酵中高效表达目的蛋白,并进行培养条件的优化和耐酸性检测,以期提高B.subtilisWB800-P7 木聚糖酶生产能力和适用性能,利于木聚糖酶在工业中的获取与应用。
1 材料与方法
1.1 细菌菌株、质粒和试剂
土壤中分离得到的Bacillus velezensisP7 菌株(ID:MH769179)纤维素酶系酶活力为:内切葡聚糖酶酶活力2.66 IU;外切酶活力0.6 IU;β-葡聚糖苷酶0.25IU;木聚糖酶活力1.32 IU。
大肠杆菌Trans-T1 Phage Pesistant、pHT43-HIS 质粒、B.subtilisWB800、2×Fast Pfu DNA 聚合酶、限制酶(Bam HI、Xba I)、T4DNA 连接酶,(ThermoFisher,中国上海)购自赛默飞世尔科技(中国)有限公司;氨苄青霉素(Ampicillin),购自索莱宝生物科技有限公司;山毛榉木聚糖,购自Sigma(美国);其余生化试剂均为国产分析纯产品。
1.2 菌株生长基质和条件
大肠杆菌 Trans-T1 和枯草芽孢杆菌在Luria-Bertani(LB)培养基上37 ℃培养。带有重组质粒的大肠杆菌Trans-T1和枯草芽孢杆菌在氨苄青霉素(100 μg/mL)的培养基中培养。枯草芽孢杆菌在GM培养基中制备感受态细胞,参考文献[11],并略做修改。
1.3 重组质粒的构建及转化
根据实验室从Bacillus velezensisP7菌株中克隆获得的木聚糖酶xynA基因序列(GenbankNC_000964.3)设计上下游引物,即

下划线分别为限制性内切酶Bam HI、Xba I。用细菌基因组DNA 快速提取试剂盒提取Bacillus velezensisP7 菌株基因组。根据序列,合成引物寡核苷酸,进行聚合酶链反应(PCR)扩增。扩增660 个碱基对(bp)片段。
使用质粒提取试剂盒提取空质粒,再用Bam HI和Xba I 酶切DNA 片段和空质粒,用凝胶提取试剂盒进行凝胶纯化。用T4 连接酶连接得到重组质粒pHT43-xynA(见图1)。DNA 克隆,限制性酶切和大肠杆菌转化方法均按照既定方法常规进行[12]。通过化学方法转化重组质粒进枯草芽孢杆菌WB800 中进行异源表达。
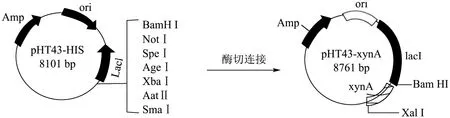
图1 pHT43-xynA 重组质粒连接图谱Fig.1 Plasmid map of pHT43-xynA
1.4 蛋白表达及纯化电泳分析
将携带重组质粒的B.subtilisWB800 在含有氨苄青霉素(100 μg/mL)的LB 培养基中于37 ℃过夜生长。将培养物接种(1%)到含有氨苄青霉素(100 μg/mL)的新鲜LB 培养基中,并继续培养直到OD600达到0.6~0.8。通过添加1 mmol/L(终浓度)异丙基-β-D-硫代半乳糖苷(IPTG)诱导木聚糖酶基因异源表达,并在37 ℃下继续孵育16 h。在8000 ×g,10 ℃条件下离心5 min,收集上清液。
(1)1向上清液中加入1 mL 已洗脱掉保护液的Ni-NTA 琼脂糖树脂(洗脱3 次,1 mL/min 流速),在4~8 ℃,60 r/min,2 mL/min 流速的条件下孵育12 h后加入层析柱中,分别用10、20、50、100、250、500 mmol/L 的咪唑缓冲液洗脱,有梯度的洗脱树脂,并且分开依次的收集液体,进行SDS-PAGE 电泳检测。确定目的蛋白和杂志蛋白的洗脱液浓度。
(2)2确定了目的蛋白和杂质蛋白的洗脱液浓度后。保存目的蛋白的洗脱液,用质量分数5%的浓缩胶与质量分数12%的分离胶进行SDS-PAGE 梯度电泳,电泳后的蛋白胶先用固定液对凝胶处理20 min,然后用考马斯亮蓝(CBB)染色,分析重组酶的分泌表达情况SDS-PAGE 分析。最后将镍柱保存在20%的酒精中4 ℃保存。
1.5 木聚糖酶活力测定
使用木糖作为标准品,采用 DNS 法,即3,5-dinitrosalicylic acid 测定木聚糖酶[13]活力。木聚糖酶标准曲线绘制:无水木糖0.1 g(烘箱干燥),加pH 5.0 乙酸-乙酸钠缓冲液定容至100 mL,取D-木糖标准溶液0 mL、0.04 mL、0.08 mL、0.12 mL、0.16 mL、0.2 mL、0.24 mL、0.28 mL、0.32 mL、0.36 mL、0.4 mL,随后加蒸馏水定容至0.4 mL,再加入2.5 mL DNS,沸水浴10 min,冷却后蒸馏水定容至25 mL,于波长540 nm 处测定吸光值。
木聚糖酶活力的测定:于25 mL 的具塞刻度试管里加入1 mL 的1%木聚糖溶液(由0.1 mol/L,pH 5.0的醋酸缓冲液配制)和0.1 mL 适当稀释酶液于50 ℃条件下静置反应30 min,后加入2.5 mL 的DNS 溶液摇匀煮沸10 min 后,定容至25 mL 于波长540 nm 下测定吸光度值。灭活的酶液作为空白对照。木聚糖酶一个酶活力单位(IU)定义为1 min 产生1 μmol 的还原性木糖所需要的酶量。酶活计算公式如下:
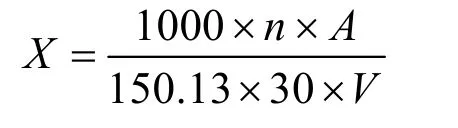
式中:
X——木聚糖酶活,IU;
A——酶解反应产生的木糖量,利用木糖曲线得到,mg;
n——木聚糖酶液稀释倍数;
150.13——木糖的相对分子质量,g/moL;
30——体系反应时间,min;
V——吸入反应液的体积,mL。
标准曲线如图2 所示:在波长540 nm 处,0~1 mg/mL 的质量浓度范围内,吸光度OD 值和木糖浓度呈良好的线性关系,分别满足方程y=0.3678x-0.0256,R2=0.995。
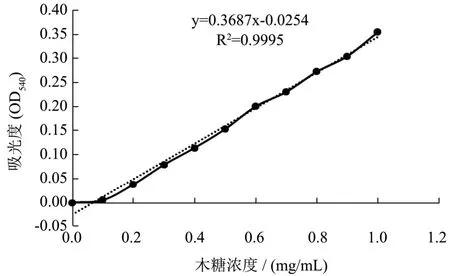
图2 木糖标准曲线Fig.2 The standard curve of xylose
1.6 重组工程菌诱导表达条件优化及发酵培养条件的优化
1.6.1 蛋白诱导表达条件优化
采用单因素实验,分别考察IPTG 诱导物的诱导时机和诱导浓度对重组菌株产酶的影响。以诱导终浓度1 mmol/L、OD600达0.6 时诱导为初始诱导条件,添加IPTG 终浓度分别为0.8、1、1.2、1.4、1.6、1.8 mmol/L 和诱导时机即诱导初始OD600分别为0.4、0.6、0.8、1.0、1.2、1.4。将重组菌的种子液以2%接种量转接至50 mL(250 mL 的三角瓶)含100 μg/mL Amp的发酵培养基中,诱导表达16 h 后,测其酶活。
1.6.2 重组菌株发酵条件优化
为提高重组工程菌的产木聚糖酶量,对B.subtilisWB800-P7 菌株进行摇瓶发酵工艺优化。以自然pH、培养温度37 ℃、接种量2%、转速180 r/min、发酵时间16 h 为基础培养条件,首先采用单因素实验设计方案确定重组菌株产酶条件的最佳优化范围。依次对培养pH(磷酸盐缓冲液调节至5.0、6.0、7.0、8.0、9.0、10.0)、温度(25、30、33、35、37、40 ℃)、菌种的接种量(0.5%、1%、1.5%、2%、2.5%、3%)、摇床转速(140、160、180、200、220、240 r/min)进行单因素试验。在单因素试验结果的基础上,对B.subtilisWB800-P7 进行正交实验[14],确定其摇瓶的最优发酵工艺条件。
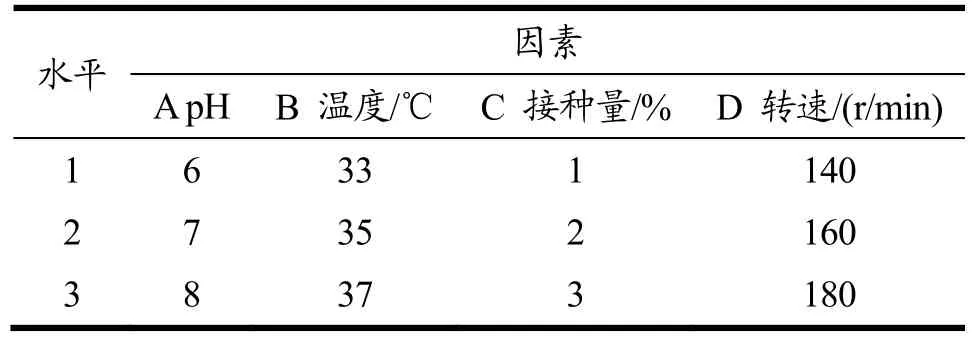
表1 实验因素水平表Table 1 Experimental factors and levels
1.7 重组酶耐酸性测定
最适作用pH 测定:将酶液加入不同pH(3~9 范围内,每隔0.5)的1%榉木木聚糖底物中。测定残余酶活力,以最高酶活作为100%,其余酶活与之相比计算相对酶活。得出适宜pH 范围。
pH 稳定性测定:在室温下,预先将酶液加入到pH 范围2~12 的缓冲液中放置2 h 后,标准条件下测定木聚糖酶的残余酶活力来分析酶的pH 稳定性。
1.8 数据分析
使用正交设计助手II V3.1 软件设计影响酶活力表达量的各项组合实验,以pH、温度(℃)、接种量(%)和转数(r/min)为自变量,以酶活力(IU)为正交值进行。每组试验做3 组平行,试验结果均以X±SD 表示。采用Origin 2018 软件绘制图表。
2 结果与分析
2.1 重组工程菌的构建
2.1.1 重组质粒pHT43-xynA的构建
将克隆的Bacillus velezensisP7木聚糖酶基因片段连接到质粒pHT43-His 上,并转化到枯草芽孢杆菌WB800 中,成功获得了重组B.subtilis WB800-P7。利用DNA 提取试剂盒得到野生菌的基因组,PCR 产物经1%琼脂糖凝胶电泳后,如图3 所示,得到约660 bp处可见一条清晰条带;用Bam HI和Xba I酶切空质粒、重组质粒,如图4 所示,得到约8101 bp 和660 bp 的片段。
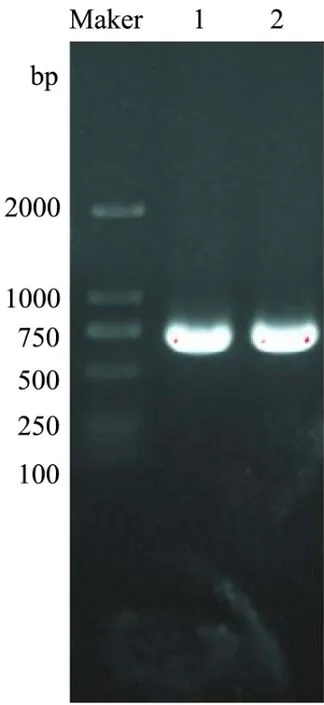
图3 枯草芽孢杆菌木聚糖酶基因PCR 扩增图Fig.3 PCR amplification of xylanase gene from Bacillus subtilis
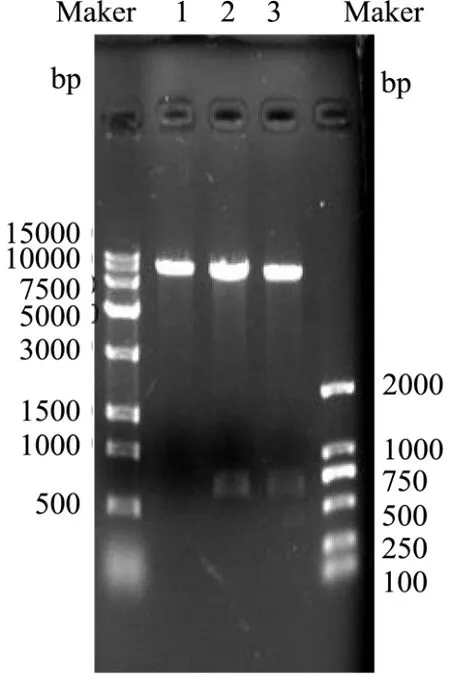
图4 重组质粒酶切电泳图Fig.4 Electrophoresis of recombinant plasmid
2.1.2 枯草芽孢杆菌重组质粒pHT43-xynA的转化
枯草芽孢杆菌感受态细胞的转化效率要远低于大肠杆菌的转化效率,本实验在传统的化学转化法的基础上对感受态细胞的制备及转化方法加以改进,成功将重组质粒转化入枯草芽孢杆菌感受态中,在含Amp抗性的平板上得到含有转化子的单菌落,结果如图5(左)。因为质粒pHT43 在枯草芽孢杆菌WB800 中主要进行目的蛋白的表达,所以质粒的复制数很低,用传统的提质粒鉴定的方法不可行,所以本实验采取菌落PCR 的方法对阳性重组菌进行筛选鉴定。挑选形态光滑,大小合适的多颗单菌落,无菌接种入5 mL 含Amp 抗性的LB 培养基中,摇床振荡培养12 h。以浑浊的菌液为模板,进行PCR。菌落PCR 的结果如图5(右)所示。将验证成功的菌液全部提取重组质粒,然后都进行双酶切验证。酶切完成后,凝胶电泳并在凝胶成像系统中照相保存。将酶切鉴定成功的阳性转化子提取液送至擎科生物技术有限公司(成都)测序,测序正确的阳性转化子命名为pHT43-xynA,对应的菌株命名为B.subtilisWB800-P7。

图5 重组工程菌单菌落平板图(左)、单菌落PCR 结果图(右)Fig.5 Single colony plate of recombinant engineering bacteria(left),single colony PCR results (right)
2.2 表达产物及纯化SDS-PAGE 分析
通过SDS-聚丙烯酰胺凝胶电泳结果显示在诱导16 h 后,发酵上清液和全细胞粗蛋白均在相对分子质量约40 ku 附近出现一条明显的特异性条带,并将镍柱纯化后得到的蛋白洗脱液进行电泳分析,结果如图6 所示,得到单独的条带了约40.0 ku,表明此纯化方法能有效的纯化重组蛋白。这与向亚萍等[15]研究海栖热袍菌极耐热木聚糖酶基因xynB在枯草芽孢杆菌Bs916 中进行异源分泌蛋白在相对分子质量43 ku 处有明显的蛋白表达条带一致。
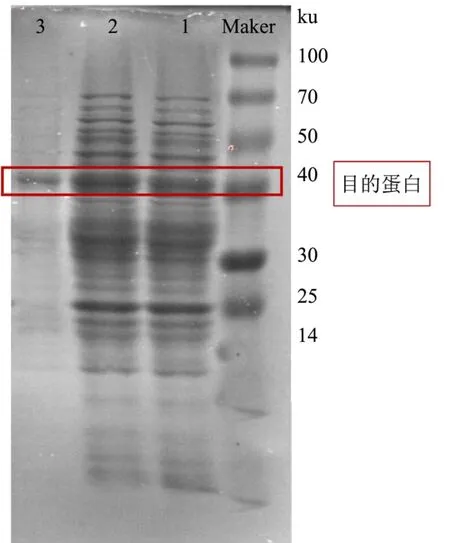
图6 蛋白纯化电泳图Fig.6 Electrophoretogram (SDS-PAGE) of protein purification
2.3 诱导表达条件的优化
以诱导物终浓度1 mmol/L、OD600为0.6 时为初始诱导条件对重组菌B.subtilisWB800-P7 对其诱导。
2.3.1 诱导时机对重组木聚糖酶产酶影响
将重组工程菌的种子液按2%接种量转接摇瓶后,培养不同时间控制初始OD600分别为0.4、0.6、0.8、1.0、1.2、1.4 时,添加终浓度为1 mmol/L IPTG,在37 ℃下发酵16 h 进行诱导表达,测其胞外木聚糖酶活性,结果如图7 所示,在OD600为0.8 时加入诱导物IPTG 进行诱导,胞外木聚糖酶活性最高,说明载有诱导启动子的重组菌在进入对数初期后即开始外源蛋白的诱导表达,提高了重组菌表达木聚糖酶的能力。
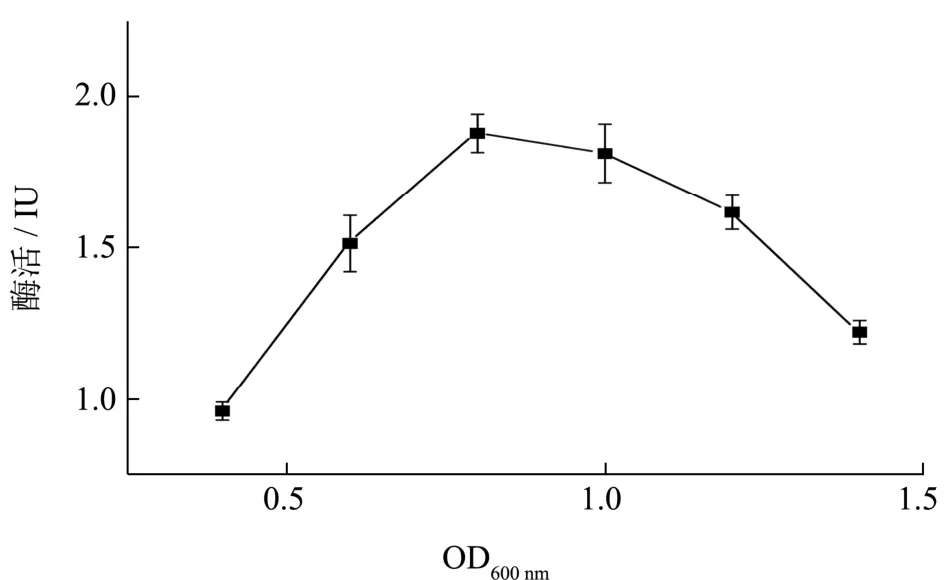
图7 诱导初始OD600对胞外酶活的影响Fig.7 Effect of OD600 before induction on the extracellular activity
2.3.2 IPTG 浓度对重组木聚糖酶产酶影响
将菌株放置37 ℃条件下培养,至菌体生长浓度到OD6000.8 时,添加不同浓度的诱导剂IPTG 0.8、1、1.2、1.4、1.6、1.8(mmol/L),诱导表达16 h,测其所产的胞外木聚糖酶活性,结果如图8 所示,诱导浓度显著影响木聚糖酶的表达,在终浓度较低时,木聚糖酶活性随着IPTG 浓度的增加而增加,当终浓度大于1.2 mmol/L 时,酶活随着IPTG 浓度的增加而减少,且在终浓度为1.2 mmol/L 时,胞外酶活最高为2.12 IU,高浓度IPTG 会抑制工程菌产酶,从而导致酶活性下降。
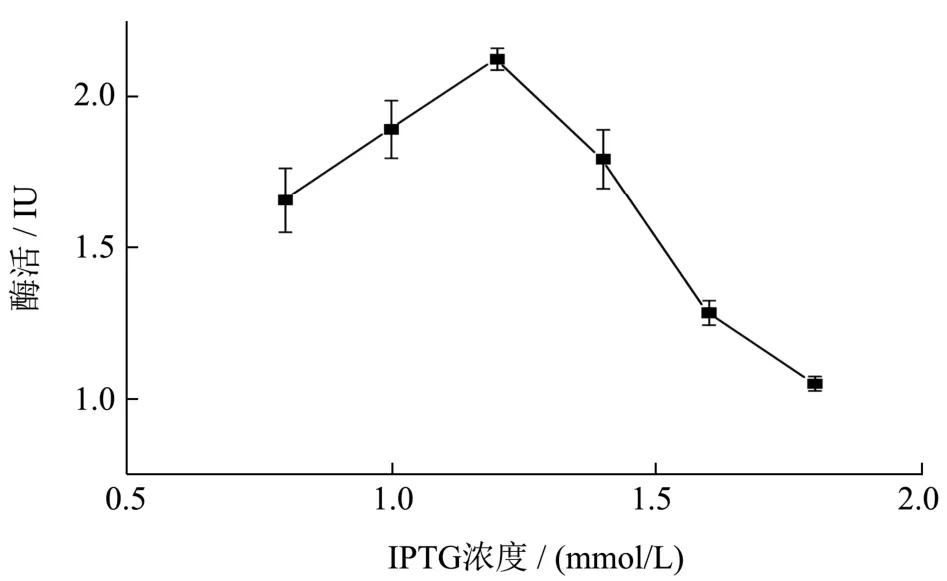
图8 IPTG 浓度对胞外酶活的影响Fig.8 Effect of IPTG concentration on the extracellular activity
2.4 重组菌B.subtilisWB800-P7 摇瓶发酵工艺研究
2.4.1 单因素实验结果分析
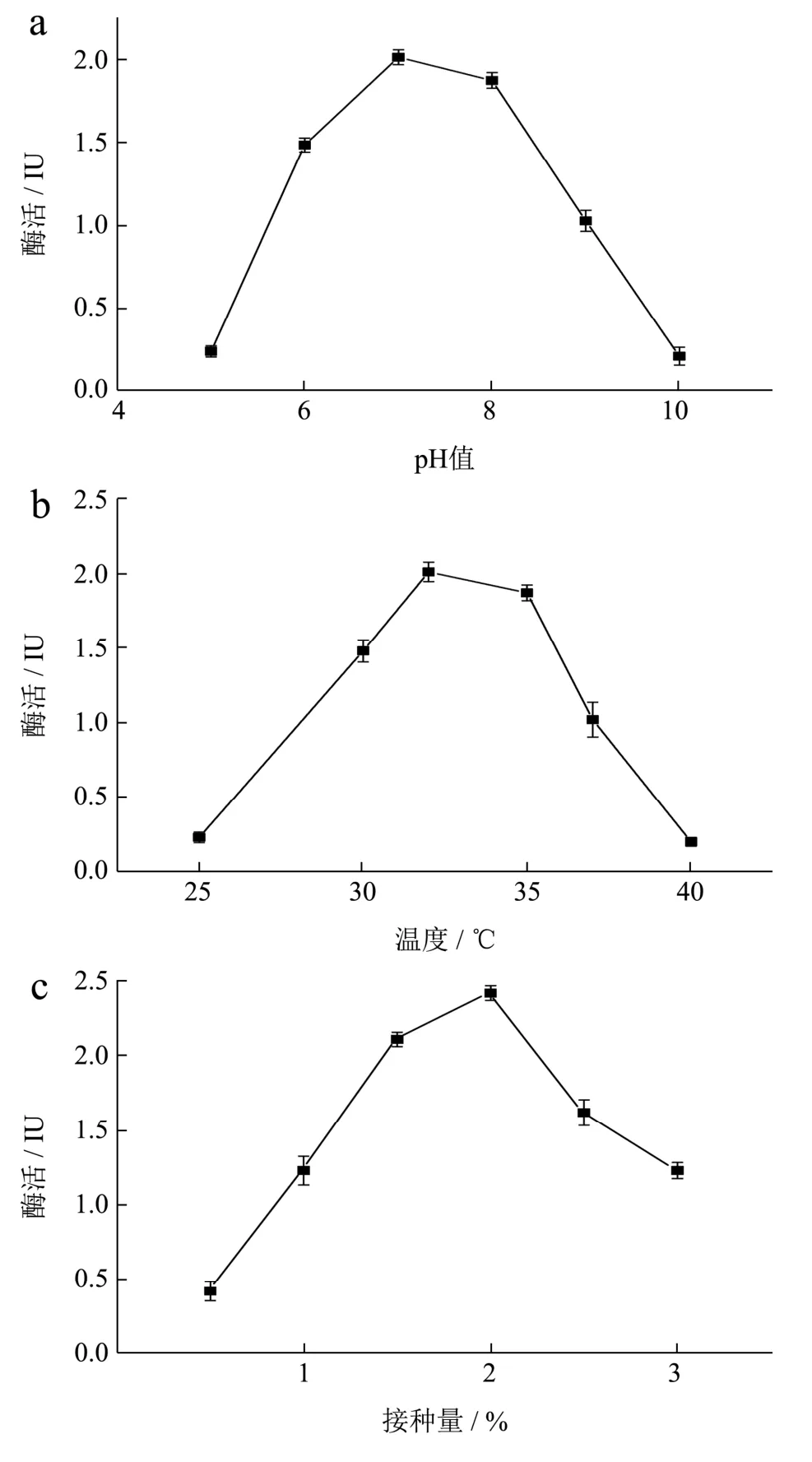
对重组工程菌B.subtilisWB800-P7进行单因素发酵条件优化,在其他初始培养条件不变的情况下,改变一个因素,获得最适发酵培养条件如图9 所示。
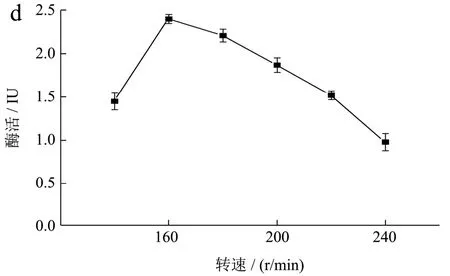
图9 单因素优化结果Fig.9 Results of the single-factor test
微生物的生长和能量代谢受其环境pH 的影响,在弱酸性或碱性的生长条件下都会导致菌体生长受限甚至失活,在中性或亚酸性环境中,适合菌体生长使得产酶量保持在高水平。菌株的产酶随pH 变化情况如图9a所示:最佳pH为7.0时,酶活力最高为2.01 IU。随着初始pH 的增加,酶活先增加然后逐渐减少,在pH 4~5 和pH 8~9 菌株的酶活都急速的降低。
高温会抑制细胞某些酶的活性,对细胞的生长和产物的合成产生不利影响,并导致微生物形态、代谢的变化,甚至导致细胞死亡,而合适的温度可以刺激生长。温度对菌株的产酶情况影响如图9b 所示:最佳培养温度为35 ℃时,酶活力最高达2.17 IU。当温度过低为25 ℃时,菌株生长受到抑制,保持休眠状态,使得酶活力很低;当温度为40 ℃时,菌株的酶活力近乎失活。
接种量影响微生物的发酵周期,接种量太大,细菌繁殖时,单位体积中细菌可利用的营养和氧气不足,将导致细菌新陈代谢异常并影响酶的合成。接种量太少时,培养基利用不充分而浪费资源,并且将增加滞后期的持续时间而增加成本[16]。在其他初始培养条件不变的情况下,不同转速对重组工程菌生长发酵产酶情况如图9c 所示:最佳接种量为2%时,酶活最高为2.42 IU;当接种量小于2%时,重组菌的相对酶活力仅为最高酶活力的40%;当接种量大于2%时,酶活力呈递减趋势。
摇床速度和溶解氧量之间存在正相关,后者也可以反映细菌的生长。如图9d 所示:最佳转速为160 r/min 时酶活力最高。转速小于160 r/min 时,物质不均匀混合,降低了细菌的产量,使得酶活降低。当转速大于160 r/min 时,溶解氧的量显着增加,导致大量代谢产物的产生,影响细菌的生长,同时振荡培养的剪切力过大,使得菌株产酶活力均下降。
2.4.2 发酵产酶条件的正交优化
本研究用筛选到的野生Bacillus velezensis进行木聚糖酶基因克隆,构建B.subtilisWB800-P7 工程菌产木聚糖酶,在最佳的诱导条件下,不改变其他培养条件,利用LB 培养基摇瓶发酵上清酶活力为2.56 IU。采用L9(34)正交表,直观分析考察重组工程菌培养条件pH、温度、接种量、转速对产酶的影响。Rj 表示为Kij 最大、最小值之差。Rj 越大,表示该因素水平变化对该实验指标的影响越大,该影响因素越重要;反之,Rj 越小,该因素越不重要。从表2 可以看出,对木聚糖酶活力产生影响的水平主次因素顺序为B(温度)>D(转速)>C(接种量)>A(pH),在发酵过程中,温度是影响细胞生长和蛋白质表达正确折叠和易位的关键因素[17],在35 ℃的温度下,B.subtilisWB800-P7 可以获得较高的生长速率和细胞密度,提高了蛋白质合成的速度。B.subtilisWB800-P7 可以获得较高的生长速率和细胞密度,提高了蛋白质合成的速度[18]。通过实验可以得出的重组工程菌的最适培养条件为A1B2C2D2,即pH 6.0、温度35 ℃、接种量2%、转速160 r/min,在此工艺条件下,木聚糖酶活力预测可达到4.11 IU,经重复实验验证后,得到实际酶活力为4.21 IU,与优化前相比,酶活提高了64.45%,比野生菌提高了2.19 倍。田艳杰等[18]研究的利用真菌(黑曲霉)木聚糖酶xynZF-318基因构建枯草芽孢工程菌所产实际酶活力0.359 U/mL(最优的发酵条件为:接种量为1.2%、装液量为20 mL、种龄为11 h、培养温度为37 ℃、摇床转速为160 r/min 下)。王停停等[19]研究源于Paenibacillus campinasensisG1-1 的木聚糖酶编码基因成功整合到毕赤酵母GS115 基因组,优化后的培养条件下胞外重组酶活达到707.2 IU/mL,属于弱碱性酶,主要应用酿酒及造纸等行业。周煌凯等[20]研究从耐碱性木聚糖酶高产短小芽孢杆菌BYG5-20 中克隆得到带有自身启动子的木聚糖酶基因xynA,将其构建在大肠杆菌-枯草芽孢杆菌穿梭载体pGJ148 中得到重组质粒pGJ148-xynA。采用电转化法将重组质粒pGJ148-xynA转入枯草芽孢杆菌1A747中,得到重组菌B.GJ148-xynA,然后进行诱导表达以及培养基的优化。重组菌GJ148-xynA发酵上清液中木聚糖酶酶活可达93.32I U/mL。产生如此差异可能是因为来源不同的基因在不同的表达载体中的表达效果不一样,以及不同酶性质的基因表达量也不同,还有酶活的测定方法存在差异性。但发酵条件的优化均起到了提高酶活力的效果。
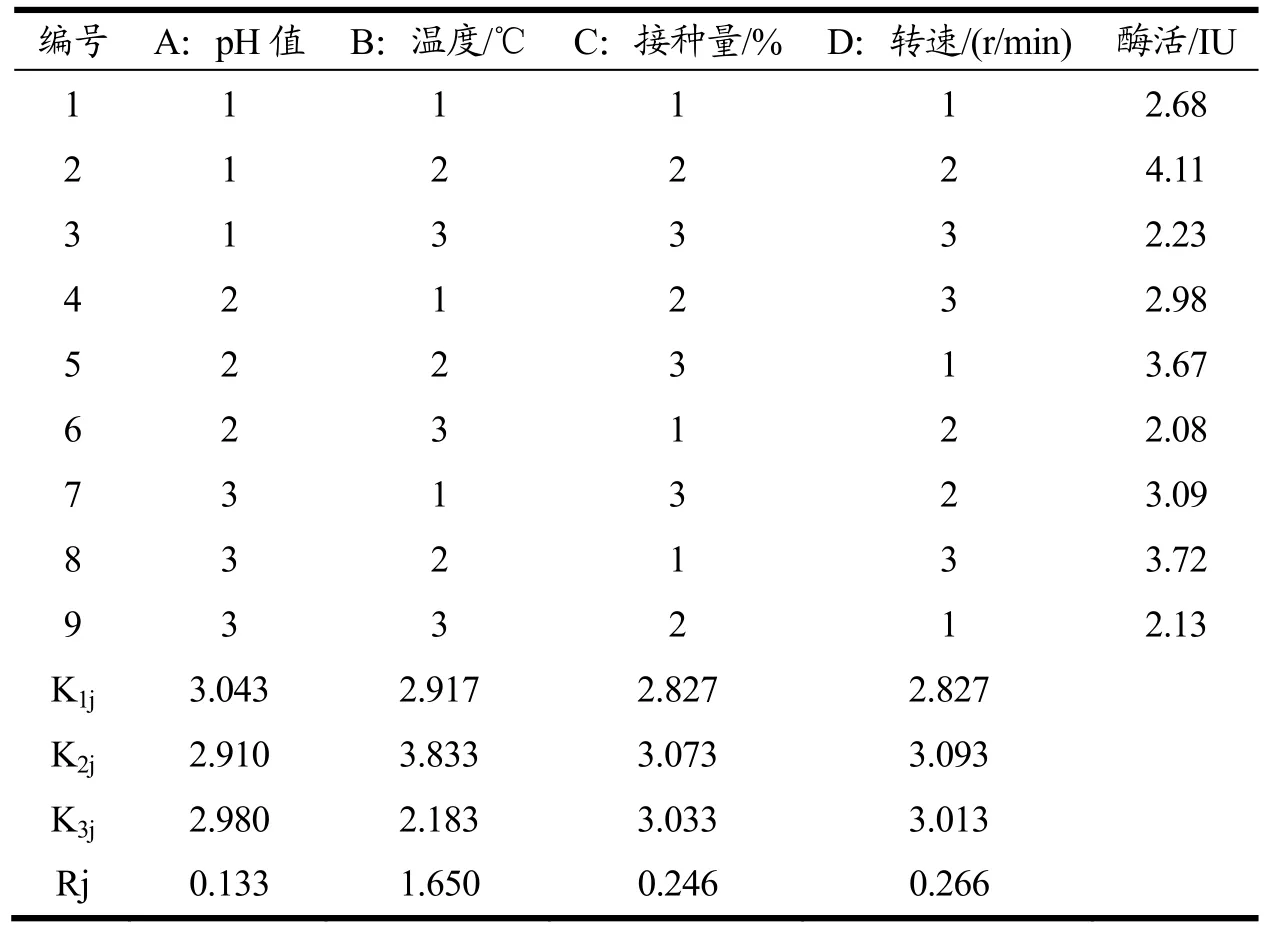
表2 正交试验分析Table 2 Orthogonal test analysis
2.5 重组木聚糖酶耐酸性
将重组B.subtilisWB800 菌株在优化后的培养条件下产的木聚糖酶发酵上清液,在不同pH(3.0~9.0)的1%木聚糖底物溶液在50 ℃水浴反应30 min后测定重组酶的水解活力。如图10,得到最适反应pH 为5.0。重组木聚糖酶经pH 2.0~12.0 处理2 h 后,测其酶活如图11 所示,在碱性条件下,酶活性降低。在酸性到中性条件下,其残余酶活力是原始酶活力的80%以上,与文献报道[21]的解淀粉芽抱杆菌产木聚糖酶在pH 为5.0~6.0 时有较高的酶活性,在37 ℃,pH 5.0、pH 5.0~7.0 条件下培养1 h,测定酶活力,残余酶活性分别保持在68%、50%以上相比,在酸性条件下的耐受性更高,且对pH 有较广的耐受范围。
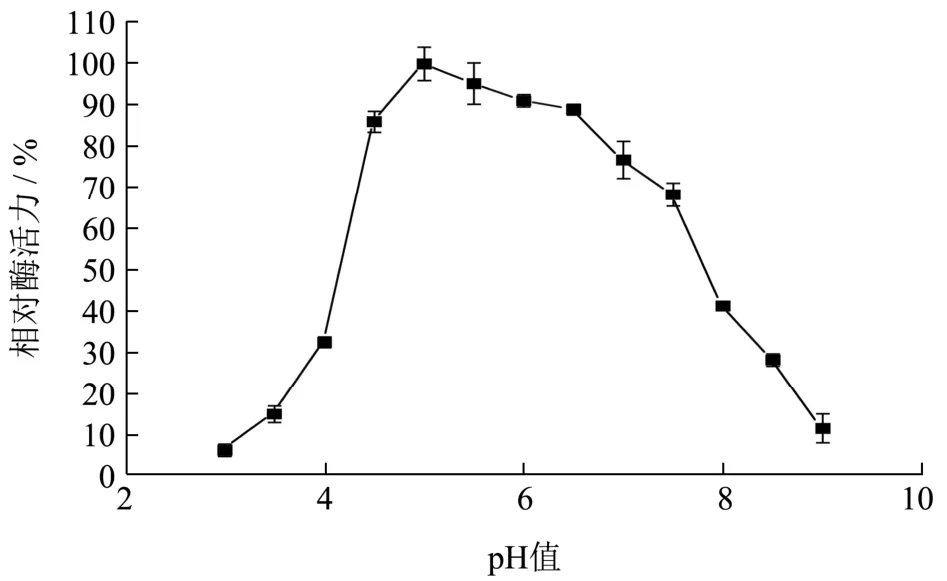
图10 pH 对木聚糖酶的影响Fig.10 Effect of pH value on xylanase
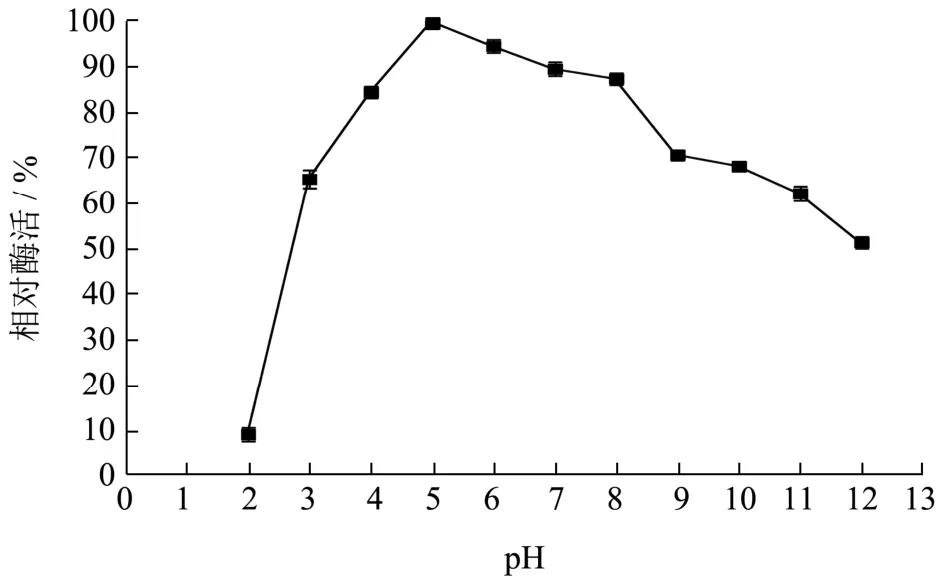
图11 木聚糖酶的pH 稳定性Fig.11 The PH stability of xylanase
关于耐酸性的木聚糖酶,研究较多的是真菌表达系统,如王金华[22]研究黑曲霉(Aspergillus nigervarniger strainN402)耐酸内切-β-1,4-木聚糖酶在酵母中的表达,其最适温度是37 ℃,木聚糖酶的最适作用pH 为4.0 在pH 为3.0~5.0 的范围内,木聚糖酶的活性较高,当pH<2.0 和pH>6.0 时,木聚糖酶活性急剧下降(低于30%),说明其有较广泛的pH 稳定范围。由于筛选环境的不同酶学性质会产生明显差异,例如张伟等[23]构建极耐热枯草芽孢杆菌木聚糖酶工程菌的最适温度达到86 ℃。通常情化下,真菌中的木聚糖酶在酸性到中性中间比较稳定。而细菌中的木聚糖酶可以在碱性条件下比较稳定。而本研究从呈弱酸性酒糟(pH 3~4)中筛选出耐酸的优势内源微生物,以此为亲本构建了能产耐酸木聚糖酶枯草芽孢杆菌工程菌且能直接将重组酶分泌到胞外,在酸性条件下,其残余酶活力是原始酶活力的80%以上,对pH 有较广的耐受范围。
3 结论
3.1 以酒糟筛选出产木聚糖酶的内源微生物野生Bacillus velezensisP7 为目标菌株,利用基因工程技术成功构建了大肠-枯草芽孢穿梭质粒载体pHT43-xynA后导入枯草芽孢杆菌WB800 中,通过SDS-PAGE 电泳分析,在40 ku 附近出现一条明显的蛋白条带,验证成功构建重组B.subtilisWB800-P7。
3.2 采用单因素实验和正交试验分析验证重组菌降解能力与酶活力。研究发酵阶段各因素对工程菌酶活的影响,得出各因素的影响程度分别为:温度>转速>接种量>pH。通过诱导和发酵条件的优化,最优IPTG诱导条件下即终浓度为1.2 mmol/L,起始的诱导OD600为0.8,最佳发酵培养条件:pH 6.0、培养温度35 ℃、接种量2%、摇床转速160 r/min 下,发酵16 h 后测得到实际最大酶活力4.21 IU,与优化前相比,酶活力提高了64.45%。证明优化成功提高了工程菌的酶活,为后期高密度发酵提供基础发酵条件。
3.3 重组酶耐酸性研究得出最佳作用pH 为5.0,在酸性到中性条件下(pH 5.0~7.0),其残余酶活力是原始酶活力的80%以上。这些特性预示在木聚糖酶具有应用潜力,为该重组酶在酒糟堆肥生产的实际应用中提供了试验数据,具有一定应用价值,且为后期的试验提供理论基础。
