纳豆红曲复合物的降脂作用及药代动力学分析
2022-01-05齐明明张文萌印书霞孙建博
齐明明,张文萌,印书霞,孙建博*
(1.中国药科大学中药学院,江苏南京 210009)(2.临沂市检验检测中心,山东临沂 276000)(3.康道生物(南通)有限公司,江苏南通 226000)
红曲是传统的曲类中药,在我国有近千年的使用历史[1],是以粳米为原料由曲霉科真菌红曲霉的菌丝体发酵而形成的红米曲[2],用于食物色素、酒和肉类储存已有数百年历史[3]。红曲中的药用成分主要有洛伐他汀、红曲色素、甾醇类、十氢化萘、γ-氨基丁酸和不饱和脂肪酸等[4-5]。洛伐他汀是β-羟基-甲戊二酸单酰辅酶A 还原酶的竞争性抑制剂[6],可抑制胆固醇的合成,增加低密度脂蛋白受体合成,临床上主要用于高血脂的治疗[7]。此外,红曲还有降低血糖、血压等作用[8-9]。纳豆冻干粉中含有一种水溶性的单链多肽丝氨酸蛋白酶,即纳豆激酶(NK),其对血栓、急性心肌梗死、脑血栓中风、脉管栓塞等血栓性疾病的预防和治疗具有一定意义[10]。有研究表明NK 具有溶解纤维蛋白的活性[11],每天补充一定量的NK,持续两个月,可降低健康受试者体内的纤维蛋白原和凝血因子含量[12],且NK 的纤溶活性作用效果快、安全性高[13]。纳豆红曲复合物(Natto monascus complex,NMC)是由红曲、植物甾醇、纳豆冻干粉为主要原料制成的一种保健食品,研究显示其具有辅助降血脂的效果[14-17]。
目前市面上含有红曲、纳豆等成分的保健食品种类众多,虽然已有研究显示这类保健食品具有一定的降脂溶栓药理作用,但相关实验数据仍相对较少,且缺乏相关的药物代谢动力学研究。因此,本实验旨在研究NMC 对高脂饮食(High fat diet,HFD)诱导大鼠模型血脂水平的影响。此外,由于之前的研究[18]显示NMC 中主要的降脂药效成分是洛伐他汀,因而本研究选用洛伐他汀作为指标性成分,考察了其在比格犬体内的药物代谢动力学过程,以期为纳豆、红曲类保健食品的研发提供实验依据。
1 材料与方法
1.1 药品和试剂
纳豆红曲复合物(批号:20181123)购自康道生物(南通)有限公司;低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)测定试剂盒(货号:A113-1-1)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)测定试剂盒(货号:A112-1-1)、总甘油三酯(Total triglyceride,TG)测定试剂盒(货号:A110-1-1)以及总胆固醇(Total cholesterol,TC)测定试剂盒(货号:A111-1-1)购自南京建成生物工程研究所;洛伐他汀胶囊(批号19021211)购自南京森贝伽生物科技有限公司。
1.2 仪器与设备
Spectra Max iD5 多功能酶标仪,美谷分子仪器(上海)有限公司;Agilent LC-MS6420 质谱检测仪,安捷伦科技有限公司;高效液相色谱检测仪,岛津企业管理(中国)有限公司;Eclipse Plus C18RRHD 色谱柱,安捷伦科技有限公司。
1.3 药物与主要试剂配制
0.5%羧甲基纤维素钠溶液(0.5% CMC-Na)的配制:精密称取CMC-Na 粉末5.0 g,加入至1000 mL加热至60 ℃后的三蒸水中,均匀铺撒于液面,80 ℃加热搅拌,现用现配。
NMC 混悬液的配制:将NMC 粉碎为粉末,过筛。精密称取16.2 g、32.4 g 和64.8 g 粉末,分别加入100 mL 的0.5% CMC-Na 溶液中混悬,配制成浓度分别为16.2 g/100 mL、32.4 g/100 mL 以及64.8 g/100 mL 的NMC 混悬液。
洛伐他汀混悬液的配制:精密称取洛伐他汀180 mg,加入100 mL 的0.5% CMC-Na 溶液中混悬,现用现配。
10%水合氯醛溶液的配制:称取10.0 g 的水合氯醛粉末,加入生理盐水100 mL 溶解,配制成4%的溶液,现用现配,使用前冷藏。
1.4 实验动物与饲料
180~220 g SD 大鼠,SPF 级,雌雄各半,购自南京青龙山动物繁殖场,许可证号:SCXK(沪)2018-0004。6~8 m 龄比格犬(普通级),体重约10 kg,6 只,雌雄各半,购自南京青龙山动物繁殖场,许可证号:SCXK(沪)2018-0007。大鼠高脂饲料(货号:TP25540)由南通特洛菲饲料科技有限公司提供。比格犬饲料购自南京青龙山动物繁殖场。饲养条件:室温22~25 ℃,相对湿度:60%±10%,自然光线,自由饮水进食,适应性饲养7 d。本实验已获得中国药科大学实验动物伦理委员会批准。
1.5 动物模型的建立及分组
SD 大鼠随机分为正常组和实验组。正常组大鼠给予普通饲料,实验组给予高脂饲料,连续喂养4 w后,于眼眶静脉丛取血1.5 mL,分别测定LDL-C、HDL-C、TG 以及TC 的水平。若实验组大鼠的血脂水平与正常组相比出现显著性差异,即为造模成功。
将造模成功的大鼠随机分为5 组,即模型组、阳性药洛伐他汀组(1.8 mg/kg)、NMC 低剂量组(162 mg/kg)、NMC 中剂量组(324 mg/kg)、和NMC 高剂量组(648 mg/kg),每组各8 只。随后,正常组大鼠给与普通饲料,而其余各组大鼠则继续给予高脂饲料,并开始灌胃给药,每天一次,连续给药4 w,正常组和模型组则给予等量的0.5% CMC-Na 溶液。
1.6 大鼠血清血脂检测
给药结束后,大鼠禁食12 h,然后于眼眶静脉丛取血1.5 mL,4 ℃静置2 h 后于4000 r/min 条件下离心20 min,取上层血清,分别使用TC、TG、HDL-C、LDL-C 试剂盒测定血脂相关指标。
1.7 色谱条件和质谱检测参数
色谱柱:EclipsePlus C18RRHD(1.8 µm,2.1×50 mm),流动相由乙腈:水=65:35(V/V)组成,进样体积3 µL,流速0.2 mL/min,柱温30 ℃,离子源温度350 ℃,去簇电压170 V,碰撞电压27 V。
质谱离子化方式:电喷雾离子化(ESI),正离子模式;多反应监测(MRM)。洛伐他汀[M+Na]+m/z:427.2→325.2,辛伐他汀[M+Na]+m/z:441.2→325.2。
在此条件下测得的洛伐他汀有较好的分离度。
血浆样品的处理:取500 µL 血浆置于抗凝离心管中,精密加入内标溶液1500 µL,于5 ℃、10000 r/min 条件下离心10 min,连续两次,随后吸取上层血浆移入聚丙烯管中密封,置于-80 ℃冰箱中冷冻保存备用。
1.8 内标对照品溶液的制备
精密称取辛伐他汀和甲苯磺丁脲各1.00 mg,加入乙腈定容至10 mL,即得0.1 mg/mL 的辛伐他汀和甲苯磺丁脲的混合溶液。随后用乙腈稀释至10 ng/mL,即得内标溶液。
1.9 比格犬给药方案
取6 只健康比格犬,口服给予8 片NMC。分别于给药前(0 h)和给药后0.5、1、2、3、4、5、6、8、12 h 和24 h 采集腿静脉血2 mL,置于抗凝的离心管中。
1.10 数据统计学处理
所有的数据结果均以mean±SEM 表示,采用单因素方差分析进行统计学分析,若p<0.05 则表示存在显著性差异,若p<0.01 则表示存在极显著性差异。
2 结果与讨论
2.1 NMC 对HFD 诱导大鼠血脂水平的影响
2.1.1 大鼠一般情况
适应性喂养一周后,SD 大鼠饮食正常,毛色光亮,精神状态良好,敏捷度良好,活动反应能力正常。分组喂养4 w 后,正常组大鼠无明显变化,而HFD 诱导大鼠食欲降低,毛色发黄无光泽,粪便稀溏,血液黏稠。
2.1.2 高脂血症大鼠模型的建立
如表1 所示,造模4 w 后,与正常组相比,HFD诱导大鼠的血清中LDL-C与TC 水平均显著升高(p<0.01),TG 水平明显升高(p<0.05),证明大鼠高脂血症模型造模成功。

表1 正常组大鼠与HFD 诱导大鼠血脂情况Table 1 The blood fat data of normal and HFD-induced rats(mmol/L,mean±SEM)
2.1.3 NMC 对HFD 诱导大鼠血脂的影响
给药4w 后,采用相应试剂盒测定各组大鼠血清中LDL-C、HDL-C、TC 和TG 水平,结果如表2 所示。各组大鼠血清中的HDL-C 无显著性差异。与空白组相比,模型组大鼠血清中LDL-C(10.35 vs.0.28)、TC(15.29 vs.1.57)以及TG(0.44 vs.0.32)水平均显著升高(p<0.01)。与模型组相比,NMC 低、中剂量组大鼠血清中LDL-C(8.04,8.11)以及TG(0.22,0.23)水平显著降低(p<0.01),且NMC 高剂量组大鼠血清中LDL-C(6.53)、TC(10.53)以及TG(0.28)水平均显著降低(p<0.01)。此外,洛伐他汀也可显著降低HFD 诱导大鼠血清中的LDL-C(7.93)、TC(11.86)以及TG(0.25)水平,但与NMC 高剂量组无显著性差异(p>0.05)。这些结果表明,NMC 灌胃给药可降低HFD 诱导大鼠的血脂水平,其作用具有剂量依赖性,且高剂量的作用效果与洛伐他汀相当。

表2 NMC 对HFD 诱导大鼠血脂的影响Table 2 The effects of NMC on the blood fat of HFD-induced rats (mmol/L,mean±SEM)
2.1.4 NMC 对HFD 诱导大鼠肝脏病理学的影响
如图1 所示,给药4 w 后,正常组大鼠肝脏外观呈深红色,表面光滑细腻,断面无颗粒,质地柔软坚韧。模型组大鼠肝脏颜色变浅,呈淡黄色,质地变硬且易碎,断面呈颗粒状,体积变化不明显。NMC 低、中、高剂量组大鼠肝脏颜色逐渐加深,有颗粒状斑点,肝脏断面呈颗粒状,洛伐他汀组大鼠肝脏颜色则偏淡红色。
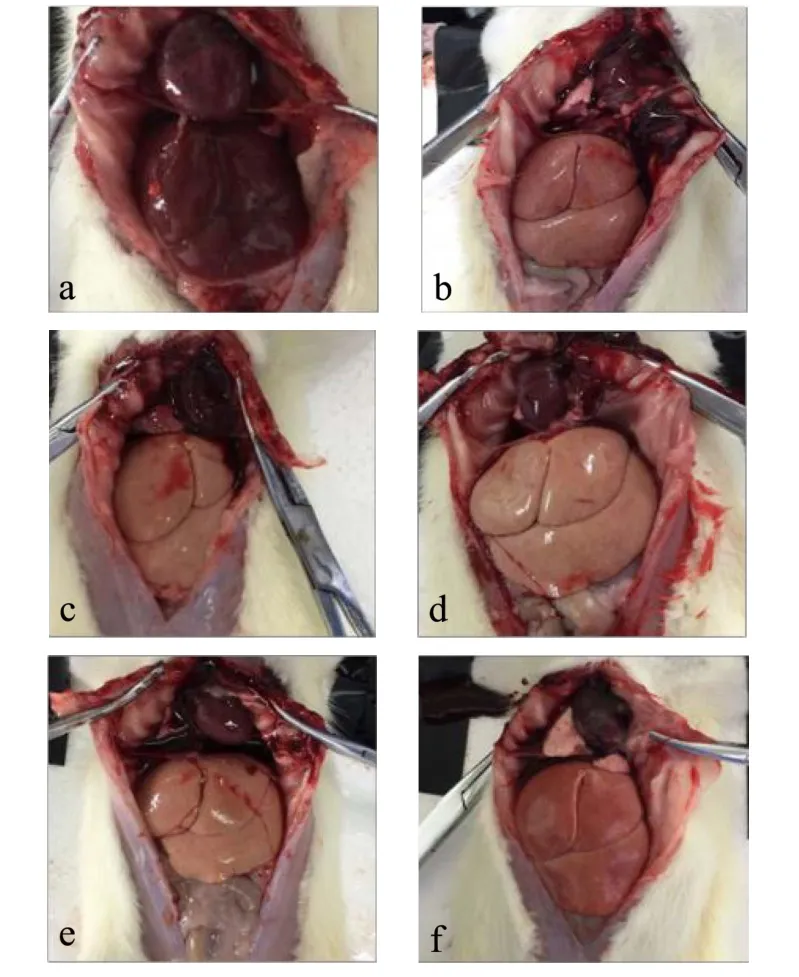
图1 各组具有代表性的大鼠肝脏外观照片Fig.1 The representative liver photographs of rats from different groups
随后,本研究运用苏木精-伊红染色法检测了NMC 对HFD 诱导大鼠肝脏组织病理学的影响。染色结果如图2 所示,正常组大鼠肝细胞形态正常,细胞边界及细胞核清晰,胞浆呈粉红色(图2a)。与正常组相比,模型组大鼠肝脏组织出现炎性细胞浸润,肝细胞体积显著增大且肿胀,核颜色加深,细胞间界限不清,胞浆中出现较大的脂肪滴,将细胞核挤向一侧,呈重度脂肪样变化(图2b)。而与模型组相比,NMC中、高剂量组大鼠肝脏组织炎性细胞浸润以及脂肪样变性减轻,细胞形态明显改善,细胞间界限较为清晰,且作用效果与洛伐他汀相当(图2d~f)。

图2 NMC 对HFD 诱导大鼠肝脏组织病理学的影响(400×)Fig.2 The effects of NMC on the liver histopathology of HFD-induced rats (400×)
2.2 NMC 药物代谢动力学研究
2.2.1 NMC 在比格犬体内的浓度-时间曲线
本研究通过HPLC 法检测,精密称定洛伐他汀标准品12.50 mg,梯度稀释,在238 nm 下测得吸光度,以峰面积积分值为纵坐标Y,进样浓度X(mg)为横坐标,进行线性回归,得标准曲线Y=2685.3X+83128,r=1。精密称定纳豆红曲复合物20.00 mg,加入乙腈溶液定容至10 mL 容量瓶中,在238 nm 处测吸光度,代入标准曲线方程,计算得每20 mg NMC 复合物中含有洛伐他汀0.355 mg。
本实验运用LC-MS 技术检测比格犬给与NMC后,其血浆中洛伐他汀的浓度变化,得到的血药浓度-时间曲线如图3 所示,在比格犬体内,NMC 给药后洛伐他汀的达峰时间Tmax为1.17 h,峰浓度Cmax为62.33 ng/mL。
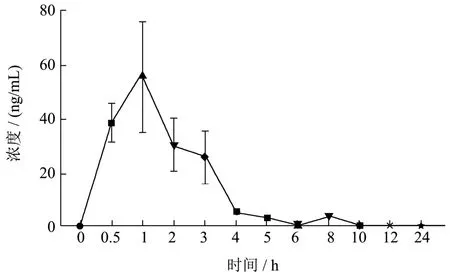
图3 比格犬口服NMC 后血浆中洛伐他汀的药物浓度-时间曲线Fig.3 The concentration-time curve of lovastatin in the plasma from beagle dogs after oral administration of NMC(Mean±SEM,n=6)
2.2.2 NMC 在比格犬体内的药代动力学参数
随后本研究根据前面的药物浓度-时间曲线,用统计矩法计算了NMC 中洛伐他汀在比格犬血浆中的药代动力学参数,主要包括末端相消除半衰期T1/2、血药浓度-时间曲线下面积AUC、体内滞留时间MRT,以及Tmax和Cmax实测值等,具体数据如表3 所示。

表3 NMC 单次给药后比格犬血浆中洛伐他汀的药代动力学参数Table 3 The pharmacokinetic parameters of lovastatin in the plasma of beagle dogs after a single doseof NMC
本采用LC-MS技术测定了NMC给药后比格犬血浆中洛伐他汀的浓度变化,并进行了药代动力学分析。实验结果显示,NMC 口服给药后,其成分洛伐他汀在比格犬体内的消除半衰期T1/2为5.95 h,以梯形法计算得的血药浓度-时间曲线下面积AUC(0-24)为137.40 mg/L×h,AUC(0-∞)为165.99 mg/L×h,平均体内滞留时间MRT 为7.83 h。
洛伐他汀可以通过多种方法进行检测,其中主要以HPLC 和LC-MS/MS 为主[16]。HPLC-UV 紫外检测法灵敏度较低,最低检测限较高,难以准确测定洛伐他汀的血药浓度,且LC-MS 中的选择性离子检测(SIM)模式准确度也较低,误差较大。而本实验使用的Agilent 6420 三重四极杆质谱检测仪,其多反应监测(MRM)模式可以同时准确定量样品中待测物和内标物的含量,具有高效、特异性强、灵敏高等特点,被广泛用于研究药物的代谢动力学特征。辛伐他汀为洛伐他汀的同系物,常被用作内标物,以解决质谱检测器信号相对不稳定的问题[19,20]。此外,此实验条件下洛伐他汀和辛伐他汀的[M+Na]+均比[M+H]+峰响应值高,且更为稳定,因此本实验选择[M+Na]+峰为定量峰。
之前的药物代谢动力学研究结果表明,洛伐他汀在人和比格犬血浆中的达峰时间和半衰期等数据相近[19-21],此外也有文献对洛伐他汀缓释制剂进行研究[22,23],但尚无有关红曲或NMC 的药物代谢动力学研究。洛伐他汀作为红曲中降脂的主要有效成分,其体内检测方法较为成熟,因此,本研究选用洛伐他汀作为红曲降脂的指标性成分,考察其在比格犬体内的药物代谢动力学过程,以期为红曲的安全性评价提供参考。本实验结果显示,比格犬单次口服NMC 后,洛伐他汀血药浓度达峰时间约为1.17 h,半衰期约为5.95 h,体内滞留时间为7.83 h,这与之前的文献报道基本相同,但峰浓度(30.05~129.33 mg/L)个体间差异较大,可能是因为实验动物存在个体差异。
3 结论
本研究表明NMC灌胃给药可降低HFD诱导大鼠的LDL-C、TG 和TC 等血脂水平,并可减轻肝脏细胞脂肪变性,且作用效果与洛伐他汀相当。而且,药代动力学实验结果表明,NMC 的有效成分洛伐他汀在比格犬体内可被正常吸收、代谢,并在12 h 之内代谢完全。本研究成果可为纳豆、红曲类保健食品的研发提供实验依据。
