微生物细胞工厂碳流调控进展
2021-12-28高聪郭亮胡贵鹏陈修来刘立明
高聪,郭亮,胡贵鹏,陈修来,刘立明
(1 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2 江南大学药学院,江苏 无锡 214122)
微生物细胞工厂是实现可持续发展的重要突破口。利用微生物细胞工厂生产化学品具有多种优势,使用可再生资源替代石化原料,缓解石油依赖困境;反应条件更加绿色温和,降低环境负荷。构建高效微生物细胞工厂的核心是通过基因调控增加目标化合物的产量、生产强度和得率。虽然过去30 年时间里,利用代谢工程手段改造微生物细胞生产材料单体[1]、药物中间体[2]、生物燃料[3]等领域取得了许多突破,但是仍存在许多问题。
首先,传统的基因操作,如基因过表达和基因敲除,在增强目标化合物转化率的同时,常会导致宿主细胞生长速率下降;其次,微生物细胞代谢网络中许多生化反应存在反馈调控和多层级调节现象。因此,在构建微生物细胞工厂的过程中需要进行大量试错实验,增加了研发周期和成本;最后,由于缺乏精细的调节工具,微生物细胞工厂的实际合成效率远远低于化学品的理论合成路线得率,增加了化学品生物合成成本,阻碍了微生物细胞工厂的规模化生产应用[4]。随着系统生物学和合成生物学的进步,更多理性计算和工程设计方法[5]被引入到微生物细胞工厂的构建过程中。通过选择关键代谢流调控靶点,降低目标化学品合成与菌株生长、副产物积累之间的代谢竞争,优化合成路径整体催化效率,可以最大程度提高工程菌株的生产潜能。因此,发展碳代谢流调控策略是强化微生物细胞工厂合成效率的重要手段。
在微生物细胞的碳代谢流调控过程中,主要涉及4个关键瓶颈,具体包括:①如何确定关键调控靶点?②如何平衡细胞生长和产物合成?③如何降低副产物对产物合成的分流?④如何提高长路径的催化效率?围绕上述瓶颈,本文依次分析了关键影响因素和潜在解决策略,并针对最新研究进展,提出未来构建高效微生物细胞工厂的潜在切入点和技术展望。
1 选择代谢流调节关键靶点
代谢流调控的第一个关键科学问题是如何选择关键调节靶点。在微生物从头发酵过程中,底物到目标产品的转化通常涉及许多内部之间存在紧密关联的生化反应。因此,开发高效的改造靶点预测技术,可更加理性地指导代谢工程,节约时间成本和人力成本。为了快速优化从底物到目标产品合成的代谢流分配,目前主要有基于模型指导和基于实验室适应性进化指导的两类策略。
1.1 基于模型指导的靶点选择
传统微生物细胞工厂改造往往涉及基因组学、转录组学、蛋白组学和代谢物组学等数据的分析。借助上述组学分析,可获得影响产物合成的关键靶点。例如,在枯草芽孢杆菌中,综合运用全基因组和转录组分析,鉴别了提高核黄素产量的7个关键突变位点。将上述位点引入野生型菌株中,并借助代谢工程手段削弱嘌呤从头合成途径,增强核黄素合成代谢途径,可使核黄素产量较野生型提高3.4倍[6]。
在组学技术基础上建立和发展起来的代谢网络模型可实现更加理性化的关键靶点选择。在应用代谢网络模型指导代谢工程菌种改造过程中,针对改造目的不同,可以将其分为“从无到有”的代谢工程菌株改造靶点选择(例如在工程菌株中寻找表达生物碱和萜类化合物等植物次级代谢产物改造靶点[7])和“从有到优”的代谢工程改造靶点选择(针对某些自然状态下难以过量积累的产品,如脂肪酸甲酯[8]、衣康酸[9]等代谢靶点的选择)。例如,通过将酶学性质引入大肠杆菌代谢模型iML1515中,构建了大肠杆菌酶约束模型ec_iML1515。基于该模型,预测出20 个影响赖氨酸合成的代谢改造靶点。实验验证表明,过量表达二氢硫辛酰胺脱氢酶基因lpdA、黄素还原酶基因fre、乙酰辅酶A合成酶基因acs、二氨基二甲酸脱羧酶基因lysA 和天冬氨酸激酶基因lysC,赖氨酸产量分别提高了63.8%、108.7%、55.6%、50.0%和123.6%[10]。值得注意的是,在模型预测改造靶点的过程中,网络模型质量和数据精度会影响预测准确性。因此,构建基于干湿实验结合[10]或整合细胞完整生命活动过程的细胞模型[11]将有助于提高靶点预测的准确性。
1.2 基于适应性实验室进化的靶点选择
适应性实验室进化是获得表型优良菌株的重要途径。其工作原理是,通过在基因组水平上对出发菌株的遗传物质进行突变或者重组,建立群体多样性文库,最终在高效筛选系统的辅助下获得目标性状菌株。常用的方法主要包括以物理/化学诱变方法[12]、基因改组、易错PCR[13]等为代表的传统策略和以重组酶、CRISPR 介导的多位点进化[14]和连续自动进化[15]等为代表的新型技术。通过对出发菌株与筛选菌株进行基因组比较分析,最终获得代谢改造靶点。例如,通过构建一种基于转录调节因子Lrp 的缬氨酸传感器,可以检测支链氨基酸含量并将其转化为荧光信号输出。将传感器引入丙酮酸脱氢酶失活的产缬氨酸谷氨酸棒状杆菌中,可筛选获得具有更高生长速率、缬氨酸产量提升1倍、副产物积累减少2/3~3/4 的突变菌株。基因组测序结果表明,该缬氨酸高产突变菌株的脲酶附属蛋白UreD 和全局转录因子GlxR 发生突变。在野生型菌株中引入上述突变,可使菌株的缬氨酸产量提高100%,并降低副产物丙氨酸的积累[16]。
2 平衡细胞生长与产物合成碳流
利用代谢工程改造微生物生产化学品的过程中,细胞生长与产物合成之间碳代谢流竞争是代谢流调节中最常见的科学问题(图1)。当代谢流集中于细胞生长相关途径,目标产品的得率会降低;当胞内代谢流集中于产物合成途径,细胞生长也会受到影响[17]。因此,在适当的时机分配生长必须代谢流和产物合成代谢流,可以实现细胞生长与目标产物合成之间的平衡,提高菌株化学品生产能力。根据具体调控过程,可以归纳为以下三类:①静态调节技术;②单次动态调节技术;③连续动态调节技术。

图1 如何解决菌体生长与目标产物合成竞争的问题
2.1 静态调节
静态调控是指对目标代谢通路进行静态优化的代谢工程改造策略。这种改造方式具有设计简单、改造周期短、效果稳定等优势。目前,静态调控的主要技术有基因的过表达和基因插入和敲除等。例如,最近发展的重组酶与CRISPR/Cas9组合基因编辑技术,利用重组酶RecT 将合成的单链寡脱氧核苷酸通过同源重组作用插入基因组,而Cas9 与单链向导RNA(sgRNA)复合物则通过引入不可修复的双链断裂区来阻止未编辑细胞的存活,大幅提高了基因编辑效率。基于RecT+CRISPR基因编辑技术,可在谷氨酸棒状杆菌中无痕敲除一个或多个基因,快速构建多种突变体,加速菌株代谢工程进程[18]。虽然静态调节技术成熟,但是静态调控往往难以一步实现菌株生长和产物合成之间的平衡,需要多轮、多靶点的组合优化才能获得最佳的工程菌株。
2.2 单次动态调节
单次动态调节技术是指当外源输入信号时,系统仅进行一次针对靶基因表达/关闭的调控。采用单次动态调节技术,可将发酵过程分为前期生长阶段和后期产物生成阶段,以改善细胞生长,增加最终产物产量。其代表技术包括一系列的生物开关,如化学物诱导型开关(如LacI-IPTG、AraCARA[19]、TetR-ATC[20])、温度敏感型开关[21-22]、pH响应型开关[23]、溶氧响应开关[24]等。除了上述生物开关,具有非侵入性和快速可调性的光信号[25-26]和磁信号[27]响应生物开关,也逐步被应用于微生物细胞工厂代谢流调控中。例如,利用光敏性转录因子在光诱导下激活转录的原理,通过控制外源蓝光的开启或关闭,可改变酵母细胞中碳代谢流方向,实现细胞生长和产物合成之间的解偶联,使工程菌株的异丁醇产量达到8.5g/L,较对照菌株提高了5倍,2-甲基-1-丁醇产量达到2.4g/L[25]。
2.3 连续动态调节
连续动态调节技术的优势在于可根据环境和代谢流的变化,动态控制细胞响应。随着新的调控机制的阐明,越来越多新型调控元件被开发,并应用于系统调控微生物的代谢流。根据调控原理,常见的连续动态调控技术可分为三类:①代谢物响应型;②细胞密度响应型;③细胞状态响应型。
通过挖掘响应终产物或者中间代谢物浓度变化的转录蛋白[28]、核糖开关[29]等元件,可构建出代谢物反馈动态调控开关。例如,利用来源于枯草芽孢杆菌FapR 调控蛋白响应脂肪酸合成前体丙二酸辅酶A浓度的原理,在大肠杆菌中构建了双功能代谢开关,实现在胞内高丙二酸辅酶A浓度条件下,激活PGAP启动子转录,同时抑制T7启动子转录。含有代谢开关的工程菌株能够根据丙二酰辅酶A 的浓度,动态调节其上下游基因的表达水平,使代谢流量高效导向脂肪酸的合成,产量较野生菌株提高了15.7倍[30]。虽然动态调控策略已有许多成功应用的例子,但是寻找合适传感器和执行器可能费时费力。因此,开发路径/菌株普适性的动态调控工具是未来的重要方向[31]。
第一种路径普适性的自诱导信号是细胞密度。细胞密度是微生物细胞工厂的一个重要的参数,反映了细胞的整体生长状况和代谢能力。借助细菌本源的群体感应(QS)系统[32]或者异源引入QS 系统[33]控制目标基因表达,可实现基因表达水平随着细胞密度的增加而持续动态调节。例如,在以木聚糖为唯一底物合成莽草酸的过程中,以莽草酸激酶AroK为调控靶点,引入来源于费氏弧菌的QS系统和重组酶Cre 系统,可构建一个QS 依赖的新型动态调控开关,通过优化RBS 强度和筛选LuxR 突变体,该动态开关展示出良好的系统可调性和可移植性。利用该技术,工程大肠杆菌以25g/L 木聚糖为底物,可生产3.2g/L莽草酸[34]。
第二种路径普适性的自诱导信号是细胞状态。由于环境营养条件的差异,微生物细胞在不同的生长阶段会有不同的生长速率和细胞状态。最常见的两种状态是处于对数生长期的细胞状态和进入稳定期的细胞状态。通过对两种状态下的细胞进行转录组分析,可获得两类具有完全不同转录特征的启动子:生长期关联启动子(growth phase promoter,简写GPP)[35],其转录活性在菌株处于对数生长期时极强,处于稳定期时受抑制;稳定期关联启动子(stationary phase promoter,简写SPP),其转录活性在菌株处于对数生长期时受抑制,处于稳定期时激活[36]。在此基础上,设计GPP 负责转录控制具有N端隐藏降解子的靶蛋白,设计SPP负责转录控制的蛋白酶,构建动态调控基因回路。应用该基因回路,工程菌株可实现在外源不添加必需氨基酸和化学诱导剂的无机盐培养基中,积累12.6 g/L 莽草酸[37]。
再进一步,为了实现精确的自动控制,上述策略可以组合使用。例如,分别将响应细胞状态的PrpoS启动子和响应细胞密度的QS系统设置为两个信号输入端,构建与逻辑门(AND)。在该逻辑门中,仅当微生物密度和细胞生理状态同时达到响应阈值时,才能实现目标基因的输出,以协同提高化学品的合成能力。基于该逻辑门控制系统,工程大肠杆菌生产聚羟基丁酸酯的产量较对照菌株提高了近2倍[38]。
3 降低副产物路径与产物合成竞争
副产物路径与目标产物合成的竞争是另一类常见的科学问题(图2)。微生物在发酵生产过程中通常会伴随着副产物的积累,导致目标产品生产指标降低。在这种情况下,就需要开发出更精密的代谢流调控手段,从而更有效地解决副产物路径与目标产物合成的竞争问题。针对这一问题,主要涉及三种解决思路:①基于基因编辑的调控技术;②基于基因表达抑制的调控技术;③基于复杂基因回路的调控技术。
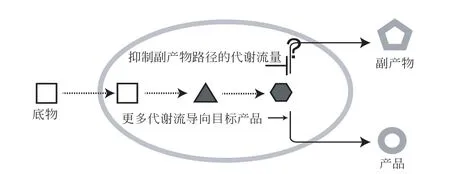
图2 如何解决副产物路径与目标产物合成竞争的问题
3.1 基因编辑技术
基因编辑是改变代谢流分布、降低副产物积累和提高目标产物得率最直接的技术[39]。目前常用的基因编辑方法有FLP/FRT[40]和Cre/Loxp 技术、锌指核酸酶(ZFN)技术[4]、转录激活因子样效应物酸酶(TALEN)技术和CRISPR-Cas9/Cpf1 技术[41]等。例如,野生型大肠杆菌W3110 仅可积累5.54g/L 丙酮酸,但是却可以积累6.34g/L 乳酸、4.72g/L 乙酸和2.34g/L 甲酸。为了提高菌株丙酮酸的积累量,利用FLP/FRT基因编辑技术,组合敲除编码乳酸脱氢酶(LdhA)、丙酮酸氧化酶(PoxB)、丙酮酸甲酸裂解酶(PflB)、磷酸转乙酰酶(Pta)和乙酸激酶(AckA)的基因,可大幅降低副产物的积累,使目标产物丙酮酸的积累量达到20.9g/L[40]。相较于FLP/FRT基因编辑技术,CRISPR-Cas9基因编辑技术编辑周期短、准确率高、操作便捷、成本低,目前应用更为广泛。例如,在己二酸的合成中,乳酸和丁酸等副产物的积累降低了己二酸得率,利用CRISPR-Cas9 技术分别删除了编码乳酸脱氢酶(LdhA)和乙酰辅酶A 乙酰转移酶(AtoB)的基因,使己二酸的得率由49.5%提升至61.7%[42]。
3.2 基因表达抑制
尽管基因组水平操作通量越来越高,但是普遍存在可调性差的问题。在某些情况下,副产物的合成也是微生物细胞维持自身稳态的一种机制。例如,大肠杆菌在厌氧条件下会同时生产乳酸、乙酸、甲酸和琥珀酸等混合酸,以维持氧化还原平衡[43]。完全阻断副产物代谢路径碳流量,会对菌株生理代谢造成不利影响。基因表达抑制技术较好地解决了上述问题。根据调控层面,这些技术可以划分为DNA 水平调控技术、RNA 水平调控技术和蛋白水平调控技术等。
应用最广泛的DNA 水平调控技术之一是CRISPR 干扰系统(CRISPRi)。在该系统中,丧失DNA切割能力的Cas9核酶突变体(dCas9蛋白)仍保留了其DNA结合能力,因此,当sgRNA靶向结合到目标DNA序列时,dCas9蛋白会与RNA聚合酶形成空间上的物理阻遏,降低目标基因的转录强度,实现基因表达抑制[44]。同时,设计不同的sgRNA靶向序列,实现不同的结合位阻,可获得不同水平的抑制强度[20]。例如,利用CRISPRi 技术,分别组合抑制大肠杆菌副产物乙酸合成基因pta,琥珀酸合成基因frdA,乳酸合成基因ldhA 和乙醇合成基因adhE,产物正丁醇的得率提高了5.4倍[45]。
代表性RNA 调控技术主要包括小RNA(sRNA)干扰[46]和反义RNA(asRNAs)调控[47]两大类。合成sRNA 序列包含支架序列和靶标结合序列,这种双重结构使其可以在招募Hfq 蛋白的同时,完成与目标mRNA的杂交,促使目标mRNA降解,实现表达抑制。例如,基于大肠杆菌本源Hfq蛋白,分别设计了靶向酪氨酸和戊二胺合成代谢路径的sRNA库。通过组合优化,确定影响目标产品合成的关键基因和最优表达抑制水平,使大肠杆菌的酪氨酸产量达到2g/L,尸胺产量达到12.6g/L[46]。不同于sRNA干扰,小分子RNA可以通过与目标基因的mRNA形成互补双链而抑制基因的表达。利用这种原理,设计asRNAs 降低竞争路径基因的表达水平,可使代谢流集中分配到目标产品。例如,通过设计抑制基因fabD(编码丙二酰辅酶A-ACP 转酰基酶)表达的反义RNA,使胞内的丙二酰辅酶A浓度提高4.5倍,产物4-羟基香豆素、白藜芦醇和柚皮素的产量分别提高2.53 倍、1.70 倍和1.53倍[47]。
蛋白调控技术主要通过改变目标蛋白的N 末端[48]或C末端氨基酸序列[49],使其稳定性发生改变,从而调整目标蛋白丰度。例如,利用蛋白降解原理,构建了两种调节工具。首先,对靶蛋白的N末端进行修饰,依次添加上蛋白酶TEVp的切割识别位点和蛋白降解子。由于靶蛋白的N末端降解子被切割位点隐藏,靶蛋白处于初始稳定状态。当蛋白酶表达后,蛋白酶识别位点被切割,降解子裸露,靶蛋白转为不稳定状态,从而调整靶蛋白丰度从高水平转换到低水平(OFF 开关)。相反,也可以对靶蛋白的C 末端进行修饰,依次添加上蛋白酶TEVp 的切割识别位点和蛋白降解标签。由于靶蛋白的C末端降解标签初始处于裸露状态,靶蛋白会被胞内蛋白降解机器识别并被持续降解。当蛋白酶表达后,靶蛋白的C末端降解标签会被切除,被切割降解标签的靶蛋白转变为稳定状态,从而实现靶蛋白丰度由低水平到高水平的转换(ON开关)[37]。蛋白水平的调控相较转录水平的调控具有更短的响应时间,但是该过程是一个高ATP 消耗的过程,例如降解一个模式底物(肌联蛋白)需要600 个ATP分子[50]。同时,多个靶蛋白的降解往往会造成排队效应[51],降低元件的初始参数,进而影响基因回路系统的输出。最近的文献指出可以采用亮氨酸拉链裂解蛋白的方式控制蛋白酶活性[52],靶蛋白无需完全降解即可行使生物学活性,在构建蛋白开关时展示出良好的应用前景。
3.3 复杂基因回路
代谢网络中的碳流分布是多维度相互影响的,单一靶点或信号的改变难以实现最优的化学品合成。因此,借助包含两层以上的动态调控系统,实现多维度胞内生物信息的输入、分析和输出,可以更加有效的提高工程菌株目标化学品的合成能力。不同于AND 逻辑门中相互独立的两层输入端,在分层动态调控系统中,不同层级动态调控系统之间可利用转录调控蛋白[53],代谢物的积累[54],细胞密度[55]等条件实现耦合。例如,在对多种革兰氏阳性和阴性菌株中QS 系统的正交性和动态调控范围进行评价后,选择了来源于费氏弧菌(Vibrio fischeri)和来源于粪肠球菌(Enterococcus faecalis)的QS 系统,分别用于控制中链脂肪酸路径酶的合成和内切核糖核酸酶MazF 的表达,实现第一层调控系统由细胞密度控制,第二层调控系统由mRNA全局降解控制,最终改变细胞代谢资源全局分布的目的。在5-L发酵罐水平上,实验菌株较没有引入动态调控系统的对照菌株,中链脂肪酸产量提高了5.4 倍,同时副产物乙酸积累量由12g/L 降低至2g/L,乳酸和琥珀酸积累量分别由6g/L、4g/L降低至0.5g/L[55]。发展多层级调控系统是理解细胞复杂调控网络的途径之一,同时可为未来构建执行复杂生命活动功能的智能微生物细胞奠定研究基础[56]。
4 强化产物合成路径效率
碳流调控的最后一个关键科学问题是如何解决目标产物合成路径效率低的问题(图3)。在代谢流调节中,合成路径较长,或者调控靶点下游合成路径酶活性较低时,仅仅依靠改道代谢流,难以有效的增加目标产品的合成效率。为了解决合成路径效率低的问题,近年来文献报道了许多策略,可以粗略归为四类:①降低胞内代谢干扰;②优化路径催化效率;③强化路径代谢通量;④实施代谢路径分工。

图3 解决目标产物合成路径效率低的问题
4.1 降低胞内代谢干扰
长路径合成过程中酶与酶之间较低的协同催化效率,常会导致代谢中间产物积累。这些中间代谢产物会参与到胞内代谢环境中,进而对宿主产生毒性,或被竞争途径消耗。解决这些问题的重要思路有主要两类:①空间工程,通过缩短目标合成路径中多个路径酶的空间距离,构建底物催化通道;②亚细胞定位工程,将目标产物合成相关的途径定位于特定的亚细胞结构(如线粒体[57],过氧化物酶体[58]和液泡[59])中,实现代谢反应隔离,降低胞质反应对路径合成效率的影响。
空间工程的代表性技术包括多酶复合物和脚手架技术。构建多酶复合物可以将途经中的酶共定位,以形成最优比例的复合物,增加途径代谢产物和酶的局部浓度,限制途径中间体的积累。例如,通过将木糖转运与异构化反应级联,可构建人工合成酶-膜转运蛋白的多酶复合物,强化底物木糖用于生产乙醇的代谢途径,在提高乙醇合成的同时降低副产物木糖醇的积累,最终使产物中乙醇/木糖醇比例由3 倍提到至6 倍[60]。常用的脚手架技术包括利用锌指蛋白与DNA 特异性结合原理的DNA 脚手架、利用含有蛋白结合域适体的RNA 脚手架和基于蛋白结合配体的蛋白脚手架等。例如,在合成葡萄糖二酸的三步级联催化中,肌醇加氧酶(MIOX)的活性受到中间代谢物肌醇浓度的强烈抑制,利用锌指蛋白绞手架特异性结合DNA的特点,分别将3 种路径酶(Udh、Ino1 和MIOX)靶向到3种不同的锌指蛋白(GBD、SH3和PDZ)中,经过比例优化,降低中间代谢物肌醇的积累,可使大肠杆菌葡萄糖二酸的产量相比对照提高5倍[61]。
亚细胞定位工程可以避免代谢途径中间物的损失,减少与其他细胞成分之间发生的不必要反应,有利于整个途径行使更加复杂的功能。在酵母细胞中,将异丁醇合成路径下游关键酶α-酮酸脱羧酶(α-KDC)和醇脱氢酶(ADH)共定位于线粒体中,避免缬氨酸合成路径(支链氨基酸转氨酶BAT1和BAT2)的干扰。最终,工程酵母的异丁醇产量相比出发菌株提高260%[62]。最近的研究表明,路径中多个关键酶也可以被分别分配到多种亚细胞结构中,以实现代谢协同,提高长路径的合成效率。例如,利用模块化区室的概念,可将曼陀罗素和天仙子胺两种生物碱的合成路径分别共定位于细胞质、线粒体、过氧化物酶体、液泡和内质网等亚细胞结构中,最终实现了两种药用生物碱的从头合成[59]。
4.2 优化路径催化效率
为了提高路径催化效率,可以从两个方面进行解决。第一,实现途径中不同酶的催化协同,降低中间代谢物积累;第二,对具有反馈/负反馈效应的酶进行蛋白质工程改造,提高路径催化效率。
对于一条长合成路径中,每种酶的表达水平、催化性能和变构调节作用不同,均会影响整体路径的合成效率。为了解决这一问题,可采用模块路径工程直接优化下游合成路径中多个酶的表达水平,提高限速酶的相对丰度,以提高合成路径催化效率。例如,在酿酒酵母中,将葡萄糖到鸟氨酸的合成路径的酶,按照代谢节点或者酶的催化性能划分为3 个模块,通过优化这些模块中酶的相对表达量,使L-鸟氨酸产量达到5.1g/L[63]。
除了协同表达水平,路径酶的催化性能也是影响长路径合成效率的关键点。某些酶可以催化多种底物,导致副产物积累和较低的产物得率。利用蛋白质工程改造酶对目标底物的亲和性,可提高代谢流再分配到目标产物的效率。例如,在N-乙酰-d-葡萄糖胺(GlcNAc)生物生成N-乙酰-d-神经氨酸(Neu5Ac)的过程中,N-乙酰葡萄糖胺2-差向异构酶(AGE)可同时催化GlcNAc 和N-乙酰-d-甘露胺(ManNAc)之间的双向反应。运用蛋白质工程策略改造AGE 酶活性位点,可提高其对Neu5Ac 的亲和性。最终,突变体C372A 对GlcNAc的Km值比野生型低50%,对ManNAc 的Km值比野生型高130%,使Neu5Ac 产量提高5.9%[64]。另外,对于有些辅因子依赖型酶,不匹配的辅因子会严重影响酶催化性能。利用蛋白质工程优化其辅因子的偏好性,可提高路径催化效率。例如,赖氨酸的生产过程是一个高消耗NADPH的过程,胞内NADPH丰度下降会影响NADPH 依赖型二氢二吡啶酸还原酶(DHDPR)的性能。通过对DHDPR辅因子结合域进行定向突变,DHDPR突变体R13A的辅因子偏好从NADPH 转变为NADH,进而使赖氨酸产量增加21.4%[65]。
4.3 强化路径代谢通量
路径代谢通量的强化可以在多种调控水平上实现。例如,在转录水平调控上,可通过质粒拷贝数优化[42]、目标基因表达框的启动子替换[28]、转录激活蛋白引入[66]等手段,强化代谢路径的通量;在翻译水平调控上,可借助核糖体结合位点替换[10]、翻译起始区序列调节[67]等技术,提高目标代谢路径通量;在蛋白水平调控上,基于蛋白降解速率控制[37]、蛋白二聚化活性控制[68]等策略,优化代谢路径酶的丰度与活性;在细胞水平调控上,发展压力代谢进化[69]、细胞形态工程[70]等方法,调节细胞对底物和目标产物的物质传递效率。其中,针对代谢流通量很低的路径,可采用压力代谢进化的方式,驱使代谢流量进入目标路径。这种环境压力和细胞自适应进化的组合,可加快微生物的改造进程,赋予微生物原本不具备的生理性状和化学品合成能力。例如,在大肠杆菌中引入核酮糖-1,5-二磷酸羧化酶、磷酸核糖激酶和甲酸脱氢酶,同时敲除磷酸果糖激酶和葡萄糖-6-磷酸脱氢酶(分别阻断细胞的糖酵解和戊糖磷酸途径),可驱使细胞利用卡尔文循环固定和还原CO2。然后,在适应性进化过程中,逐步降低混合碳源中木糖的比例并增加CO2比例,经过350天的适应性进化后,最终在异养微生物大肠杆菌中成功实现了完全自养[69]。实际上,代谢进化策略是强化低代谢流通量路径的有效策略,已广泛应用在多种一碳资源(CO2[71]、甲醇[72]、甲酸[73]等)利用途径强化中。
4.4 实施代谢路径分工
在单一宿主内同时表达多个路径酶会造成代谢负荷,影响细胞生产性能。为了提升长路径的整体催化效率,可以利用合成群落系统,实施代谢路径分工。一方面,利用共培养技术,在实现菌种间代谢物的交换的同时,降低完整路径在单一菌株表达所造成的生产负荷;另一方面,借助不同菌株的固有优势,如大肠杆菌生长迅速,酵母具有完善的真核蛋白表达系统,可以优化路径的整体合成效率。例如,在生产氧化紫杉烷类化合物时,以木糖为碳源,设计了大肠杆菌/酿酒酵母双菌共生系统。其中,大肠杆菌代谢木糖会外源分泌乙酸,不能利用木糖的酿酒酵母利用乙酸作为唯一碳源进行生长,而不积累会抑制大肠杆菌生长的乙醇。将紫杉烯合成路径分配到大肠杆菌细胞中,而将大肠杆菌难以表达的P450-CPR酶分配到酿酒酵母中表达,通过菌株比例优化和乙酸积累路径改造,氧化紫杉烷产量达到33mg/L[74]。通过构建更为复杂的微生物群落,可以实现多种化学品的集成式生产。例如,以纤维素为底物,首先利用里氏木霉(Trichoderma reesei)和戊糖乳杆菌(Lactobacillus pentosus)搭建“乳酸”生产平台,当向群落系统中引入第三种菌时,可生产不同化学品。例如,引入酪丁酸梭菌(Clostridium tyrobutyricum)生产丁酸,引入仓鼠韦荣球菌(Veillonella criceti)生产乙酸和丙酸,引入埃氏巨型球菌(Megasphaera elsdenii)生产戊酸和正己酸[75]。
5 革新性技术的兴起
受益于近年来合成生物学元件的挖掘、组学分析技术的发展和多学科之间的技术融合,越来越多的革新技术展示出其在提升精确度、智能化和时效性等领域的应用潜力(图4)。

图4 未来代谢调控工具发展方向
5.1 高精度调控工具
目前部分调控工具存在调控对象不精细、调控幅度较窄、调控研究手段粗糙等限制。以传统技术为基础,借助交叉学科技术,可提高目前调控改造精度。例如,在调控对象上,传统CRISPR/Cas9基因组编辑技术难以实现单碱基的精确编辑。最近建立的包括C到T[76],A到T和G到C[77],C到A和C到G[78]等单碱基定向编辑技术,可为基因组水平的精确编辑和表达调控提供便利。在调控幅度上,传统的诱导剂-阻遏蛋白表达技术的调控倍数普遍低于100倍。而最新建立的基于反式RNA控制翻译起始的Toehold开关,其调控幅度可达到400倍[79];基于类球红细菌光感二聚体RsLOV 构建的单组分光激活系统,其调控幅度达到500 倍[66];组合蓝光响应T7 RNA 聚合酶表达调控系统和光敏感型四环素系统,使其调控幅度达到700 倍[80];通过在起始密码子和蛋白编码区之间优化不同前导序列,可实现约1000倍的表达水平控制[67]。在调控研究手段上,传统研究尺度集中于细胞群体水平,难以明确细胞本身生理变化和个体表达差异。借助微流控技术,可以实现对单细胞生理变化的观测[81]和群体异质性的评估[82]。
5.2 仿生学调控工具
受限于理论和技术水平,人类还无法完全重复出许多植物、动物已有的生物体系。利用仿生学原理,一方面,可以直接借助自然界已存在但是目前难以人工重建的生物系统;另一方面,可以启发于自然界中已存在的物质能量转化模块,实现人工体系的高效合成。例如,直接提取叶绿体类囊体膜并封存于区室化的液滴中,可以构建仿生叶绿体结构,完成光驱动CO2固定[82]。类似地,将光转换器PR、PSII 和ATP 合酶整合到脂质囊泡中,可以构建人工光合细胞器,实现ATP合成与CO2固定之间的耦合[83]。
5.3 智能化调控工具
传统的代谢调控策略,普遍存在人工参与度高、理性设计不足的问题。因此,借助多学科交叉领域技术,可提高调控手段的智能性。借助生物传感器,可降低人工参与度,构建出具有自动调节细胞代谢负荷[84]、自动适应性进化[85]、自动消除群体异质性[86]功能的基因回路。利用计算机辅助系统,可以快速实现海量数据的分析,降低人工试错成本。例如,借助计算机算法和软件,已开发了针对大肠杆菌和酵母的基因回路自动化设计平台[87-88],利用该平台可以构建出类似电子显示屏的复杂基因回路[89];借助机器学习预测,可以快速实现基因型到表型的精准预测,提高工程菌株色氨酸产量74%[90]。
5.4 多任务调控工具
传统的代谢调控策略,普遍存在任务单一的瓶颈。借助纳米材料技术,可构建具有复杂空间排布的结构,执行多种任务。例如,为了在大肠杆菌中构建多种酶共存的催化微环境,传统策略是引入脚手架技术,但是引入的路径酶个数较少(<4),且难以特异性改变酶活,而利用细胞相容性高的纳米超分子结构作为载体,借助DNA 链特异性招募路径酶和酶抑制蛋白,可实现多种酶/酶抑制剂的顺序聚集(蛋白复合体)和解聚[91],实现调控手段的多功能性。
5.5 快响应调控工具
目前的代谢调控手段,普遍集中于转录水平,具有响应时间长、调控精度差的限制。挖掘细胞本源调控机制,在后翻译水平或蛋白水平建立调控策略,可有效降低响应时效。例如,利用蛋白酶的级联降解原理,首次构建了蛋白振荡器[37]。该振荡器的振荡周期较传统转录振荡器的(160±40)min[92]缩短到90min。同时,组合响应时效不同的调控手段,可实现大范围的响应时间精细优化。例如,在酵母细胞中,通过结合磷酸化调控(快响应)和转录调控(慢响应),构建了双时间尺度的动态调控工具,实现细胞生命活动的可调控制[93]。
6 结语
在微生物代谢流调节中,首先需要确定调节靶点,然后确定代谢流调节的类型,挖掘关键调控元件,发展适宜的调控工具。最后,提高路径中酶与代谢物的催化协同,优化代谢流调节效果。随着越来越多生物元件被挖掘与标准化,同时,结合先进的生物技术,如高通量筛选平台[94]、自动化工作站[95]、DNA快速合成及测序等,预期微生物细胞工厂的设计-构建-测试循环将实现短周期、智能化、高效率的革命性突破[96]。
