RAD51和XRCC4在伴有淋巴结转移食管鳞癌中的表达及临床病理意义*
2021-12-21张仁静李雨珊莫琳蹇顺海何欣蓉
张仁静 李雨珊 莫琳 蹇顺海 何欣蓉
(1.川北医学院附属医院病理科,四川 南充 637000;2.川北医学院病理教研室,四川 南充 637000;3.南充市中心医院检验科,四川 南充 637000)
食管癌是我国四大最常见的肿瘤之一[1],发病隐匿,80% 以上患者确诊时已进入中晚期,5 年生存率仅为 10%~30%[2]。我国食管癌患者的组织学分类以鳞状细胞癌为主,占90%左右,发现能够预测食管鳞癌预后的生物标志物和治疗的潜在新靶点极为迫切。DNA 双链断裂(double-strand break,DSB)可以通过两种主要途径修复:同源重组(homologousrecombination,HR)和非同源末端连接(nonhomologous end joining,NHEJ)[3-4]。HR需要同源序列作为修复模板,其途径的主要蛋白包括由 RAD51、BRCA1、BRCA2 和 PALB2 基因编码的蛋白[5],RAD51是HR修复途径的核心因子,因为其介导同源 DNA 序列和链入侵的配对[5-6]。 NHEJ 涉及两个 DSB 末端的直接连接,几乎不需要序列同源性,需要四种核心因子Ku、DNA-PKcs、XLF 和 XRCC4-LIG4,XRCC4通过与单个 XLF 二聚体两个头部结构域相互作用而结合 DNA 末端〔7〕,促进 LIG4 独立的断端桥接[7-8]。HR 或 NHEJ 中的缺陷可导致基因组不稳定性和肿瘤发生[9-10]。本实验拟通过检测RAD51、XRCC4蛋白在食管鳞癌细胞及组织中的表达情况,探讨RAD51、XRCC4蛋白与食管鳞癌发生、发展及预后的关系,为食管鳞癌的预后预测和治疗探索潜在的新临床靶点。
1 资料与方法
1.1 一般资料 收集川北医学院附属医院病理科2017~2018年食管癌根治术标本62例。术前均未行放、化疗,术后活检证实为食管鳞状细胞癌且有淋巴结转移,标本完整。本组患者发病年龄 41~82岁,平均年龄 62.8岁。男性 45例,女性 17 例。另从中取14例癌旁组织( 距癌灶≥3 cm)作对照。食管癌细胞系TE-1及人食管上皮细胞株HEEp均获赠于川北医学院风湿病研究所,新生牛血清(浙江天杭生物科技股份有限公司),DMEM(Hyclone),0.25%胰酶(Gibco),即用型快捷免疫组化MaxVisionTM试剂盒(产品编号: KIT-5010/5020/5030) 及DAB 显色试剂盒(产品编号: DAB-2031/2032) (福州迈新生物技术开发有限公司),XRCC4(C-4):sc271087(santa CRUZ);Rad51(ab133543)(abcam)。
1.2 细胞复苏与传代 将人食管正常上皮细胞株HEEp、人食管癌细胞系TE-1置于37℃水浴箱中快速融化,加入含10% 胎牛血清的DMEM培养液 2 mL,1000 r/min 离心5 min,弃去上清,重悬后将细胞加入含10% 胎牛血清的DMEM培养基中,置于37℃、5% CO2培养箱中培养,待细胞融合至80%~90% 时传代。
1.3 免疫细胞化学 制作细胞爬片,分TE-1、HEEP两组,将细胞接种于放有爬片的六孔板中,待细胞铺满后,用PBS漂洗,4%多聚甲醛固定,0.5% Txiton X-100打孔,3% H2O2封闭,PBS漂洗,取出并风干爬片,分别加入RAD51抗体(1∶300)、XRCC4抗体(1∶300)4℃孵育过夜,PBS漂洗,二抗室温孵育25 min,DAB显色,苏木素复染,封片剂封片。
1.4 石蜡包埋组织免疫化学 所有标本均采用4%中性缓冲甲醛固定、脱水、常规石蜡包埋、经3~5 μm连续切片,环保透明剂脱蜡,免疫组化采用MaxVisionTM染色,严格按照试剂盒说明操作。DAB显色后,苏木素复染,盐酸酒精分化,脱水,吹干,中性树胶封片。以PBS 缓冲液代替一抗作阴性对照,已知的阳性组织作为阳性对照。免疫组织化学结果判读:RAD51、XRCC4蛋白均主要定位在食管鳞状细胞癌细胞核,表现为细胞核呈浅黄色、棕黄色或棕褐色,在细胞质中也有少量表达。RAD51蛋白根据着色强度的分值: 无着色、淡黄色、棕黄色、棕褐色分别计为 0、1、2、3分,根据阳性细胞占总细胞数百分比的分值: 阳性细胞 <10%、10% ~ 24%、25%~49%、50%~74%、≥75%分别为 0、1、2、3、4分,着色强度分值×阳性细胞百分数分值计为免疫组化,本实验0~1分判为阴性,≥2分为阳性(+)(图1、2);XRCC4蛋白根据着色强度的分值: 无着色、淡黄色、棕黄色、棕褐色分别计为 0、1、2、3 分,根据阳性细胞占总细胞数百分比的分值 <10%、10%~50%、51%~75%、≥75%分别为 1、2、3、4 分,着色强度分值×阳性细胞百分数分值计为免疫组化,本实验0~4分判为阴性,≥5分为阳性(+)(图3、4)。

图1 免疫组织化学法检测RAD51蛋白在分化食管鳞癌组织中的表达

图3 免疫组织化学法检测XRCC4蛋白在分化食管鳞癌组织中的表达

图4 免疫组织化学法检测XRCC4蛋白在分化食管鳞癌配对癌转移淋巴结组织中的表达
1.5 统计学分析 应用 SPSS 17.0统计软件进行统计分析,计数资料以百分数(%)表示,采用2检验、 Spearman等级相关检验进行结果分析,Kaplan-meier进行生存分析,P<0.05为差异具有统计学意义。
2 结果
2.1 免疫细胞化学结果 RAD51、XRCC4蛋白均主要定位癌细胞核,表现为细胞核呈浅黄色、棕黄色或棕褐色,在细胞质中也有少量表达。RAD51、XRCC蛋白在食管癌细胞TE-1中呈阳性表达,而在正常食管上皮HEEp细胞中呈阴性表达(图5)。

图5 免疫组织化学法检测RAD51蛋白和XRCC4蛋白的表达
2.2 RAD51、XRCC4蛋白在石蜡包埋有淋巴结转移的食管鳞癌组织中呈阳性表达 RAD51在食管鳞癌原发灶中的阳性表达率高于癌旁组织的阳性表达率,高于配对癌转移淋巴结中癌组织阳性表达率(P=0.000,P=0.065)(表1),XRCC4在食管鳞癌原发灶灶中的阳性表达率为62.90%,高于癌旁组织的阳性表达率,高于配对癌转移淋巴结中癌组织的阳性表达率(P=0.041,P=0.007)(表2)。
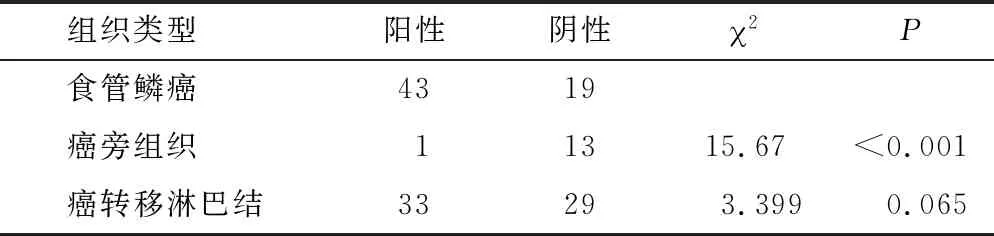
表1 RAD51蛋白在食管鳞癌及癌旁组织中的表达
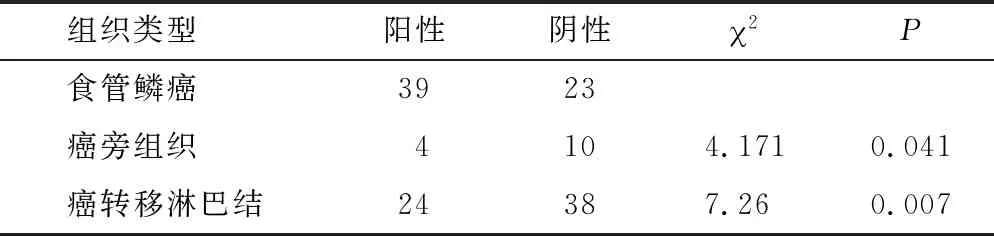
表2 XRCC4蛋白食管鳞癌及癌旁组织中的表达
2.3 RAD51、XRCC4蛋白的表达水平与患者临床病理指标之间均无明显相关,除了RAD51在女性中的阳性表达高于男性 RAD51在女性中的阳性表达高于男性,差异有统计学意义(P=0.022),在低分化中的阳性表达率高于在高中分化中的阳性表达率,患者年龄≥50岁的阳性表达高于<50岁的阳性表达,肿瘤最大径≥4 cm的阳性表达高于最大径<4 cm的阳性表达,浸润深达全层的阳性表达低于其他组,不同P-TNM分期阳性表达不同,分期越早阳性表达率越高,但差异均无统计学意义(P=0.079,P=1.000,P=0.409,P=0.743,P=0.649)。XRCC4蛋白在男性中的阳性表达高于女性,患者年龄≥50岁的阳性表达高于<50岁的阳性表达,肿瘤最大径≥4 cm的阳性表达高于最大径<4cm的阳性表达,低分化的阳性表达高于高中分化的阳性表达,浸润深达全层的阳性表达低于其他组,不同P-TNM分期阳性表达不同,分期越晚阳性表达率越高,但差异均无统计学意义(P=0.318,P=0.533,P=0.235,P=0.459,P=0.733,P=0.868)(表3)。
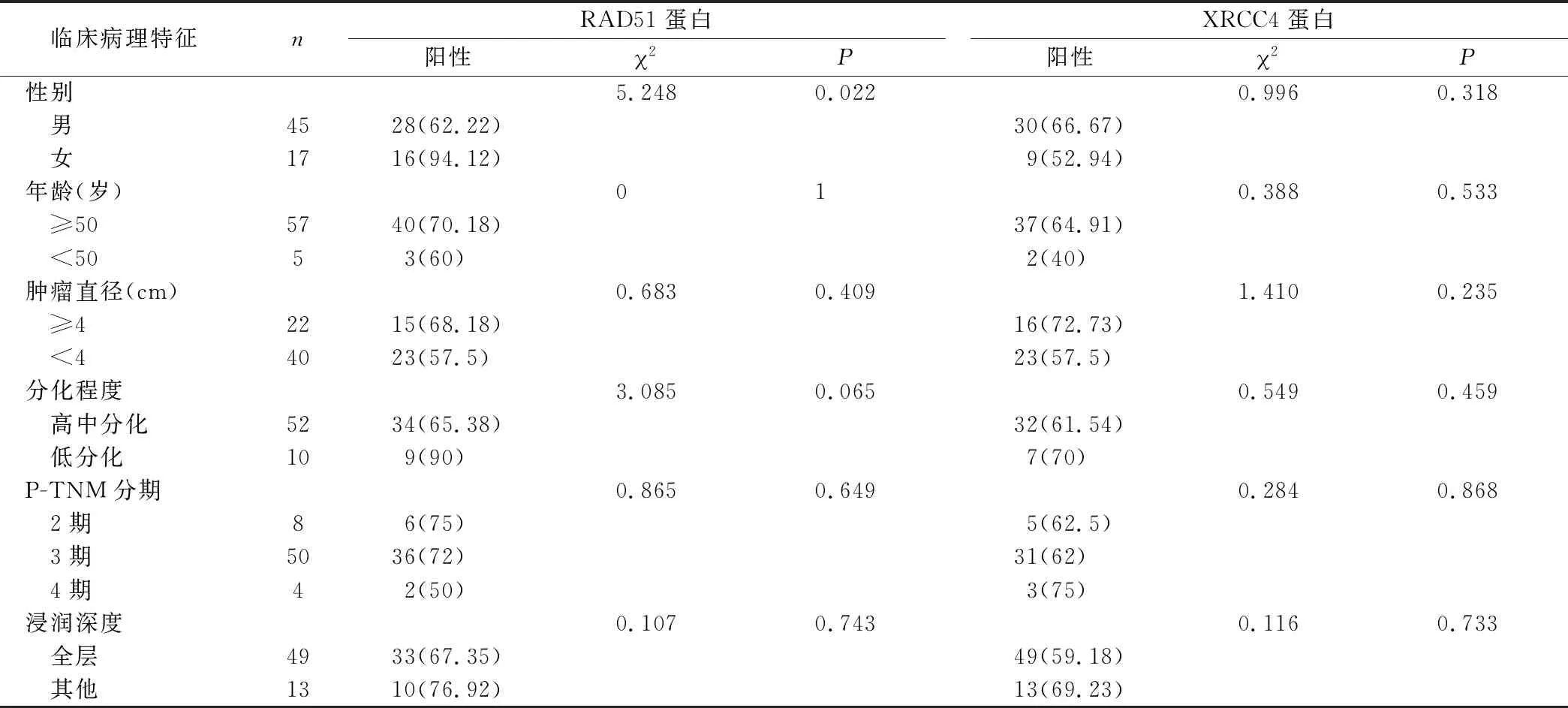
表3 RAD51、XRCC4蛋白在食管鳞癌组织中的表达及其临床病理特征
2.4 RAD51、XRCC4蛋白在有淋巴结转移的食管鳞癌中的阳性表达无相关 经Spearsman等级相关性分析,RAD51、XRCC4蛋白在有淋巴结转移的食管鳞癌中的阳性表达无相关性(r=0.158,P=0.219)。
2.5 RAD51、XRCC4蛋白阳性表达与阴性表达患者的PFS无明显差异 本研究共随访到了53例患者,其中 29人已有复发,4 人死亡,20人依据最后一次影像检查时间定为删失值。生存分析发现RAD51蛋白阳性表达与RAD51蛋白阴性表达患者的无病进展生存期(PFS)无明显差异(2=0.029,P=0.866),见图6;而XRCC4蛋白阳性表达患者相较XRCC4蛋白阴性表达能有较好的生存获益,但差异无统计学意义(2=2.607,P=0.106),见图7。

图6 RAD51蛋白阳性表达与阴性表达患者的PFS分析

图7 XRCC4蛋白阳性表达与阴性表达患者的PFS分析
3 讨论
食管癌是我国最常见的恶性肿瘤之一,而川东北地区的阆中市、盐亭县等又是我国食管癌的高发区。很多原因都可以导致食管癌的发生,其中DNA双链断裂(DNA double-Strand-break, DSB)发挥了重要作用。 DSB是细胞的严重损伤,如果不修复,可导致染色体丢失和/或细胞死亡,如果修复不当会引起基因突变和染色体重排,从而使生物体易患免疫缺陷,神经损伤和癌症[11];修复DNA 双链断裂的NHEJ途径只基于断裂末端的结构而容易出错,可以导致DSB 位点短缺、大的缺失或染色体重排,与NHEJ相比HR途径更精准,但也可以触发染色体易位[12]。
据报道,RAD51 蛋白在胰腺导管腺癌、甲状腺乳头状癌、乳腺癌、上皮性卵巢癌患者中过度表达[13-16],XRCC4也与食管癌、膀胱癌、星形细胞瘤的发病机制有关[17-19]。我们实验结果显示RAD51、XRCC4蛋白在食管鳞癌细胞系TE-1中均呈阳性表达,在食管鳞癌组织中的阳性表达水平相较癌旁组织均显著上调。本研究临床病理特征分析显示,年龄越高、肿瘤直径越大、分化程度越低,RAD51、XRCC4蛋白阳性表达率越高的趋势,但可能由于本实验样本量较少,后期将增大样本量,以验证RAD51蛋白表达水平与临床病理特征的关系,尤其发现RAD51蛋白在女性患者中的阳性率高于男性(P<0.05),分析可能与女性患者中组织学分类以低分化为主有关,进一步说明RAD51蛋白表达水平可能与肿瘤分化程度有关,分化越低,阳性表达越强。总之我们的实验结果表明RAD51、XRCC4蛋白可能参与了食管鳞癌的发生和进展。选择NHEJ还是HR途径的关键在于断裂末端的切除处理[20],NHEJ 修复的抑制促进了基于 HR 的精准修复[21-22]。比较RAD51、XRCC4蛋白在有淋巴结转移的食管鳞癌中的阳性表达率,差异无统计学意义(P>0.05),表明两者可能相互配合,共同参与DSB。Spearman等级相关检验显示两者无相关性,也可能和实验样本较少有关。
RAD51 过表达与淋巴结和远处转移显着相关[23-24]。我们的实验数据显示 RAD51、XRCC4蛋白在食管鳞癌组织中的表达水平高于配对癌转移淋巴结中癌组织(均P<0.05),两者可能起着抑制食管鳞癌的淋巴结转移作用。有研究显示,与RAD51阳性表达的患者相比,RAD51阴性表达患者PFS 显著延长[25],XRCC4 与星形细胞瘤预后不良相关[26]。生存分析显示RAD51、XRCC4蛋白阳性表达与阴性表达患者的PFS无明显差异,分析可能与实验病例数较少,后期将加大病例量以进一步揭示RAD51、XRCC4蛋白表达在食管鳞癌中的生存意义。以上这些数据表明,我们一直认为修复DNA损伤的蛋白可能在肿瘤的发生、进展、转移、生存预后等方面起着重要作用,但具体机制还有待进一步验证。
4 结论
RAD51、XRCC4蛋白参与了食管鳞癌的发病机制、淋巴结转移并可能和预后相关,是潜在的食管鳞癌诊断和预后的生物标志物。
