miR-20a-5p通过下调BMPR2促进人脑微血管内皮细胞增殖和抑制凋亡*
2021-12-21蒲举季一飞龙继发周华勇杨旭张扬威柳华
蒲举 季一飞 龙继发 周华勇 杨旭 张扬威 柳华
(1.南充市中心医院·川北医学院第二临床医学院神经内科,四川 南充 637000;2.西南交通大学附属医院·成都市第三人民医院神经内科,四川 成都 610031)
血脑屏障通过调节必要的营养素、离子和激素的运输来帮助维持脑稳态,同时由于复合膜而阻止神经毒素或病原体进入大脑;其完整性的丧失与阿尔茨海默氏病、帕金森氏病和多发性硬化症以及脑肿瘤相关[1-2]。脑微血管的内皮细胞是组成血脑屏障的重要细胞类型,有助于血脑屏障的完整性,并有助于控制运输过程[1]。微小RNA(microRNA,miRNA/miRs)是约22个核苷酸的单链RNA分子,通过与特定靶标mRNA的3′非翻译区(3′ UTR)结合来调节基因表达[3]。最近的研究表明,miRNA在内皮细胞损伤等神经系统疾病中异常表达,与疾病进展密切相关[4]。miR-20a-5p被报道在氧化型低密度脂蛋白(ox-LDL)诱导的内皮细胞损伤中显著下调,其过表达可以减轻ox-LDL诱导的内皮细胞损伤[5]。但miR-20a-5p在人脑微血管内皮细胞中的潜在功能尚不明确。本研究生物信息学预测出miR-20a-5p和骨形成蛋白2型受体(Bone morphogenetic protein receptor 2,BMPR2)存在结合位点,BMPR2可能是miR-20a-5p的靶基因。研究表明,BMPR2的下调促进肺动脉细胞的增殖过程[6]。但miR-20a-5p是否通过靶向BMPR2参与人脑微血管内皮细胞的增殖和凋亡,目前仍未可知。基于此,本研究考察miR-20a-5p对人脑微血管内皮细胞增殖和凋亡的影响,并通过miR-20a-5p和BMPR2之间的靶向关系研究,旨在探索其作用机制。
1 材料与方法
1.1 细胞与主要试剂 永生化人脑微血管内皮细胞(hCMEC/D3)来自美国典藏培养物中心,内皮细胞培养基EBM-2购自瑞士Lonza公司,噻唑蓝(methyl thiazolyl tetrazolium,MTT)购自美国Sigma公司,PrimeScriptTMRT Master Mix、SYBR®Premix Ex TaqTM购自大连Takara Bio公司,抗BMPR2、抗细胞周期蛋白D1(CyclinD1)、抗活化的的天冬氨酸特异性半胱氨酸蛋白酶3(Cleaved-caspase-3)、抗磷酸化-磷脂酰肌醇-3激酶(p-PI3K)、抗磷酸化蛋白激酶B(p-AKT)、抗β肌动蛋白(β-actin)Ⅰ抗、辣根过氧化物酶偶联的IgG Ⅱ抗购自美国Abcam公司,Annexin V-FITC细胞凋亡检测试剂盒购自美国BD Biosciences公司。
1.2 细胞培养 参照文献[7]的报道,将hCMEC/D3在含5%胎牛血清的EBM-2培养基中培养,并置于37℃、5% CO2培养箱生长。每2 d更换一次培养基。
1.3 脂质体转染 miR-20a-5p mimics、阴性对照miR-NC、miR-20a-5p inhibitor(anti-miR-20a-5p)、阴性对照anti-miR-NC、BMPR2小干扰RNA(si-BMPR2)、小干扰RNA(si-NC)、过表达质粒(pcDNA-BMPR2)、空载pcDNA-NC从上海GenePharma公司获得。将hCMEC/D3分为miR-NC组(转染miR-NC),miR-20a-5p组(转染miR-20a-5p mimics)、si-NC组(转染si-NC)、si-BMPR2组(转染si-BMPR2)、pcDNA-NC组(转染pcDNA-NC)、pcDNA-BMPR2组(转染pcDNA-BMPR2)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-20a-5p组(转染miR-20a-5p inhibitor)、miR-20a-5p+pcDNA-NC组(共转染miR-20a-5p mimics和pcDNA-NC)、miR-20a-5p+pcDNA-BMPR2组(共转染miR-20a-5p mimics和pcDNA-BMPR2)。hCMEC/D3接种于6孔板,其融合度为70%时,通过Lipofectamine 2000按照上述分组进行转染。37℃和5% CO2条件下温育6 h,将培养基更换为常规培养基,再培养48 h。转染48 h后,从hCMEC/D3中提取总RNA和蛋白,分别使用实时定量PCR(quantitative real-time PCR,qRT-PCR)和免疫印迹(Western Blot)测定miR-20a-5p和BMPR2表达,评估转染效率。
1.4 qRT-PCR检测miR-20a-5p表达 为了检测miR-20a-5p表达,使用TRIzol试剂从hCMEC/D3提取总RNA。然后,通过测定260和280 nm处的吸光度来确定RNA浓度,A260/A280比为1.8~2.0表示可接受的纯度。接下来使用PrimeScriptTMRT Master Mix,将2 μg总RNA反转录为cDNA。于ABI 7500 Real-Time PCR系统热循环仪上使用SYBR®Premix Ex TaqTM进行PCR。用于扩增的引物为miR-20a-5p 5′-GCCCGCTAAAGTGCTTATAGTG-3′(正向引物)和5′-CCAGTGCAGGGTCCGAGGT-3′(反向引物)。U6:5′-TGCGGGTGCTCGCTTCGGCAG C-3′(正向引物)和5′-CCAGTGCAGGGAGGT-3′(反向引物)。U6用作内部对照。使用2-ΔΔCt法分析结果。
1.5 Western Blot检测BMPR2、CyclinD1、Cleaved-caspase-3、p-PI3K、p-AKT蛋白水平 转染后的hCMEC/D3用冰RIPA缓冲液提取,使用双辛可宁酸蛋白质测定法评估蛋白质浓度。然后,将30 μg /泳道蛋白转移到10% PVDF膜上,并用5%脱脂牛奶在37℃处理2 h封闭膜。PVDF膜冲洗后,将膜与Ⅰ抗在4℃孵育过夜。抗体如下:BMPR2(1∶1000)、CyclinD1(1∶1000)、Cleaved-caspase-3(1∶3000)、p-PI3K(1∶1000)、p-AKT(1∶1000)和β-actin(加样对照,1∶3000)。之后与辣根过氧化物酶偶联的IgG Ⅱ抗(1∶1500)在室温下孵育1 h。使用增强ECL试剂检测印迹ImageJ软件进行光密度分析定量蛋白表达。
1.6 MTT检测细胞增殖 在96孔板中接种hCMEC/D3,按照1.3中分组进行转染。48 h后在细胞中加入5 mg/mL的MTT溶液,每孔20 μL,继续孵育4 h。加入200 μL二甲基亚砜,震荡培养10 min。在450 nm波长处,记录Bio Tek酶标仪中细胞的吸光度值OD450nm,以OD450nm代表细胞活性。
1.7 流式细胞仪检测细胞凋亡 按照Annexin V-FITC细胞凋亡检测试剂盒的检测步骤,收集转染48 h后hCMEC/D3,用10 μL Annexin V-FITC和5 μL碘化丙啶黑暗孵育细胞15 min。于FACSCalibur流式细胞仪分析细胞凋亡率。
1.8 荧光素酶报告基因检测 使用starbase网站(http://starbase.sysu.edu.cn/)预测miR-20a-5p的潜在靶标。对于萤光素酶报告基因分析,使用pGL3萤光素酶报告载体构建BMPR2-3′ UTR野生型(WT)及突变型(MUT)片段,该片段包含miR-20a-5p的结合序列。使用Lipofectamine 2000将BMPR2-3′ UTR-WT或BMPR2-3′ UTR-MUT和miR-20a-5p mimics或miR-NC转染到hCMEC/D3中。培养48 h后,收获细胞,通过Promega双荧光素酶报告基因测定系统测定荧光素酶活性。
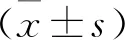
2 结果
2.1 过表达miR-20a-5p对hCMEC/D3增殖和凋亡的影响 在hCMEC/D3中转染miR-20a-5p mimics后,qRT-PCR检测转染效率,发现miR-20a-5p组miR-20a-5p表达量远远高于miR-NC组(P<0.05),提示成功构建过表达miR-20a-5p的细胞。Western Blot、MTT和流式细胞仪检测结果显示,miR-20a-5p组hCMEC/D3的CyclinD1蛋白量和细胞活性明显高于miR-NC组,Cleaved-caspase-3蛋白量和细胞凋亡率显著低于miR-NC组(P<0.05),见图1、表1。

图1 过表达miR-20a-5p对hCMEC/D3增殖和凋亡的影响

表1 过表达miR-20a-5p对hCMEC/D3增殖和凋亡的影响
2.2 BMPR2对hCMEC/D3增殖和凋亡的影响 在hCMEC/D3中转染BMPR2小干扰RNA(si-BMPR2)或过表达质粒(pcDNA-BMPR2),Western Blot检测转染情况,发现si-BMPR2组BMPR2蛋白水平明显低于si-NC组,而pcDNA-BMPR2组BMPR2蛋白水平明显高于pcDNA-NC组,提示转染有效。Western Blot、MTT和流式细胞仪检测结果表明,与si-NC组比较,si-BMPR2组hCMEC/D3的CyclinD1蛋白表达水平和细胞活性显著升高,Cleaved-caspase-3蛋白表达水平和细胞凋亡率明显降低(P<0.05);与pcDNA-NC组比较,pcDNA-BMPR2组hCMEC/D3中CyclinD1蛋白表达水平和细胞活性显著降低,Cleaved-caspase-3蛋白表达水平和细胞凋亡率明显升高(P<0.05),见图2、表2。

表2 BMPR2对hCMEC/D3增殖和凋亡的影响
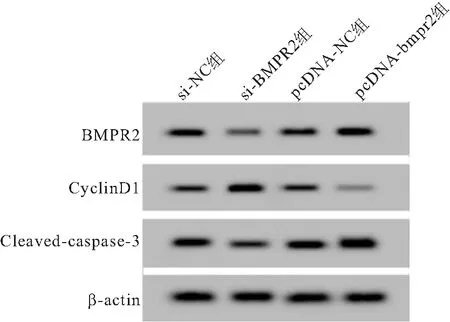
图2 Western Blot检测BMPR2、CyclinD1、Cleaved-caspase-3蛋白的表达
2.3 miR-20a-5p靶向BMPR2,调控BMPR2蛋白的表达 采用starbase预测了miR-20a-5p的假定靶标,发现BMPR2-3′ UTR包含miR-20a-5p的互补结合位点。为了证实miR-20a-5p和BMPR2之间的关联,通过荧光素酶报告基因进行检测,结果显示,当用BMPR2-3′ UTR-WT转染hCMEC/D3时,与miR-20a-5p mimics的共转染可抑制荧光素酶活性(P<0.05),而BMPR2-3′ UTR-MUT与miR-20a-5p mimics共转染对荧光素酶活性无明显影响(P>0.05)。Western Blot进一步检测表明,与miR-NC组比较,在转染miR-20a-5p mimics的细胞中BMPR2蛋白水平降低;与anti-miR-NC组比较,转染anti-miR-20a-5p的细胞中BMPR2蛋白水平升高(P<0.05),见图3,表3、4。

表3 miR-NC或miR-20a-5p与BMPR2-3′ UTR-野生型及突变型报告质粒共转染hCMEC/D3后双荧光素酶活性检测
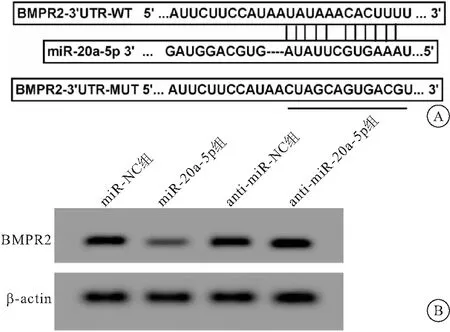
图3 miR-20a-5p靶向BMPR2,调控BMPR2蛋白的表达
2.4 高表达BMPR2可以逆转miR-20a-5p对hCMEC/D3增殖和凋亡的影响 Western Blot、MTT和流式细胞仪检测结果显示,与miR-20a-5p+pcDNA-NC组比较,miR-20a-5p+pcDNA-BMPR2组hCMEC/D3的BMPR2蛋白水平明显增加,CyclinD1蛋白水平显著降低,Cleaved-caspase-3蛋白表达水平明显升高,细胞活性明显降低,细胞凋亡率显著增加(P<0.05),见表5、图4。

表4 Western Blot检测BMPR2蛋白表达

表5 高表达BMPR2可以逆转miR-20a-5p对hCMEC/D3增殖和凋亡的影响

图4 高表达BMPR2可以逆转miR-20a-5p对hCMEC/D3增殖和凋亡的影响
2.5 PI3K/AKT信号通路相关蛋白的表达 Western Blot检测PI3K/AKT信号通路相关蛋白的表达结果表明,与miR-NC组比较,转染miR-20a-5p mimics明显提高hCMEC/D3中p-PI3K、p-AKT蛋白水平(P<0.05);与miR-20a-5p+pcDNA-NC组比较,miR-20a-5p+pcDNA-BMPR2组显著降低hCMEC/D3中p-PI3K、p-AKT蛋白水平(P<0.05),见表6、图5。

图5 PI3K/AKT信号通路相关蛋白的表达

表6 PI3K/AKT信号通路相关蛋白的表达
3 讨论
已有研究证实miRNA在调节细胞增殖、分化、凋亡和血管生成中的重要性[8-9]。miR-20a-5p作为miR-17-92基因簇的成员,在肿瘤等疾病的发生和发展具有关键作用[10-11]。例如,胰腺癌中miR-20a-5p表达上调,具有促进肿瘤细胞增殖,并抑制细胞凋亡的作用[12]。在ox-LDL刺激的人主动脉内皮细胞(HAEC)中检测到miR-20a的表达受抑制,过表达miR-20a可能通过靶向TLR4和NLRP3信号传导,从而保护HAEC免受ox-LDL诱导的炎性损伤,抑制动脉粥样硬化的发展[13]。本实验为了研究miR-20a-5p在人脑微血管内皮细胞中的功能和意义,在细胞中转染miR-20a-5p mimics以过表达miR-20a-5p。结果显示,过表达miR-20a-5p使hCMEC/D3的细胞活性、CyclinD1蛋白表达水平显著升高,细胞凋亡率和Cleaved-caspase-3蛋白表达水平明显降低。提示miR-20a-5p在人脑微血管内皮细胞发挥促增殖和抗凋亡作用。
BMPR2是细胞增殖、凋亡等过程的重要调控因素,在某些癌症的发生、肿瘤生长和转移中起着重要作用[14-15]。既往研究表明,BMPR2在血管内皮细胞、气道上皮细胞等细胞中表达,能调节内皮细胞的通透性和血管壁的重构参与肺动脉高压进展[16]。BMPR2的异常造成肺动脉内皮损伤,导致内皮功能障碍[17]。本实验结果显示,低表达BMPR2明显提高hCMEC/D3的细胞活性、CyclinD1蛋白表达水平,显著减少细胞凋亡率和Cleaved-caspase-3蛋白表达水平,高表达BMPR2时具有相反的效果。miRNA通过与3′ UTR的互补位点或转录本的翻译区域结合,对目标mRNA进行翻译抑制或降解[18]。为了确定进一步的机制,本研究使用starbase筛选了miR-20a-5p可能的靶基因,BMPR2被确定为潜在靶点。正如生物信息学所预测的那样,双荧光素酶报告基因测定证实了miR-20a-5p对BMPR2的靶向调控作用。此外,为了鉴定miR-20a-5p是否调节hCMEC/D3中BMPR2的表达,Western Blot检测了转染miR-20a-5p mimics或miR-20a-5p inhibitor后的BMPR2水平。结果表明,上调miR-20a-5p后,hCMEC/D3中BMPR2蛋白水平降低,而在下调miR-20a-5p后,BMPR2蛋白水平升高。另外,高表达BMPR2可以逆转过表达miR-20a-5p对hCMEC/D3增殖的促进作用及对细胞凋亡的抑制作用。这些结果表明,BMPR2是miR-20a-5p的功能性靶标。根据报道,PI3K/AKT信号通路的激活有利于miR-126减轻缺血再灌注引起的脑微血管内皮细胞损伤[19]。miR-20a通过激活PTEN/PI3K/AKT途径诱导肝癌细胞辐射抗性[20]。本实验中,过表达miR-20a-5p明显促进hCMEC/D3中p-PI3K、p-AKT的蛋白表达,而过表达miR-20a-5p激活PI3K/AKT信号通路活性的作用被高表达BMPR2所逆转。提示miR-20a-5p通过靶向BMPR2并激活PI3K/AKT信号通路,从而参与人脑微血管内皮细胞的增殖和凋亡过程。
4 结论
过表达miR-20a-5p可以促进人脑微血管内皮细胞的增殖,并抑制细胞凋亡,其作用机制与靶向细胞中的BMPR2及提高PI3K/AKT信号通路活性有关,为血脑屏障相关疾病的研究提供了新的线索。
