X 连锁低磷血症治疗新药Burosumab 研究进展
2021-12-15屈扬扬白秋江
屈扬扬,白秋江
(1. 河北省唐山市人民医院药剂科,河北 唐山 063001; 2. 南京大学医学院附属泰康仙林鼓楼医院药剂科,江苏 南京 210046)
X 连锁低磷血症(XLH)由 X 染色体内肽酶(PHEX)基因失活突变引起,骨室中成纤维细胞生长因子23(FGF23)上调,从而导致低磷血症的罕见遗传性疾病[1],其患病率约为 1.7 ∶100 000(儿童)或 4.8 ∶100 000(成人及儿童)[2]。目前的研究认为,其发病机制为 PHEX 基因突变失活导致FGF23 上调,从而导致近端肾小管上皮细胞的膜结合钠-磷协同转运体降解及1 α-羟基化和24-羟基化酶活性遭到抑制,最终导致肾磷盐丢失、维生素 D 代谢异常及骨矿化异常的临床综合征[2]。XLH 的实验室特征包括血清中磷水平低于年龄正常值、FGF23水平升高、磷分泌排泄增加及血清1,25-二羟维生素D水平低或不正常,临床表现包括低磷血症、佝偻病、下肢弯曲和生长障碍,其他并发症包括炎症、骨关节炎、假性骨折和牙脓肿。超过半数的XLH 患者存在严重的牙病,与牙本质和牙骨质异常矿化有关[3]。炎症和骨关节炎可严重限制患者的活动范围,并导致疼痛[4]。常规治疗采用早期口服磷酸盐合剂及足量的骨化三醇,虽能改善骨骼矿化,但不能解决FGF23 过多导致的肾磷酸盐重吸收和活性维生素D 产生障碍的问题[5]。
Burosumab 是一种FGF23 全人源单克隆抗体,可与FGF23 结合,并抑制其生物活性及其下游信号通路,增加肾脏对磷的重吸收及血清维生素D 水平,最终改善骨骼矿化和相关骨病,其于2018 年2 月获得了欧盟有条件的上市许可,用于1 岁以上儿童及骨骼生长期的青少年有骨病影像证据的XLH,且于2018 年4 月成为首个获美国食品和药物管理局(FDA)上市批准[6]的治疗1 岁以上儿童及成年患者XLH 的药物。现对其作用机制、临床应用、药物代谢动力学及各期临床试验情况综述如下。
1 药理作用机制
FGF23 是磷酸盐稳态的关键调节因子[7],与协同受体Klotho 一起,调节肾近端小管的磷酸盐的重吸收及1 α - 羟基化和 24 - 羟基化[8]。XLH 是由 FGF23 过剩引起,增加肾磷酸盐排泄,引发低血清磷酸盐状态,最终导致骨矿化受损和骨病。FGF23 降低1 α-羟化酶活性,从而降低血清1,25-二羟维生素D 水平,减弱胃肠道对磷酸盐的吸收,降低血清磷酸盐水平,损害骨矿化[9-10]。骨矿化不良导致肢体畸形、身材矮小、骨关节炎、骨折及其他不良后果。Burosumab 结合并抑制FGF23 的生物活性,阻断FGF23 在靶组织中的生物效应,从而增加肾脏磷酸盐的重吸收,减少磷酸的排泄,升高1,25-二羟维生素D 的血清浓度,增加磷酸盐在胃肠道的吸收[11]。
2 用法用量[11]
治疗前1 周,停止口服磷酸盐和/或活性维生素D类似物(如骨化三醇、帕立骨化醇、骨化二醇等)。治疗前,空腹血清磷浓度应低于该年龄的参考范围(RRA)。每次注射的最大剂量为1.5 mL,需分次注射并选择不同注射部位。4 周内不可调整剂量。
XLH 成年(≥18 岁,下文同)患者:初始剂量为 1mg/kg,每 4 周 1 次,剂量 10 ~90 mg。前 3 个月每月及每次调整剂量后,测量用药2 周后的血清磷浓度,如在RRA 内,则继续维持原剂量;如高于参考范围,则停1 次剂量,4周后再评估;如低于参考范围,则可重新启动治疗,此时最大剂量为 40 mg /kg,每 4 周 1 次。
XLH 儿科(≥1 ~ < 18 岁,后文同)患儿:体质量低于10 kg,推荐起始剂量为1 mg/kg,四舍五入至整数,每2 周1 次;体质量在10 kg 及以上,推荐初始剂量为0.8 mg /kg,四舍五入至 10 的整倍数,每 2 周 1 次,剂量10 ~90 mg。前 3 个月每 4 周检查 1 次血清磷浓度,高于参考范围下限,低于5 mg / dL,维持原剂量。低于参考范围下限,且体质量低于 10 kg 的患儿,则增至1.5 ~ 2.0 mg / kg,每 2 周 1 次;体质量不低于 10 kg的患儿,则增至2.0 mg /kg,每 2 周 1 次。血清磷浓度如高于 5 mg/dL,则需停药 1 次,4 周后再评估。
3 药物代谢动力学(药动学)
皮下注射Burosumab 的药动学模型呈线性相关,XLH 患者基于初始血清磷水平调整Burosumab 剂量[12]。儿科患者的药动学状况,与成年人并无实质差异。
以下药动学状况[11-14]按 70 kg 体质量的 XLH 成年患者的推荐剂量计。Burosumab 吸收缓慢,血药浓度平均达峰时间(tmax)为 8 ~ 11 d,生物利用度近 100% 。1 项对XLH 成年患者人群的研究显示,接受16 个月,每月28 d 的Burosumab 的滴定剂量,前4 次剂量后血清磷的平均峰值升高,6 ~10 次剂量的血清磷峰值相当,之后有轻微降低。血清药物浓度与血清中磷水平呈线性平行关系,且每次给药后基本在同一时间达到峰值。表观分布容积为8 L,约为XLH 成年患者的血浆容量,即血管外分布有限。药物的清除与体质量有关,70 kg 体质量的XLH 成年患者和30 kg 的XLH 患儿的表观清除率分别为 0.290 L /d,0.136 L /d。半衰期约为 19 d。Burosumab的分解途径尚不明确,可能通过分解代谢途径分解成小肽和氨基酸。
4 临床试验
4.1 XLH 成年患者
IMEL 等[15]早期进行的开放标签剂量递增(最大剂量 0.6 mg/kg)的Ⅰ/Ⅱ期临床试验中,受试者来自 6 个中心,肾小管对磷的最大吸收(TmP)/肾小球滤过率(GFR)< 2.0 mg/dL,GFR≥ 60 mL /min,血钙 < 10.8 mg/dL,血清FGF23 >30 mg/mL;主要排除标准为妊娠期、重大手术,近3 个月内接种过疫苗,并要求受试者在接受筛查前10 d 未服用维生素D(或类似物)及钙、磷酸盐补充剂、氢氧化铝等药物。虽未设对照,但有78.57%的患者(22/28 例)参与了为期12 个月的延长试验。患者依从性高,主要指标血清磷浓度升高,次要指标如TmP/GFR、1,25-二羟维生素D 和骨骼标记物呈阳性反应。试验表明,Burosumab 治疗可提高血清磷浓度,增加肾小球对磷的重吸收,并改善骨矿化。
一项随机、双盲、安慰剂对照、Ⅲ期临床试验中,134 例受试者(≤65 岁),已确诊为PHEX 基因突变的XLH 和或符合XLH 的临床表现和实验室特征,且有血磷酸盐浓度低于正常值下限(LLN,2.5 mg /dL),肾脏磷的 TmP /GFR <2.5 mg/dL,简要疼痛量表(BPI)>4 如使用镇痛药物则在受试前21 d 达到稳定并维持该剂量[16]。该试验的排除标准为血清钙≥10.8mg/dL(2.7mmol/L),血清甲状旁腺素大于正常值上限的2.5 倍,和(或)受试者前60 d 使用过抑制甲状旁腺素的药物,或在3 个月内接受过创伤性的骨科整形手术,和接受影响磷代谢的受试者(如口服磷酸盐、活性维生素D 及类似物等),至少需药物洗脱2 周才能参加试验。XLH 成年患者每4 周分别给予皮下注射Burosumab 1 mg/kg 或安慰剂。试验表明,在第24 周,Burosumab 组、安慰剂组骨折完全愈合率分别为42.65%和7.58%,血清磷恢复正常的比例分别为94.11%和7.58%。且Burosumab 组的西安大略和麦克马斯特大学骨关节炎僵硬指数分量表(WOMAC)评分明显更低。
另一项试验对134 例患者进行后续研究,纳入、排除标准基本同文献[16],近期(≤6 个月)有创伤性骨折或骨科手术史,如口服磷酸盐和活性维生素D 或类似物,药物洗脱2 周后可参与试验。24 周后开放标签,所有患者接受 Burosumab 治疗至 48 周,第 24 ~48 周Burosumab 组和安慰剂组血清磷保持RRA 的患者占比分别为83.82%和89.39%。第48 周,患者基线骨折或假性骨折完全愈合率分别为63.24%和34.85%。从基线到第48 周,Burosumab 治疗组僵硬、疼痛、身体机能评分及6 min 步行总距离方面均有显著且持续的临床改善[17]。试验表明,XLH 患者持续使用Burosumab 的耐受性良好,并可纠正降低血清磷浓度,促进骨折和假性骨折持续愈合,关键骨骼肌的损伤持续改善。
INSOGNA 等[18]进行的单臂国际Ⅲ期临床试验,主要纳入标准为年龄18 ~65 岁,明确有PHEX 突变的XLH,血FGF23 水平>30 pg/mL,TmP/GFR<2.5 mg /dL,BPI≥4;排除标准为2 年内接受过常规治疗。结果13 例患者完成48 周治疗,11 例患者经髂骨活检进行组织学分析。治疗后,所有患者的骨软化相关指标如骨样体积/骨体积、骨样厚度、骨样表面/骨表面和矿化滞后时间均有改善。接下来24 周的开放标签延长研究也显示,Burosumab 对患者有持续益处。
4.2 XLH 患儿
CARPENTER 等[19]在 纳 入 52 例 5 ~ 12 岁 (平 均8.5 岁)XLH 患儿的随机开放标签Ⅱ期临床试验中,纳入标准为有骺板活动性佝偻病,股骨或胫骨的弯曲,或青春期被划分为Tanner 阶段2 或更低,患者及其家属有明确的 PHEX 突变且血 FGF23 水平 > 30 pg / mL,已诊断为XLH,附加入选条件为空腹血磷浓度低于2.8 mg/d,根据美国和欧洲的数据站立身高在该性别和年龄基线的50%以下。排除标准为入选前14 d 使用活性维生素D 或类似物,筛选7 d 内使用过噻嗪类利尿剂,筛检3 个月内使用过生长激素治疗;超声检查有3 级以上的肾钙化症及由研究者确定的3 级以上的甲状旁腺亢进的低钙或高钙血症,或在筛选前2 个月使用过钙剂。初始剂量为 0.1 mg / kg、每 2 周 1 次或0.2 mg /kg、每 4 周 1 次,滴定剂量最高到 2.0 mg /kg(第 40 周 平 均 剂 量 为 0.98 mg / kg、每 2 周 1 次 和1.50 mg /kg、每 4 周 1 次),以达到 3.5 ~5.0 mg /dL 的血清磷浓度。试验表明,Burosumab 可增加肾小管磷酸盐重吸收,升高血清磷浓度,提高线性生长及生理功能。同时,可减轻患儿的疼痛程度及佝偻病的严重程度。
2019 年对 13 例 1 ~ 4 岁(平均 2.9 岁)XLH 患儿的某开放标签多中心Ⅱ期临床试验中[20],患儿空腹血清磷浓度 < 0.97 mmol/L(3.0 mg /dL),血清肌酐在该年龄段正常范围(8.8 ~ 35.4 μmol/L),有影像学证实的佝偻病,在患者及其直系亲属中已明确PHEX 基因突变。剂量为 0.8 mg /kg、每 2 周 1 次,如血清磷酸维持在低水平则增至 1.2 mg /kg、每 2 周 1 次。结果,第 40 周和第64 周,血清磷快速恢复正常,Thacher 佝偻病严重程度评分亦有所改善。
MARTIN RAMOS 等[21]的Ⅱ期临床试验中纳入 5 例6 ~16 岁确 诊 PHEX 突 变 患 儿 ,每 2 周 皮 下 注 射Burosumab 0.8 mg/kg,治疗 1 年。结果表明,患儿 Burosumab 的耐受性良好,该制剂能改善生长状态,且无高磷血症副反应。
一项随机、对照开放标签在16 个临床中心进行的Ⅲ期临床试验[22]中,纳入标准为空腹血清磷浓度< 0.97 mmol/L(3.0 mg /dL),年龄 1 ~ 12 岁,患儿及其直系亲属中存在PHEX 基因突变,不大于3 岁的儿童,佝偻病严重评分至少为2 分(满分为10 分),3 岁以下/以上患儿分别至少接受6,12 个月的常规治疗;排除标准为Tanner 评级至少为4 级,身高高于国家标准中同性别和年龄正常值的50%,在过去的12 个月内接受过生长激素治疗,血浆甲状旁腺激素水平>19 pmol/L(180 pg/mL),超声提示肾脏钙化 4 级,低钙或高钙血症和有骨科手术计划的患儿。61 例患儿中有32 例(女18 例,男14 例)随机分配继续接受常规治疗(口服磷酸盐 + 活性维生素 D),29 例(女 16 例,男 13 例)接受Burosumab 0.8 ~ 1.2 mg /kg 治疗,平均剂量为每 2 周0.9 mg /kg,持续 64 周。在主要治疗终点(第 40,64 周),与常规治疗组相比,Burosumab 组影像学总体印象评分显著改善,佝偻病严重程度评分也有实质性的临床改善,血清磷和碱性磷酸酶等生化指标也很快回归正常。Burosumab 治疗组患儿的身高和6 min 步行距离也明显优于常规治疗组。
5 不良反应
5.1 XLH 成年患者
文献[16]中纳入的大多数为白种人 /高加索人(81% )和女性(65% )。Burosumab 组平均剂量为每 4 周皮下注射 0.95 mg/kg(0.3 ~1.2 mg/kg)。两组治疗 24 周时的不良反应发生情况见表1,维生素D 减少包括维生素D 缺乏或减少,以及血液中25-羟基胆钙化醇减少,表2、表3 同;牙齿感染包括牙齿感染或脓肿;血磷升高包括血磷升高和高磷血症。
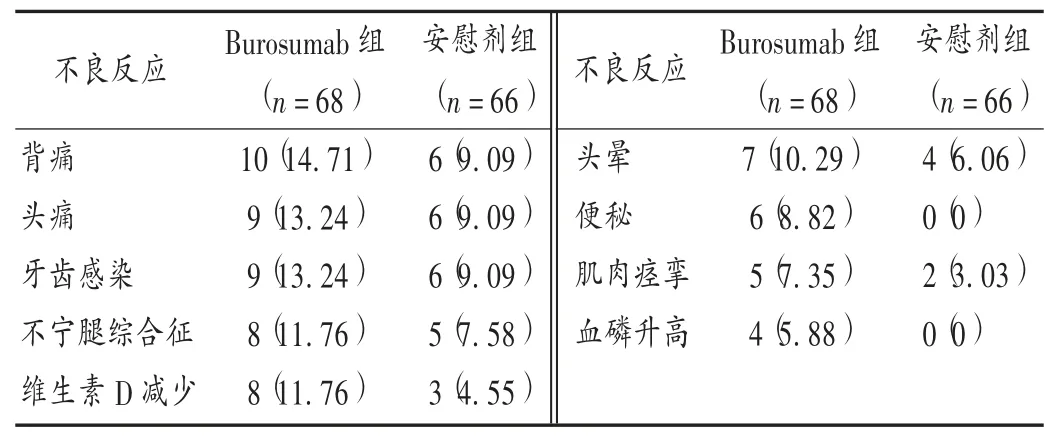
表1 两组患者不良反应发生情况比较[例(%)]Tab.1 Comparison of incidence of adverse reactions in adult patients between the two groups[case(%)]
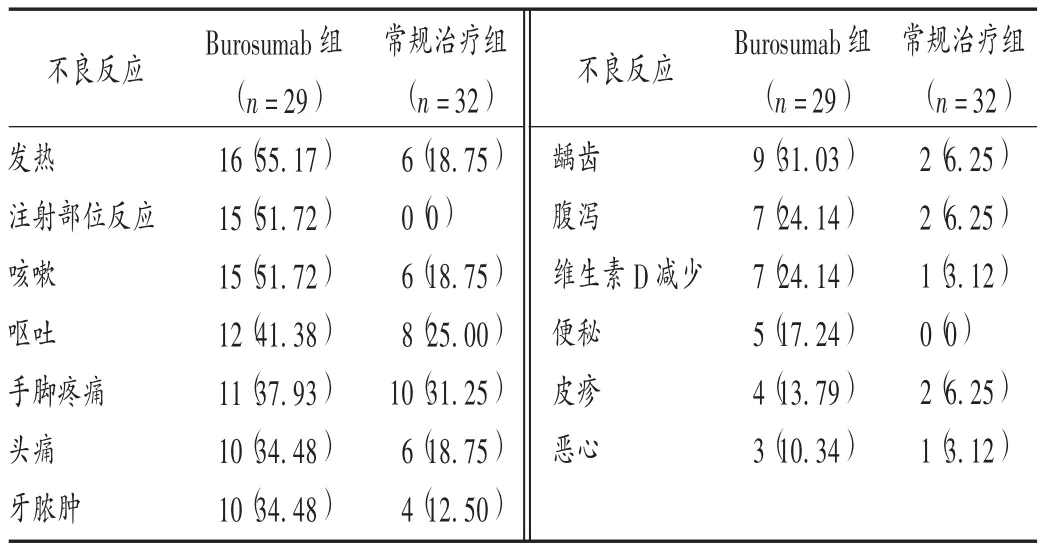
表2 两组患儿不良反应发生情况比较[例(%)]Tab.2 Comparison of incidence of adverse reactions in children between the two groups[case(%)]
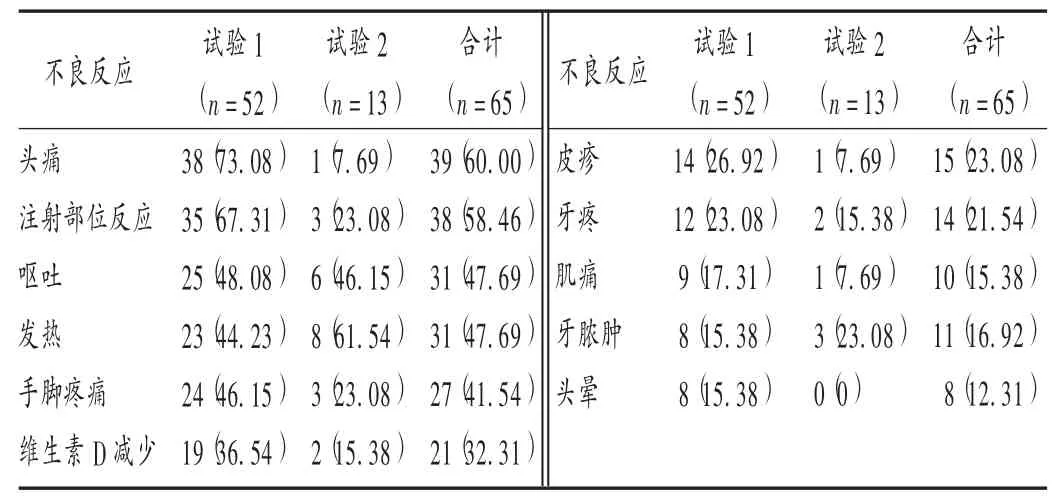
表3 不同试验中患儿不良反应发生情况比较[例(%)]Tab.3 Comparison of incidence of adverse reactions among children in different trials[case(%)]
24 周后,开放标签所有患者都接受皮下注射Burosumab 治疗的试验[17]中,均未发现新的不良反应。
文献[16]中,Burosumab 组和安慰剂组中约6%的患者发生轻、中度过敏反应,无须中止治疗。Burosumab组7%患者因高磷血症[血清磷单次高于5.0 mg/dL 或2 次高于 4.5 mg /dL(正常值上限)]减小剂量。所有高磷血症患者按推荐用法用量减少剂量的50% ,其中1 例因持续高磷血症需减少第2 次剂量。Burosumab组和安慰剂组约12%患者出现注射部位红斑、皮疹、淤伤、疼痛、瘙痒和血肿,程度较轻,多在注射后1 d 发生,持续 1 ~ 3 d 后,均未干预,基本痊愈。Burosumab 组约12%患者不宁腿综合征(RLS)加重或出现新的轻度或中度RLS,但未导致停药。
5.2 XLH 患儿
IMEL 等[22]的随机对照Ⅲ 期临床试验中,Burosumab组患者非严重不良反应发生率明显高于常规治疗组。详见表2。表中,咳嗽包括咳嗽和排痰性咳嗽;牙脓肿包括牙脓肿、牙齿感染和牙痛;皮疹包括瘙痒性、斑疹性、红斑性、脓疱性及全身性皮疹,表3 同。
CARPENTER 等[19](试验 1)和 WHYTE 等[20](试验 2)试验中患儿的不良反应发生情况见表3。表中,注射部位不良反应包括注射部位红斑、瘙痒、肿胀、疼痛、皮疹、淤青、变色、不适、血肿、出血、硬化、黄斑、荨麻疹等;头晕包括病理性头晕和劳累性头晕。
6 小结
针对XLH 患者FGF23 过度表达的特点,Burosumab与FGF23 结合,并抑制其信号转导,增加肾小管重吸收和胃肠道对磷酸盐的吸收,从而提高血清磷浓度,改善骨矿化,减轻疼痛程度,改善佝偻病严重程度和XLH 相关症状,提高患者的生活质量。与现有常规疗法相比,Burosumab 可从根本上解决由于FGF23 过多导致的肾磷酸盐重吸收和活性维生素D 产生障碍。多项临床研究数据证实,Burosumab 疗效明显优于常规治疗,耐受性好,虽不良反应发生率较高,但均为轻度或中度,多不需要干预,仅少数不良反应可能需要调整剂量。Burosumab 若作为一线用药取代常规疗法,仍需进一步的临床试验,并对使用过该药物的现有患者进行长期随访,监测其潜在的长期危险因素和不良反应,并在更大范围内监测其长期安全性和有效性。
