肠道湿热证泄泻小鼠模型的研制及葛根芩连汤疗效❋
2021-11-05惠华英何云山罗成宇薛天悦谭周进
惠华英, 何云山, 吴 仪, 罗成宇, 薛天悦, 谭周进
(湖南中医药大学,长沙 410208)
肠道湿热证泄泻,是指湿热内蕴,阻滞肠道,以腹痛即泻、泻下急迫、粪色黄褐臭秽为主要表现的证候[1],多为感受湿热之邪或饮食不节(不洁),致使湿热蕴结肠道而成。随着人们生活方式和饮食结构的变化,肠道湿热证泄泻已成为多发性疾病。糖尿病、慢性肝病、肾病、溃疡性结肠炎等往往伴随着湿热泄泻的发生,增加了疾病的复杂性而影响诊断和治疗,因此开展肠道湿热证泄泻的研究,可望加深对此类重大疾病诊治方面的认识。动物模型是进行中医理论和中药研究的重要桥梁,肠道湿热证泄泻动物模型的建立是进行疾病发生机理和治疗研究的基础和前提。
中医学认为湿热侵袭肠道,津为热迫而下注,可见便次增多;热蒸肠道、气机壅滞故见腹痛泄泻或里急后重等,因此湿与热是复制湿热证模型的重要条件。现代对湿热证模型的研究重视从内湿和外湿的角度进行模型制备,同时考虑环境和饮食复合因素共同作用模拟“内外湿”,使内外相引,并引入“致病因子”,最终生成具有湿热证泄泻证候表现的动物模型。如“高糖高脂+高温高湿+生物致病因子”法[2-4]、“高温高湿+高糖高脂+苦寒药物(大黄、番泻叶)”法[5-7]。在这些模型的研究中,一般认为“高温高湿”制造外湿,“肥甘饮食”制造内湿,而生物致病因子(大肠杆菌、伤寒杆菌、沙门氏菌等)及内毒素模拟客邪[8],所得模型出现体温持续升高、肛周红肿、腹泻及急性炎症反应等症状,符合肠道湿热证泄泻临床表现。但这种方法制备的模型无法区别湿热的轻重,同时模型制备过程中引入了外来细菌,对机体自身的肠道菌群平衡造成干扰,而采用苦寒药物法所得模型产生泄泻是由药物所致,无法体现出疾病发生的本质。肠道湿热证泄泻动物模型的制备,应从病因病机多方面进行模拟,所得动物模型对相关疾病的预防及诊治研究具有重要意义。
葛根芩连汤源自汉·张仲景所著《伤寒论》,全方由葛根、黄芩、黄连、炙甘草组成,功效解表清里,是治疗肠道湿热证泄泻的代表方。药理研究表明,葛根芩连汤具有解热抗炎、抗菌、抗心律失常、降糖降脂、增强机体免疫等功能[9-11],临床广泛用于治疗急性肠炎、感染性腹泻、结肠炎、小儿手足口病、糖尿病等[12-16],避免了抗生素使用所造成的耐药性和不良残留,有利于人类和动物健康。然而,对葛根芩连汤疗效机理的研究还有待深入。《冯氏锦囊秘录》中指出:“盖阴络不伤,肠胃不虚,虽有外邪,亦不能患,惟醉饱房劳,坐卧风湿,恣啖生冷,以致湿热阴络受伤”[17]。据此,本研究依据病因病机复制肠道湿热证泄泻小鼠模型,并以葛根芩连汤进行治疗,以期为该病的形成及方剂疗效机理研究提供参考。本研究已通过湖南中医药大学实验动物伦理委员会审查,伦理学批号LLBH-201910150002。
1 材料
1.1 动物
清洁级雄性昆明小鼠,体质量18~22 g,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号SCXK(湘)2016-0002。饲养于湖南中医药大学实验动物中心,实验动物使用许可证编号SYXK(湘)2019-0009,动物房为SPF清洁级,室温23 ℃~25 ℃,相对湿度50%~70%,动物普通饲料由湖南斯莱克景达实验动物有限公司提供。高糖高脂饲料组成为普通饲料中混入12% 猪油和8% 蜂蜜,高糖高脂饲料由江苏省协同医药生物工程有限责任公司生产,生产编号苏饲证(2014)01008。
1.2 药物及制备
葛根芩连汤组成:黄连9 g(四川,批号CKN19041006),炙甘草6 g(甘肃,批号1806004),葛根15 g(湖南,批号CK19042602),黄芩9 g(内蒙古,批号TH1905220),以上药材购自湖南中医药大学第一附属医院。依据原方先煮葛根后纳诸药。葛根加水浸泡30 min,先武火煮沸后转小火继续煎煮20 min,加入已浸泡30 min的剩余诸药,煮沸后继续煎煮30 min,三层纱布过滤。滤渣中继续加水200 mL,煮沸后继续煎煮30 min过滤,合并2次所得滤液,浓缩至含生药浓度为0.25 g·mL-1,4 ℃ 冰箱保存备用。
1.3 主要试剂及仪器
小鼠P物质(SP)酶联免疫分析试剂盒(Mouse SP ELISA kit),上海茁彩生物科技有限公司(Lot 1211E19);红星二锅头 (56度),北京红星股份有限公司。PRX-280C型人工气候箱(江苏天翎仪器有限公司);PMK4202ZH-E型电子天平(奥豪斯仪器有限公司);BCD-220WP3CX型冰箱(合肥美菱股份有限公司);PURELAB Chorus型超纯水仪(ELGA);BA410型显微镜(麦克迪奥实业集团有限公司);1850R型高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);VORTEX-5型涡旋混合器(Kylin-bell)。
2 方法
2.1 动物分组及给药
雄性小鼠50只,适应性饲养2 d后随机分为正常组20只,模型组30只。模型制备成功后,取正常组和模型组小鼠各10只处死取样,剩余模型动物随机分为治疗组和自愈组各10只。按照实验动物临床等效剂量,治疗组小鼠灌胃葛根芩连汤水煎液20 mL·kg-1·d-1,每日2次,2次时间间隔8 h,连续4 d。正常组和自愈组给予等量无菌水。
2.2 肠道湿热证泄泻模型制备
模型的制备参照综合因素法加以改进[5]:模型组小鼠先在屏蔽环境中喂养高糖高脂饲料11 d,于第12天开始将模型小鼠置于温度(32±0.5) ℃、相对湿度95% 的人工气候箱中,连续8 h·d-1,并于放入人工气候箱前后分别灌胃白酒稀释液 (V白酒∶V无菌水=1∶1) 10 mL·kg-1,中午灌胃冰水10 mL·kg-1,普通饲料喂养,每天更换垫料持续4 d,正常组灌胃等量无菌水。
2.3 小鼠一般状态观察
根据2017年中华中医药学会脾胃病分会发布的《泄泻中医诊疗专家共识意见》中肠道湿热证泄泻症状[1],每日观察小鼠的大便性状、饮水量、食量、体质量、小便、毛发、精神状态、活动程度等情况。分别于喂食高糖高脂饲料前、放入人工气候箱前、放入人工气候箱4 d后以及治疗4 d后测定小鼠肛温。
2.4 血生化检测
小鼠禁食禁水12 h,取眼球血注入促凝管中,混匀后送至湖南中医药大学第一附属医院进行血生化检测,4 h内完成总胆固醇(TC)、甘油三脂(TG)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(GLU)等指标的测定。
2.5 小鼠P物质(SP)含量测定
快速摘取小鼠眼球采血至1.5 mL EP 管中,室温放置2 h后于4 ℃1000×g 条件下离心20 min,分离上清,按照小鼠P物质测定试剂盒说明书进行操作,测定血清P物质水平。
2.6 肠道组织病理切片
造模成功后,取正常组和模型组小鼠快速断颈处死,于超净工作台上取出整段小肠,分别截取约2 cm肠道放入4%多聚甲醛中固定,经脱水、浸蜡、包埋、切片、染色后制成病理切片,光学显微镜下观察。
2.7 统计学方法
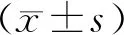
3 结果与分析
3.1 肠道湿热证泄泻模型的建立
3.1.1 肠道湿热证泄泻模型小鼠的一般特征 肠道湿热证泄泻主要临床症状为腹痛即泻,泻下急迫或泻而不爽,粪色黄褐臭秽,肛门灼热,烦热口渴。在整个饲养过程中,正常组小鼠毛发细密有光泽,精神状态佳,肛门洁净,大便颗粒饱满,水分适中,爪甲抓握能力强(图1A-C)。与正常组比较,模型组小鼠以高糖高脂饲料喂养11 d后出现了毛色发暗、大便干硬、小便色黄现象;高温高湿+白酒+冰水处理1 d后,模型小鼠表现为懒动、活动量减少,部分小鼠出现腹泻,此阶段进行4 d后,模型小鼠全部出现腹泻,大便黄褐、稀或黏腻,肛门污秽,精神萎靡,爪甲抓握能力差(图1D-F)。

图1 小鼠状态及大便比较图(A、B、C:正常组;D、E、F:模型组)
3.1.2 肠道湿热证泄泻造模对小鼠食量和饮水量影响 对于湿热证,食量和饮水量是重要的评价指标。图2示,正常组小鼠在整个喂养阶段进食量变化幅度不大,但模型组小鼠在高糖高脂喂养阶段进食量增加,且总体增加幅度较大。在进入人工气候箱后,模型组小鼠食量明显减少,甚至低于正常组小鼠。在整个造模过程中,模型小鼠前期的饮水量较正常组增加,在进入高温高湿气候箱中喂养后饮水量较正常组减少。

注:A.肠道湿热证泄泻造模对小鼠食量的影响;B.肠道湿热证泄泻造模对小鼠饮水量的影响
3.1.3 肠道湿热证泄泻造模对小鼠体质量和肛温的影响 在正常喂养情况下,小鼠体质量随着小鼠成长逐渐均匀的增加。本实验中,在高糖高脂阶段,模型组小鼠体质量逐渐增加,但进入人工气候箱和灌胃白酒、冰水后,模型组小鼠体质量增长速度下降,且造模结束时模型组小鼠体质量显著低于正常组小鼠(t=2.769,P=0.013)。表1示,造模前正常组与模型组小鼠肛温相近,且正常组小鼠肛温在喂养期间稳定在36.7 ℃~37 ℃之间,而模型组小鼠肛温随着“高糖高脂”喂养时间的延长逐渐升高,在造模结束时模型小鼠肛温显著高于正常组(t=-2.704,P=0.027)。

表1 肠道湿热证泄泻造模对小鼠体质量和肛温影响比较
3.1.4 肠道湿热证泄泻造模对小鼠肠黏膜的影响 对小鼠肠道组织切片进行HE染色,观察小鼠肠道黏膜完整性。图3A示,正常组小鼠肠道组织结构完整,肠绒毛排列紧密,形态规则,杯形细胞丰富,固有层细胞排列整齐。模型组小鼠肠绒毛出现脱落,绒毛整齐度和完整性受到影响,炎症细胞浸润,出现肠黏膜上皮坏死脱落现象(图3B)。
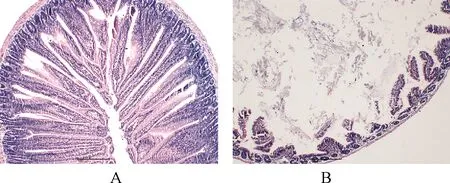
注:A.正常组小肠组织切片;B.模型组小肠组织切片
3.1.5 肠道湿热证泄泻造模对小鼠血清SP的影响 采用小鼠SP测定试剂盒对小鼠血清中SP含量进行测定。图4示,与正常组比较,模型动物血清中SP含量升高,且2组间比较统计学差异显著(t=-2.790,P=0.010)。
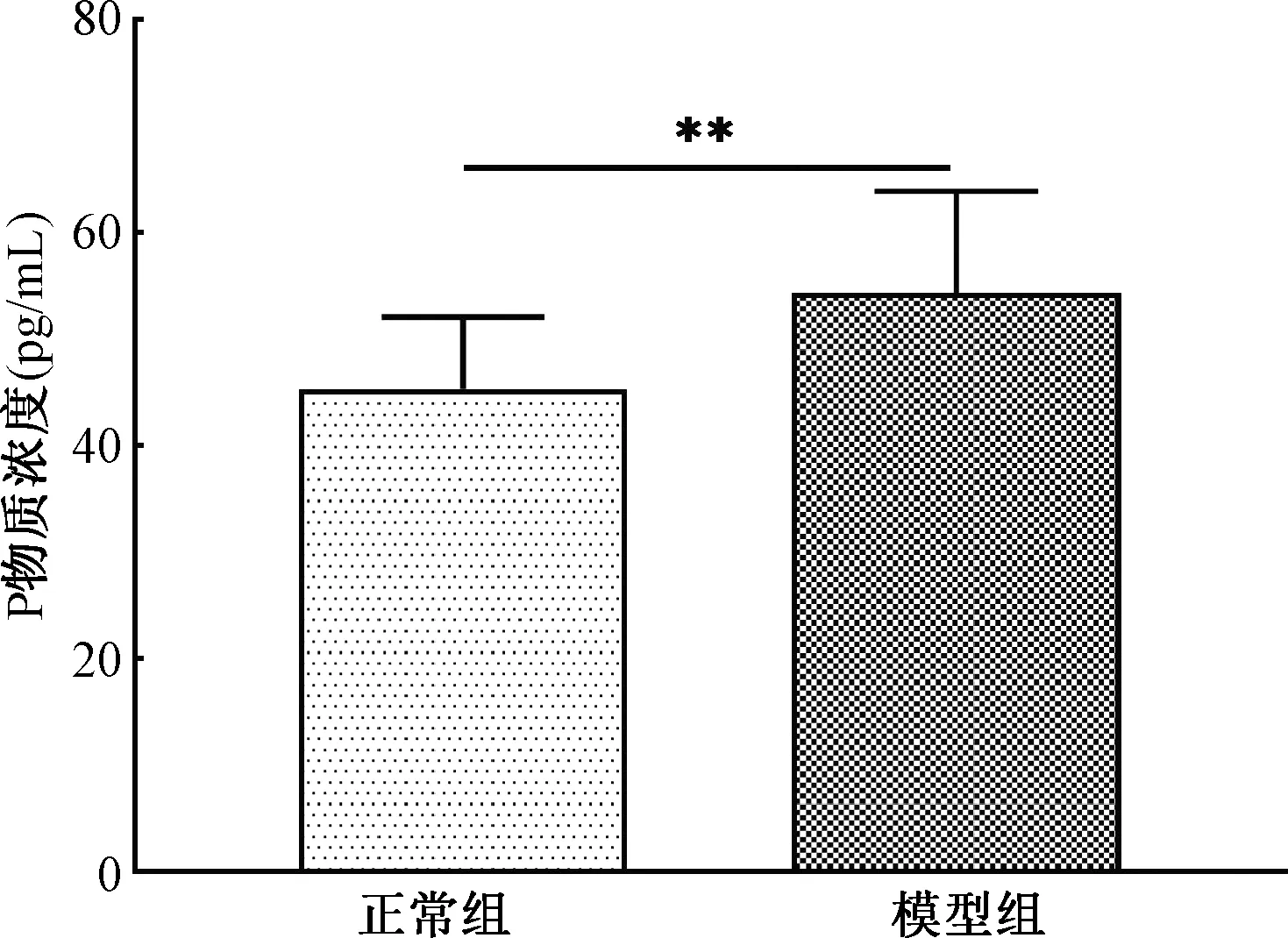
注:**P<0.01
3.1.6 肠道湿热证泄泻小鼠血生化特征 表2示,与正常组比较,模型组小鼠血中TG和HDL-C含量降低,且TG含量与正常组比较差异显著(t=-2.488,P=0.038)。模型组小鼠血中所含GLU和TC水平高于正常组,但2组间比较差异无统计学意义。

表2 肠道湿热泄泻造模对模型动物血生化影响比较
3.2 葛根芩连汤对肠道湿热证泄泻小鼠的疗效
3.2.1 葛根芩连汤干预肠道湿热证泄泻小鼠的一般特征 模型动物在使用葛根芩连汤治疗前,小鼠活泼性差,扎堆,懒动,卷毛,毛发无光泽,爪甲抓握能力差,大便稀溏,肛门污浊,葛根芩连汤治疗1 d后,治疗组小鼠活泼性增加,部分小鼠大便成型,肛门恢复洁净;治疗4 d后所有治疗组小鼠稀便消失,大便颗粒饱满且性状接近于正常组,小鼠肛门洁净,活动灵敏,爪甲抓握有力,毛发光泽度恢复到正常组水平。
3.2.2 葛根芩连汤干预对肠道湿热证泄泻小鼠食量和饮水量的影响 图5A示,停止造模后自愈组和治疗组小鼠食量均有增加,但治疗组小鼠食量较自愈组小鼠食量增加更快。图5B示,使用葛根芩连汤治疗后,治疗组小鼠的饮水量总体接近正常组水平,而自愈组饮水量较正常组相比偏低。
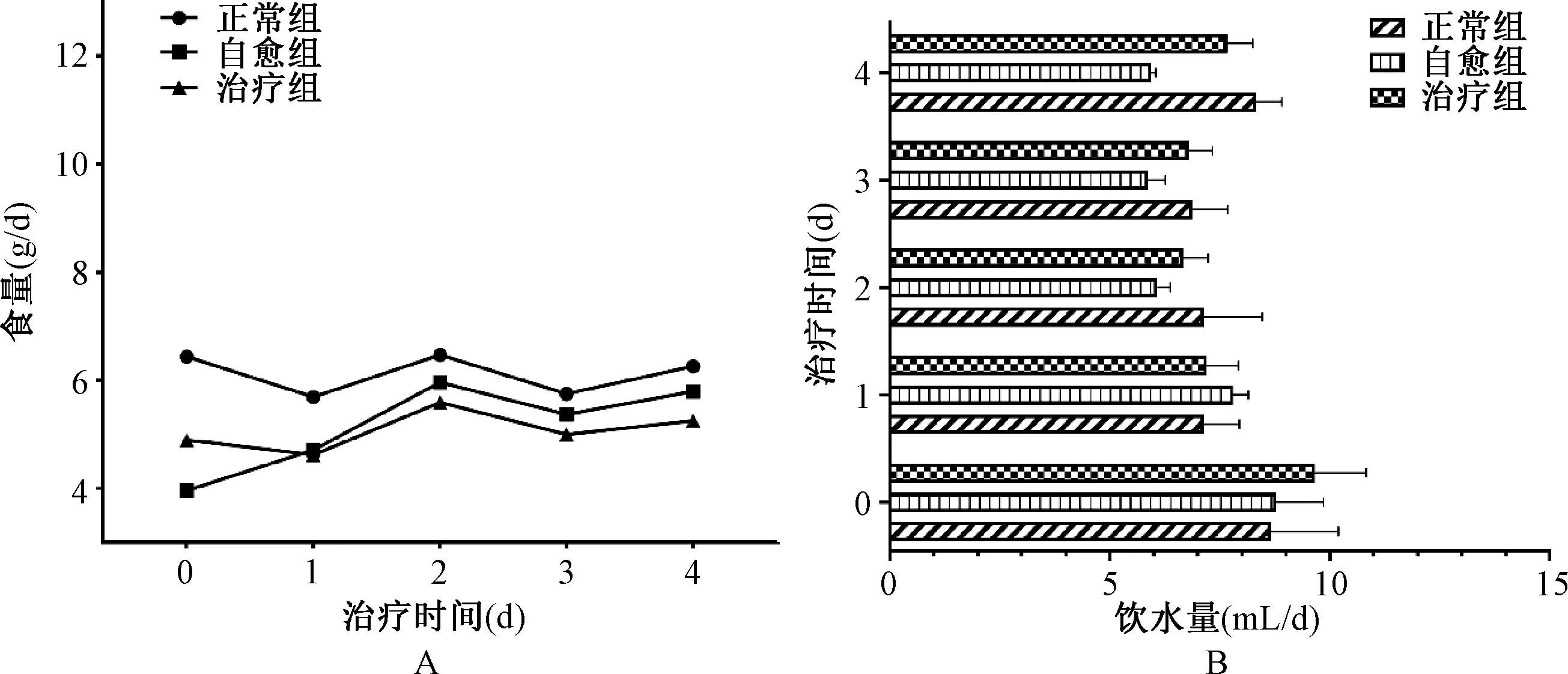
注:A.方剂干预对肠道湿热证泄泻小鼠食量的影响;B.方剂干预对肠道湿热证泄泻小鼠饮水量的影响
3.2.3 葛根芩连汤干预对肠道湿热证泄泻小鼠体质量和肛温的影响 停止造模后,治疗组和自愈组动物体质量均逐渐增加,但与正常组比较体质量仍然偏低。表3示,治疗前自愈组和治疗组肛温明显高于正常组,且差异极显著(t=-10.191,P=0.000;t=-12.255,P=0.000)。使用葛根芩连汤治疗4 d后,治疗组小鼠肛温降低且接近于正常组水平。停止造模后,自愈组小鼠肛温也发生下降,但与正常组和治疗组比较仍然偏高,且与正常组比较差异显著(t=-6.235,P=0.000)。

表3 葛根芩连汤干预对肠道湿热证泄泻小鼠体质量与肛温影响比较
3.2.4 葛根芩连汤干预对肠道湿热证泄泻小鼠血清SP影响 图6示,使用葛根芩连汤对模型小鼠进行干预后,治疗组小鼠血清SP含量下降且接近于正常组水平(t=1.365,P=0.209)。自愈组小鼠血清SP含量高于正常组和治疗组,且与治疗组比较差异显著(t=-4.084,P=0.004),但与正常组比较差异无统计学意义(t=-2.266,P=0.053)。
3.2.5 葛根芩连汤干预对肠道湿热证泄泻小鼠血生化的影响 表4示,自愈组小鼠TC、TG含量均低于正常组,且与正常组相比差异显著(t=3.365,P=0.010;t=4.173,P=0.003),而GLU水平显著高于正常组(t=-2.335,P=0.048)。经葛根芩连汤治疗后,治疗组小鼠TC、TG含量与自愈组相比均回升,且与正常组比较差异无统计学意义(t=0.717,P=0.494;t=2.048,P=0.75)。在血糖方面,治疗组小鼠GLU水平降低且接近于正常组水平(t=-0.331,P=0.749)。

表4 葛根芩连汤干预对肠道湿热证泄泻小鼠血生化的影响
4 讨论
泄泻系因感受湿热外邪,或饮食内伤致脾失健运,传导失司,脾虚湿盛是泄泻的主要病机。《景岳全书》曰:“泄泻之因,惟水、火、土三气为最。夫水者,寒气也;火者,热气也;土者,湿气也。此泻痢之本也。[18]”《脾胃论》曰:“故夫饮食失节,寒温不适,脾胃乃伤。[19]”高糖高脂饲料性属肥甘厚腻之品,过食损伤脾胃,窒碍胃肠,可聚湿化热。模型制备过程中,以高糖高脂饲料喂食模型动物11 d后,模型组小鼠出现大便干硬和小便色黄现象,提示小鼠可能出现脾胃运化功能障碍,体内已有内热蓄积。“湿热蒸腾五六月,肌表口鼻皆能入,太阴阳明受病多”[20],暑湿环境可使机体感受湿热外邪,内归于脾,且高温高湿抑制机体抗病力,增加易感性。酒性属湿热之品,嗜酒成癖久易化湿生热,寒凉饮食易伤脾阳。本研究中将脾胃运化功能受到影响的模型动物置入高温高湿的人工气候箱中喂养,同气相求,使内外湿热相引,给小鼠交替灌胃高剂量白酒和冰水,进一步损伤脾胃加重机体湿热内聚。在预实验中,给小鼠直接使用高度数白酒易造成模型动物胃肠道严重胀气致死或酒醉现象,为降低小鼠死亡率,设计灌胃稀释后的白酒,减少酒精对小鼠肠道的刺激损伤作用,但仍保持高饮酒量。在高糖高脂、高温高湿、白酒、冰水多因素作用下,最终导致小鼠脾胃运化机能失常,升降失序,清浊不分,下走大肠而出现泄泻,且在高温高湿条件下喂养并灌胃白酒、冰水后,模型动物出现了食量减少、体质量下降、抓握无力等症状,说明小鼠脾胃纳运失职,消化吸收功能减退,水谷之精微不能吸收输布全身,造成机体失养,不思饮食,神疲乏力。肛温升高提示小鼠可能湿热内聚,下注肠道,这与肠道湿热证泄泻的次症肛门灼热相符。
肠道是机体与外界直接接触的器官之一。当肠道上皮结构异常或其表面的黏液层被破坏时,将导致肠道的机械屏障作用减弱,肠黏膜通透性增高。大量研究证实,湿热证本质与机体的免疫及炎症过程有关。采用“高糖高脂+高温高湿+大肠杆菌”法制备的大肠湿热证模型,血清中所含促炎因子IL-1、IL-2和IL-6水平升高[21],以“高糖高脂+高温高湿+白酒+大肠杆菌”法制备的湿热泄泻动物模型,出现小肠黏膜绒毛脱落、肠上皮细胞肿胀甚至坏死等[22]。在本研究中,动物小肠HE染色切片显示,模型动物肠道出现了肠黏膜绒毛脱落或肠上皮坏死现象,肠黏膜完整性遭到破坏,说明本法所得模型亦存在机体肠道炎性反应。
胃肠激素是一种既存在于胃肠道又存在于中枢神经系统中的脑-肠肽,由胃肠道管壁上的内分泌细胞分泌,可直接作用于神经元,具有迅速收缩胃肠道平滑肌的能力,促进胃肠蠕动。胃肠激素分泌紊乱可引起胃肠功能性疾病,测定胃肠激素水平已成为临床诊断许多胃肠道疾病的重要手段。SP是胃肠激素的一种,是调节胃肠运动的主要兴奋性神经递质[23]。血循环中的SP大部分来自于小肠,进食脂肪、刺激迷走神经等都可引起SP含量增加[24]。冯五金等[25]研究了脾胃湿热证、肝脾不和证及大肠湿热证患者血中胃肠激素水平,发现不同证型胃肠激素水平变化不同。大肠湿热证患者胃肠激素水平升高,且以SP显著升高为特征,中药治疗后患者的SP含量有明显恢复,说明肠道分泌旺盛和运动亢进是大肠湿热证的特征,与临床表现一致。文艳巧等[4]采用“高糖高脂+饥饱失常+湿热环境+饮酒+大肠杆菌”法制备的湿热证大鼠模型,血清及肠道中所含SP水平均明显升高,采用清热解毒方郁金散治疗后模型大鼠SP含量均降低,进一步验证了湿热证与SP水平的相关性。本研究中,模型小鼠血清SP与正常组相比显著升高,提示模型动物出现肠道分泌旺盛及运动亢进现象,使肠道蠕动加快,产生腹泻,与前人研究结果相一致。
湿热证与血脂代谢异常有关[26,27]。田杰、阙铁生等[28,29]研究验证了血脂代谢紊乱是温病湿热证共有的特征之一。贾月嫦等[30]采用“高脂饲料+高温高湿+大肠杆菌感染”法建立的湿热证大鼠模型血清中TG、TC和低密度脂蛋白胆固醇(LDL-C)含量升高,而高密度脂蛋白胆固醇(HDL-C)水平降低。程方平等[31]制备的湿热证大鼠模型血清中HDL-C和LDL-C含量均升高。吕文亮[32]采用“肥甘饮食+高温高湿+鼠伤寒沙门氏菌”法建立的湿热证模型大鼠血清所含TC、TG、LDL-C升高而HDL-C降低。姚万玲[33]采用“高糖高脂+饥饱失常+高温高湿+饮酒+腹腔注射大肠杆菌”复合因素建立的湿热证大鼠模型所含TC和TG水平均升高,可见血脂代谢异常是湿热证的特征之一。本研究中,模型小鼠血清中TC和GLU含量升高而HDL-C水平降低,且模型组TG含量显著低于正常组,说明模型小鼠存在血脂代谢异常现象,与前人研究结果相一致。以上分析结果提示,模型小鼠体内出现湿热蕴积现象。
葛根芩连汤虽为表里双解之剂,但侧重于清里热、止热利,临床常用于里热腹泻[34]。方中葛根既能解表退热,又能生发脾阳之气而治下利。黄芩黄连性味苦寒,清热燥湿,厚肠止利;炙甘草益气和中,亦可调和诸药。采用“高糖高脂+高温高湿+白酒+冰水”所致腹泻小鼠经葛根芩连汤治疗后,大便恢复正常,肛周洁净,肛温降低,行动灵敏,食量和体质量增加,说明葛根芩连汤对肠道湿热证泄泻模型症状具有明显的改善作用。方剂干预4 d后,治疗组小鼠血清SP含量恢复,TG和GLU含量向正常组水平回归,提示葛根芩连汤可降低模型动物血清SP含量,调节胃肠激素和血糖水平,改善机体血脂代谢异常。以上信息说明,葛根芩连汤对腹泻小鼠疗效显著,同时也反证了肠道湿热证泄泻模型制备成功。
采用“高糖高脂+高温高湿+白酒+冰水”复合因素法,成功复制了肠道湿热证泄泻小鼠模型,葛根芩连汤对模型小鼠的显著疗效反证了模型制备成功。本研究从模型动物的症状表现、SP含量、血生化指标及肠道病理切片的角度进行了模型的评价,但这些指标对于肠道湿热证泄泻的客观化评价还存在不足。结合现代系统生物学检测技术和生物信息学分析方法,从系统生物学、肠道菌群、炎症免疫反应、糖脂代谢等多方面、多角度研究肠道湿热证泄泻的特异性评价指标,对湿热证的客观化诊断具有重大意义。
