BMSCs来源外泌体调节表皮HaCaT细胞及对烧伤创面愈合的促进作用
2021-11-03唐强黄志群廖秋姣陈端凯陆钢姜艳唐乾利
唐强 黄志群 廖秋姣 陈端凯 陆钢 姜艳 唐乾利


[摘要]目的:探讨骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)的外泌体对表皮细胞(HaCaT细胞)增殖、侵袭与迁移的影响,以及对小鼠烧伤创面愈合的作用。方法:分离培养小鼠的BMSCs,超速离心法收集BMSCs来源的外泌体,采用BMSCs来源的外泌体培养HaCaT细胞,CCK-8法检测BMSCs来源的外泌体对HaCaT细胞增殖的影响,细胞划痕实验和Transwell实验检测BMSCs来源的外泌体对HaCaT细胞迁移与侵袭的影响。选取25只C57BL/6小鼠构建烧伤模型,22只成功建模,将存活小鼠分为对照组和外泌体组,每组11只,外泌体组烫伤周围注射BMSCs来源的外泌体,对照组小鼠同时注射等体积PBS溶液。采用Image J软件分析小鼠创面愈合率,通过HE染色观察创面组织学变化,采用酶联免疫吸附法(ELISA)检测创面组织中炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10)的水平,免疫组织化学染色检测创面组织Ⅰ型胶原(Col Ⅰ)和Ⅲ型胶原(Col Ⅲ)表达。结果:成功分离培养出小鼠BMSCs,并得到BMSCs来源的外泌体。与对照组比较,实验组HaCaT细胞增殖活性明显升高;细胞的划痕愈合率较对照组显著升高,细胞侵袭数目较对照组也显著增加,差异均具有统计学意义(P<0.05)。与对照组小鼠比较,经BMSCs来源的外泌体处理的小鼠,第3、7、14、21、28天的创面愈合率显著升高,创面组织结构得到明显改善,且组织中促炎因子TNF-α、IL-1β的含量均显著降低,而抗炎因子IL-10的含量显著升高,Ⅲ型胶原表达明显,差异均具有统计学意义(P<0.05)。结论:BMSCs外泌体可促进HaCaT细胞的增殖、侵袭与迁移能力,并减轻小鼠烧伤创面组织的炎症程度,促进创面愈合。
[关键词]烧伤;骨髓間充质干细胞;外泌体;HaCaT细胞;创面愈合
[中图分类号]R644 [文献标志码]A [文章编号]1008-6455(2021)09-0001-06
Exosomes Derived from BMSCs Regulate Epidermal HaCaT Cell and Promote Burn Wound Healing
TANG Qiang1,HUANG Zhi-qun1,LIAO Qiu-jiao2,CHEN Duan-kai1,LU Gang1,JIANG Yan3,TANG Qian-li3
(1.Department of Burn Plastic Surgery and Wound Repair Surgery;2.Department of Spine and Bone Surgery,Affiliated Hospital of Youjiang Medical College for Nationalities,Baise 533000,Guangxi,China;3.Youjiang Medical College for Nationalities,Baise 533000,Guangxi,China)
Abstract: Objective To investigate the effect of exosomes secreted by bone marrow mesenchymal stem cells (BMSCs) on the proliferation, invasion and migration of human keratinocytes (HaCaT cells), and on the healing of burn wounds in mice. Methods BMSCs from mice were isolated and cultured, exosomes derived from BMSCs were collected by ultracentrifugation, HaCaT cells were cultured with exosomes derived from BMSCs, and the effect of exosomes derived from BMSCs on the proliferation of HaCaT cells was detected by CCK-8 method. Scratch test and Transwell test were used to detect the influence of BMSCs-derived exosomes on HaCaT cell migration and invasion. Twenty-five C57BL/6 mice were selected to construct a burn model. After successful modeling (n=22), the surviving mice were divided into a control group and an exosome group, with 11 in each group. Exosomes derived from BMSCs were injected around the scald in the exosomes group, and mice in the control group were injected with an equal volume of PBS solution at the same time. Image J software was used to analyze the wound healing rate of mice, and the histological changes of the wound were observed by HE staining. Enzyme-linked immunosorbent assay (ELISA) was used to detect the levels of inflammatory factors tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and interleukin-10 (IL-10) in wound tissue. Immunohistochemical staining was used to detect the expression of type Ⅰ collagen (Col Ⅰ) and type Ⅲ collagen (Col Ⅲ) in wound tissue. Results The mouse BMSCs were successfully isolated and cultured, and exosomes derived from BMSCs were obtained. Compared with the control group, the HaCaT cell proliferation activity in the experimental group was significantly increased; the scratch healing rate of the cells was significantly higher than that of the control group, and the number of cell invasion was also significantly higher than that of the control group. The differences were statistically significant (P<0.05). Compared with control mice, mice treated with BMSCs-derived exosomes had a significantly higher wound healing rate on days 3, 7, 14, 21 and 28, the tissue structure of the wound was significantly improved, and the contents of pro-inflammatory factors TNF-α and IL-1β in the tissues are significantly reduced, while the content of anti-inflammatory factor IL-10 is significantly increased. The expression of type Ⅲ collagen was obvious, and the differences were statistically significant (P<0.05). Conclusion BMSCs exosomes can promote the proliferation, invasion and migration of HaCaT cells, reduce the inflammation degree of burn wound tissue in mice, and promote wound healing.
Key words: burn; bone marrow mesenchymal stem cells; exosomes; HaCaT cells; wound healing
烧伤是一种极其复杂的外伤性疾病,根据世界卫生组织(WHO)统计,每年大约有30多万人因烧伤致使死亡,并造成1 000多万伤残调整寿命年的损失[1-2]。烧伤后皮肤发生变性,引起组织形态发生变化、细胞代谢紊乱和功能受损,而烧伤后伤口愈合也是一个复杂的过程,涉及炎症、增殖和重塑三个阶段[3],促进皮肤伤口愈合的目标是快速再生皮肤的天然保护结构,以减少感染的风险并提供组织的功能性[4]。人永生化表皮细胞HaCaT在创伤及周围部分的增殖与迁移是创面再上皮化和创面修复的关键环节之一[5]。
目前,烧伤的治疗方法主要包括基因治疗、生长因子治疗、富血小板血浆治疗、干细胞治疗和组织工程[6]。其中,基于干细胞的疗法是治疗急性和慢性伤口愈合的重要途径。研究表明,骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)可用于多种疾病的治疗,同时能够分泌有利于细胞修复和生长的营养因子[7]。为进一步探索基于BMSCs外泌体的治疗方法,本研究通过提取BMSCs来源的外泌体,观察其对HaCaT细胞功能学的影响,并在烧伤小鼠上初步观察了其对创面愈合的作用,为后续BMSCs来源的外泌体治疗创面损伤的机制研究提供依据。
1 材料和方法
1.1 材料和试剂
1.1.1 实验动物:健康清洁级雄性C57BL/6小鼠,6~8周龄,体质量18~24g,均在右江民族医学院动物中心实验室饲养。
1.1.2 主要材料、试剂:HaCaT细胞株(北京协和细胞资源中心),胎牛血清、青霉素-链霉素、DMEM培养液及胰蛋白酶(美国Gibco 公司),ELISA检测试剂盒(碧云天生物技术研究所),HE染色试剂和免疫组化染色试剂(北京索莱宝),茜素红染色试剂盒和油红O染色试剂盒(北京中杉金桥),成骨和成脂分化培养基(中国赛业),CCK-8试剂盒(日本同仁),Transwell小室(美国 System Biosciences 公司),抗体CD34、CD29、CD45、CD44、Col Ⅰ和Col Ⅲ(英国Abcam 公司),其他试剂均为国产分析纯。
1.2 BMSCs的分离、培养及鉴定:采用全骨髓贴壁法提取C57BL/6小鼠的BMSCs。将小鼠脱臼处死,在无菌环境下分离两侧股骨和胫骨,PBS冲洗骨髓腔,细胞滤网过滤,制成细胞悬液。将细胞悬液用含10%胎牛血清、1%青霉素-链霉素的低糖DMEM培养液原代培养,置于37℃、5% CO2恒温培养箱中,每2d换液1次,去除未贴壁细胞。待细胞融合度达到80%时,0.25%胰蛋白酶消化。收集第3代BMSCs,1 000rpm/min离心5min,制成细胞悬液并调整浓度为1×105个/毫升,通过流式细胞术检测CD34、CD29、CD45、CD44表达。第3代BMSCs分别使用成骨完全培养基诱导21d和成脂分化培养基诱导14d后,进行茜素红染色和油红O染色。
1.3 BMSCs的外泌体提取及鉴定:取生长状态良好的第3代BMSCs,PBS漂洗后,用无血清DMEM培养基培养48h,收集培养上清液,4℃离心机中以300g离心10min,取上清液,以2 000g离心20min,取上清液,继续以10 000g离心30min,留取上清液,滤膜过滤,再以100 000g离心1.5h,弃去上清液得到外泌体沉淀,加入PBS重悬,获得外泌体悬液。采用透射电子显微镜观察外泌体,NTA测量外泌体的直径与浓度,Western blot检测BMSCs外泌体蛋白标志物Alix、TSG101、CD9表达。
1.4 HaCaT细胞培养、分组及处理:HaCaT细胞复苏后,加入含10%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基,置于37℃、5% CO2恒温培养箱中培养,待细胞融合度达到约80%时,加入0.25%胰蛋白酶消化,并以1:3的比例进行传代培养,后续实验选取生长状态较好的细胞进行。
1.5 CCK-8实验:将HaCaT细胞以1×104个/孔的密度接种到96孔板中,置于37℃、5% CO2恒温培养箱中培养24h。将细胞随机分为对照组和实验组,对照组细胞在DMEM培养基中继续培养,实验组细胞使用含10μg/ml BMSCs来源的外泌体的DMEM培养基培养,分别于培养0、1、3、5、7d时,每孔加10μl CCK-8,继续孵育4h,采用酶标仪检测450nm处各孔吸光光度值。
1.6 Transwell实验:在Transwell小室的上室加50μl稀释的Matrigel胶,放于37℃培养箱中待胶凝固。将HaCaT细胞分组处理48h后,调整浓度为2×104个/毫升。取100μl细胞悬液加入Transwell小室的上室,对照组的下室加入含10%胎牛血清的完全培养液,实验组的下室加入含10μg/ml外泌体的完全培养基。置于37℃、5% CO2恒温培养箱中孵育24h,弃培养液,4%多聚甲醛固定,0.1%结晶紫染色,PBS洗涤并封片,在光学显微镜下观察并拍摄图像,统计侵袭细胞数目。
1.7 细胞划痕实验:将HaCaT细胞分组处理48h后,调整细胞浓度以4×105个/孔接种在6孔板中培养24h,用移液管尖端沿直尺垂直于培养孔背后的中间处划一道痕,PBS清洗细胞,并冲掉划痕下细胞,添加无血清DMEM培养基,置于37℃、5% CO2恒温培养箱中继续培养,分别于0h和48h时,在光学显微镜下观察划痕愈合情况并拍摄图像,采用Image J软件分析划痕愈合情况。
1.8 动物造模、分组与处理:小鼠通过腹腔注射戊巴比妥钠麻醉后,剔除背部毛,大小为2cm×2cm。将小鼠在烫伤板上固定后,背部剃毛区域皮肤均匀涂抹无水酒精,涂抹后立即点燃,15s后迅速扑灭,即制成深Ⅱ度烧伤小鼠模型,接着腹腔注射0.5ml乳酸林格液,將小鼠单笼饲养,期间自由饮水和摄食。造模后,25只小鼠中有3只死亡,将余下22只小鼠随机分为对照组和外泌体组,每组11只,外泌体组小鼠在烫伤周围注射1ml PBS溶液重悬的BMSCs来的外泌体(0.2mg/ml),对照组小鼠同时注射等体积PBS溶液。
1.9 烧伤创面愈合率:小鼠造模并进行相应处理后,在第3、7、14、21、28天观察创面愈合情况,以透明纸和方格纸描画出创面大小,Image J软件分析创面面积,创面愈合率(%)=[(初始创面面积﹣测定创面面积)/初始创面面积]×100%,以确定伤口愈合程度。
1.10 HE染色:在BMSCs来源的外泌体处理后第7、14、21、28天,取小鼠创面组织样本进行组织病理学评估,将创面组织在4%多聚甲醛固定后,经漂洗、脱水处理,常规石蜡包埋后进行切片,以获得厚度为5μm的石蜡切片。取部分切片常规行HE染色,通过显微镜观察创面组织学变化情况。
1.11 ELISA检测:在BMSCs来源的外泌体处理后第28 天,取小鼠创面组织制成组织匀浆,4 000rpm/min离心10min,获取上清液,采用ELISA测定组织中炎性因子TNF-α、IL-1β、IL-10的水平,步骤严格按照ELISA试剂盒说明书操作。
1.12 免疫组织化学染色:创面组织石蜡切片脱蜡、脱水后,使用0.01M枸橼酸盐缓冲液(pH6.0)在微波炉中进行高温抗原修复,室温冷却,加入内源性过氧化物酶处理15min,室温下5%山羊血清封闭1h,加入稀释的兔抗Col Ⅰ(1:500)与Col Ⅲ(1:500)为第一抗体,置于4℃下孵育过夜,第2天,PBS洗涤,加入稀释的辣根过氧化物酶标记山羊抗兔IgG(1:1 000),37℃下孵育30min,PBS洗涤,DAB显色,苏木精复染,中性树胶封片,通过显微镜下观察并拍摄图像,Image J软件对图像进行测定分析。
1.13 统计学分析:采用SPSS 27.0统计软件对本研究数据进行分析处理,计量资料采用均数±标准差(x?±s)表示,多样本比较采用单因素方差分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 骨髓间充质干细胞鉴定结果:通过流式细胞仪检测BMSCs上细胞表面抗原CD34,CD29,CD45以及CD44的表达,结果显示,CD29和CD44呈阳性表达,而CD34和CD45呈阴性表达(见图1A)。倒置显微镜下观察到BMSCs形态均匀,细胞呈纺锤形,并呈螺旋状排列(见图1B)。BMSCs油红O染色结果显示,在细胞内部可观察到红色的脂滴(见图1C)。茜素红染色观察到有明显的橘红色钙沉淀,说明有钙结节形成(见图1D)。
2.2 外泌体的鉴定:透射电镜下外泌体形态为杯状或球形(见图2A)。直径大小分布在0~200nm,粒径峰值为50nm,平均直径为(75.5±1.4)nm,浓度为(1.57±0.09)×1 010/ml(见图2B)。Western blot检测结果显示,外泌体标志蛋白TSG101、Alix、CD9均表达阳性(见图2C)。结果表明这些纳米颗粒为外泌体。
2.3 BMSCs来源的外泌体促进HaCaT细胞增殖:CCK-8检测结果显示,与对照组比较,在培养3、5、7d时,经过与BMSCs来源的外泌体共培养的实验组HaCaT细胞增殖活性显著升高,差异具有统计学意义(P<0.05)。见图3。
2.4 BMSCs来源的外泌体促进HaCaT细胞迁移与侵袭:细胞划痕实验和Transwell实验检测结果显示,HaCaT细胞经过与BMSCs来源的外泌体共培养后,细胞的划痕愈合率及细胞侵袭数目较对照组显著增加,差异具有统计学意义(P<0.05)。见图4~5。
2.5 BMSCs来源的外泌体促进小鼠烧伤创面愈合:各组小鼠烧伤创面愈合率检测结果显示,经过BMSCs来源的外泌体处理的小鼠,在第3、7、14、21、28天,创面愈合率较对照组均显著升高,差异具有统计学意义(P<0.05)。见图6。
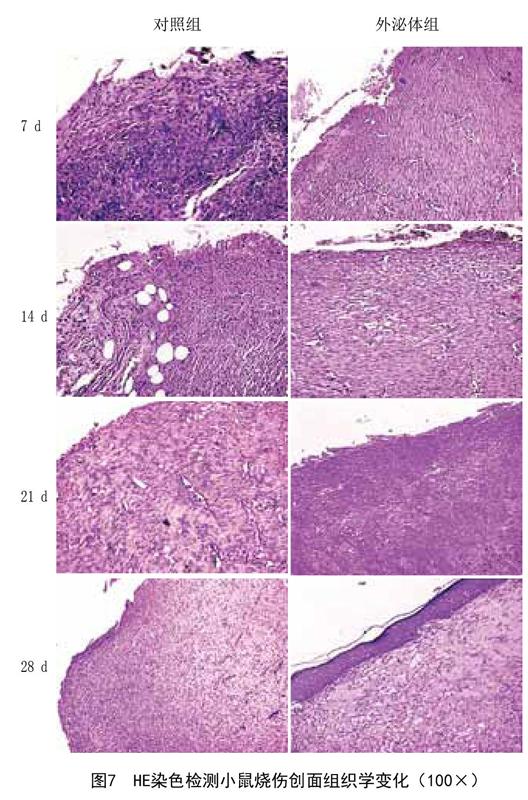
2.6 BMSCs来源的外泌体减轻小鼠烧伤组织损伤程度:HE染色结果显示,在烧伤后第7天,对照组皮肤组织坏死,纤维组织大量增生,炎症细胞浸润十分明显,而外泌体组炎症细胞浸润较少且分布较为均匀,有新肉芽组织形成;烧伤后第14天,对照组有新肉芽组织形成,并伴随炎性细胞浸润,外泌体组炎性细胞浸润轻微,上皮组织增生明显;烧伤后第21天,对照组上皮组织增生,炎症反应较轻,外泌体组纤维组织增生较少,可见组织再生;烧伤后第28天对照组纤维组织增生较少,外泌体组皮肤坏死明显恢复,组织结构较为完整。见图7。
2.7 BMSCs来源的外泌体调控炎性因子表达:ELISA检测结果显示,与对照组比较,外泌体组小鼠创面组织中促炎因子TNF-α、IL-1β的含量均显著降低,而抗炎因子IL-10的含量显著升高,差异具有统计学意义(P<0.05)。见表1。
2.8 BMSCs来源的外泌体对Ⅰ型和Ⅲ型胶原表达的影响:免疫组化染色結果显示,对照组创面组织中Ⅰ型胶原表达较外泌体组创面组织中Ⅰ型胶原表达更为明显,而外泌体组中的Ⅲ型胶原较对照组中的Ⅲ型胶原表达更为明显(见图8)。
3 讨论
烧伤形成的创面一直被认为是最具有破坏力的创伤形式之一,通常会导致多种并发症的发生,例如继发性炎症反应、组织器官衰竭和烧伤引起的一些长期后遗症等[3]。虽然在过去的几十年中,由于治疗手段的不断改善,烧伤患者的生存率得到了提高,但仍然存在许多挑战,例如烧伤后患者出现的功能障碍,无法实现功能全面的皮肤再生以及重度烧伤患者因烧伤瘢痕严重产生心理疾病[8]。细胞疗法是皮肤烧伤损伤后形态重建和功能恢复最有前途的方法之一。在不同临床条件下优化修复过程和组织再生的细胞群体取决于多种因素,例如细胞类型、细胞培养技术、受损组织和患者的免疫反应等[9]。识别具有巨大治疗潜力的丰富细胞来源特别重要,干细胞具有自我更新和分化为多种细胞类型的潜力[7],这使得运用干细胞再生受损的组织和器官对各种病症的治疗引起了广泛的关注。目前,干细胞作为促进皮肤再生的手段在伤口愈合领域的运用也引起了研究者们较大的兴趣。
越来越多的证据表明,BMSCs参与了癌症微环境的形成,其在肿瘤进展中的潜在作用是通过分泌的旁分泌因子所介导的[10]。外泌体是直径大小40~150nm的细胞外膜囊泡,广泛存在于所有生物流体中,包括血浆、尿液、唾液、母乳以及支气管肺泡灌洗液,当多囊泡体与质膜融合时,外泌体就会释放到细胞外环境中去[11]。外泌体作为一种旁分泌因子,外泌体可以参与生物化学物质的运输,例如细胞因子、mRNA、非编码RNA以及蛋白质[12],可通过遗传物质的转移在细胞遗传信息交换中发挥至关重要的作用。因此,外泌体在调节细胞存活和组织修复中也起到了关键作用。郭建忠等研究表明了血清来源的外泌体可以促进成纤维细胞的增殖和表皮HaCaT细胞的迁移,这使得其对小鼠烫伤伤口的愈合也产生了良好的促进作用[13]。Zhang等证明了脂肪组织衍生的干细胞通过产生外泌体激活PI3K/Akt信号通路,从而加速皮肤伤口的愈合[14]。Li等通过表明MSCs衍生的外泌体lncRNA H19通过削弱miR-152-3p介导的对PTEN抑制作用来预防成纤维细胞的凋亡,通过注射MSCs来源的外泌体lncRNA H19后,糖尿病足溃疡小鼠的伤口愈合明显加快[15]。
在本研究中,從BMSCs分离到了50~200nm的生物活性成分,经过鉴定发现,这些颗粒中TSG101、Alix及CD9蛋白均呈现阳性表达,结果均符合外泌体特征,由此判断成功分离到BMSCs来源的外泌体。烧伤后变性的真皮具有通过改善周围微环境而恢复正常皮肤形态并促进伤口愈合的能力。在变性真皮中的血管内皮细胞在血管新生具有重要作用,表皮细胞在表皮修复中通过增殖和再上皮化发挥着关键作用,烧伤后数小时内上皮再形成过程开始,这对于恢复完整的表皮屏障作用来说至关重要[16]。本研究结果显示,通过BMSCs来源的外泌体作用于表皮细胞HaCaT后,细胞的增殖、侵袭与迁移能力均明显提高,这一结果提示HaCaT细胞行为可能与BMSCs来源的外泌体有直接关系,因此可能在创面愈合中发挥有益作用。
烧伤后炎症介质在体内释放增加,这会引起过度的全身炎症反应,从而导致病理变化过程中的血管通透性增加。促炎细胞因子TNF-α和IL-β在细胞因子网络和全身性炎症中起着重要作用,他们不仅可以引起细胞因子的释放,而且可以增强嗜中性粒细胞和内皮细胞的黏附以及嗜中性粒细胞的迁移,从而进一步加重了器官的损伤[17-18]。抗炎细胞因子IL-10具有重要免疫调节功能,能够通过活化的巨噬细胞来抑制炎性细胞因子如TNF-α、IL-6的表达[19]。这些炎性因子的表达水平通常是烧伤治疗后检测的重要指标之一。在本研究中,注射BMSCs来源的外泌体的烧伤小鼠皮肤组织中观察到,创面组织愈合加快,组织修复较为明显,同时TNF-α、IL-1β的含量降低而IL-10的含量升高,由此说明,BMSCs来源的外泌体可抑制小鼠烧伤后的炎症反应,加快创面的愈合。
综上所述,BMSCs来源的外泌体可通过抑制炎症反应及促进表皮细胞增殖和迁移来促进小鼠烧伤后创面愈合。但外泌体中的成分复杂,具体哪些因子发挥了有益作用以及其具体机制,将在后续研究中进一步明确。
[参考文献]
[1]Antonino A.A case report of deep skin burns following radiofrequency-assisted liposculpting technology of BodyTite[J].Dermatol Ther,2020,33(4):e13683.
[2]Nguyen JQ,Marks HL,Everett T,et al.Early visualization of skin burn severity using a topically applied dye-loaded liquid bandage[J].Sci Rep,2020,10(1):9314.
[3]Almutlaq BA,Jarman A,Alfraihi R,et al.Skin burns in Saudi Arabia: causes, management, outcomes and quality of life after skin burns[J].Int J Burns Trauma,2020,10(2):28-37.
[4]Wu Q,Ji FK,Wang JH,et al.Stromal cell-derived factor 1 promoted migration of adipose-derived stem cells to the wounded area in traumatic rats[J].Biochem Biophys Res Commun,2015,467(1):140-145.
[5]Lee CW,Su YH,Chiang YC,et al.Glycofullerenes inhibit particulate matter induced inflammation and loss of barrier proteins in HaCaT human keratinocytes[J].Biomolecules,2020,10(4):514.
[6]Yosuke N,Satoshi F,Suzan A,et al.Polyurethane foam for skin graft fixation in clinical-relevant ovine burn wound model for wound repair and regeneration research[J].Regen Ther,2020,14:341-343.
[7]Paganelli A,Tarentini E,Benassi L,et al.Mesenchymal stem cells for the treatment of psoriasis: a comprehensive review[J].Clin Exp Dermatol,2020,45(7):824-830.
[8]张雨.烧伤创面修复技术的研究进展[J].医疗装备,2017,30(10):191-192.
[9]Pere D,Shiran F,Yi Z,et al.Scale-up manufacturing of gelatin-based microcarriers for cell therapy[J].J Biomed Mater Res B Appl Biomater,2020,108(7):2937-2949.
[10]唐琦琦,修光辉,孙洁,等.骨髓间充质干细胞来源外泌体在疾病中的应用研究进展[J].中国现代医药杂志,2020,22(7):88-92.
[11]Rani S,Ryan AE,Griffin MD,et al.Mesenchymal stem cell-derived extracellular vesicles: toward cell-free therapeutic applications[J].Mol Ther,2015,23(5):812-823.
[12]Jafari D,Shajari S,Jafari R,et al.Designer exosomes: a new platform for biotechnology therapeutics[J].BioDrugs,2020,34(5):567-586.
[13]郭建忠,楊磊.血清外泌体对小鼠烫伤伤口愈合的促进作用及机制研究[J].广州医药,2019,50(2):69-71.
[14]Zhang W,Bai X,Zhao B,et al.Cell-free therapy based on adipose tissue stem cell-derived exosomes promotes wound healing via the PI3K/Akt signaling pathway[J].Exp Cell Res,2018,370(2):333-342.
[15]Li B,Luan S,Chen J,et al.The MSC-derived exosomal lncRNA H19 promotes wound healing in diabetic foot ulcers by upregulating PTEN via microRNA-152-3p[J].Mol Ther Nucleic Acids,2020,19:814-826.
[16]Tarek K,Dalia ES,Ahmed N,et al.Potential of stem cells for skin regeneration following burn[J].Menoufia Med J,2020,33(2):694-698.
[17]唐强,黄志群,陆钢,等.再生医疗技术对深Ⅱ度烧伤患者的炎症因子水平及创面愈合的影响[J].中国美容医学,2020,29(4):94-97.
[18]Shou J,Kong X,Wang X,et al.Tizoxanide inhibits inflammation in LPS-activated RAW264.7 macrophages via the suppression of NF-κB and MAPK activation[J].Inflammation,2019,42(4):1336-1349.
[19]殷玉莲,潘玲婷,程亦勤,等.巨噬细胞促进创面修复中作用的研究进展[J].海南医学院学报,2019,25(15):1191-1195.
[收稿日期]2020-09-21
本文引用格式:唐强,黄志群,廖秋姣,等.BMSCs来源外泌体调节表皮HaCaT细胞及对烧伤创面愈合的促进作用[J].中国美容医学,2021,30(9):1-6.
