超高压对弧菌属细菌压力分子蛋白结构和磷酸化能力的影响
2021-10-14李羽葳王勃然
李羽葳,王勃然,贾 鑫✉
(中国农业大学 食品科学与营养工程学院,北京 100080)
我国国土面积广袤,海岸线漫长,海水产品资源丰富。瓣鳃纲如牡蛎、扇贝等食用贝类,因产量高、高蛋白、低脂肪、肉质鲜美等原因深受消费者喜爱,牡蛎蛋白更能与锌螯合制成补锌食品[1],促进生长发育。传统贝类水产品加工通过加热方式,破坏共价键使得蛋白质变性从而杀菌,但是加热的贝类肉质收缩,汁液流失严重,有明显的黄色熟化外观[2],有损食品感官品质[3]。超高压处理作为一种水产品非热加工方式,能够使得生物体高分子立体结构中的疏水相互作用、氢键、离子键等非共价键结合发生变化,从而达到杀菌、钝酶的作用[4-6]。此外,超高压处理技术能够在有效杀菌的同时不破坏水产品原有的风味,较好地分离贝类肉壳。且随着压力的增加,贝类肉质完整饱满外观变化不显著,具有多汁性,无肉眼可见的颜色差异[7]。
弧菌属细菌是一种革兰氏阴性兼性厌氧型细菌,其中大多种类均有较强的致病性。瓣鳃纲动物的鳃不仅是呼吸器官,还是重要的滤食器官,故食用贝类易被细菌污染。特别是深圳等沿海城市是副溶血弧菌引起食物中毒和感染性腹泻的高发区域[8],往年因食入致病性弧菌属细菌导致死亡的案例时有发生。
压力分子蛋白在细菌中普遍存在,是细菌中响应环境胁迫(温度、盐度、压力等)的重要信息调控中心,RsbT 蛋白作为压力分子蛋白中重要的蛋白激酶,调节下游基因表达。在革兰阳性枯草芽孢杆菌压力分子蛋白感应环境变化,通过蛋白介导的可逆磷酸化最终激活介导环境胁迫应答的σB因子,增强其调节子(regulon)下游基因的转录,调控超过150 种与压力应答、生物膜形成等相关的基因表达,使细菌适应新环境并得以生存。拟借鉴革兰氏阳性菌响应环境胁迫机制探究革兰氏阴性菌的信息传递通路。前期研究表明革兰阴性巴西弧菌蛋白响应无氧胁迫,诱使vbRsbR蛋白感应结构域发生构象变化,并激活压力分子蛋白亚基激酶vbRsbT,促进压力分子蛋白核心磷酸化水平升高。
1 材料与方法
1.1 实验材料
RsbT 蛋白激酶质粒、大肠杆菌(重组Anti-Thiophosphate 抗体)、山羊抗兔IgG H&L(HRP)、Western Blot 转印膜、Western ECL Substrate:伯乐生命医学产品(北京)有限公司;镍琼脂糖填料:北京韦氏博慧色谱科技有限公司;氯化钠:国药集团化学试剂北京有限公司;胰蛋白胨、酵母抽提物:OXIDO(北京);Rosetta 感受态:康为世纪(北京);IPTG(VWR 0487)、卡那霉素(VWR 75856.686)、10 孔蛋白电泳预制胶(8%)、电极缓冲液、分子量标准蛋白质、彩虹245 plus广谱蛋白Marker:北京索莱宝科技有限公司。
1.2 仪器与设备
圆二色光谱仪:英国应用光物理公司;SCI-VS漩涡振荡器(SCILOGEX)、5424 快速蛋白转印系统、电泳仪、水平脱色摇床:伯乐(Bio-Rad)公司;B-100G5/5L/600 MPa 型UHP 设备:上海励途超高压设备有限公司;立式压力蒸汽灭菌锅:深圳海博讯实业有限公司医疗设备厂;Fresco 低温冷冻离心机:赛默飞世尔科技有限公司;台式恒温振荡器:北京中科华美生化有限公司;超净工作台:上海智城分析仪器制造有限公司;SH13V-AZ55型真空封口机:九阳股份有限公司;电磁炉(C21-WK2102 型):美的集团。
1.3 实验方法
1.3.1 目的蛋白表达纯化
采用大肠杆菌为载体,转化质粒并进行过夜培养、质粒扩大培养及蛋白纯化等过程提取RsbT蛋白激酶。扩大培养后先进行菌体破碎,获得上清液与沉淀,通过SDS-PAGE 凝胶电泳获得蛋白富集区域(上清液)与分子量(RsbT 蛋白激酶分子量约为62 kD),并使用缓冲液(0.5 mol/L TEA,0.5 mol/L NaCl,50 mL 甘油,0.1 mol/L MgCl2·6H2O,100 mL 体系)通过镍柱纯化得到目的蛋白,再次通过SDS-PAGE 凝胶电泳分析蛋白的纯度和浓度。
1.3.2 超高压处理
以200 MPa 为梯度进行不同压力(100、300、500 MPa)的超高压处理,保压时间5 min,处理温度室温,保存温度–80 ℃。
1.3.3 压力分子蛋白二级结构分析
RsbT 蛋白激酶是一种蛋白质,采用圆二色谱法探究梯度压力处理对RsbT 蛋白激酶二级结构的影响。
1.3.4 RsbT 体外激酶试验
使用免疫蛋白印迹法与化学显色可得到RsbT蛋白激酶的自磷酸化能力,验证梯度压力处理对RsbT 蛋白激酶生理活性的影响。将RsbT 蛋白激酶与ATP-γ-S 反应30 min,并用Western-Blot 来验证梯度压力对RsbT 蛋白激酶自磷酸化能力的抑制;再细化RsbT 蛋白激酶与ATP-γ-S 的反应时间节点(1、2、5、10、15、30、60 min),并用Western-Blot 来验证梯度压力对RsbT 蛋白激酶自磷酸化能力的抑制。
1.4 数据分析
数据处理与作图采用Excel 2016 和Origin,成像图片处理采用Adobe Photoshop,灰度分析采用ImageJ. JS 完成。
2 结果与分析
2.1 SDS-PAGE 检验RsbT 蛋白激酶纯化结果
不同超高压条件下纯化得到的RsbT 蛋白激酶见图1,由图1 可知68 kD 处为纯化后RsbT 蛋白激酶,蛋白激酶纯度高。经检测,纯化后的RsbT蛋白激酶浓度为12 mg/mL。
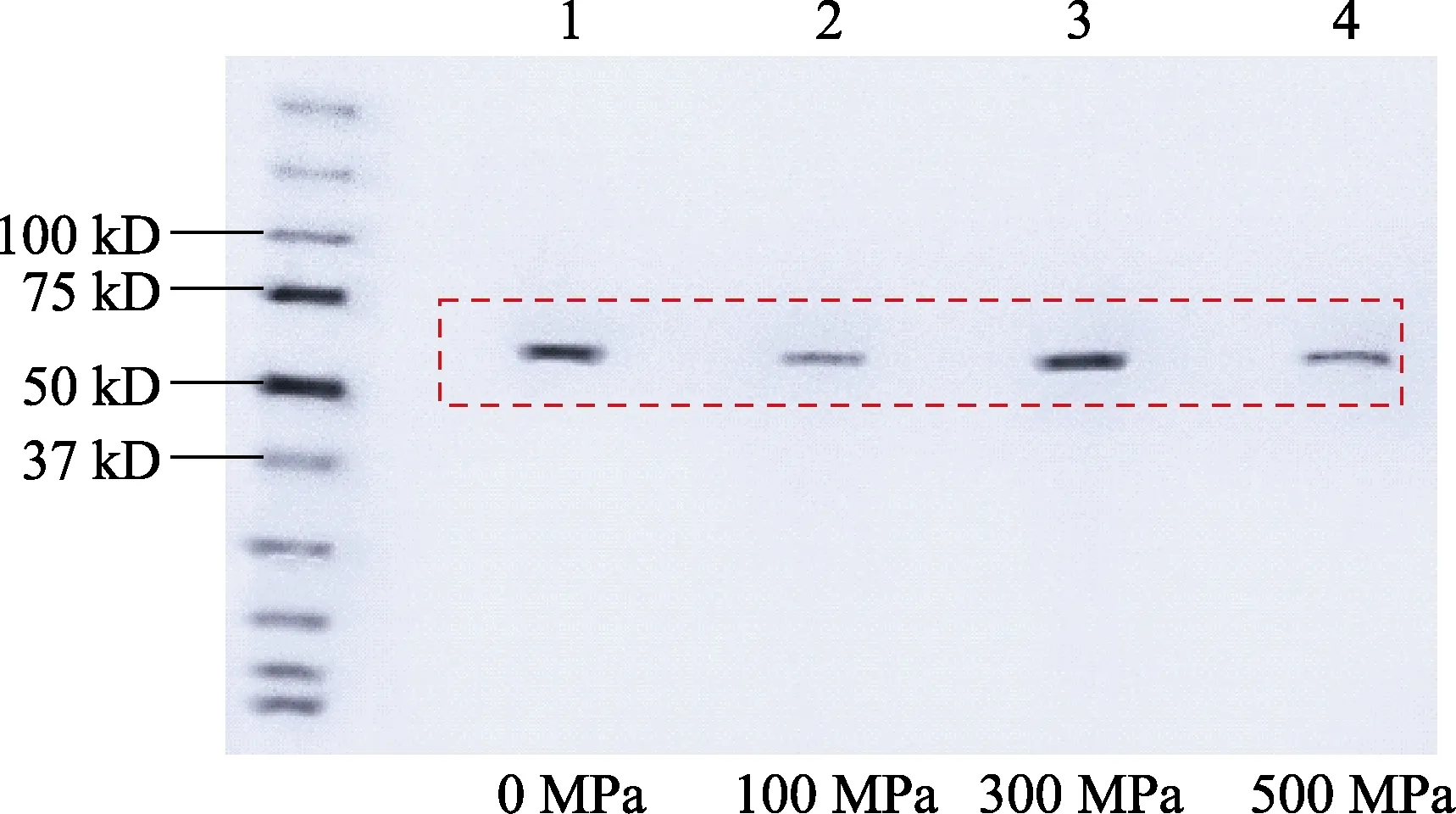
图1 RsbT 蛋白激酶纯化结果Fig.1 Purification results of RsbT protein kinase
2.2 超高压处理对RsbT 蛋白激酶空间结构的影响
常见的超高压处理压力在100~600 MPa 之间,而由于设备维护、设备保养等条件限制最高处理压力限制在550 MPa。根据前期报道,300 MPa压力为杀死绝大多数革兰氏阴性弧菌属细菌的最佳条件[11-12]。故本实验选择选取100、300、500 MPa三个压力点对RsbT 蛋白激酶进行超高压处理。
在蛋白质分子中,肽链可形成α-螺旋、β-折叠、β-转角、无规则卷曲等特定的二级结构。蛋白质的肽键在紫外185~240 nm 波段处有光吸收,因此蛋白质在这一波长范围内有圆二色性,不同蛋白质所表现的椭圆值波长的变化曲线(圆二色谱)不同。蛋白质的圆二色谱是其含有所有二级结构的圆二色谱的代数加和曲线,因此用紫外185~240 nm 波段的圆二色谱可研究蛋白质中所有二级结构的含量。圆二色谱可有效反应蛋白质中的二级结构变化,不同浓度的蛋白质圆二色谱峰值也不同。
为较好观察圆二色谱,需将椭圆值峰值控制在–20~0(10–3cm2/分克分子)范围内。图1 为三种稀释倍数的RsbT 蛋白激酶圆二色谱。三条曲线的波峰基本处在同一波长值,且在该稀释倍数范围内,波峰值与浓度成正相关。在195 nm 波长吸收段左右,RsbT 蛋白激酶的圆二色谱明显超过仪器测量限制,为绘制三个压力处理后的RsbT蛋白激酶圆二色谱提供一定的参考。
由图2 得,压力处理对RsbT 蛋白激酶空间结构影响较大。从峰形变化来看,每个峰的形状能够反映相应波长下二级结构种类。100 MPa 处理后的峰形与原始蛋白几乎一样,说明100 MPa 尚不能够有效改变二级结构,而300、500 Mpa 处理后的峰形与原始蛋白差别显著,说明300 MPa 以上能够有效使得RsbT 蛋白激酶二级结构发生明显变化。从峰值变化方面,峰值大小代表二级结构的累加。相同浓度下,峰值大小:原始蛋白>100 MPa>300 MPa>500 MPa。表明压力越大,RsbT蛋白激酶二级结构破坏程度越大。经500 MPa 处理的RsbT 蛋白激酶几乎无圆二色谱吸收峰,表明500 MPa 处理几乎破坏RsbT 蛋白激酶所有二级结构。
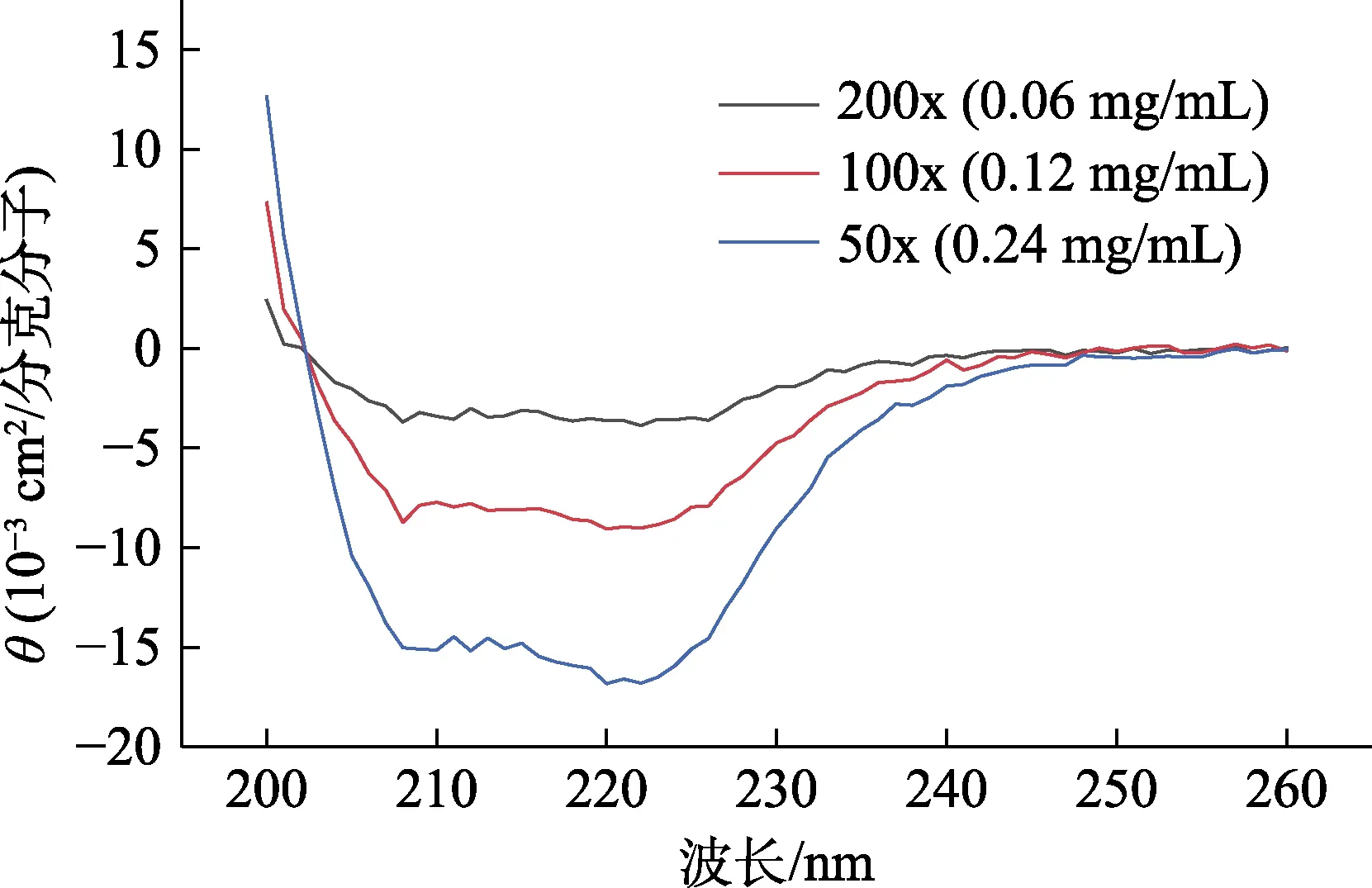
图2 RsbT 蛋白激酶三种稀释倍数下的圆二色谱Fig.2 Circular dichroism of RsbT protein kinase in three dilutions
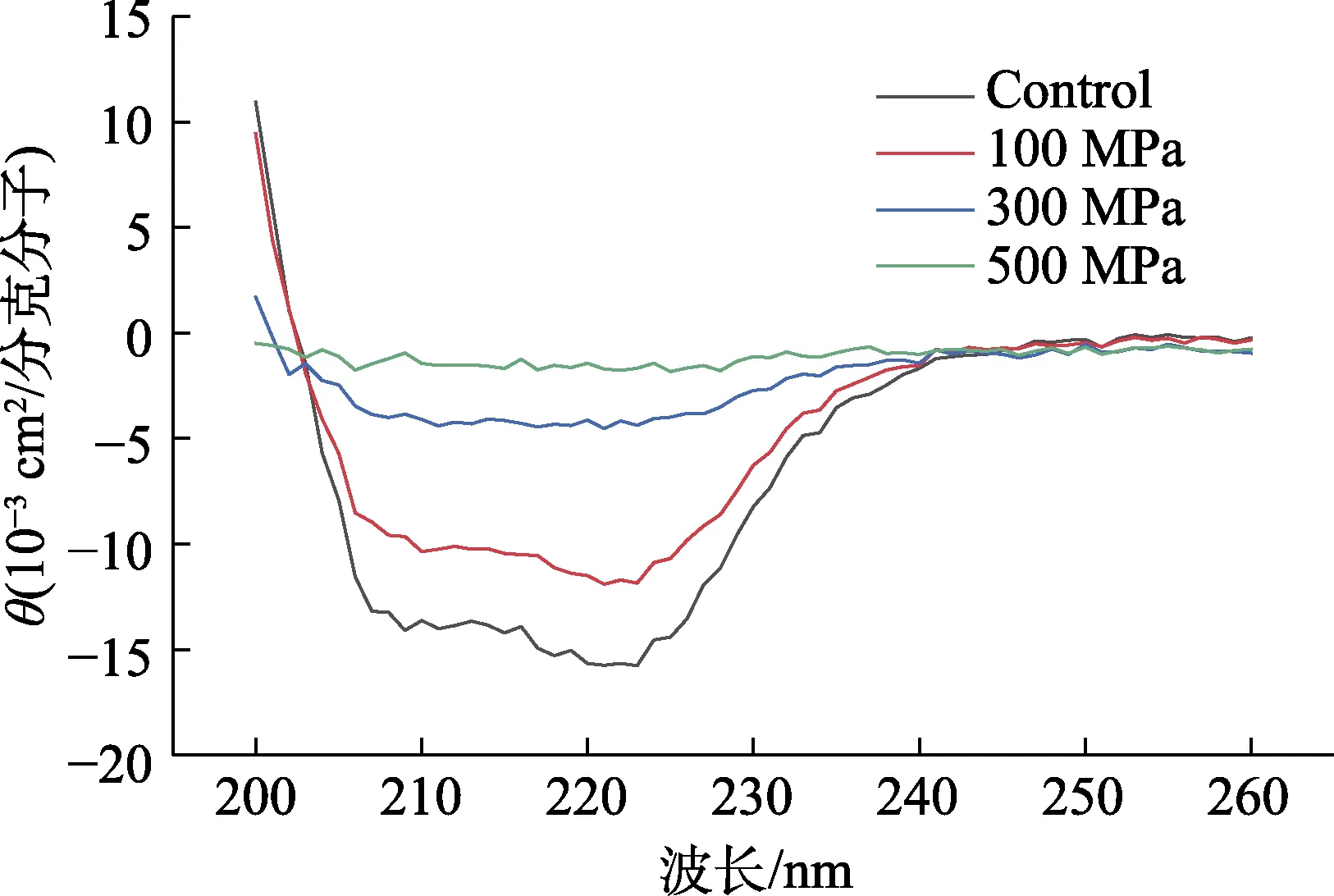
图3 梯度压力处理RsbT 蛋白激酶下的圆二色谱Fig.3 Circular dichroism of RsbT protein kinase under gradient pressure treatment
2.3 超高压处理对RsbT 蛋白激酶自磷酸化的影响
蛋白激酶的磷酸化能力是判断这种蛋白激酶的活性的直接参考依据。通过RsbT 蛋白激酶与ATP-γ-S 进行磷酸化反应,使用EDTA 控制反应时间,采用Western-Blot 进行蛋白印迹,并且用化学试剂进行化学发光检测,研究RsbT 蛋白激酶自磷酸化程度影响。
图4-A,RsbT 蛋白激酶利用ATP-γ-S 磷酸化反应0 min 与30 min 后,灰度峰面积排序均为Original>100 MPa>300 MPa>500 MPa。对照组(以等量的双蒸水代替ATP-γ-S)亮度与500 MPa 处理后亮度几乎一致。进行灰度分析,获得RsbT蛋白激酶利用ATP-γ-S 磷酸化反应0 min 与30 min后的灰度峰面积。
图4-B,超高压处理对RsbT 蛋白激酶自磷酸化能力存在影响,且压力越大,RsbT 蛋白激酶磷酸化能力越弱。此外,在反应30 min 后的灰度峰面积中,100 MPa 与300 MPa 之间存在显著下降,猜测100~300 MPa 范围内存在一个更小梯度压力范围能够明显抑制RsbT 蛋白激酶的活性,从而抑制弧菌属细菌胞内信息调控中心下游信号转导。
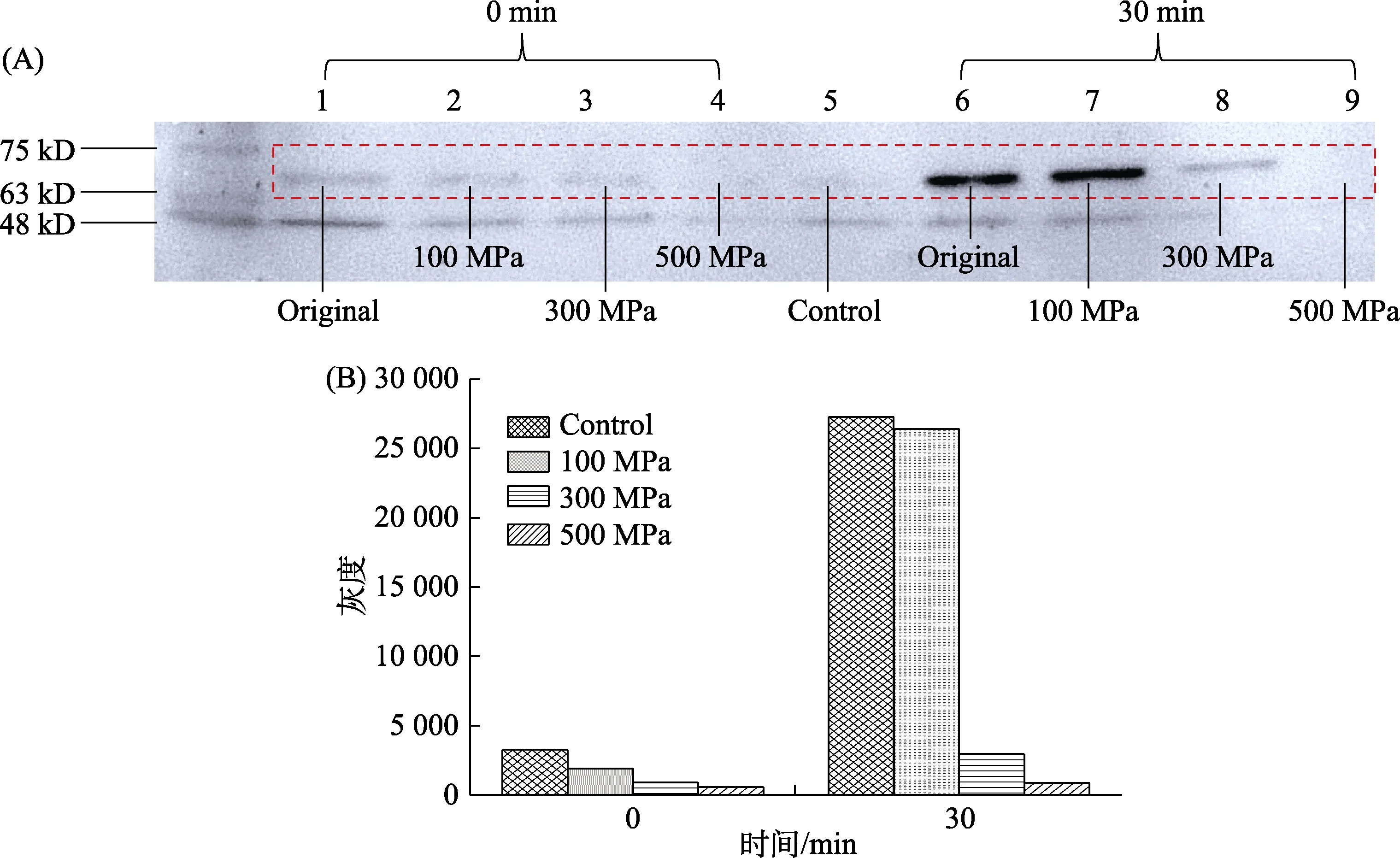
图4 梯度压力处理RsbT 蛋白激酶免疫印迹30 min 灰度分析Fig.4 The grayscale analysis of 30mins western blotting images of RsbT protein kinase under gradient pressure treatment
为更加深入了解到100、300、500 MPa 三个压力对RsbT 蛋白激酶磷酸化的影响程度,进行RsbT 蛋白激酶利用ATP-γ-S 磷酸化反应的时间(1、2、5、10、15、30、60 min)的磷酸化动力学研究。图5 中,对比未经处理(Original)与100 MPa 压力处理后的免疫印迹电泳图像,结合灰度分析发现100 MPa 处理后的蛋白表现出明显的自磷酸化程度时间依赖性。其免疫印迹灰度峰面积略低于未经处理的原始蛋白,说明100 MPa 能够部分抑制RsbT 蛋白激酶磷酸化能力,但RsbT 蛋白激酶仍具有较好的自磷酸化活性。
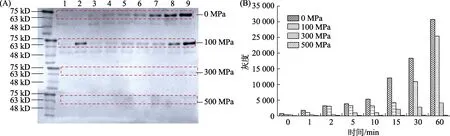
图5 梯度压力处理RsbT 蛋白激酶免疫印迹灰度分析Fig.5 The grayscale analysis of western blotting images of RsbT protein kinase under gradient pressure treatment
对比未处理(Original)与300 MPa 压力处理的图像,300 MPa 处理后的蛋白也呈现一定磷酸化程度时间依赖性,但是其自磷酸化活性已经基本消失。经500 MPa 压力处理后,RsbT 蛋白激酶利用ATP-γ-S 磷酸化反应后的化学发光程度低于软件可识别阈值。综上分析,300 MPa 以上压力能够使得RsbT 蛋白激酶完全失去自磷酸化活性,100 MPa 与300 MPa 之间应存在更小的压力区间,使得RsbT 蛋白激酶失活。
3 结论
细菌的致病力与耐受环境条件的胁迫息息相关。致病性弧菌属细菌受到外界胁迫后,压力分子蛋白感应并通过可逆磷酸化的方式传递胁迫信号。以100、300、500 MPa 静水压分别对RsbT蛋白保压5 min,可见超高压对RsbT 蛋白激酶的空间结构和自磷酸化能力均有显著影响,且二级结构破坏程度与自磷酸化能力降低程度相吻合。在空间结构方面,压力越大,RsbT 蛋白激酶二级结构破坏程度越大。使用300 MPa 及以上压力处理时,二级结构完全被破坏。在自磷酸化方面,100 MPa 压力能够部分抑制RsbT 蛋白激酶磷酸化能力。300、500 MPa 压力能够使得RsbT 蛋白激酶完全丧失磷酸化能力。本研究可得出,300 MPa及以上静水压保压时间5 min 处理RsbT 蛋白激酶,能够完全破坏RsbT 蛋白激酶空间结构,使之完全丧失自磷酸化活性,从而抑制弧菌属细菌胞内信息调控中心下游信号转导。
随着我国基础建设的不断发展,海鲜产品的销售范围扩大,其中食用贝类更是受到了沿海地区消费者的青睐。超高压技术在我国水产品工业中高速发展,目前已应用于脱壳、杀菌等领域。但是目前我国超高压杀菌技术,尤其是革兰氏阴性菌方面的理论基础相对薄弱,阻碍了这项技术在国内的进一步发展。本实验创新式地从结构变化和自磷酸化效用两个角度探究了超高压对弧菌属细菌信号传递中心RsbT 蛋白激酶的影响,并阐明了构效关系。为进一步研究弧菌属细菌相应超高压胁迫的信息通路以及杀菌的有效压力范围提供理论依据。
