微囊藻毒素-LR慢性暴露对水雍菜光合生理的影响
2021-09-10陈国元廖腾芳李青松
陈国元,廖腾芳,李青松
(厦门理工学院 环境科学与工程学院, 福建 厦门 361024)
近几十年来,水体富营养化已成为全球主要的环境问题之一。但从资源的角度看,富营养化水体也是一种不可多得的农业资源。如何在有效治理水体富营养化的同时,合理利用这些富营养化水体资源进行农业生产,是迫切需要研究解决的问题。水生植物不仅可以吸收水中的氮和磷,抑制藻类生长[1-2],还可以提高水体的自净能力,种植水生植物可以作为富营养化水体修复的主要生物调控措施[3]。水生蔬菜是水生植物的重要组成部分,其可以通过采摘避免茎叶腐烂,从而有效降低水体中的营养盐。已有研究证明,种植水生蔬菜不仅对富营养化水体中的氮、磷具有良好的去除效果[4],同时部分水生蔬菜体内含有的大量抑藻活性物质,可以对有害藻类产生化感抑制[5-6]。另外,水生蔬菜作为食材具有很高的营养价值和可观的经济价值。因此,在富营养化水体中种植水生蔬菜可以实现从单纯的治理污水变为利用污水。但是水体富营养化过程中往往伴随着藻类水华,其中以微囊藻水华发生频率最高[7]。水华微囊藻中的优势种类通常具有产毒能力[8],因此微囊藻毒素(MCs)在富营养化水体中最为常见[9]。目前,已经鉴定出100多种MCs异构体[10],其中LR型(MC-LR)是一种毒性较强,且广泛分布于自然水体中的变体类型[11-12]。水体中存在的MC-LR可诱导植物形态、生理生化反应发生改变,具体表现为植株鲜质量、叶片长度、叶面积、根系长度、根系活力、氮代谢及抗氧化系统等方面的变化[13-14]。目前,自然水体中检测到的溶解态MC-LR质量浓度大部分低于30 μg/L[9,11-12]。大量研究表明,MC-LR对植物的影响(促进、抑制或无显著影响)与其暴露的质量浓度、时间及植物种类密切相关[14-17]。因此,在富营养化水体中种植水生蔬菜,必需了解其在相应质量浓度MCs慢性暴露情况下的生长及生理变化,才能确定其是否适合在含有MCs的富营养化水体中生长。光合作用是植物生长发育的基础,也是植物生长发育的关键驱动力[18]。研究植物光合作用与环境因子的关系,有助于了解植物在外界胁迫下的生长机制。因此,研究环境相关质量浓度MCs暴露条件下水生蔬菜的光合生理特性,可以揭示水生蔬菜在生理、形态及生物化学方面对MCs胁迫的响应,对于富营养化水体中水生蔬菜的种植具有重要指导意义。
水雍菜(Ipomoeaaquatica)为旋花科番薯属一年或多年蔓生草本植物,其茎叶含有丰富的营养物质,既可食用又有一定的药用功效。水雍菜经济价值高,适应性强,栽培范围广泛。已有研究表明,水雍菜浮床具有很好的氮磷去除效果,并具有很好的水质改善效果[19-20]。因此,水雍菜可以作为富营养化水体植物修复的候选水生蔬菜品种,但尚未见其在MC-LR暴露条件下光合生理响应的有关研究报道。为此,本试验研究环境相关质量浓度(0~30 μg/L)MC-LR暴露对水雍菜光合生理特性的影响,以期揭示MC-LR对水雍菜光合反应系统的影响机制,为富营养化水体中水雍菜的种植提供理论指导。
1 材料与方法
1.1 试验材料
水雍菜苗购至湖南佳禾特菜果蔬有限公司,分别选择株高(约15 cm)一致、生长良好的水雍菜苗,自来水冲洗干净后再用蒸馏水清洗,最后将其在山崎牌通用型无土栽培蔬菜营养液(上海芽芽绿化有限公司产品)中预培养1周,选取生长良好的植株用于后续试验。MC-LR(Calbiochem,德国),纯度≥95%,购于上海恒远生物科技有限公司。
1.2 试验方法
培养液的配制:根据产品说明,先将山崎牌通用型无土栽培蔬菜营养液按照1∶300稀释,然后分别添加MC-LR溶液,使MC-LR质量浓度分别为0,1,10和30 μg/L。
试验设计:将生长良好的水雍菜苗植入一系列内装200 mL含不同质量浓度MC-LR培养液的250 mL广口锥形瓶内,锥形瓶底层铺有厚度5 cm、粒径4 mm的玻璃珠,加入对植物生长无显著影响的微生物抑制剂C16H18NaN3O4S(MERCK)100 mg/L。以MC-LR质量浓度为0 μg/L的培养组为对照组。每个锥形瓶内植入1株水雍菜苗,对照组及每个处理组均设置3个平行试验。试验于MGC-450BPY-2智能型光照培养箱中进行,条件为:恒温光照((25±1) ℃,3 000 lx),12 L/12 D。为防止烂根,每天上午09:00和下午16:00各曝气2 h,每3 d换1次培养液。培养30 d后原位测定叶片叶绿素SPAD值及叶绿素荧光参数,并采样测定叶片中H2O2含量及1,5-二磷酸核酮糖羧化酶(Rubisco)、Rubisco活化酶(RCA)的活性。
1.3 测定方法
1.3.1 叶绿素SPAD值及叶绿素荧光参数的测定 选取水雍菜苗顶部完全展开的叶片,使用SPAD-502叶绿素仪(日本柯尼卡美能达公司)测定叶绿素SPAD值。叶绿素荧光参数使用Yaxin-1161G叶绿素荧光仪(北京雅欣理仪科技有限公司)测定。测量前将叶片用黑色不透明塑料袋包裹,暗适应处理20 min后采用脉冲瞬态荧光动力学模式测量,参数设置为:饱和脉冲强度3 000 μmol/(m2·s),光化光强度1 000 μmol/(m2·s),测量总时长100 s,远红光时长10 s,测量完毕直接在荧光仪上读出光系统Ⅱ(PSⅡ)最大量子产量(Fv/Fm)、PSⅡ有效量子产量(ΦPSⅡ)、光化学淬灭系数(qP)和非光化学淬灭系数(qN)。
1.3.2 H2O2含量的测定 叶片经去离子水洗涤3次后,用吸水纸吸干剪碎。称取0.1 g叶片组织,加入2 mL 0.05 mol/L磷酸缓冲液(pH 7.0),4 ℃下研磨成浆,过滤后6 000g离心25 min,得上清液[21],然后采用植物过氧化氢(H2O2)酶联免疫分析试剂盒(上海恒远生物科技有限公司),在SpectraMax M2多功能酶标仪(美国Molecular Devices公司)上测定H2O2含量,检测范围为40~1 600 μg/L。
1.3.3 Rubisco和RCA活性的测定 称取0.2 g叶片组织,加入5 mL预冷到4 ℃的提取缓冲液 (100 mmol/L Tris-HCl(pH 7.8),20 mmol/L KCl和1 mmol/L EDTA),20 000g离心15 min,上清液即为粗酶液[22],然后用植物Rubp羧化酶(Rubisco)酶联免疫分析试剂盒(上海恒远生物科技有限公司)测定Rubisco活性,检测范围为12~400 IU/L。
称取0.2 g 叶片组织,加入 600 μL预冷到4 ℃的提取缓冲液(50 mmol/L Tricine缓冲液(pH 7.0),100 mmol/L MgCl2,10 mmol/L NaHCO3,1 mmol/L EDTA,1 mmol/L ATP,10 mmol/L DTT,1 mmol/L PMSF,2 mmol/L Benzamide,0.01 mmol/L Leupeptin),20 000g离心20 min,上清液即为粗酶液[23],然后用植物Rubisco活化酶(RCA)酶联免疫分析试剂盒(上海恒远生物科技有限公司)测定RCA活性,检测范围为1~40 U/L。
1.4 数据统计与处理
运用SPSS 10.0软件及Sigmaplot 10.0软件对试验数据进行统计分析和作图。首先利用ANOVA分析不同处理对水雍菜叶片光合系统各项指标的影响,然后采用最小显著性差异法(LSD)比较不同处理的差异显著性(P<0.05)。
2 结果与分析
2.1 低质量浓度MC-LR慢性暴露对水雍菜叶片叶绿素SPAD值及H2O2含量的影响
由图1可知,1 μg/L MC-LR处理组中水雍菜叶片的叶绿素SPAD值较对照组上升了2.21%,10 μg/L MC-LR处理组中叶片的叶绿素SPAD值较对照组降低了5.63%,但二者均与对照组差异不显著(P>0.05),而30 μg/L MC-LR处理组中叶片的叶绿素SPAD值较对照降低了16.55%,与对照存在显著差异(P<0.05)。
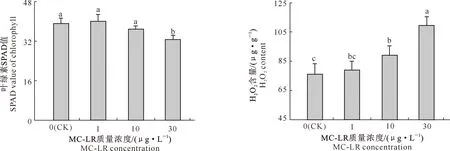
图柱上标不同小写字母表示不同处理间差异显著(P<0.05)。下同Different lowercase letters indicate significant difference among different treatments (P<0.05). The same below图1 MC-LR慢性暴露条件下水雍菜叶片的叶绿素SPAD值及H2O2含量的变化Fig.1 Chlorophyll SPAD value and H2O2 content in leaves of Ipomoea aquatica after chronic exposure to MC-LR
由图1还可知,1 μg/L MC-LR处理组中水雍菜叶片的H2O2含量较对照组上升了3.72%,但与对照组差异不显著(P>0.05);10 和30 μg/L MC-LR处理组中叶片的H2O2含量较对照组分别上升了17.13%和43.80%,且与对照组的差异均达到了显著水平(P<0.05)。
2.2 低质量浓度MC-LR慢性暴露对水雍菜叶片叶绿素荧光参数的影响
叶绿素荧光参数的变化与光合作用过程密切相关。由图2可知,1和10 μg/L MC-LR处理组中水雍菜叶片的叶绿素光系统Ⅱ(PSⅡ)最大量子产量(Fv/Fm)值较对照组分别上升了2.61%和降低了5.22%,但与对照组差异均不显著(P>0.05),而30 μg/L MC-LR处理组中水雍菜叶片的Fv/Fm值较对照组降低了16.53%,差异达到了显著水平(P<0.05)。PSⅡ有效量子产量(ΦPSⅡ)的变化趋势与Fv/Fm类似,具体表现为,1和10 μg/L MC-LR处理组中水雍菜叶片的ΦPSⅡ值较对照组分别上升了2.05%和降低了7.13%,但与对照组差异均不显著(P>0.05),而30 μg/L MC-LR处理组中叶片的ΦPSⅡ值较对照组显著降低了21.93%(P<0.05)。
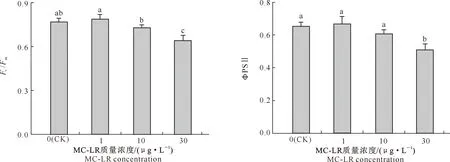
图2 MC-LR慢性暴露条件下水雍菜叶片Fv/Fm和ΦPSⅡ的变化Fig.2 Fv/Fm and ΦPSⅡ in leaves of Ipomoea aquatica after chronic exposure to MC-LR
由图3可知,1 μg/L MC-LR处理组中水雍菜叶片的qP值较对照组上升了3.15%,但与对照组差异不显著(P>0.05);10 和30 μg/L MC-LR处理组中叶片的qP值较对照组分别下降了12.04%和27.23%,且与对照组差异均达到了显著水平(P<0.05)。
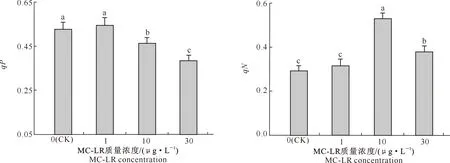
图3 MC-LR慢性暴露条件下水雍菜叶片qP和qN的变化Fig.3 qP and qN in leaves of Ipomoea aquatica after chronic exposure to MC-LR
由图3还可知,1 μg/L MC-LR处理组中水雍菜叶片的qN值较对照组上升了7.98%,但与对照组差异不显著(P>0.05);10和30 μg/L MC-LR处理组叶片的qN值较对照组分别上升了80.70%和29.56%,且二者与对照组差异均达到了显著水平(P<0.05);30 μg/L MC-LR处理组叶片的qN值较10 μg/L处理组下降28.30%,且二者之间存在显著差异(P<0.05)。
2.3 低质量浓度MC-LR慢性暴露对水雍菜叶片Rubisco和RCA活性的影响
由图4可知,1 μg/L MC-LR处理组中水雍菜叶片的Rubisco活性较对照组上升了2.97%,但与对照组差异不显著(P>0.05),10和30 μg/L MC-LR处理组中水雍菜叶片的Rubisco活性较对照组均显著降低(P<0.05),降幅分别为17.62%和35.25%。1 μg/L MC-LR处理组中水雍菜叶片的RCA活性较对照组上升了3.88%,但与对照组差异并不显著(P>0.05),而10和30 μg/L MC-LR处理组中叶片的RCA活性分别较对照组显著降低了14.35%和32.04%(P<0.05)。
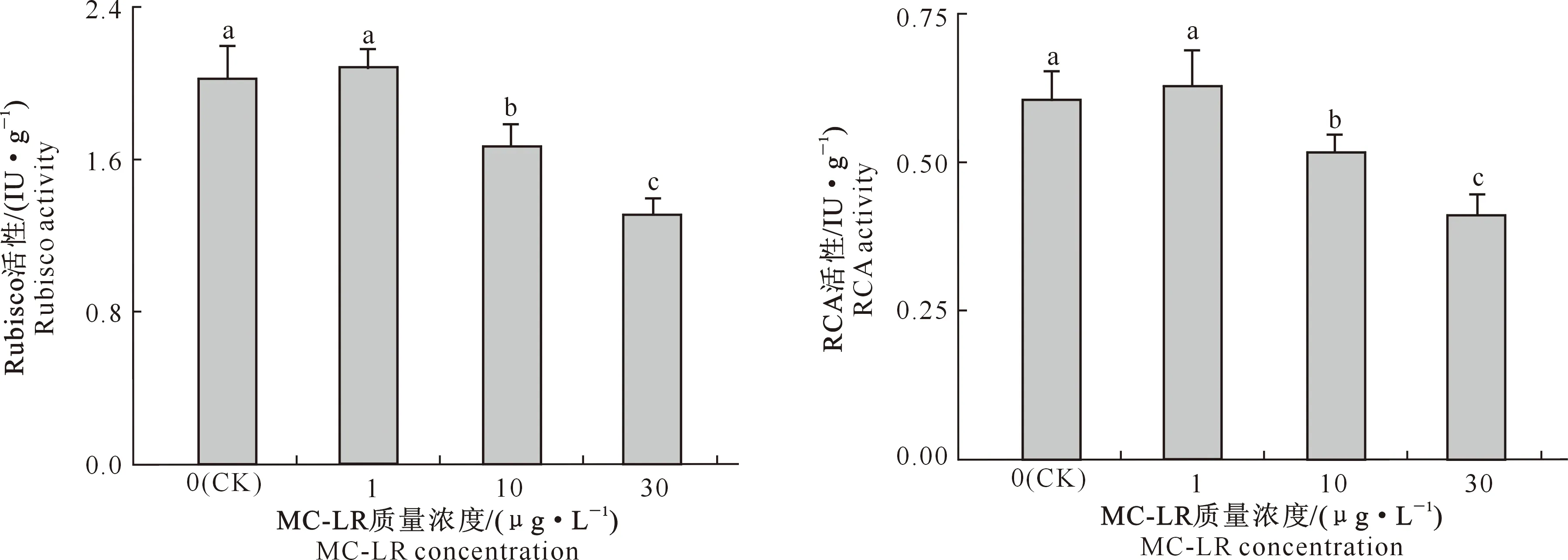
图4 MC-LR慢性暴露条件下水雍菜叶片Rubisco和RCA活性的变化Fig.4 Rubisco and RCA activities in leaves of Ipomoea aquatica after chronic exposure to MC-LR
3 讨 论
3.1 低质量浓度MC-LR慢性暴露对水雍菜叶片叶绿素含量的影响
植物叶绿素能够捕获光能并将其转化为化学能,是植物光合作用的主要物质基础,其含量是衡量植物光合能力的关键参数,也是衡量植物对逆境胁迫适应性的一个重要指标[24-25]。叶片叶绿素SPAD值与叶绿素含量之间存在极显著的正相关性,其可以表征叶片中叶绿素的相对含量[26-28]。本研究中,30 μg/L MC-LR处理组水雍菜叶片的叶绿素SPAD值显著低于对照组(P<0.05),说明30 μg/L MC-LR慢性暴露30 d后可以显著降低水雍菜叶片的叶绿素含量。已有研究指出,植物体内的叶绿素含量处于叶绿素合成与降解的动态平衡中[29],而植物体内叶绿素的合成是一个非常复杂的过程,容易受到外界不良环境条件的影响[30]。植物在受到外界环境胁迫时,其体内会产生过量的活性氧(ROS),从而促进叶绿素降解[31]。大量研究表明,一定水平的MC-LR暴露会诱导植物产生氧化应激反应,导致其体内产生大量ROS[14,32],H2O2即是植物体内主要的ROS之一。本研究发现,30 μg/L MC-LR处理组水雍菜叶片的H2O2含量较对照组上升了43.80%,表明30 μg/L MC-LR慢性暴露引起了水雍菜严重的氧化应激反应,从而破坏了叶绿素合成与降解的动态平衡,叶绿素降解速率高于合成速率,导致叶片叶绿素含量显著下降。
3.2 低质量浓度MC-LR慢性暴露对水雍菜叶片光合荧光参数的影响
叶绿素光合荧光参数可以反映光合过程中光能的吸收和转化、能量的传递与分配及光系统Ⅱ(PSⅡ)反应中心的活性情况等[33-34]。光合荧光参数对环境胁迫非常敏感,可以用其变化来评估植物的光合生理状态[35]。在植物的光合荧光参数中,Fv/Fm表示PSⅡ反应中心处于开放状态时的最大光化学效率,可以用于评估PSⅡ的最大光能转化效率。Fv/Fm值是研究外界环境因子对植物光合作用影响的重要指标,植物在受到外界胁迫时,Fv/Fm变化幅度很大,因此很多学者以Fv/Fm来评估植物的光合活性[16,36]。本研究表明,MC-LR对水雍菜叶片Fv/Fm的影响具有剂量效应,这与时玥等[37]、王余等[38]的研究结果一致。时玥等[37]研究表明,1和10 μg/L MC-LR暴露21 d对水稻叶片的Fv/Fm值无显著影响,而500 μg/L MC-LR暴露会导致水稻叶片的Fv/Fm极显著下降;王余等[38]研究表明,1 μg/L MC-LR暴露7 d对水稻叶片的Fv/Fm无显著影响,而100 μg/L MC-LR暴露会导致水稻叶片的Fv/Fm显著下降。但Machado等[16]的研究却表明,微囊藻提取液(内含10和50 μg/L MC-LR)作用14 d,野胡萝卜(Daucuscarota)叶片的Fv/Fm显著上升;作用28 d,10 μg/L MC-LR处理组叶片的Fv/Fm仍然显著高于对照组,而50 μg/L MC-LR处理组叶片的Fv/Fm与对照组无显著性差异。Corbel等[39]研究表明,蓝藻提取液(内含5~100 μg/L MC-LR)灌溉培养90 d后,番茄叶片的Fv/Fm未出现显著变化。以上结果说明,MC-LR对植物的影响与暴露剂量、暴露时间及植物种类有关。有研究表明,当植物受到环境胁迫而PSⅡ反应中心受到损伤时,Fv/Fm会显著下降[40],其值降低是植物受抑制的特征之一[41]。因此,30 μg/L MC-LR慢性胁迫对水雍菜叶片的PSⅡ反应中心造成了一定损伤,PSⅡ活性下降,导致其光能转化效率降低,从而导致水雍菜的生长受到抑制。
ΦPSⅡ表示PSⅡ反应中心部分关闭情况下的实际光化学效率,可以评估PSⅡ天线系统吸收的能量用于光合作用的比例。PSⅡ反应中心的实际光化学效率是植物光合作用的关键限制因子,ΦPSⅡ值越高表明PSⅡ的光合效率越高[42]。本研究表明,30 μg/L MC-LR处理组水雍菜叶片的ΦPSⅡ显著降低,表明30 μg/L MC-LR胁迫对水雍菜的实际光化学效率有显著抑制作用,限制了水雍菜光合机构将所捕获的光能以更高的速度和效率转化为化学能,阻碍了为碳同化提供充足能量,从而限制了光合效率。
植物生长过程中,叶片叶绿素吸收的光能可以通过光合电子传递、叶绿素荧光发射和热耗散3种途径来消耗[24]。在光合荧光参数中,光化学淬灭系数qP反映了PSⅡ开放反应中心所占的比例,即将PSⅡ天线色素捕获的光子能量用于光化学电子传递的份额;非光化学淬灭参数qN是指天线色素吸收的光能中不能用于电子传递而以热的形式耗散掉的光能部分[43]。当积累在PSⅡ反应中心的光能过剩时,植物会通过提高qN及时耗散能量,热耗散是植物保护PSⅡ而抵抗逆境的重要机制[44]。本研究表明,与对照相比,10 μg/L MC-LR处理组水雍菜叶片的qP值显著下降,qN值显著上升,说明在10 μg/L MC-LR胁迫下,水雍菜PSⅡ开放反应中心所占比例和参与CO2固定的电子数减少,叶片光合过程中的光化学淬灭受到一定程度的抑制,水雍菜PSⅡ将吸收过剩的能量通过热耗散的形式进行释放,以保护自身组织免受过剩光能的损害。30 μg/L MC-LR处理组水雍菜叶片的qP和qN值均显著低于10 μg/L MC-LR处理组,说明在30 μg/L MC-LR胁迫下,水雍菜叶片光合机构损伤严重,叶片中参与光化学反应的能量显著降低,同时其热耗散能力减弱。
3.3 低质量浓度MC-LR慢性暴露对水雍菜叶片光合酶活性的影响
Rubisco是光合作用的关键酶,其活性影响植物的光合能力,并决定植物的光合速率[45]。有研究表明,Rubisco蛋白占植物叶片中溶解性蛋白(SP)的30%以上,SP含量与Rubisco蛋白含量及其活性之间有密切关系[46]。MC-LR暴露对植物叶片氮循环及蛋白质含量有显著影响[13,32]。Jiang等[32]研究发现,1~10 μg/L MC-LR作用14 d后苦草叶片的SP含量下降。Chen等[13]研究发现,9.9~29.8 μg/L MC-LR作用30 d后,菖蒲幼苗叶片的氮代谢受到抑制,SP含量显著降低,MC-LR质量浓度越高,抑制程度越严重。大量研究表明,植物叶片中的叶绿素含量与蛋白质含量呈显著正相关[27-28]。因此30 μg/L MC-LR处理组水雍菜叶片叶绿素含量的显著降低也表明了其蛋白含量有所下降,从而减弱了叶片的Rubisco活性。另外,Rubisco活性不仅受Rubisco蛋白含量的影响,而且与Rubisco活化状态密切相关。而Rubisco活化状态受到RCA活性的影响。RCA是一种叶绿体酶,通过碳同化反应参与Rubisco的分离和活化[47]。RCA通过构象变化去除Rubisco活性位点紧密结合的抑制剂,从而保持分子在光合作用期间的活性[48]。Scales等[49]研究表明,氧化还原状态是影响RCA活性的因素之一。Kumar等[50]研究发现,小麦体内的总抗氧化能力与叶片RCA活性呈显著正相关。本研究中,10和30 μg/L MC-LR处理组水雍菜叶片的H2O2含量显著上升,说明水雍菜处于一定程度的氧化胁迫中,RCA活性受到抑制,从而导致Rubisco活性下降。
综上所述,在本试验设置的质量浓度范围内,MC-LR慢性暴露30 d后对水雍菜叶片光合生理特性的影响呈现出明显的剂量效应。具体表现为,1 μg/L MC-LR对水雍菜叶片叶绿素荧光参数及Rubisco、RCA活性均无显著影响;10 μg/L MC-LR对水雍菜产生了一定程度的氧化胁迫,H2O2含量升高,水雍菜通过提高热耗散能力来保护其光合系统,但是Rubisco和RCA受到抑制,其活性显著下降;30 μg/L MC-LR对水雍菜产生了严重的氧化胁迫,H2O2含量显著上升,而叶片光合系统对光能的吸收和转化、能量的传递与分配及PSⅡ反应中心的活性和光合酶活性都受到严重抑制。
