红螯螯虾卵黄蛋白原VWD结构域的原核表达及纯化
2021-09-08文露婷许艺兰童桂香黄黎明杨彦豪杜雪松黄光华韦信贤王瑞杨慧赞
文露婷 许艺兰 童桂香 黄黎明 杨彦豪 杜雪松 黄光华 韦信贤 王瑞 杨慧赞

摘要:【目的】原核表達红螯螯虾(Cherax quadricarinatus)卵黄蛋白原(Vg)VWD结构域,为深入开展Vg的生物学功能研究和开发相应的生物活性物质提供技术支持,也为改进虾类养殖催熟及获取高质量后代打下基础。【方法】在GenBank中搜索红螯螯虾卵Vg的mRNA序列(AF306784.1)及查找其VWD结构域(2345~2491 aa),采用ExPASy ProtParam、ProtScale、InterProscan及TMHMM等在线软件进行生物信息学分析及理论评估,结合大肠杆菌密码子偏好优化原始VWD氨基酸序列;然后通过全基因合成获得目的基因,连接至载体pET-28a构建重组质粒pET-28a-VWD,挑取阳性克隆转化大肠杆菌BL21(λDE3)感受态细胞及采用IPTG进行诱导表达,并以10% SDS-PAGE电泳和Wes-tern blotting检测诱导表达的融合蛋白。【结果】红螯螯虾VWD结构域相对分子量为19692.11 Da,理论等电点(pI)为9.35,分子式为C855H1334N258O261S9,属于不稳定的亲水性蛋白,不含跨膜结构域。延伸链和无规则卷曲是红螯螯虾VWD结构域二级结构的主要元件,其中,α-螺旋占7.73%,β-转角占10.50%,延伸链占35.91%,无规则卷曲占45.86%。重组质粒pET-28a-VWD经大肠杆菌BL21(λDE3)感受态细胞诱导表达即获得融合蛋白VWD,以2 mol/L盐酸胍溶解和Ni-NTA亲和层析纯化及复性后,10% SDS-PAGE电泳和Western blotting检测均在蛋白相对分子量约20.0 kD处出现1条清晰的特异性条带,融合蛋白VWD表达形式以包涵体为主。融合蛋白VWD在BL21(λDE3)感受态细胞中高效表达的最佳诱导条件:当单克隆菌液OD600 nm达0.6时添加0.5 mmol/L IPTG,置于20 ℃下诱导培养16 h。纯化后的融合蛋白VWD浓度为1.32 mg/mL。【结论】通过全基因合成获得的优化红螯螯虾VWD基因能在大肠杆菌BL21(λDE3)感受态细胞中诱导表达出以包涵体为主要形式的融合蛋白,经盐酸胍溶解和Ni-NTA亲和层析柱纯化及复性即可获得高纯度的活性VWD蛋白,为后续开展红螯螯虾Vg生物学功能研究及开发相应的生物活性物质提供技术支持。
关键词: 红螯螯虾;卵黄蛋白原(Vg);VWD结构域;全基因合成;原核表达;包涵体
中图分类号: S966.12 文献标志码: A 文章编号:2095-1191(2021)05-1378-09
Abstract:【Objective】Prokaryotic expression of the vitellogenin(Vg) VWD domain of red claw crayfish(Cherax quadricarinatus) not only provided technical support for further research on the biological function of Vg and the development of corresponding bioactive substances, but also laid foundation for improving C. quadricarinatus culture, accelera-ting ripening and obtaining high-quality offspring. 【Method】The protein sequence of VWD domain(2345-2491 aa) was found according to the Vg mRNA sequence(accession number:AF306784.1) of C. quadricarinatus published in GenBank database. Bioinformatics analysis and theoretical evaluation were carried out by using online softwares such as ExPASyProtParam, ProtScale, InterProscan and TMHMM. Optimization of original VWD amino acid sequence combined with codon preference of Escherichia coli. Then the target gene was obtained by whole gene synthesis,and the recombinant plasmid E. coli pET-28a-VWD was constructed by connecting to vector pET-28a,and transformed into positive clone conversion BL21(λDE3) competent cells which were induced by IPTG. The induced fusion protein was detected by 10% SDS-PAGE electrophoresis and Western blotting.【Result】The relative molecular weight of VWD domain of C. quadricarinatus was 19692.11 Da, theoretical isoelectric points(pI)was 9.35, and the molecular formula was C855H1334N258O261S9. It was an unstable hydrophilic protein and did not contain a transmembrane domain. Extended chain and irregular curl were the main elements of the secondary structure of VWD domain in C. quadricarinatus, among which, α-helix accounted for 7.73%, β-turn accounted for 10.50%, the extended chain accounted for 35.91%, and the irregular curl accounted for 45.86%. The recombinant plasmid pET-28a-VWD expressed the fusion protein VWD by inducing the competent cells E. coli BL21(λDE3). After dissolution with 2 mol/L guanidine hydrochloride and purification and renaturation on Ni-NTA affinity chromatography column, a clear specific band appeared at the relative molecular weight of the protein about 20.0 kD by 10% SDS-PAGE electrophoresis and Western blotting. The expression form of fusion protein VWD was mainly inclusion body. The best induction conditions for high expression of the fusion protein VWD in the competent cells BL21 (λDE3): when the OD600 nm of the monoclonal bacterial solution reached 0.6, 0.5 mmol/L IPTG was added and cultured at 20 ℃ for 16 h. The concentration of purified fusion protein VWD was 1.32 mg/mL. 【Conclusion】The optimized VWD gene of C. quadricarinatus obtained by whole gene synthesis can be expressed in E. coli competent cells BL21(λDE3),and the expression form of fusion protein VWD is mainly inclusion body. After dissolving with guanidine hydrochloride and purifying and renaturating with Ni-NTA affinity chromatography column, high-purity active VWD protein can be obtained, which provides technical support for the subsequent research on the biological function of C. quadricarinatus Vg and the development of corresponding bioactive substances.
Key words: Cherax quadricarinatus; vitellogenin(Vg); VWD domain; whole gene synthesis; prokaryotic expre-ssion;inclusion body
Foundation item: Guangxi Key Science and Technology Project(Guike AA17204095-5,Guike AA17204094-7); Guangxi Natural Science Foundation(2019GXNSFAA185036);Guangxi Key Research and Development Project(Guike AB182 21068)
0 引言
【研究意义】卵黄蛋白原(Vitellogenin,Vg)是卵黄蛋白(Yolk protein)的前体,是由若干个基因编码的特异性高分子量蛋白,富含糖、磷、脂,存在于卵生和非哺乳类性成熟的动物血液中(Avarre et al.,2007;王加伟等,2016),可为动物胚胎发育提供和转运氨基酸、脂肪、维生素、硫及钙等营养物质。除了已知的营养和运输功能外,Vg在进入卵细胞的过程中还发挥着其他非营养性功能(卢建平和姜乃澄,2000;潘杰,2020)。在褐飞虱和烟粉虱等虫体内,Vg可被病原微生物所利用,实现入卵传播(Cheng and Hou,2005;Wei et al.,2017);在蚊子体内,Vg通过调节含硫酯键蛋白(Thioester-containing protein 1)表达,而实现对疟原虫免疫清除的调控(Rono and Ceccarelli,2010);在蜜蜂血淋巴中,Vg通过与病原微生物细胞壁的脂磷壁酸或脂多糖互作,介导昆虫对病原微生物的免疫清除等(Salmela et al.,2015)。此外,Vg可作为一种雌激素和类雌激素的标志物,应用于水环境中内分泌干扰物、环境毒理与污染等状况的调查研究(周庆祥和江桂斌,2003)。Vg具有丰富的生物功能和极高的研究价值,因此开展Vg外源表达及纯化研究,对进一步挖掘其生物学功能及综合利用开发具有重要意义。【前人研究进展】目前,关于Vg的研究主要集中在生物学功能(Li et al.,2009;Garcia et al.,2010)、分子结构特征(Dalvin et al.,2011;Sun et al.,2013)及表达调控机制(Lu et al.,2016;Luo et al.,2017)等方面。大量研究表明,无论是在无脊椎动物还是在脊椎动物中,Vg的分子结构及其功能均具有一定的相似性,同时又具有各自的独特性。Vg一般含有3个非常保守的结构域,分别是卵黄蛋白原N氨基端的结构域(VitN)、羧基端的血管性血友病因子结构域(VWD)及未知功能的结构域(DUF)(Tufail and Takeda,2008)。VitN结构域是Vg最主要的磷酸化位点,也是重要的蛋白修饰区域,包含Vg与卵黄蛋白原受体(VgRs)的互作位点,在Vg的剪切、Vg-VgRs识别及其所介导的营养运输中发挥重要作用;VWD结构域和DUF结构域则具有与病毒或细菌等病原微生物互作的功能,能对病原微生物进行识别清除,并介导其垂直传播(霍岩等,2018)。已有研究发现,通过干扰果蝇Vg与VgRs结合,能影响其体内逆转录病毒进入卵细胞(Leblanc et al.,2000;Brasset et al.,2006)。Li等(2009)研究发现鱼类Vg对细菌的细胞壁脂多糖和磷脂壁酸具有识别功能,能促使细菌裂解。Huo等(2014)研究表明,雄性灰飞虱体内Vg的DUF结构域和VWD结构域可与水稻条纹病毒(Rice stripe virus,RSV)结构蛋白结合,再通过与营养细胞表面的VgRs结合而进入卵母细胞内,达到垂直传播的目的。针对红螯螯虾(Cherax quadricarinatus)Vg的相关研究,Abdu等(2002)通过克隆及测序分析红螯螯虾Vg基因全长cDNA序列,证实其编码2584个氨基酸残基,与其他甲壳类动物的Vg序列相似性在65%左右,靠近基因3'端的区域编码一种带负电荷且具有结合钙能力的蛋白质(P106);Shechter等(2005)通过摘除雄性红螯螯虾的窦腺复合体(XO-SG)诱导Vg转录、翻译和释放,发现该过程与雌性个体的卵黄发生过程相似,Vg在红螯螯虾蜕皮间期未发生表达,但在脱壳后早期高表达。可见,明确Vg在内分泌调控蜕皮甲壳类动物中的表达情况,可为研究甲壳类动物Vg表达和翻译的内分泌调节机制及揭示蜕皮与生殖内分泌轴间的关系提供诱导模型。【本研究切入点】至今,针对甲壳类动物Vg的研究主要集中在Vg表达调控、生物学功能及其机制方面,有关Vg单个结构域具体功能及其作用机制的研究鲜见报道,尤其是VWD结构域。Vg各结构域的分子结构及其生物学功能存在明显差异,因此有必要对各结构域进行单独研究,以探明其具体的作用机制。【拟解决的关键问题】对红螯螯虾Vg的VWD结构域(2345~2491 aa)进行生物信息学分析及理论评估,设计并优化其基因序列,采用全基因合成获得优化基因序列,并通过原核表达载体诱导表达VWD蛋白,为深入开展Vg的生物学功能研究和开发相应的生物活性物质提供技术支持,也为改进虾类养殖催熟及获取高质量后代打下基础。
1 材料与方法
1. 1 试验材料
大肠杆菌BL21(λDE3)感受态细胞由广西水产遗传育种与健康养殖重点实验室保存提供。载体pET-28a、琼脂糖凝胶回收试剂盒、质粒提取试剂盒、Ni-NTA纯化树脂预装柱非预染蛋白Marker、预染蛋白Marker、蛋白浓度定量试剂盒、TMB显色试剂盒及IPTG等购自生工生物工程(上海)股份有限公司;兔抗His-Tag抗体和辣根过氧化物酶(HRP)标记羊抗兔IgG抗體购自德国Merck公司;Pfu高温聚合酶、限制性内切酶及T4 DNA连接酶购自美国Promega公司;其他试剂均为国产分析纯。
1. 2 VWD序列生物信息学分析
登录GenBank搜索红螯螯虾Vg的mRNA序列(AF306784.1),导出其VWD结构域(2345~2491 aa),利用NCBI ORFFinder(https://www.ncbi.nlm.nih.gov/orffinder)查找VWD基因的开放阅读框(ORF)并推导其氨基酸序列。将推导的氨基酸序列提交至ExPASy数据库(https://www.expasy.org/),采用ProtParam、ProtScale、InterProscan和TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)等在线分析软件分别进行亲/疏水性、信号肽、跨膜结构域及基本结构等生物学信息进行分析和理论评估。
1. 3 序列优化与全基因合成
根据VWD氨基酸序列的评估结果及大肠杆菌密码子偏好性,通过OPTIMIZER(http://genomes.urv.es/OPTIMIZER/)和DNAWORKS(https://hpcwebapps.cit.nih.gov/dnaworks/)对原始VWD氨基酸序列进行密码子优化及序列改造,设计优化目的片段的全基因合成方案:将优化后目的片段分割成18段带有重叠序列的寡核苷酸片段(F:5'-GACACGGATCCCT TACAACCGT-3';R:5'-GTGTCCTCGAGTTAGCCG GACGGAG-3',下划线部分分别为BamH I和Xho I酶切位点),委托生工生物工程(上海)股份有限公司合成。全基因合成策略是将合成的18段寡核苷酸片段混合在一个体系中,通过第一轮PCR扩增的多个热循环和退火实现目的片段的全长序列拼接,再利用首尾引物通过第二轮PCR进一步扩增和富集全长目的基因。第一轮PCR反应体系50.0 ?L:18对引物Mix各0.5 ?L,dNTP(25 mmol/L)1.0 ?L,10×Pfu Buffer 5.0 ?L,Pfu高温聚合酶(5 U/?L)0.4 ?L,ddH2O补足至50.0 ?L。扩增程序:95 ℃预变性3 min;95 ℃ 22 s,55 ℃ 20 s,72 ℃ 30 s,进行20个循环;72 ℃延伸5 min。以第一轮PCR产物为模板进行第二轮PCR扩增,反应体系50.0 ?L:首尾引物各2.0 ?L(引物浓度同上),第一轮PCR产物(模板),dNTP(25 mmol/L)1.0 ?L,10×Pfu Buffer 5.0 ?L,Pfu高温聚合酶(5 U/?L)0.4 ?L,ddH2O补足至50.0 ?L。扩增程序:95 ℃预变性3 min;95 ℃ 22 s,55 ℃ 20 s,72 ℃ 30 s,进行22个循环;72 ℃延伸5 min。第二轮PCR扩增产物采用1.2%琼脂糖凝胶电泳进行检测,并对特异性条带进行纯化回收。
1. 4 重组表达载体构建与验证
根据引物设计的酶切位点,利用BamH I和Xho I对纯化回收得到的目的基因和载体pET-28a进行双酶切。目的基因酶切体系50.0 ?L:纯化回收的目的基因20.0 ?L(1.0 ?g),10×FD Buffer 5.0 ?L,BamH I和Xho I各1.0 ?L(10 U/?L),ddH2O 23.0 ?L。载体pET-28a酶切体系50.0 ?L:pET-28a 1.0 ?g,10×FD Buffer 5.0 ?L,BamH I和Xho I各1.0 ?L(10 U/?L),ddH2O补足至50.0 ?L。将上述2个酶切体系分别放入37 ℃恒温水浴锅中反应2 h。将酶切后纯化回收的目的DNA片段和pET-28a进行连接,连接体系20.0 ?L:目的片段酶切产物8.0 ?L,pET-28a酶切产物4.0 ?L,10×T4 DNA Ligase Buffer 2.0 ?L,T4 DNAigase 1.0 ?L(5 U/?L), ddH2O补足至20.0 ?L。将上述连接混合液放入22 ℃的PCR仪内反应1 h,然后转化BL21(λDE3)感受态细胞,均匀涂布于含卡拉霉素的LB培养基上,37 ℃培养过夜,筛选阳性克隆,提取质粒,进行酶切验证,反应体系10.0 ?L:重组质粒100 ng,10×FD Buffer 1.0 ?L,BamH I和Xho I各1.0 ?L(10 U/?L),ddH2O补足至10.0 ?L,置于37 ℃恒溫水浴锅中消化2 h。经1.2%琼脂糖凝胶电泳检测,将阳性克隆接种至含卡拉霉素的LB肉汤培养基中,250 r/min摇床培养过夜,菌液送至北京华大基因科技有限公司测序。测序引物为载体pET-28a的T7启动子和终止子通用引物(5'端测序引物5'-TAATACGACT CACTATAGGG-3',3'端测序引物5'-GCTAGTTATT GCTCAGCGGG-3')。
1. 5 VWD蛋白原核表达
成功构建的重组质粒命名为pET-28a-VWD,挑取阳性克隆转化BL21(λDE3)感受态细胞,热激后涂布于含卡拉霉素的LB培养基上,37 ℃培养过夜;挑取单克隆菌落接种至含卡拉霉素的LB液体培养基中进行37 ℃活化培养,当菌液OD600 nm达0.6时,添加一定浓度的IPTG,分别于16和20 ℃下培养16 h,再置于37 ℃下培养4 h,设未添加IPTG的为阴性对照。取菌液12000 r/min离心5 min,弃上清液,收集菌体沉淀,加入PBS(pH 7.4)进行悬浮,利用超声波破碎仪使其充分溶解,离心后弃上清液,向沉淀中加入缓冲液A(8 mol/L Urea,50 mmol/L Tris-HCl,300 mmol/L NaCl,pH 8.0)进行溶解,再次离心,向上清液和沉淀中分别加入等体积的2×Loading Buffer,煮沸后进行10% SDS-PAGE电泳,通过考马斯亮蓝(R250)染色确定蛋白表达量及纯度,进而确定诱导表达所需的最佳IPTG浓度、诱导温度及诱导时间。最后于最佳诱导条件下进行大量表达,菌液在4 ℃下3000 r/min离心10 min后,收集菌体沉淀。
1. 6 融合蛋白纯化
向收集到的菌体中加入缓冲液B(8 mol/L Urea,50 mmol/L Tris,300 mmol/L NaCl,0.1% Triton X-100,pH 8.0),4 ℃静置30 min后置于冰上进行200 W的多次间歇性超声波破碎,待菌液澄清后,4 ℃下12000 r/min离心10 min,收集上清液粗蛋白(包涵体),加入2 mol/L盐酸胍进行溶解。取5 mL的Ni-NTA亲和层析柱,以5倍柱床体积的Binding Buffer清洗平衡柱,流速5 mL/min;将粗蛋白与平衡后的Ni-NTA亲和层析柱填料孵育1 h;孵育后的产物上柱进行提纯和复性,收集流出液;先用Binding Buffer清洗平衡柱,接着以Washing Buffer洗柱,收集流出液;用Elution Buffer再次洗脱,收集流出液。分别对粗蛋白、洗杂流出液及洗脱流出液进行处理,经10% SDS-PAGE电泳后进行R250染色分析。将纯度较高的6个组分分别加入到缓冲液C(50 mmol/L Tris,300 mmol/L NaCl,0.1% SKL,pH 8.5)中进行透析,透析结束采用PEG-20000进行浓缩,0.45 μm滤膜过滤后分装为1 mL/管,-80 ℃保存。
1. 7 融合蛋白表达验证
对复性且纯化后的融合蛋白进行制样,经10% SDS-PAGE电泳后,在200 mA恒定电流及低温条件下转膜(PVDF)2 h,再以含5%脱脂奶粉的TBST封闭2 h,将兔抗His-Tag抗体进行1∶2000稀释,HRP标记羊抗兔IgG抗体进行1∶5000稀释,常温孵育过夜,洗膜3次,将TMB显色液滴加到PVDF膜上显色,进行Western blotting特异性验证。
2 结果与分析
2. 1 红螯螯虾VWD结构域生物信息学分析结果
2. 1. 1 红螯螯虾VWD结构域的理化性质 红螯螯虾VWD结构域相对分子量为19692.11 Da,理论等电点(pI)为9.35,负电荷残基(Asp+Glu)总数为12个,正电荷残基(Arg+Lys)总数为15个,共计2717个原子,分子式为C855H1334N258O261S9,不稳定系数为40.74,大于40,即为不稳定蛋白;其脂肪指数为63.98,亲水性平均系数(GRAVY)为-0.367,ProtScale预测结果(图1)也表明该蛋白的亲水氨基酸数量分布明显多于疏水氨基酸,故推测为亲水性蛋白。经TMHMM预测显示,编码VWD结构域的181个氨基酸残基全部位于细胞膜外,即不含跨膜結构域(图2)。
2. 1. 2 红螯螯虾VWD结构域的结构特征 利用SOPMA对红螯螯虾VWD结构域二级结构进行预测,结果如图3所示。红螯螯虾VWD结构域二级结构由α-螺旋(Alpha helix)、延伸链(Extended strand)、β-转角(Beta turn)及无规则卷曲(Random coil)4种类型构成,其中,α-螺旋有14个(占7.73%),β-转角有19个(占10.50%),延伸链有65条(占35.91%),无规则卷曲有83个(占45.86%),即延伸链和无规则卷曲是VWD结构域二级结构的主要元件。α-螺旋聚集在第20~40位氨基酸间,β-转角则零星散布于整个氨基酸序列中。
红螯螯虾VWD结构域三级结构是以c6rbfA蛋白结构为基础进行同源建模,其中对齐残基数为137个,覆盖率为76%,一致性为17%,预测可信度为100%。红螯螯虾VWD结构域三级结构(图4)由上下两层Sheet片段通过长链卷曲相连接而成,其下层还包含一段螺旋结构。
2. 2 重组质粒pET-28a-VWD验证结果
2. 2. 1 全基因合成验证结果 通过全基因合成获得的PCR产物经1.2%琼脂糖凝胶电泳检测,发现在450 bp附近出现单一、明亮的特异性条带(图5),与预期设计的目的基因大小相符,说明已成功合成获得红螯螯虾VWD基因。
2. 2. 2 重组质粒pET-28a-VWD鉴定结果 提取重组质粒pET-28a-VWD,经BamH I和Xho I双酶切后进行1.2%琼脂糖凝胶电泳检测,结果(图6)显示,酶切产物为2条大小约5300和450 bp的片段,与预期结果相符。对筛选出的阳性克隆(重组质粒pET-28a-VWD)进行增菌培养,菌液送至北京华大基因科技有限公司测序,其测序结果与NCBI(https://www.ncbi.nlm.nih.gov/)已公布红螯螯虾Vg基因的核苷酸序列(AAG17936.1)相似性为100.0%,而推导氨基酸序列与红螯螯虾Vg氨基酸序列(AAS68191.1)的相似性为75%,说明通过全基因合成并克隆转化获得的氨基酸序列即为红螯螯虾Vg的VWD结构域,同时确认重组质粒pET-28a-VWD构建成功。
2. 3 融合蛋白VWD表达形式鉴定结果
为确定融合蛋白VWD的表达形式,将扩培菌液经超声波裂解后进行离心,收集上清液和菌体沉淀,分别采用10% SDS-PAGE电泳进行检测,并进行R250染色分析,结果如图7所示。在各诱导温度下,菌体沉淀泳道均在蛋白相对分子量约20.0 kD处现出1条清晰的特异性条带,而在上清液中检测不到对应的条带,说明融合蛋白VWD的表达形式以包涵体为主。
2. 4 融合蛋白VWD分离及纯化效果
向超声波裂解获得的包涵体中加入2 mol/L盐酸胍溶解,经Ni-NTA亲和层析柱纯化及复性后进行10% SDS-PAGE电泳,结果(图8)显示,在蛋白相对分子量约20.0 kD处出现1条明显的特异性条带,其大小与预期结果(19.7 kD)相符。采用不同浓度的咪唑(Imidazole)对分离获得的融合蛋白VWD进行洗脱纯化,结果表明,随着洗脱液浓度的增加,纯化产物的条带越清晰,杂质逐渐变少,其中以500 mmol/L咪唑的洗脱纯化效果最佳。
2. 5 融合蛋白VWD表达验证结果
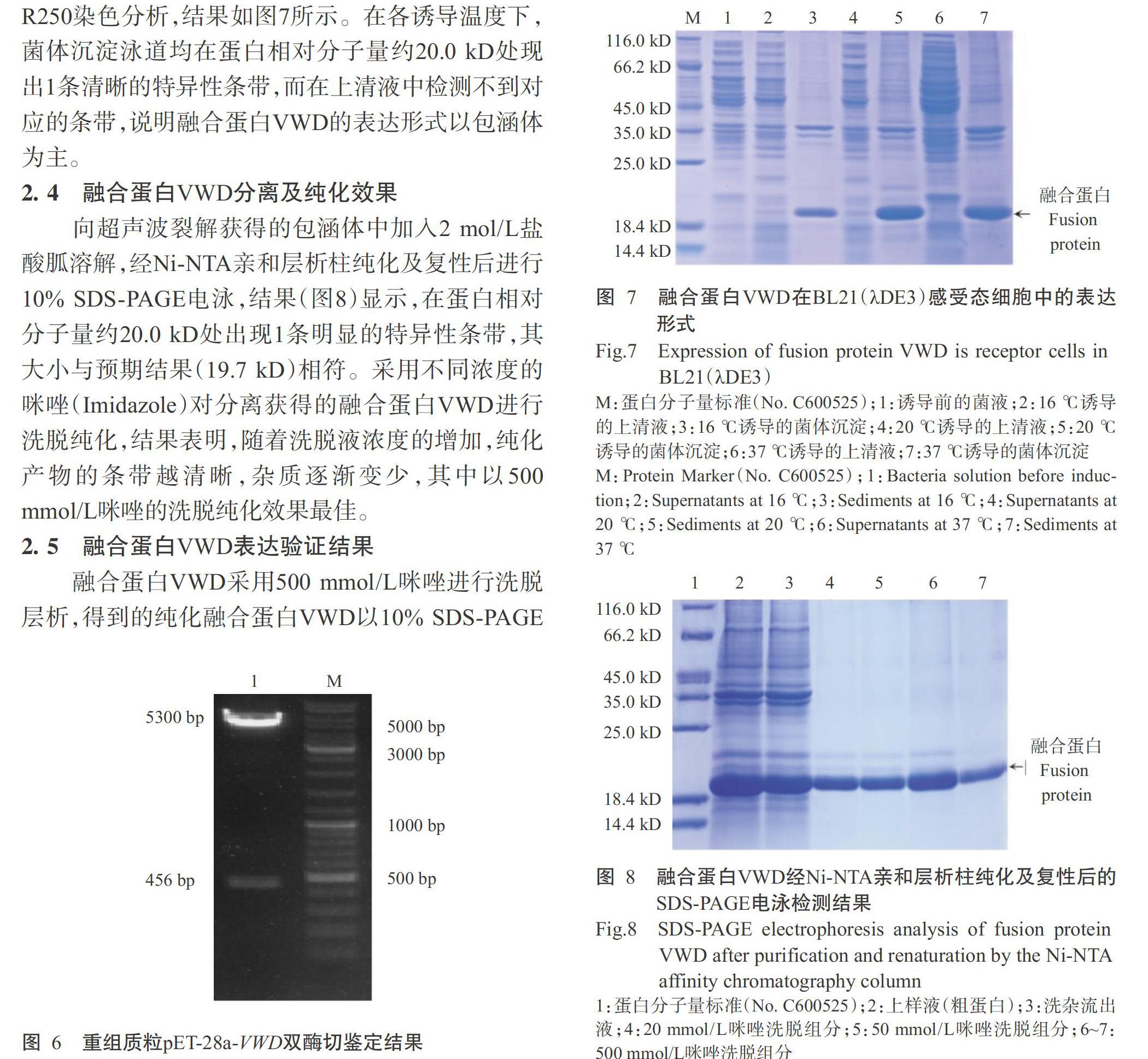
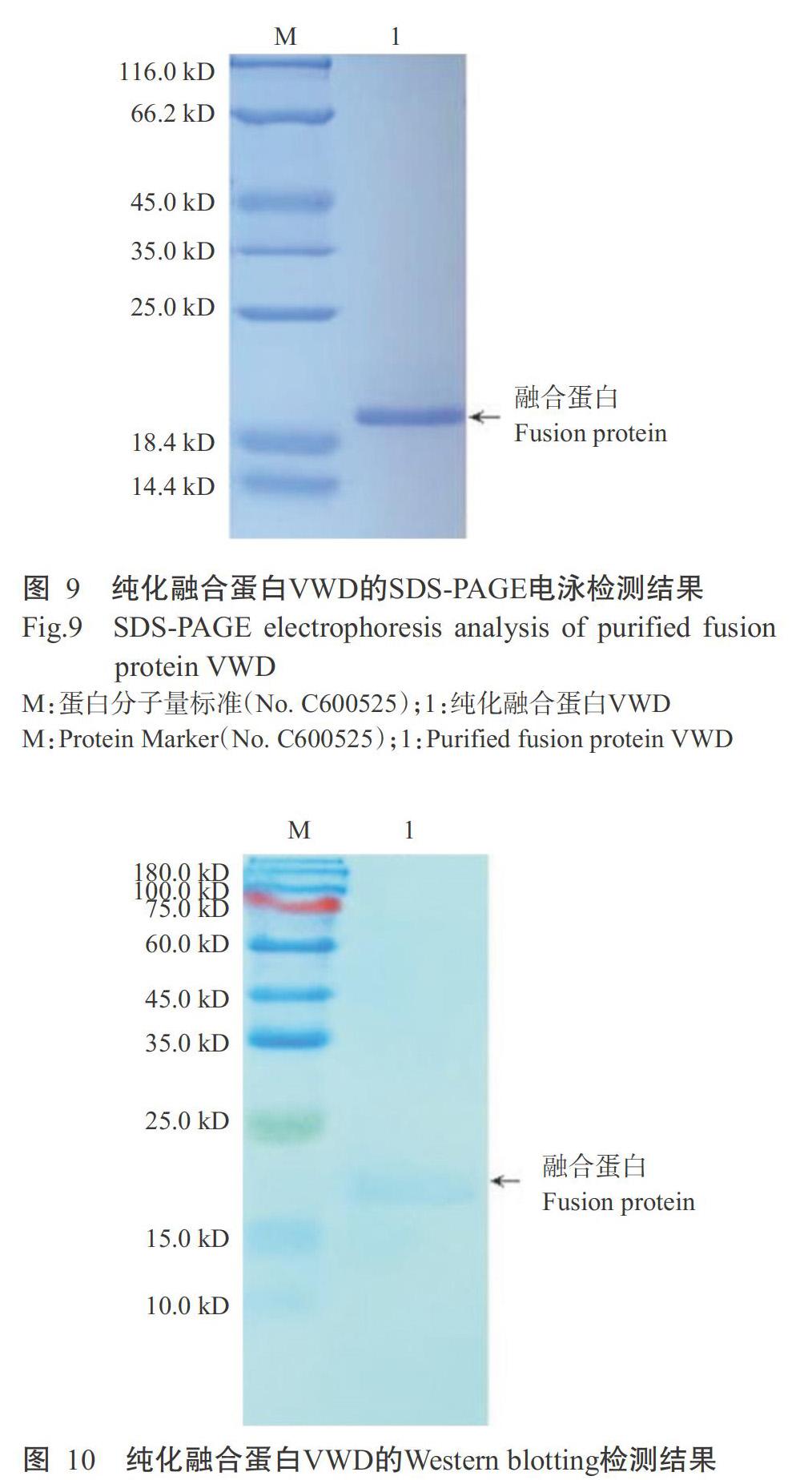
融合蛋白VWD采用500 mmol/L咪唑进行洗脱层析,得到的纯化融合蛋白VWD以10% SDS-PAGE电泳进行检测,结果(图9)显示,在蛋白相对分子量约20.0 kD的相应位置出现单一、清晰的特异性条带,无杂带,可初步确定融合蛋白VWD在复性的同时得到高效纯化。Western blotting检测结果(图10)也发现,在约20.0 kD的相应位置出现明显的特异性条带,说明纯化获得的融合蛋白VWD即为红螯螯虾VWD结构域的原核表达蛋白。采用非干扰型蛋白定量试剂盒测定纯化融合蛋白VWD浓度,得知其浓度为1.32 mg/mL。
3 讨论
Vg的VWD结构域具有与病毒或细菌互作的特性,对病原微生物进行识别及介导其清除或垂直传播均有密切联系。Vg作为卵黄蛋白的前体,是卵生动物胚胎发育的主要营养来源(罗明坤等,2015;潘贤辉等,2018);Vg作为卵内的重要营养蛋白,除了已知的营养运输功能之外,在进入卵细胞的过程中还发挥着其他非营养性功能(霍岩等,2018)。近年来研究发现,Vg以多种功能参与宿主的免疫防御(Salmela et al.,2015),但不同Vg基因编码的所有Vg蛋白是否都发挥免疫作用尚未明确,Vg不同结构域与各种免疫功能的相关性也不清楚。Sun等(2013)从斑马鱼肝脏组织中提取RNA并逆转录合成cDNA,采用RACE克隆斑马鱼rDUF1943、rDUF1944和rVWD基因cDNA序列,然后构建表达载体进行表达与纯化,结果发现诱导表达获得的融合蛋白rDUF1943、rDUF1944和rVWD均能结合金黄色葡萄球菌、枯草芽孢杆菌和藤黄微球菌等革兰氏阳性菌及大肠杆菌和鳗弧菌等革兰氏阴性菌,即DUF1943、DUF1944和VWD可能在Vg发挥模式识别受体功能时扮演着重要角色。本研究通过对红螯螯虾Vg的VWD结构域进行单独克隆、表达及纯化,以期制备获得VWD蛋白用于后续相关的生物学功能及机制研究。与Sun等(2013)的研究不同,本研究是基于NCBI已公布红螯螯虾Vg的VWD结构域(2345~2491 aa)进行生物信息学分析及理论评估,并结合大肠杆菌密码子偏好对原始VWD氨基酸序列进行优化及改造,然后通过全基因合成获得目的基因,省去了模板制备和文库构建的相关步骤。
全基因合成技术是通过对基因序列进行改造,优化后的目的基因编码序列更符合宿主细胞密码子的偏好性,能有效解决原核生物和真核生物在翻译前后修饰过程差异所造成真核生物无法在大肠杆菌上表达及正确折叠的问题,使目的基因在大肠杆菌中得以正确转录和翻译(Papamichail et al.,2016)。本研究结果表明,重组质粒pET-28a-VWD在大肠杆菌BL21(λDE3)感受态细胞中高效表达的最佳诱导条件:当单克隆菌液OD600 nm达0.6时添加0.5 mmol/L IPTG,置于20 ℃下诱导培养16 h能获得最大的融合蛋白表达量;获得的融合蛋白VWD主要以包涵体形式表达,经2 mol/L盐酸胍溶解和Ni-NTA亲和层析纯化后可获得高纯度的活性VWD蛋白。大肠杆菌是目前用于重组蛋白异源表达最成熟的原核表达系统(谢磊等,2004),是借助胞質将外源蛋白通过可溶性(活性肽)或非可溶性(包涵体)的形式进行表达(张永德等,2018)。大肠杆菌胞质是一个还原性较强的环境,极易阻碍胞质内所表达外源蛋白或多肽中二硫键的正确形成,进而折叠形成不具生物活性的包涵体(Rosano and Ceccarelli,2014;张永德等,2018)。因此,要获得活性蛋白用于生物学功能研究,可对目的基因进行改造,接入信号肽分子引导外源蛋白分泌到周质空间进行折叠,或将目的蛋白与大肠杆菌的外膜蛋白融合表达也可诱导其分泌到周质空间中(Meng et al.,2011;Klint et al.,2013)。本研究通过密码子优化大量表达获得融合蛋白VWD包涵体,后续使用2 mol/L盐酸胍对包涵体进行溶解,以降低蛋白结构柔韧性,干扰其聚集,接着采用携带His-Tag标签的Ni-NTA亲和层析柱对包涵体进行纯化及复性,最后通过透析去除变性剂以促进折叠。
4 结论
通过全基因合成获得的优化红螯螯虾VWD基因能在大肠杆菌BL21(λDE3)感受态细胞中诱导表达出以包涵体为主要形式的融合蛋白,经盐酸胍溶解和Ni-NTA亲和层析柱纯化即可获得高纯度的活性VWD蛋白,为后续开展红螯螯虾Vg生物学功能研究及开发相应的生物活性物质提供技术支持。
参考文献:
霍岩,陈晓英,方荣祥,张莉莉. 2018. 卵黄蛋白原的产生及其非营养功能的研究现状[J]. 生物技术通报,34(2):66-73. doi:10.13560/j.cnki.biotech.bull.1985.2018-0003. [Huo Y,Chen X Y,Fang R X,Zhang L L. 2018. Study on the production of vitellogenin and its non-nutritional functions[J]. Biotechnology Bulletin,34(2):66-73.]
卢建平,姜乃澄. 2000. 罗氏沼虾胚胎发育过程中同工酶的研究[J]. 东海海洋,18(3):34-39. doi:10.3969/j.issn.1001-909X.2000.03.006. [Lu J P,Jiang N C. 2000. The isozyme patterns in embryo development of the freshwater prawn Macrobrachium rosenbergh[J]. Donghai Marine Science,18(3):34-39.]
罗明坤,赵金良,Thammaratsuntorn Jeerawat,李传阳,魏继海,赵永华. 2015. 尼罗罗非鱼卵巢发育过程中性类固醇激素与卵黄蛋白原含量变化及Vtg mRNA表达特征[J]. 中国水产科学,22(6):1123-1132. doi:10.3724/SP.J.1118. 2015.14467. [Luo M K,Zhao J L,Thammaratsuntorn J,Li C Y,Wei J H,Zhao Y H. 2015. Changes in sex steroid hormones,vitellogenin content,and Vtg mRNA expression during ovarian development in Oreochromis niloticus[J]. Journal of Fishery Sciences of China,22(6):1123-1132.]
潘杰. 2020. 两种类固醇对中华绒螯蟹卵黄蛋白原及其受体基因的表达调控[D]. 上海:上海海洋大学. [Pan J. 2020. Study on the expression of vitellogenesis-related genes regulated by two steroids in Eriocheir sinensis[D]. Shanghai:Shanghai Ocean University.]
潘賢辉,刘奕,周康奇,胡隐昌,郑曙明,宋红梅,牟希东,杨叶欣. 2018. 双须骨舌鱼卵黄蛋白原基因vtg的克隆、组织表达和原核表达分析[J]. 动物学杂志,53(4):597-614. doi:10.13859/j.cjz.201804011. [Pan X H,Liu Y,Zhou K Q,Hu Y C,Zheng S M,Song H M,Mu X D,Yang Y X. 2018. Molecular cloning,expression pattern and prokaryo-tic expression of vitellogenin gene(vtg) from Osteoglossum bicirrhosum[J]. Chinese Journal of Zoology,53(4):597-614.]
王加伟,彭露,邹明民,杨一帆,汪蕾,尤民生. 2016. 昆虫卵黄原蛋白受体(VgRs)及其主要功能综述[J]. 环境昆虫学报,38(4):831-842. doi:10.3969/j.issn.1674-0858.2016. 04.25. [Wang J W,Peng L,Zou M M,Yang Y F,Wang L,You M S. 2016. A review of insect vitellogenin receptors(VgRs) and their fundamental functions[J]. Journal of Environmental Entomology,38(4):831-842.]
谢磊,孙建波,张世清,黄俊生. 2004. 大肠杆菌表达系统及其研究进展[J]. 华南热带农业大学学报,10(2):16-20. doi:10.3969/j.issn.1674-7054.2004.02.005. [Xie L,Sun J B,Zhang S Q,Huang J S. 2004. Research progress in the E. coli expression system[J]. Journal of South China University of Tropical Agriculture,10(2):16-20.]
张永德,林勇,冯鹏霏,陈忠,杜雪松,黄姻,潘传燕,罗洪林. 2018. 尼罗罗非鱼Lck多克隆抗体的制备及鉴定[J]. 南方农业学报,49(11):2304-2310. doi:10.3969/j.issn.2095-1191.2018.11.27. [Zhang Y D,Lin Y,Feng P F,Chen Z,Du X S,Huang Y,Pan C Y,Luo H L. 2018. Preparation and identification of Lck polyclonal antibody in Nile tilapia[J]. Journal of Southern Agriculture,49(11):2304-2310.]
周庆祥,江桂斌. 2003. 卵黄蛋白原的分离测定及其在环境内分泌干扰物质筛选中的应用[J]. 化学进展,15(1):67-73. doi:10.3321/j.issn:1005-281X.2003.01.010. [Zhou Q X,Jiang G B. 2003. Separation and determination and vitellongenin and its application as a bionmarker for the screening of environment endocrine disrupting chemicals[J]. Progress in Chemistry,15(1):67-73.]
Abdu U,Davis C,Khalaila I,Sagi A. 2002. The vitellogenin cDNA of Cherax quadricarinatus encodes a lipoprotein with calcium binding ability,and its expression is induced following the removal of the androgenic gland in a sexually plastic system[J]. General and Comparative Endocriology,127(3):263-272. doi:10.1016/S0016-6480(02)00053-9.
Avarre J C,Lubzens E,Babin P J. 2007. Apolipocrustacein,formerly vitellogenin,is the major egg yolk precursor protein in decapod crustaceans and is homologous to insect apolipophorin II/I and vertebrate apolipoprotein B[J]. BMC Evolutionary Biology,7:3. doi:10.1186/1471-2148-7-3.
Brasset E,Taddei A R,Arnaud F,Faye B,Fausto A M,Mazzini M,Giorgi F,Vaury C. 2006. Viral particles of the endogenous retrovirus ZAM from Drosophila melanogaster use a pre-existing endosome/exosome pathway for transfer to the oocyte[J]. Retrovirology,3:25. doi:10.1186/1742-4690-3-25.
Cheng D J,Hou R F. 2005. Determination and distribution of a femalespecific protein in the brown planthopper,Nila-parvata lugens St?l(Homoptera:Delphacidae)[J]. Tissue & Cell,37(1): 37-45. doi:10.1016/j.tice.2004. 09.003.
Dalvin S,Frost P,Loeffen P,Skern-Mauritzen R,Baban J,R?nnestad I,Nilsen F. 2011. Characterisation of two vitellogenins in the salmon louse Lepeophtheirus salmonis:Molecular,functional and evolutional analysis[J]. Disea-ses of Aquatic Organisms,94(3):211-224. doi:10.3354/dao02331.
Garcia J,Munro E S,Monte M M,Fourrier M C S,Whitelaw J,Smail D A,Ellis A E. 2010. Atlantic salmon(Salmo salar L.) serum vitellogenin neutralises infectivity of infectious pancreatic necrosis virus(IPNV)[J]. Fish & Shellfish Immunology,29(2):293-297. doi:10.1016/j.fsi.2010.04.010.
Huo Y,Liu W W,Zhang F J,Chen X Y,Li L,Liu Q F,Zhou Y J,Wei T Y,Fang R X,Wang X F. 2014. Transovarial transmission of a plant virus is mediated by vitellogenin of its insect vector[J]. PLoS Pathogens,10(3):e1003949. doi:10.1371/journal. ppat.1003949.
Klint J K,Senff S,Saez N J,Seshadri R,Lau H Y,Bende N S,Undheim E A B,Rash L D,Mobli M,King G F. 2013. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm of E. coli[J]. PLoS One,8(5):e63865. doi:10.1371/journal.pone.0063865.
Leblanc P,Desset S,Giorgi F,Taddei A R,Fausto A M,Mazzini M,Dastugue B,Vaury C. 2000. Life cycle of an endogenous retrovirus,ZAM,in Drosophila melanogaster[J]. Journal of Virology,74(22):10658-10669. doi:10. 1128/jvi.74.22.10658-10669.2000.
Li Z J,Zhang S C,Zhang J,Liu M,Liu Z H. 2009. Vitellogenin is a cidal factor capable of killing bacteria via interaction with lipopolysaccharide and lipoteichoic acid[J]. Molecular Immunology,46(16):3232-3239. doi:10. 1016/j.molimm.2009.08.006.
Lu K,Chen X,Liu W T,Zhang X Y,Chen M X,Zhou Q. 2016. Nutritional signaling regulates vitellogenin synthesis and egg development through juvenile hormone in Nilaparvata lugens(St?l)[J]. International Journal of Molecular Sciences,17(3):269. doi:10.3390/ijms17030269.
Luo M W,Li D,Wang Z M,Guo W,Kang L,Zhou S T. 2017. Juvenile hormone differentially regulates two Grp78 genes encoding protein chaperones required for insect fat body cell homeostasis and vitellogenesis[J]. The Journal of Biological Chemistry,292(21):8823-8834. doi: 10.1074/jbc.M117.780957.
Meng E,Cai T F,Li W Y,Zhang H,Liu Y B,Peng K,Liang S P,Zhang D Y. 2011. Functional expression of spider neurotoxic peptide huwentoxin-I in E. coli[J]. PLoS One,6(6):e21608. doi:10.1371/journal.pone.0021608.
Papamichail D,Liu H M,Machado V,Gould N,Coleman J R,Papamichail G. 2016. Codon Context optimization in synthetic gene design[J]. IEEE/ACM Transactions on Computational Biology and Bioinformatics,15(2):452-459. doi:10.1109/TCBB. 2016.2542808.
Rono M K,Whitten M M A,Oulad-Abdelghani M,Levashina E A,Marois E. 2010. The major yolk protein vitellogenin interferes with the anti-plasmodium response in the malaria mosquito Anopheles gambiae[J]. PLoS Biology,8(7):e1000434. doi:10.1371/journal.pbio.1000434.
Rosano G L,Ceccarelli E A. 2014. Recombinant protein expression in Escherichia coli:Advances and challenges[J]. Fronters in Microbiology,5:172. doi:10.3389/fmicb. 2014.00172.
Salmela H,Amdam G V,Freitak D. 2015. Transfer of immunity from mother to offspring is mediated via egg-yolk protein vitellogenin[J]. PLoS Pathogens,11(7):e1005015. doi:10.1371/journal.ppat.1005015.
Shechter A,Aflalo E D,Davis C,Sagi A. 2005. Expression of the reproductive female-specific vitellogenin gene in endocrinologically induced male and intersex Cherax quadricarinatus crayfish[J]. Biology of Reproduction,73(1):72-79. doi:10.1095/biolreprod.104.038554.
Sun C,Hu L L,Liu S S,Gao Z,Zhang S C. 2013. Functional analysis of domain of unknown function(DUF)1943,DUF1944 and von Willebrand factor type D domain (VWD) in vitellogenin 2 in zebrafish[J]. Developmental and Comparative Immunology,41(4):469-476. doi:10. 1016/j.dci.2013.07.005.
Tufail M,Takeda M. 2008. Molecular characteristics of insect vitellogenins[J]. Journal of Insect Physiology,54(12):1447-1458. doi:10.1016/j.jinsphys.2008.08.007.
Wei J,He Y Z,Guo Q,Guo T,Liu Y Q,Zhou X P,Liu S S,Wang X W. 2017. Vector development and vitellogenin determine the transovarial transmission of begomoviruses[J]. Proceedings of the National Academy of Sciences of the United States of America,14(26):6746-6751. doi:10.1073/pnas.1701720114.
(責任编辑 兰宗宝)
