组胺受体及抗组胺药的分类及其在变应性鼻炎中的应用
2021-09-06李崇妮赵长青安云芳
李崇妮,赵长青,安云芳
(1.山西医科大学,山西 太原 030001; 2.山西医科大学第二医院 耳鼻咽喉头颈外科,山西 太原 030001)
组胺是自体活性物质之一,在体内组胺是由L-组氨酸在组氨酸脱羧酶的作用下生成,人类对组胺的发现和认识经历了漫长的过程。1907年,人类首次从含有多种生物碱的麦角中提取合成了组胺[1]。1910年,英国学者Dale和Laidlaw通过动物试验,发现组胺可以引起血管扩张,气道、子宫和肠道平滑肌收缩,心率加快,心肌收缩力增强,血压下降等休克样反应[2]。1924年,Lewis和Grant发现皮下注射组胺可引起红斑、风疹和潮红三联反应,与外伤时皮肤观察到的表现相似,表明组胺可能来源于皮肤中的细胞[3]。1927年,Best等从肺和肝脏组织中提取出组胺,从而证明组胺可来源于人体正常组织[4]。1937年,在巴斯德研究所Bovet和Staub合成首个有效的抗组胺药,但是由于药理毒性太强,无法在临床上广泛应用。1942年,法国科学家Halpern在临床上首次使用安全性尚可的抗组胺药—芬苯扎胺,该药成为在临床上正式使用的第一种H1受体拮抗剂(H1 receptor antagonists,H1RAs)。1957年,Bovet因发现抗组胺药获得诺贝尔生理学和医学奖。1972年,Black在胃壁细胞发现H2受体,1983年,Schwartz在大脑皮层中发现H3受体,2000年,Nakamura从人类白细胞DNA中成功克隆H4受体。本文就组胺、组胺受体的生物学作用,抗组胺药分类及其在变应性鼻炎(allergic rhinitis, AR)中的应用等作一综述。
1 组胺及组胺受体的生物学作用
组胺是参与变态反应和炎症反应的重要化学介质,主要通过与其受体结合发挥生物学效应。由于4种受体亚型在组织中的分布不同、结构和功能上存在差异,而且与激动剂和拮抗剂结合的亲和力不同,决定了组胺与不同受体结合发挥不同的作用。
组胺4种受体均为7次跨膜螺旋的G蛋白偶联受体(G-protein-coupled receptors,GPCRs),组胺与受体结合后,通过G蛋白将细胞外信号传递到细胞内,从而发挥生物学作用[5-6]。组胺受体G蛋白是由α、β、γ 3个亚单位组成的三聚体,静息状态时,组胺受体处于非活性状态,G蛋白三聚体的α亚单位与二磷酸鸟苷(guanosine diphosphate,GDP)结合。当激动剂组胺与GPCRs结合,受体被激活,处于活性状态,GDP与细胞质中的三磷酸鸟苷(guanosine triphosphate,GTP)交换,GTP-α亚单位与βγ亚单位分离,并激活下游信号通路,产生相应的生物学效应,之后激动剂与受体分离。α亚单位具有GTP酶活性,能使GTP水解为GDP,之后GDP-α亚单位与βγ亚单位结合恢复静息状态。GPCRs具有一定的自发活性,即使在缺乏激动剂时,也能够激活信号传导通路,产生生物学效应[7]。在静息状态时,受体的活性构象和非活性构象通常处于平衡状态(图1A)。当体内组胺浓度升高,由于组胺(激动剂)与受体的活性构象亲和力较强,导致该平衡向活性构象偏移,出现相应的临床症状(图1B)。当服用抗组胺药后,由于抗组胺药(反向激动剂)与非活性构象亲和力较强,使该平衡向非活性构象偏移,临床症状得以缓解(图1C)。
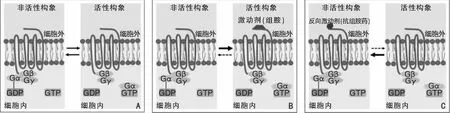
图1 组胺受体在不同状态下的生物学效应 A:平衡状态; B:激动剂与受体结合; C:抗组胺药与受体结合
目前研究发现,H1受体广泛分布于外周和中枢,在外周主要分布于皮肤和黏膜的血管内皮细胞、平滑肌细胞,调节血管舒张和支气管收缩,在中枢主要分布于丘脑、皮层和胆碱能神经细胞丛等具有唤醒功能的区域,有调节睡眠与觉醒、认知及抗惊厥等作用[8]。H2受体主要分布于胃壁细胞,调节胃酸分泌。H3受体主要表达于胺能神经元的突触前膜,主要调节组胺、乙酰胆碱等神经递质的释放[9-10]。H4受体特异性表达于肥大细胞、嗜酸性粒细胞、单核细胞、T细胞等免疫细胞膜表面,目前研究发现其在AR等免疫疾病中起调节作用,作用机制尚不完全明确[11]。
2 组胺受体在鼻黏膜的分布
研究发现在正常人鼻黏膜中,组胺4种受体类型均有表达,其表达峰度依为H1﹥H2﹥H3及H4[12]。Nakaya等[13]发现在人类正常鼻黏膜中,H1受体主要存在于血管内皮细胞、上皮细胞和神经细胞中,H2受体主要位于上皮和腺体细胞中,H3和H4受体主要分布在神经细胞,并且同一神经细胞上可能同时存在H1、H3和H4受体。Suzuki等[14]学者研究发现在鼻黏膜下腺体周围存在H3受体,可能参与促进黏膜下腺的分泌。国内学者曹宇发现H1、H2和H3受体在大鼠鼻腔嗅区黏膜的嗅觉上皮细胞中存在,并且主要位于嗅觉神经元中,表明组胺及其受体参与嗅觉传导[15]。
Shirasak等[16]采用免疫印迹和免疫组化发现在AR患者鼻黏膜的上皮细胞和血管内皮细胞中H1受体的表达水平明显高于非AR患者。国内学者燕志强等[17]研究发现H4受体在AR患者鼻黏膜中较正常人表达水平增高。目前AR的研究主要集中于组胺和H1受体,其余3种受体在AR发病中可能存在潜在作用,有待进一步研究。
3 抗组胺药的分类及其副作用
20世纪80年代之前研发的抗组胺药为第一代抗组胺药,与H1受体结合后可减轻过敏症状,但因存在中枢抑制作用限制了其在临床上的应用。针对第一代抗组胺药的不良反应,80年代以后逐渐研发出多种新一代抗组胺药,中枢抑制较第一代明显减轻,将其统称为第二代抗组胺药,但仍有较强的心脏毒性和体重增加等不良反应。之后发现第二代抗组胺药的活性代谢物或光学异构体,具有同等或更强的药理学作用,同时可降低心脏毒性,称为新二代抗组胺药。
3.1 口服H1RAs
3.1.1 第一代H1RAs 第一代H1RAs包括氯苯那敏、苯海拉明、异丙嗪等,与H1受体结合后可明显减轻过敏症状。但是亲脂性较高,容易通过血脑屏障,从而产生明显的中枢抑制作用,如镇静、嗜睡、注意力下降、认知学习能力减退等[17]。产生中枢抑制最主要的机制是由于第一代H1RAs不能与血脑屏障中促进药物泵出(外排泵)的P-蛋白(P-glycoprotein, P-gp)结合[18],药物无法泵出血脑屏障,导致中枢系统中的药物浓度较高,与H1受体结合后出现嗜睡等明显的中枢抑制作用。采用正电子发射断层扫描(PET)发现第一代H1RAs可与中枢系统中70%的H1受体结合,而第二代H1RAs与中枢系统中H1受体的结合率低于20%,因此,第一代H1RAs较第二代有明显的中枢抑制作用。同时第一代H1RAs对周围受体选择性较差[19-20],可产生相应的不良反应:①作用于毒蕈碱受体,导致口干、眼干、尿潴留、便秘、窦性心动过速、瞳孔散大等;②作用于肾上腺素受体,导致头晕和体位性低血压;③作用于5-羟色胺受体,导致食欲和体重增加;④通过影响心脏离子通道,产生心脏毒性作用,如室性心律失常等[21]。
第一代H1RAs主要通过肝脏的细胞色素P450酶代谢,最终经肾脏排出体外。当与其他通过该酶代谢的药物联合服用时,如大环类脂类抗生素、抗抑郁药、抗真菌药及H2受体拮抗剂等,可导致血药浓度升高,从而增加其毒副作用。此外在用药时需要关注肝肾功能。
3.1.2 第二代H1RAs 第二代H1RAs包括阿司咪唑、西替利嗪、依巴斯汀、非索非那定、氯雷他定等。第二代和第一代H1RAs的最大区别在于中枢抑制作用明显减少,因为大部分第二代H1RAs分子量大,亲脂性低,不易通过血脑屏障,从而降低了中枢神经系统的不良反应。研究发现部分第二代H1RAs,如氯雷他定,其分子量较低,同时亲脂性较高,尽管容易穿透血脑屏障,但由于它与血脑屏障中的外排泵 P-gp具有很高的亲和力[22],可快速被泵出血脑屏障,导致中枢系统中的药物浓度迅速降低,减轻其中枢抑制作用。第二代H1RAs对周围H1受体具有更高的选择性[23],对肾上腺素和胆碱能受体的亲和性极低,故副作用较第一代明显减少,但部分药物仍存在心脏毒性和体重增加等不良反应。大部分第二代H1RAs也由肝脏的细胞色素P450酶代谢,并经肾脏清除,故在使用时需要注意药物相互作用及肝肾功能。
3.1.3 新二代H1RAs 由于第二代H1RAs依然存在不良反应,故在其基础上研发出新型H1RAs,代表性药物包括左西替利嗪、地氯雷他定等。新二代H1RAs在保留了第二代H1RAs的中枢抑制作用较小的基础上,尚具有以下优点:①起效快,抗过敏效应强,该类药物多为第二代H1RAs的活性代谢物或光学异构体,本身具有活性,故起效快,而且对H1受体具有高选择性,与受体结合时间更长,故抗过敏效应强;②无心脏毒性,因为不影响心脏离子通道,所以不引发一系列心脏反应[24];③药物相互作用小,不经过肝脏的细胞色素P450酶代谢,故P450酶抑制剂不会影响其代谢[25];④对肝肾功能不全者安全性高。临床上常见副作用有头晕、口干,偶有头痛和恶心等,停药后可很快消失。
3.2 鼻用H1RAs
鼻用H1RAs包括盐酸左卡巴斯汀鼻喷剂、盐酸氮卓斯汀鼻喷剂和盐酸奥洛他定鼻喷剂等。用药后能够迅速被鼻黏膜吸收,与H1受体结合可缓解组胺引起的喷嚏、鼻痒等鼻部症状,并且全身不良反应较少[26]。盐酸氮卓斯汀鼻喷剂和盐酸奥洛他定鼻喷剂除具有抗组胺作用外,还具有抑制肥大细胞和嗜碱性粒细胞释放组胺;抑制白三烯的合成和释放;抑制细胞因子如白介素和肿瘤坏死因子的释放等作用,从而进一步减轻变态反应[27]。与口服H1RAs相比,该类药物无中枢抑制和抗胆碱活性等不良反应,较常见的不良反应为口苦和咽部刺激感[28],其他不良反应包括嗜睡、头痛和鼻部不适等,但发生率都较低,因此在AR治疗上具有一定的优势。有研究证实鼻用H1RAs单用效果不如鼻用糖皮质激素,但是两者联合应用可相互协同,能够更快、更好地控制鼻部症状[28]。
鼻腔局部给药具有以下优点[29]:①起效快,由于鼻腔黏膜面积大,黏膜下血管丰富,药物可迅速被吸收;②生物利用度高,药物直接作用于鼻黏膜,可避免胃肠道和肝脏的首过效应;③使用方便,易于被患者接受,患者依从性较好。
4 H2、H3、H4受体相关药物在AR治疗中的研究
4.1 H2受体拮抗剂和激动剂在AR治疗中的研究
AR是易感个体接触变应原后,主要由IgE介导的以喷嚏、流涕和鼻塞为主要临床症状的非感染性鼻黏膜慢性炎症,而干扰素(interferon-γ,IFN-γ)和白介素-4(interleukin,IL-4)可以调节IgE的合成,从而影响AR症状的严重程度。有学者通过临床对照试验发现雷尼替丁(H2受体拮抗剂)可能引起IFN-γ增加和IL-4减少,这两种作用均可导致IgE合成减少,从而缓解临床过敏症状。Shin等[30]研究发现雷尼替丁对AR模型小鼠免疫治疗存在一定程度的损害,而甲苯唑啉(H2受体激动剂)对免疫治疗没有明显的影响。目前关于H2受体在AR发生中的作用尚不清楚,需进一步研究。
4.2 H3受体拮抗剂和激动剂在AR治疗中的研究
H3受体是位于神经元突触前膜的抑制性受体,目前发现H3受体在鼻腔主要位于黏膜下腺体周围[14],并且H1和H3受体在同一神经细胞表达,组胺可能通过H1及H3协同作用,参与AR的发病。Nakaya等[31]发现R-甲基组胺(H3受体激动剂)和H1受体拮抗剂均可改善致敏小鼠的鼻部症状,但两者联合使用较单独使用效果更明显。Stokes等[32]将PF-03654764(H3受体拮抗剂)联合非索非那定对AR患者进行临床试验,取得很好的临床疗效,并且两者联合用药优于单用非索非那定。由葛兰素制药公司研发的鼻喷剂GSK1004723(H1和H3受体联合拮抗剂)已进入临床试验,结果显示鼻喷3 d后鼻部症状明显缓解[32-33],但远期疗效仍不明确。因此,H3受体拮抗剂有望用于AR的治疗。
4.3 H4激动剂和拮抗剂在AR治疗中的研究
研究发现在AR患者鼻黏膜中H4受体表达显著增强[17],为H4受体相关药物在AR治疗中的研究提供了基础。Takahashi等[34]发现AR模型小鼠鼻喷JNJ7777120(H4受体拮抗剂)后,鼻部症状有所缓解,且缓解程度与剂量相关,血清IgE无明显改变;给予AR模型小鼠口服JNJ7777120后,鼻腔灌洗液中IL-4水平降低、IFN-γ水平升高,血清IgE明显下降,表明H4受体拮抗剂不仅可以通过调节与AR相关细胞因子调节免疫反应,而且可以缓解AR小鼠鼻部症状。Neumann等[35]在哮喘模型小鼠的肺组织中发现组胺浓度比正常鼠高,使用高选择性受体拮抗剂或基因敲除阻断小鼠的H4受体功能后,哮喘症状明显缓解。Kay等[36]从人类肺组织中分离纯化出肥大细胞,发现该细胞膜表面表达H1、H2、H3受体,研究发现使用JNJ28610244 (H4受体激动剂)可以诱导肥大细胞的趋化,而JNJ7777120可以阻止该趋化作用,由此可见肥大细胞的趋化作用可由组胺通过H4受体介导。Mommert等[37]在体外试验中发现人类嗜碱性粒细胞膜表面表达H1、H2和H4受体,其中H4受体表达水平较高,组胺和ST-1006(H4受体激动剂)均可诱导嗜碱性粒细胞的迁移,而JN7777120可抑制该迁移作用,表明嗜碱性粒细胞的迁移可由组胺通过H4受体介导。以上研究发现H4受体在AR及其相关疾病中起重要作用,有望成为AR治疗新靶点。
5 总结与展望
组胺通过其4种受体在炎症反应、神经传递和免疫调节等方面发挥重要作用。H1抗组胺药作为AR的一线用药[38],能够有效缓解鼻部症状,但部分患者治疗效果不尽人意。研究表明H2受体拮抗剂能够减少IgE的合成,从而减轻过敏症状;H3与H1受体在同一神经细胞表达,可共同参与AR的发病,H1和H3联合拮抗剂已进入临床试验,但目前尚未应用于临床;组胺通过H4受体可介导肥大细胞和嗜碱性细胞的迁移,H4受体拮抗剂不仅可以缓解致敏小鼠的鼻部症状,同时可缓解哮喘模型小鼠的哮喘症状。提示H2、H3、H4受体参与AR的发生发展,应用其受体拮抗剂可调控AR发病中的相关炎性介质,从而缓解AR鼻部症状。相信在不久的将来,新型H2、H3和H4受体拮抗剂的问世,可为AR的治疗提供新策略。
