基于分子对接虚拟筛选含酪氨酸残基的ACE抑制三肽
2021-09-02孙晨松陈雯祺陈盈盈游清徽
孙晨松,陈雯祺,陈盈盈,王 硕,游清徽
(江西师范大学生命科学学院,江西南昌 330022)
血管紧张素转化酶(angiotensin-Іconverting enzyme,ACE)是一种金属肽酶,具有调控人体血压的特殊作用,在哺乳动物各类组织和血浆中大量存在,尤其广泛分布于肺,脑,肾及雄性动物的性器官中[1]。因其在调节血压中具有重要作用,近年来深受研究人员的青睐。ACE抑制剂被报道能有效控制高血压,并应用于药物研发。但目前市面上已被注册的ACE抑制剂药物大多为化工合成,如赖诺普利、卡托普利、贝那普利等,这些药物成本高、对环境不友好,并且效能有限,临床上经常引起味觉障碍、皮疹、肾功能异常等不良反应[2]。因此,鉴于对环境友好和人体安全考虑,寻找更具优势的ACE抑制剂刻不容缓。
目前关于ACE抑制剂研究的焦点是食源性多肽,食源性多肽因强大的生物活性及较低的毒副作用等性质而被大量应用于生物学实验,但由于机体的酶解消化作用使多肽的结构发生改变影响了多肽的稳定性,导致食源性多肽的体内ACE抑制活性不显著[3]。肠腔内的代谢活性是限制肽类药物吸收的主要障碍;同时,机体的自我更新、调节和稳定限制了多肽类生物大分子的进入,相比之下亚单位足够小的短肽(二肽、三肽)更容易被机体吸收[4]更利于机体各类组织器官的利用。ACE具有同源性高度相似的两个活性结构域:C-结构域和N-结构域,且两者生物活性有所不同[5−6],C-结构域具有更好的血压调节作用[7]。已有研究表明ACE抑制剂的活性效果与C-结构域前四个氨基酸序列有重要关联,且C端为Tyr或Cys为最优结构[8],近期已有文献对二肽的含酪氨酸残基ACE抑制剂进行虚拟筛选[9],但其种类相对较少,参考范围有限。因此本文为了获取更广泛的数据支撑,在张钦[9]的研究基础上,借助NovoPro工具,模拟人体内环境,筛选出C-结构域特异性抑制且含酪氨酸残基的三肽,对其体外活性进行评估,并运用分子对接找到其结合靶点,阐明作用机制。为ACE抑制剂的研发提供更全面的数据支持。
1 材料与方法
1.1 材料与仪器
血管紧张素转化酶(ACE) 美国Sigma-Aldrich公司;N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰甘氨酰甘氨酸(FAPGG)、活性肽(纯度80%) 生工生物工程(上海)股份有限公司;4-羟乙基哌嗪乙磺酸(HEPES) 上海阿达玛斯公司。
SpectraMAX M 2多功能酶标仪 美国Molecular Devices公司;SPX-60BSH生化培养箱 上海新苗医疗器械制造有限公司;XW-80A旋涡混合器 海门市其林贝尔制造有限公司;LeDock分子对接软件南京大学;电子天平AUW120D日本岛津公司;紫外检测专用酶标板 德国Greiner公司。
1.2 实验方法
1.2.1 C端含酪氨酸的三肽配体库的建立 在Novopro数据库(https://www.novoprolabs.com/tools/convert-peptide-to-smiles-string)[10]中得到所有末端为酪氨酸的三肽结构SMILES序列,MOE软件[11]采用Amber10:EHT力场进行分子力学优化和能量优化并得到mol2格式文件,共400种。
1.2.2 分子对接 通过PBD数据库[12]获取人ACE-赖洛普利复合物的三维结构数据(PBD ID:1O86)。首先去除配体结构,水分子和杂原子,再用PDB2PQR软件[13]和VMD软件[14]加氢修饰和优化,最终根据默认数值构建催化位点的对接口袋参数。以C端为酪氨酸的三肽为分子探针,利用LeDock软件[15]把构建的口袋参数与ACE受体进行分子对接。根据结合能结果筛选出ACE抑制的有效肽序列。
1.2.3 生物活性和水溶性预测 利用PeptideRanker在线系统[16]预测分子对接筛选评分高的三肽的潜在生物活性(http://bioware.ucd.ie/~compass/biowareweb/Server_pages/peptideranker.php),评分大于0.5则表示有生物活性,用Innovagen程序(http://www.innovagen.com/proteomics-tools)的“Peptide property calculator”工具预测前述有活性三肽的水溶性。
1.2.4 ADMET性质预测 利用admetSAR[17−18]预测生物活性大于0.5且水溶性好的三肽的ADMET(http://lmmd.ecust.edu.cn/admetsar1/predict/)性质,主要包括人体肠道吸收(human intestinalaabsorption,HIA)、血脑屏障穿透(blood-brain barrierpenetration,BBB)和急性口服毒性。将筛选得到具有良好生物活性、水溶性和ADMET性质的活性肽与在线数据库BIOPEP-UWM和AHTPDB(http://crdd.osdd.net/raghava/ahtpdb/)中已被收录的ACE抑制肽进行对比,将未被研究报道的活性肽进行后续研究。
1.2.5 ACE抑制肽的合成 采用FMOC固相合成[19]法制备肽RWY、FRY、YRY和RFY。所得到的肽纯度为80%,均经过脱盐处理。
1.2.6 肽的ACE抑制活性检测 利用多功能酶标仪测定ACE抑制活性。以FAPGG作为ACE底物,通过紫外专用酶标板在340 nm下测定吸光值,具体操作方法如骆琳等[20]稍作改进,配制缓冲液(80 mmol/L HEPES 300 mmol/L NaCl)并调节p H至8.3。配制1mmol/L的FAPGG作为底物,操作步骤如表1。

表1 ACE抑制率的测定Table 1 Determination of ACE inhibition rate
添加各组组分后立即在340 nm下检测第一次吸光值,37℃恒温培养箱下反应30 min后测第二次吸光值,把对照组反应前后的吸光值差值记为A,抑制组的差值记为B,则肽的ACE抑制率Q(%)=100(A−B)/A×100,测定不同浓度组分肽的ACE抑制率,每组平行至少做6次。
1.3 数据处理
多次重复实验过程,利用Microsoft Excel和Pymol整理数据和作图并用Spss Statistics软件预测三肽IC50值。
2 结果与分析
2.1 C端含酪氨酸三肽对接结果及生物活性预测
根据LeDock分子对接结合能结果,选取分值大于−9.5的三肽,在此基础上根据ACE-赖洛普利复合物配体结合效率淘汰掉打分小于−0.294的三肽,最终得到了77个与ACE靶点结合较好的三肽。
PeptideRanker服务器可预测肽是否有生物活性,其评定结果越接近1则说明可能拥有用的生物活性越强,其评定活性的最低标准为0.5。因此,从前述步骤筛选出的77个三肽中进一步淘汰28个,余下49个具备生物活性潜能的三肽。利用Innovagen进行水溶性的筛选,最终得到12个水溶性好的三肽结果见表2。
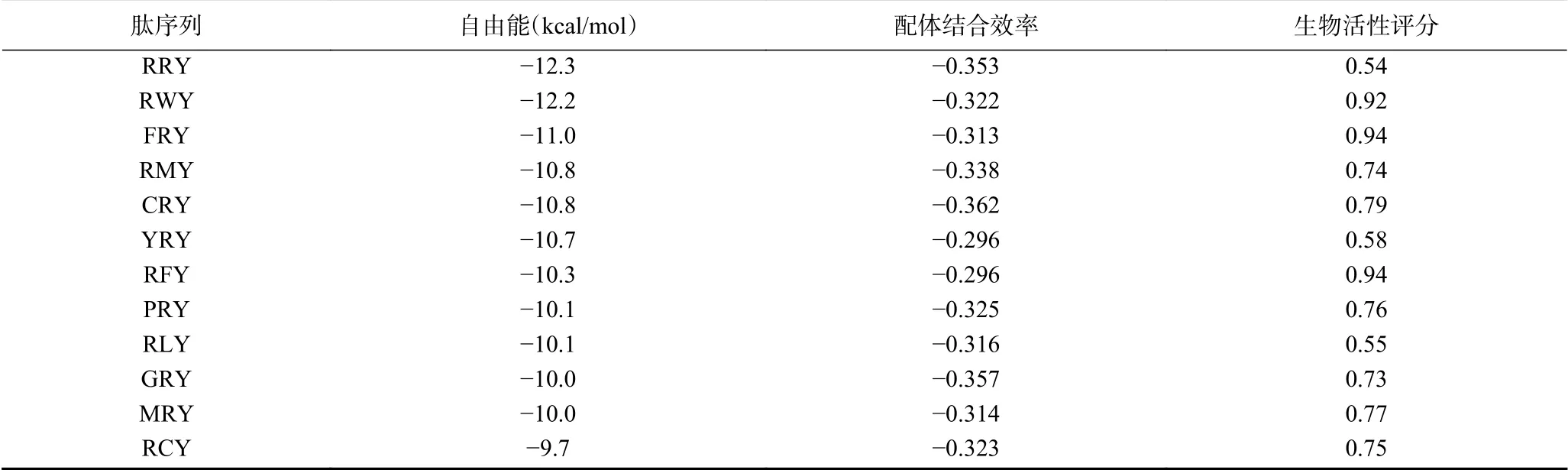
表2 肽序列打分、配体结合效率及生物活性评分Table 2 Peptide sequence score,ligand binding efficiency and biological activity score
2.2 三肽ADMET性质预测
admetSAR是开源可读,并且实时更新的数据库,它可根据活性肽的SMILES序列预测其吸收、代谢和毒性等与环境和人类健康相关的性质。预测三肽的ADMET特性可作为有效的ACE抑制肽筛选的重要依据。本次对三肽的血脑屏障渗透性(BBB)、胃肠吸收性(HIA)、Caco-2通透性、药物毒性、艾姆斯毒性和致癌物进行了预测。三肽的ADMET特性的预测结果如表3。

表3 肽序列ADMET性质预测Table 3 Prediction of the properties of peptide sequence ADMET
吸收和代谢是影响口服利用度的最重要因素,更好的治疗药物,不仅要有BBB、HIA和Caco-2通透性的正参数,而且需要5种CYP450的代谢抑制参数[21]。BBB是保障中枢神经内环境稳定的重要结构,其对进入脑组织的大部分物质具有选择和限制性,因此所筛选的三肽必须具备良好的血脑屏障渗透性才能有效的发挥抑制作用[22]。HIA标志着三肽在体内的吸收利用程度。结果表明,其中三肽RWY、FRY、YRY、RFY、PRY被标记为BBB+,HIA+,表明五种三肽血脑屏障渗透率高且胃肠吸收好。作为肠上皮细胞系中的重要细胞,Caco-2细胞的研究与药物在机体内的代谢和吸收关系重大,其渗透性越好,越容易被机体利用[23]。CYP450是药物代谢中占据主导作用的酶,若其被抑制,则药物代谢减弱甚至对人体造成不良影响[24]。上述五种三肽的Caco-2渗透性良好,并且根据CYP450的预算值推测其均无毒,此外也未检测出艾姆斯毒性和致癌物。最后将五种三肽与数据库BIOPEP(http://crdd.osdd.net/raghava/ahtpdb/)所发现的活性序列进行对比,只有肽PRY被报道过是ACE抑制剂IC50值为2.5 μmol/L,其余四种三肽均为首次发现的ACE抑制肽。经FMOC固相合成的肽RWY、FRY、YRY、RFY利用多功能酶标仪检测ACE抑制率,FRY、RWY 、RFY、YRY 的IC50值分别为113.10、228.67、101.00和272.61μmol/L。
2.3 分子对接机制
一般而言,根据对接分数和分值评定的高低不足以作为抑制活性唯一的验证标准[25],为进一步阐明分子间的相互作用机制,本文利用Pymol软件对筛选出的四个三肽与ACE之间的相互作用结果进行了分析。
如图1a结果所示,三肽RWY分别与Glu162(2.84Å/2.91Å)、CYX352(2.61Å)、CYX370(2.90Å)、Asp377(3.58Å)、HSD353(3.28Å)、Glu384(2.59Å)这一系列ACE的氨基酸残基之间形成了7个距离不同的氢键,其中与Glu162形成了2条重叠的氢键,因此未在平面图显示完全,CYX为二硫键参与的Cys,HSD为His的一种形态。RWY与Glu384结合的键长最短,键能最大,结合最牢固。

图1 ACE与RWY分子对接作用图Fig.1 Diagram of molecular docking between ACE and RWY
如图2a所示,三肽FRY与HSD353(2.82Å)、Glu384(3.51Å/3.02Å/3.29Å)、HSD387(2.66Å)、Glu 411(3.74Å/3.12Å)、Glu162(3.12Å)、Glu376(2.60Å)、Asp415(3.22Å/2.81Å)等这些氨基酸残基之间形成距离不同的11个氢键,其中Glu384和Asp415残基分别都有两条氢键重叠。

图2 ACE与FRY分子对接作用图Fig.2 Diagram of molecular docking between ACE and FRY
如图3a结果所示,三肽YRY与HSD353(2.63Å/2.93Å)、Asp377(2.95Å)、Glu162(2.95Å)、Glu384(3.45Å)、Asp453(2.97Å)、HSD513(2.94Å)等这些氨基酸残基之间形成7条氢键。

图3 ACE与YRY分子对接作用图Fig.3 Diagram of molecular docking between ACE and YRY
如图4a结果所示,三肽RFY与氨基酸残基Glu162(2.64Å/3.13Å)、Cys370(2.62Å/2.89Å)、Asp377(3.10Å)、Ala356(2.69Å)之间形成6条氢键,并与His387(3.79Å)形成pi-pi共轭键。
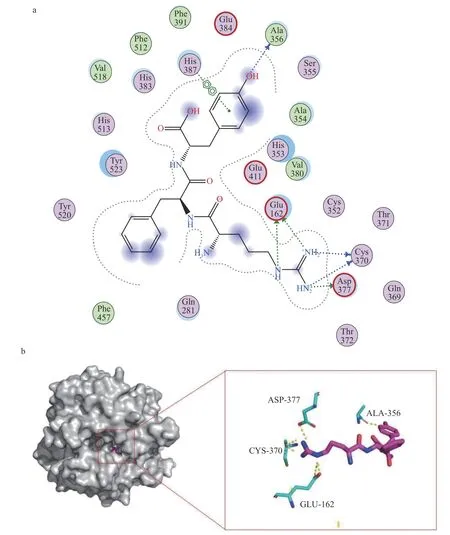
图4 ACE与RFY分子对接作用图Fig.4 Diagram of molecular docking between ACE and RFY
已有大量研究表明,ACE存在三个活性口袋,即S1、S2和S1′,氨基酸残基Ala354、Glu384和Tyr523存在于S1口袋,Gln281、His353、Lys511、His513和Tyr520存在于S2口袋,Glu162存在于S1′口袋[26−28];此外ACE的活性位点Zn(II)在影响ACE的活性中也起到重要作用,活性中心Zn(II)与His383、His387和Glu411相互协调。肽和ACE残基通过主要的相互作用力(如范德华力)和某些次要的相互作用力(如氢键、疏水作用力和静电作用力)连接在一起,氢键是形成稳定肽ACE复合物的主要作用力[29]。RWY和ACE的氨基酸残基Glu162、HSD353、Glu384之间形成4条氢键,说明RWY与S1′口袋、S2口袋和S1口袋均有相互作用,FRY与氨基酸残基HSD383、HSD387、Glu411、Glu384和Glu162之间形成8条氢键,由此可知FRY通过Zn(II)中心、S1和S1′口袋抑制ACE活性,YRY则与残基HSD353、HSD513、Glu162和Glu384间构建5条氢键,与S2、S1′和S1口袋存在相互作用,RFY与残基Glu162形成2条氢键,与His387形成pi-pi共轭键,则说明RFY和S1′和S1口袋存在相互作用。表4中列出了抑制肽,药物赖诺普利与口袋中氨基酸残基之间的相互作用,筛选出的四种抑制肽都与S1′口袋相互作用,且唯一与S1′口袋形成2条氢键的RFY表现出最优体外ACE抑制活性,说明S1′口袋可能在ACE抑制活性中发挥重要作用,这与于志鹏等[30]研究结果相似。虽然这些抑制肽的ACE抑制活性不及阳性药物赖诺普利(IC50=1.2μmol/L)[31],但相比于许多已发现的ACE活性短肽,如IVF(IC50=3390μmol/L)[32],VKK(IC50=1045μmol/L)[33]筛选出的抑制肽仍具备很大优势。
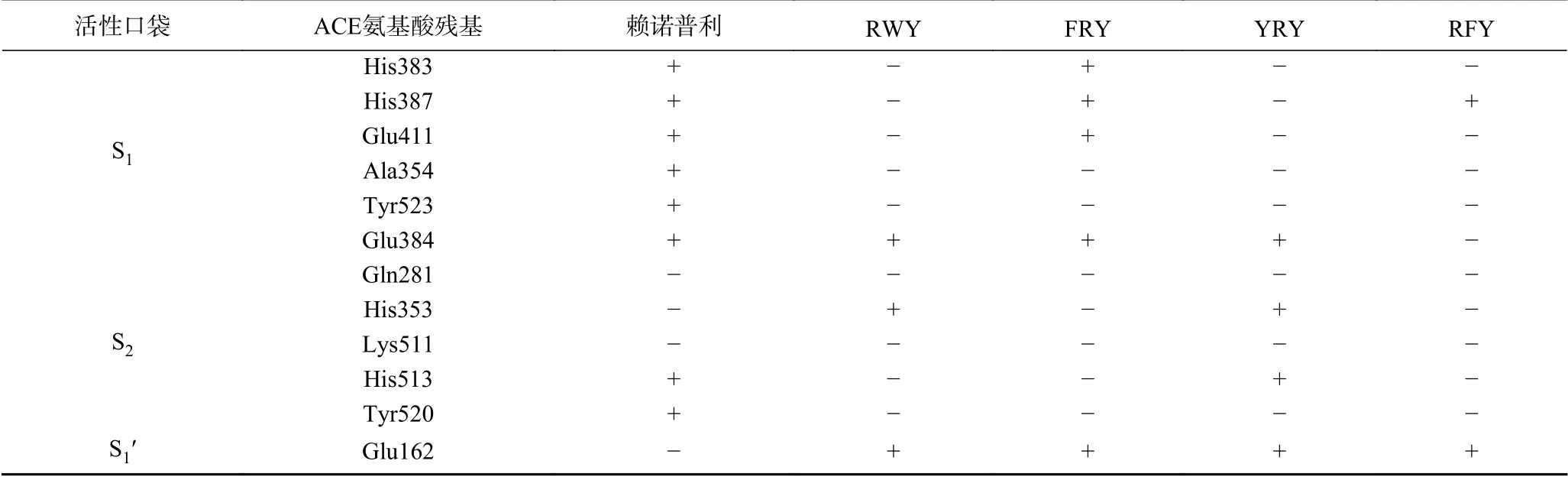
表4 赖诺普利、抑制肽与ACE口袋中氨基酸残基相互作用Table 4 Lisinopril,inhibitory peptidesinteract with amino acid residuesin the ACE pocket
3 结论
利用生物信息学手段,以C端为酪氨酸残基的ACE抑制三肽为研究对象,进行高通量筛选,并对筛选结果的生物活性、水溶性和生物毒性进行进一步优化得到存在ACE抑制可能性的肽RWY、FRY、YRY、RFY。经体外实验验证四者都具备良好的ACE抑制活性,IC50值分别为228.67、113.10、272.61、101.00μmol/L,分子对接结果显示ACE活性口袋S1′中的氨基酸残基Glu162与RWY、FRY、YRY及RFY都存在氢键作用力,RFY与Glu162存在2条氢键作用力,这可能是RFY表现出相对较高的抑制活性的原因。虽然与临床药物赖诺普利相比这些三肽表现出相对较低的ACE抑制活性,然而有研究指出食源性ACE抑制肽类相比之下由于较低的副作用而更安全[34]因此应用前景极大。本文的筛选方法避免了传统方法耗时、低效、盲目等缺点,其有效性也得到了证实,大大减少了实验工作量,而实现抑制肽的高产量制备则是接下来的重点研究方向。
